热锻炼对杜鹃花耐热性的影响
梁 雯,赵 冰,黄文梅
(西北农林科技大学 风景园林艺术学院,陕西 杨凌712100)
高温会引起植物细胞成分、细胞组织结构和新陈代谢的变化[1-2],严重时导致植物叶片萎蔫甚至死亡,是限制植物分布及生长的主要环境因子。与动物相比,植物不能移动,只能利用自身抵抗热害的能力来应对自然界中出现的高温热害,这种抵抗热害的能力就是耐热性[3]。植物的耐热性可以通过施用生长调节剂,如钙(主要为氯化钙)[4]、水杨酸[1-3]等或高温锻炼来提高。植物在非致死高温处理(即热锻炼)下可以获得耐热性[5-9],通过感知温度信号并将这些信号转导成生物化学过程来启动温度锻炼,最终导致耐热性的发展[8]。热锻炼处理能使植物叶肉细胞及叶绿体在高温下保持结构稳定[8,10],减少活性氧积累[8],提高抗氧化酶活性,调节渗透物质积累[11],减少光抑制[12]等,从而提高植物耐热性。热锻炼能提高亚洲百合Asiatic lilies[13],灰岩皱叶报春Primula forrestii和滇北球花报春Primula denticulate ssp.sinodenticulata[10],菊花Chrysanthemum[11]等园林植物的耐热性,但针对热锻炼提高杜鹃花Rhododendron耐热性的研究迄今亦未见报道。周广等[14]通过多年对杜鹃花的引种驯化研究,发现高温热害是影响杜鹃花引种驯化和应用的主要因子。探究如何提高杜鹃花的耐热性,使其更加广泛地应用到园林中,是园林工作者亟待解决的问题。本研究以杜鹃花品种 ‘状元红’Rhododendron ‘Zhuangyuan Hong’生长健壮植株为试材,研究热锻炼对植物叶片解剖结构、光合作用和生理特征(包括细胞膜系统、渗透调节系统以及酶促抗氧化系统)变化的影响,揭示热胁迫下热锻炼处理对杜鹃花耐热性的影响及其作用机理,为杜鹃花的引种驯化以及园林应用提供理论依据。
1 材料与方法
1.1 材料与处理
供试杜鹃花品种 ‘状元红’购于浙江嘉善,在陕西杨凌新天地日光温室[温度(25±1)℃]培养,生长健壮。选取栽植于塑料盆里的大小一致的 ‘状元红’18盆,1株·盆-1。栽培基质为V(松针)∶V(泥炭土)=1∶2。试验在西北农林科技大学林学院实验楼人工气候箱中进行,处理光照度约为12 000 lx, 光周期14 h,相对湿度80%。花盆随机摆放,2 d浇1次水并互换位置以减少位置的影响。试验开始前所有植株在22℃下适应3 d,随后随机选择一半植株移到30℃下热锻炼处理6 d,另一半依然置于22℃作为对照。6 d后,将处理组和对照组植株各取6盆并分成2组,转移到重度高温(38℃)和极端高温(42℃)下进行6 d胁迫试验,并把经过热锻炼的余下的3盆转移到人工气候箱(22℃)培养6 d。整个试验设6 个处理(表 1)。

表1 试验中的6个处理Table 1 6 treatments in this trial
1.2 解剖结构观察
处理结束后选取各盆植株从顶端开始数的第3片叶,将它们迅速切成3 mm×1 mm大小,用体积分数为4%的戊二醛溶液固定过夜,之后用磷酸缓冲液漂洗,梯度乙醇依次脱水,并进行乙酸异戊酯置换,用K-850CO2临界点干燥仪(Quorum,英国)干燥,E-1045离子溅射仪(HITACHI,日本)喷金,再用JSM-6360LV钨灯丝扫描电子显微镜(JEOL,日本)进行观察拍照,记录叶片栅栏、海绵等组织排列情况。用Nano Measure 1.2测量软件测量叶片叶肉组织厚度,并计算栅栏海绵组织比、叶片组织结构疏松度(RS)和叶片组织结构紧密度(RCT)。栅栏海绵组织比=栅栏组织厚度/海绵组织厚度×100%;叶片组织结构疏松度(RS)=海绵组织厚度/叶片厚度×100%;叶片组织结构紧密度(RCT)=栅栏组织厚度/叶片厚度×100%。
1.3 光合参数测定
使用LI-6400便携式光合荧光仪(LI-COR,美国)测定叶片的净光合速率(Pn),气孔导度(Gs),蒸腾速率(Ts),细胞间隙二氧化碳摩尔分数(Ci)。测定时叶室面积为6 cm2,样品室流速设为500 μmol·s-1。
1.4 保护酶活性及可溶性物质等的测定分析
处理结束后选取植株中部叶位的叶片测定各项生理参数。称取叶片0.1 g·次-1,重复测定3次。利用过氧化氢(H2O2)测试盒(南京建成生物工程研究所,A064)测定过氧化氢质量摩尔浓度,采用硫代巴比妥酸法测定丙二醛(MDA)质量摩尔浓度。采用蒽酮比色法测定可溶性糖质量分数,试剂盒法测定可溶性蛋白质质量分数(南京建成生物工程研究所,A045),酸性茚三酮显色法测定游离脯氨酸(Pro)质量分数。并采用氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性,愈创木酚法测定过氧化物酶(POD)活性,紫外吸收法测定过氧化氢酶(CAT)活性。
1.5 数据分析
利用Excel和IBM SPSS Statistics 19进行数据处理和方差分析,检验不同处理间的差异显著性。
2 结果与分析
2.1 热锻炼对叶片解剖结构的影响
叶片是植物发展进化过程中对环境改变敏感且可塑性较大的器官,环境的变化常导致叶肉栅栏组织、海绵组织等解剖结构的响应与适应。由图1可以看出:在38℃热胁迫下,相比未经过热锻炼的植株,经过热锻炼处理的植株栅栏组织细胞皱缩程度较轻,排列也较整齐;海绵组织则稍显疏松。在42℃热胁迫下,未经热锻炼的植株叶片海绵组织皱缩严重,栅栏组织细胞皱缩,其栅状排列几不可见;经热锻炼的植株叶片栅栏组织细胞皱缩但仍保持其栅状排列,海绵组织结构则严重破坏。结果表明,经热锻炼预处理的 ‘状元红’植株叶片能在热胁迫下较好地保持栅栏组织结构的稳定性。

图1 各处理下 ‘状元红’叶片叶肉组织解剖结构Figure 1 Mesophyll tissue anatomical structure of the leaves in ‘Zhuangyuan Hong’ under each treatment
栅栏海绵组织比是栅栏组织厚度与海绵组织厚度的比值,可用叶片组织结构紧密度与组织结构疏松度的比值表示。叶片组织结构紧密度越大或组织结构疏松度越小,栅海比越大。从表2可知,对照温度下,经热锻炼和未经热锻炼处理对叶片栅海比无显著影响。42℃时各处理叶片的栅海比与38℃时要低。而在同一热胁迫下,热锻炼组栅海比比对照组要高,在38℃时高24.8%,42℃时高31.3%。检测叶片组织结构紧密度发现,在对照温度下,热锻炼处理后叶片组织结构紧密度显著低于未经锻炼的叶片。38℃下热锻炼的叶片组织结构紧密度则有所增加,但差异不显著。42℃时热锻炼处理的叶片组织结构紧密度比未经锻炼的叶片增加了13.0%,差异显著。检测叶片组织结构疏松度发现,对照温度下,热锻炼对叶片组织结构疏松度没有显著差异。但当温度达到38℃和42℃时,热锻炼叶片组织结构疏松度值分别显著低于未经热锻炼的叶片。
2.2 热锻炼对叶片光合作用的影响
光合作用是植物对热胁迫最为敏感的生理过程之一[15]。表3为热锻炼对 ‘状元红’叶片光合作用参数的影响。由表3可知:在对照温度下,经热锻炼的植株叶片净光合速率(Pn)高于未经锻炼的叶片,表明此时植株光合作用受到影响,但差异不显著;在同一热激水平下,经热锻炼的植株叶片净光合速率均显著高于未经锻炼的叶片。对照温度下,经热锻炼的叶气孔导度(Gs)显著高于未经锻炼的叶片;在38℃胁迫下经热锻炼的叶片叶气孔导度值低于未经锻炼的叶片;而在42℃胁迫下则是高于未经热锻炼的叶片,但差异均不显著。高温胁迫时,经热锻炼的植株叶片胞间二氧化碳摩尔分数(Ci)均低于未经锻炼的叶片,38℃下,两者相差了25.5%,差异显著。测定叶片蒸腾速率 (Ts)值发现,对照温度下,经热锻炼的叶片蒸腾速率值显著高于未经锻炼的叶片;38℃下经热锻炼的叶片蒸腾速率低于未经锻炼的叶片,42℃下则高于未经锻炼的叶片,但差异均不显著。
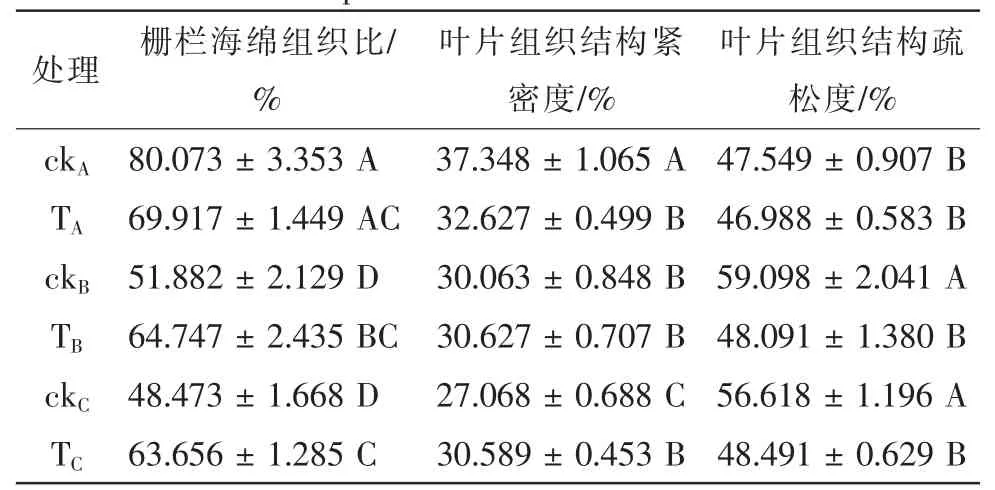
表2 不同温度下热锻炼对叶片叶肉组织结构的影响Table 2 Effects of heat acclimation on mesophyll structure under different temperatures

表3 不同温度下热锻炼对叶片光合参数的影响Table 3 Effects of heat acclimation on photosynthetic parameters under different temperatures
2.3 热锻炼对叶片细胞膜系统的影响
高温影响细胞膜结构和活性氧积累,使得膜脂质过氧化,加重膜损害。从表4可以看出,过氧化氢及MDA质量摩尔浓度变化趋势相同。在对照温度下,热锻炼对过氧化氢及MDA质量摩尔浓度的影响不显著。随着热胁迫程度的增加,过氧化氢及MDA质量摩尔浓度均减少。在38℃时,相比于未经锻炼的叶片,经热锻炼的叶片中过氧化氢质量摩尔浓度显著降低,MDA质量摩尔浓度变化则不显著。在42℃时,过氧化氢与MDA质量摩尔浓度变化均不显著。

表4 不同温度下热锻炼对叶片过氧化氢和MDA质量摩尔浓度的影响Table 4 Effects of heat acclimation on molality of H2O2and MDA under different temperatures
2.4 热锻炼对叶片渗透调节系统的影响
热胁迫下,植物通过细胞内溶质积累完成渗透调节,调节细胞水分环境的变化[13]。由表5可以看出:在对照温度下,经热锻炼的 ‘状元红’植株叶片可溶性糖、可溶性蛋白质、游离脯氨酸质量分数均高于未经锻炼的植株叶片;随着热胁迫温度上升,热锻炼组中所有可溶性物质质量分数均低于未经锻炼组。胁迫温度达38℃时,热锻炼对可溶性糖、可溶性蛋白质质量分数影响差异不明显,对游离脯氨酸影响显著;胁迫温度达42℃时,热锻炼组叶片中可溶性糖、可溶性蛋白质均低于未锻炼组,且差异显著,但游离脯胺酸质量分数差异仍不明显。
2.5 热锻炼对叶片酶促抗氧化系统的影响
热胁迫下,植物体内活性氧产生与清除的平衡被打破,活性氧积累。SOD,POD和CAT是植物体内清除活性氧的重要保护酶[14]。对照温度下,经热锻炼的叶片中SOD活性高于未经锻炼的叶片;在38℃和42℃2个热胁迫水平下,经热锻炼的叶片SOD活性则低于未经锻炼的叶片,但差异并不明显。POD及CAT活性与SOD变化趋势相同,对照温度下,经热锻炼的叶片中POD及CAT活性均显著低于未经锻炼的叶片;38℃高温下,热锻炼组叶片POD及CAT活性均较低;42℃高温下,热锻炼组叶片CAT活性较高但与未锻炼组叶片差异并不显著,而POD活性则高出约2.5倍,差异显著。
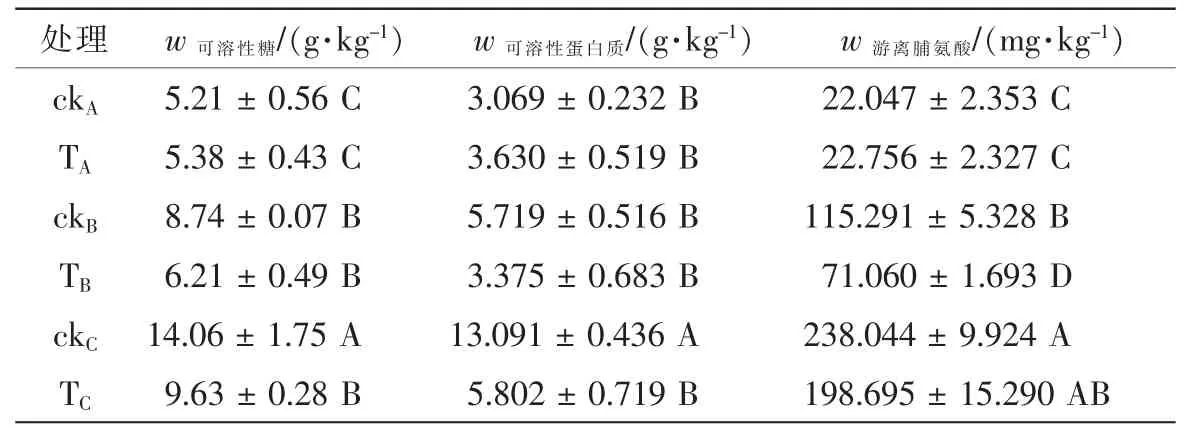
表5 不同温度下热锻炼对叶片可溶性糖、可溶性蛋白、游离脯氨酸质量分数的影响Table 5 Effects of heat acclimation on mass fraction of soluble sugar,soluble protein and pro under different temperatures
3 讨论
热锻炼能有效提高植株耐热性,降低热胁迫引起的伤害,如减缓高温引起的叶片组织结构损伤,减轻光合抑制,维持细胞膜稳定性等[1,15-16]。本研究结果表明:经30℃热锻炼后,杜鹃花品种‘状元红’在38℃和42℃热胁迫下,耐热性得到提高;表现为叶片组织结构受损较轻,栅栏海绵组织比、组织结构紧密度以及净光合速率均有提高,过氧化氢、MDA质量摩尔浓度和可溶性糖、可溶性蛋白质及游离脯胺酸质量分数以及SOD活性均下降。此外,热锻炼对POD及CAT活性也有影响。对杜鹃花而言,经30℃热锻炼后,植株在38℃热胁迫下耐热性提高比较明显,而在42℃下耐热性变化不明显。这与XU等[8]发现热锻炼对高羊茅Festuca arundinacea和多年生黑麦草Lolium perenne的影响研究结果相同,即即使经过热锻炼,植株在经受极端热胁迫后(如42℃),耐热性提高也不明显。

表6 不同温度下热锻炼对叶片SOD,POD和CAT活性的影响Table 6 Effects of heat acclimation on activity of SOD,POD and CAT under different temperatures
植物叶片的形态和解剖结构特征最能体现植物对环境的适应能力[16-17]。胡伟娟等[16]和申惠翡等[17]的研究发现,耐热性较高的植物种或品种栅海比和结构紧密度较高。本研究可知,热锻炼后植株叶片栅海比和结构紧密度均高于未锻炼的植株。这可以在一定程度上表明,热锻炼处理后的杜鹃花植株耐热性得到了提高。本研究还发现,热锻炼处理植株在2个应试热胁迫温度下,植株叶肉组织结构疏松度均低于未热锻炼的植株,与王凤兰等[18]的研究结果相同,即植株耐热性较强时,疏松度反而较低,疏松度与耐热性呈负相关。这主要是因为海绵组织厚度越大,即疏松度越高,越容易适应湿生环境,而这种环境中的植物耐热性往往较弱[17]。
光合作用是植物体内对热较敏感的生理过程之一。试验结果表明,热锻炼的植株叶片Pn在高温胁迫下要高于未经热锻炼的植株,表明热锻炼处理能减轻高温胁迫引起的光合抑制。ZHAO等[15]发现鸭茅Dactylis glomerata在经热锻炼处理后Pn要比未经热锻炼的显著增高,这与本实验结论相同。关于热胁迫对光合作用的抑制机制,早期研究认为,主要归因于气孔因素,即气孔导度下降会降低植物与外界二氧化碳的交换,大大减少二氧化碳的供应,造成光合作用原料供应不足进而引起净光合速率的下降;同时气孔导度下降降低蒸腾速率,减缓光合产物运输速率,进而造成光合产物在叶绿体中不断积累,间接制约净光合速率[19]。也有研究表明:光合作用受到抑制主要与叶肉细胞自身活性(如胞间二氧化碳摩尔分数增加)有关[20]。在38℃高温胁迫下,经热锻炼的植株净光合速率显著上升,此时胞间二氧化碳摩尔分数显著降低,提示热锻炼后净光合速率的上升可能归因于非气孔因素。但在42℃热胁迫下,热锻炼后的植株净光合速率显著上升时,胞间二氧化碳摩尔分数下降,气孔导度和和蒸腾速率上升,且变化均不显著,这表明净光合速率的上升是气孔及非气孔因素共同作用的结果。
植物受到热胁迫会促使过氧化氢积累,从而导致细胞膜膜脂过氧化,膜热稳定性下降[8]。MDA是脂质过氧化作用的产物,对细胞膜有毒害作用,其含量变化能反映细胞膜脂过氧化作用强弱和细胞的受损程度[14]。植物在受到逆境伤害后可通过渗透调节物质调节细胞膨压,对减轻高温伤害有一定作用[21]。渗透物质的积累也间接表明了细胞受到了损害,且在一定范围内积累物质越多,细胞受损程度可能越大。XU等[8]在研究高羊茅和黑麦草时发现,同一胁迫温度下经热锻炼的植株叶片过氧化氢和MDA的积累比未经锻炼的要低,说明热锻炼处理能减轻细胞膜脂过氧化程度。本实验也发现,经热锻炼处理后,渗透物质积累较少,这表明细胞受损程度较轻,植株耐热性得到了提升。
对于在高温逆境下细胞膜逐渐积累的活性氧,植物发展出2种抗氧化系统,酶清除系统和非酶清除系统。酶清除系统包括能够将超氧自由基转化成过氧化氢的SOD和能够触发过氧化氢转化成水和氧气的CAT和POD[8],本质为通过控制胞内活性氧含量来保护植物细胞。本研究中热锻炼后的植株叶片SOD活性得到了提高,与前人研究结果一致[8-9,11];但在38℃高温条件下,SOD,POD和CAT活性经热锻炼的均低于未经锻炼的,这可能是因为在这个温度下,热锻炼后过氧化氢和MDA的积累量较少,并不需要高活性的酶分解过氧化氢及MDA;而在42℃高温胁迫下,经热锻炼的植株SOD活性低,POD和CAT活性较高,同时过氧化氢含量较低,这可能是因为SOD受高温影响较大使得活性较低,而POD和CAT这2种酶则能保持较高活性,因此积累的过氧化氢主要依靠这2种酶清除的。
本实验从解剖结构、光合作用、生理生化特性等方面研究热锻炼对杜鹃花品种 ‘状元红’耐热性的影响,证实了热锻炼处理能提高植株叶片光合作用,减轻叶片叶肉以及细胞的受损程度,一定程度上提高杜鹃花植株耐热性。热锻炼处理对杜鹃花抵抗热胁迫具有一定的实践应用价值,但其分子机制还有待进一步研究。
[1] 贾思振,杨恒伟,颜志明,等.高温胁迫下水杨酸对菊花幼苗生理生化指标的影响[J].浙江农林大学学报,2016, 33(3): 449-454.JIA Sizhen,YANG Hengwei,YAN Zhiming,et al.Physiological and biochemical indexes of exogenous salicylic acid on Chrysanthemum seedlings with high temperature stress [J].J Zhejiang A&F Univ,2016,33(3):449-454.
[2] 龚仲幸,何勇,朱祝军.水杨酸对高温胁迫下一串红耐热性的影响[J].浙江农林大学学报,2015,32(5):701-707.GONG Zhongxing,HE Yong,ZHU Zhujun.Heat resistance of Salvia splendens with salicylic acid added and high temperature stress [J].J Zhejiang A&F Univ,2015,32(5):701-707.
[3] LIU Hongtao,HUANG Weidong,PAN Qiuhong,et al.Contributions of PIP2-specific-phospholipase C and free salicylic acid to heat acclimation-induced thermotolerance in pea leaves [J].J Plant Physiol,2006,163(4):405-416.
[4] 汪蓉.抗热剂对马缨杜鹃抗热性的影响研究[D].广州:仲恺农业工程学院,2014.WANG Rong.Studies on the Effect of Additives on the Themal Resistance of Rhododendron delavayi [D].Guangzhou:Zhongkai University of Agriculture and Engineering,2014.
[5] WANG Xiao,WOLLENWEBER B,JACOBSEN S,et al.Pre-anthesis high-temperature acclimation alleviates damage to the flag leaf caused by post-anthesis heat stress in wheat[J].J Plant Physiol,2011,168(6):585-593.
[6] YUAN Yuan,QIAN Hongmei,YU Yidong,et al.Thermotolerance and antioxidant response induced by heat acclimation in Freesia seedlings [J].Acta Physiol Plant,2011,33(3):1001-1009.
[7] MÜLLER Fl,RIEU I.Acclimation to high tempeture during pollen development [J].Plant Reprod,2016,29(1/2):107-118.doi:10.1007/s00497-016-0282-x.
[8] XU Sheng,LI Jianlong,ZHANG Xinquan,et al.Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress [J].Environ Exp Bot,2006,56(3):274-285.
[9] WANG Lijun,LI Shaohua.Thermotolerance and related antioxidant enzyme activities induced by heat acclimation and salicylic acid in grape(Vitis vinifera L.) leaves [J].Plant Growth Regul,2006,48(2):137-144.
[10] 胡伟娟,张启翔,潘会堂,等.灰岩皱叶报春和滇北球花报春在热锻炼和热胁迫下叶肉细胞超微结构的差异[J].华南农业大学学报, 2010, 31(3): 43-46.HU Weijuan,ZHANG Qixiang,PAN Huitang,et al.Difference in ultrastructure of mesophyll cell between two Primula species with different thermotolerance under heat acclimation and heat stress [J].J South China Agric Univ,2010,31(3):43-46.
[11] 李云,张钢,杨际双.热激锻炼对高温胁迫下菊花生理代谢的影响[J].武汉植物学研究,2008,26(2):175-178.LI Yun,ZHANG Gang,YANG Jishuang.Effects of heat shock on physiological metabolism of Chrysanthemum under high temperature stress [J].J Wuhan Bot Res,2008,26(2):175-178.
[12] 王延书.水杨酸与高温锻炼对葡萄苗抗热性和光合作用变化的影响[D].石河子:石河子大学,2007.WANG Yanshu.Effects of Salicylic Acid or Heat Acclimation on the Thermotolerance and Photosynthesis in Grape Leaves [D].Shihezi:Shihezi University,2007.
[13] 刘雪凝,杨利平.热激锻炼对亚洲百合耐热性的诱导[J].东北林业大学学报,2011,39(5):64-66.LIU Xuening,YANG Liping.Effects of thermal stimulation exercise for bulbs on heat tolerance of Asiatic hybrid lily[J].J Northeast For Univ,2011,39(5):64-66.
[14] 周广,孙宝腾,张乐华,等.井冈山杜鹃叶片抗氧化系统对高温胁迫的响应[J].西北植物学报,2010,30(6): 1149-1156.ZHOU Guang,SUN Baoteng,ZHANG Lehua,et al.Responses of antioxidant system in leaves of Rhododendron jinggangshanicum to high temperature stress [J].Acta Bot Boreal-Occident Sin,2010,30(6):1149-1156.
[15] ZHAO Xinxin,HUANG Linkai,ZHANG Xinquan,et al.Effects of heat acclimation on photosynthesis,antioxidant enzyme activities,and gene expression in orchardgrass under heat stress [J].Molecules,2014,19(9):13564-13576.
[16] 胡伟娟,张启翔,潘会堂,等.报春叶片解剖结构与耐热性的关系[J].华中农业大学学报,2010,29(3):363-368.HU Weijuan,ZHANG Qixiang,PAN Huitang,et al.Relationship between leaf anatomical structure and heat resistance of Primula [J].J Huazhong Agric Univ,2010,29(3):363-368.
[17] 申惠翡,赵冰,徐静静.15个杜鹃花品种叶片解剖结构与植株耐热性的关系[J].应用生态学报,2016,27(12): 1-13.SHEN Huifei,ZHAO Bing,XU Jingjing.Relationship between leaf anatomical structure and heat resistance of 15 Rhododendron cultivars [J].Chin J Appl Ecol,2016,27(12):3895-3904.
[18] 王凤兰,周厚高,黄子峰,等.新铁炮百合叶片抗热性形态指标初探[J].湖北农学院学报,2004,24(2):102-105.WANG Fenglan,ZHOU Hougao,HUANG Zifeng,et al.Studies on the morphological indices of heat-resistance of lily(Lilium formolongi) leaf blade [J].J Hubei Agric Coll,2004,24(2):102-105.
[19] 田彦彦.逆境胁迫对菊花光合特性及相关生理指标的影响[D].郑州:河南农业大学,2009.TIAN Yanyan.Effects of Adverse Stress on Photosynthetic Characteristics and Relative Physiological Index [D].Zhengzhou:Henan Agricultural University,2009.
[20] 郑宇,何天友,陈凌艳,等.高温胁迫对西洋杜鹃光合作用和叶绿素荧光动力学参数的影响 [J].福建农林大学学报(自然科学版), 2012, 41(6): 608-615.ZHENG Yu,HE Tianyou,CHEN Lingyan,et al.Effects of high temperature stress on photosynthesis and chlorophyll fluorescence of Rhododendron hybridum [J].J Fujian Agric For Univ Nat Sci Ed,2012,41(6):608-615.
[21] 张乐华,周广,孙宝腾,等.高温胁迫对两种常绿杜鹃亚属植物幼苗生理生化特性的影响[J].植物科学学报,2011, 29(3): 362-369.ZHANG Lehua,ZHOU Guang,SUN Baoteng,et al.Physiological and biochemical effects of high temperature stress on the seedlings of two Rhododendron species of subgenus Hymenanthes [J].Plant Sci J,2011,29(3):362-369.

