獐子岛及邻近海域秋季浮游植物的粒级结构及其影响因素
吴文广,张继红,2,*,刘 毅,王 巍,蔺 凡
1 中国水产科学研究院黄海水产研究所, 农业部海洋渔业可持续发展重点实验室, 青岛 266071 2 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,青岛 266200
浮游植物是支撑海洋生态系统的基础,浮游植物的丰度、结构等特征与环境因子密不可分,同时浮游植物群落结构也一定程度反映了海洋生态环境。掌握浮游植物粒级结构的动态变化及其环境影响机制有助于了解海洋浮游生态系统的食物网结构变化以及海洋浮游植物的生物泵效率[1]。研究表明,微型(2—20μm)和微微型(<2μm)浮游植物对环境因子的变化非常敏感,且在海洋浮游植物中占有非常重要的比例[2-5],在海洋生态系统的物质循环和能量流动中起着十分重要的作用。近年来关于浮游植物粒级结构的研究日益增多,许多专家学者对渤海[6]、黄海[1,7]、东海[7-8]等海域的浮游植物粒级结构的时空分布特征及环境影响因素做了深入的研究,为深入分析各粒级浮游植物在海洋生态系统中的作用提供了科学依据。
浮游植物作为海洋初级生产力的主要贡献者,是海洋生态系统的能量流动和物质循环的关键环节,它是海水养殖活动的重要支撑,是滤食性贝类的主要食物之一[9-10]。獐子岛位于黄海北部外长山群岛的最南端,拥有全国最大的虾夷扇贝养殖基地,是我国唯一的虾夷扇贝国家级原良种场[9]。在滤食性贝类养殖容量的评估中,叶绿素a是极为重要的参数,但目前关于我国最大的虾夷扇贝养殖基地—獐子岛水域的研究报道较少[9]。为此,查明獐子岛海域浮游植物生物量的粒级结构及空间分布有助于了解该海域的生态系统动力过程及其微食物环作用,且能指导该海域的生物资源开发及利用。于2015年10月在獐子岛及邻近海域进行表、底层海水浮游植物粒级结构及相关环境因子的走航调查,分析了浮游植物粒级结构与相关环境因子的关系,以掌握该海域浮游植物粒级结构的分布特征及环境影响因素,为创建新型健康养殖模式及养殖容量评估提供数据支持。
1 材料与方法
1.1 调查站位
本次调查于2015年10月在獐子岛及邻近海域进行走航调查,调查站位共计29个,其中獐子岛海域站位20个(6#—34#),乌蟒岛海域站位9个(41#—49#),如图1所示。
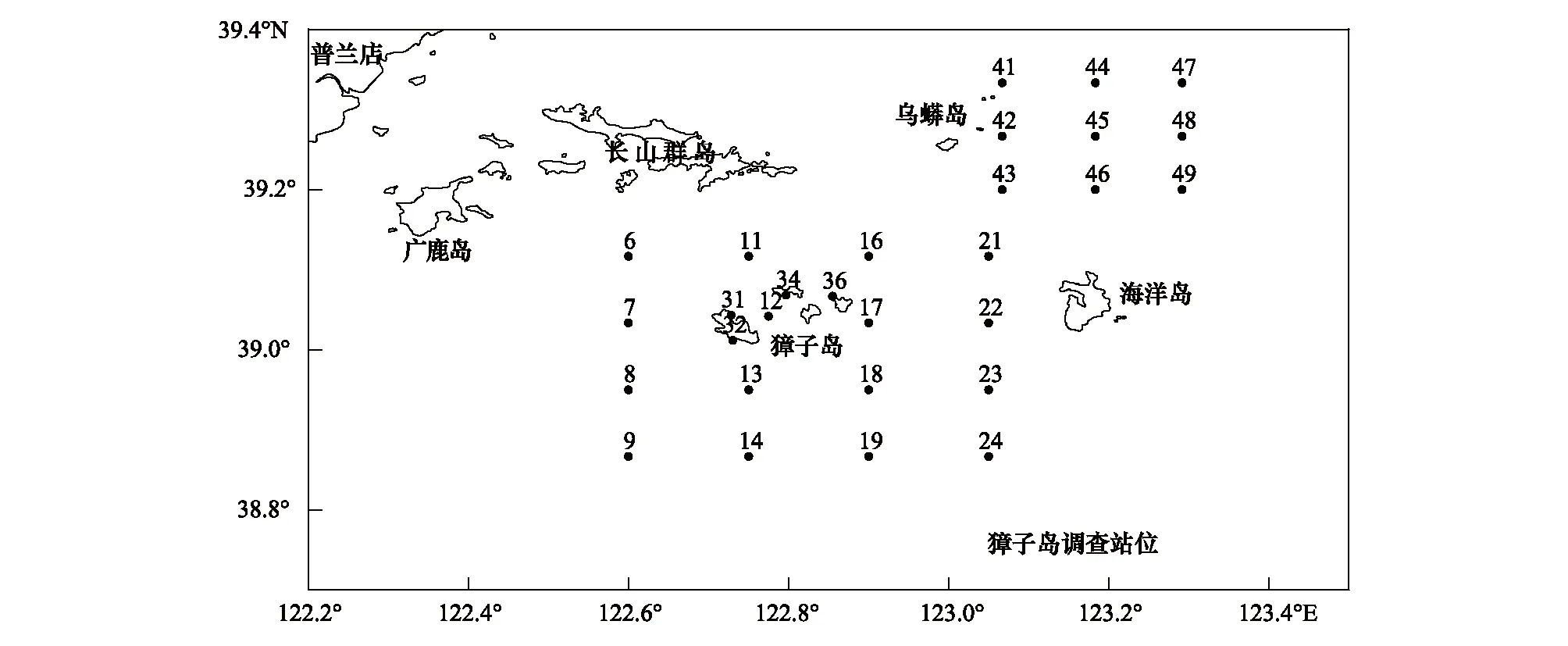
图1 獐子岛及邻近海域调查站位设置Fig.1 The survey stations for size-fractionated chlorophyll-a in Zhangzidao Island图中数字代表站位
1.2 样品采集及测定
所有站位的样品采集均参照国家《海洋监测规范》[10]规定的标准水层分别采集表层、底层水样。每个站位表、底层各取水样体积为1L,依次经过国产(浙江天台华耐产,美国标准筛定制)20μm筛绢,2μm,0.45μm的上海兴亚产纤维素酯微孔滤膜(CA)逐级过滤后滴加2滴饱和碳酸镁溶液,收集不同粒径的浮游植物:小型浮游植物(Microplankton, >20μm)、微型浮游植物(Nanoplankton, 2—20μm)和微微型浮游植物(Picoplankton, 0.45—2μm)。每个水样3个平行,经过滤后的滤膜于-20℃冷冻保存并带回实验室分析。叶绿素a的测定(萃取荧光法)采用美国产Turner-Designs Trilogy 荧光仪进行测定。
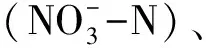
1.3 数据处理
实验数据采用Microsoft Excel 2010和SPSS 17.0软件进行统计学分析, ANOVA单因子方差分析检验组间差异,Pearson相关分析检验分级叶绿素a与环境因子回归关系显著性。
2 结果与分析
2.1 环境参数

2.2 总叶绿素a分布特征
獐子岛及邻近海域秋季表、底层总叶绿素a浓度如图2所示。表层总叶绿素a浓度均值为(0.76±0.18)μg/L,浓度范围在0.52—1.25μg/L;而底层均值为(0.46±0.30)μg/L,浓度范围在0.14—1.5μg/L。从垂直分布上看,表层总叶绿素a浓度显著高于底层(P<0.05)。从水平分布上看(图2),表层高值区出现在獐子岛西北部及乌蟒岛东南部海域,低值区出现在獐子岛东北部海域;底层高值区出现在乌蟒岛北部海域,低值区出现在獐子岛东北部及乌蟒岛南部海域。
2.3 分级叶绿素a分布特征
2.3.1 小型浮游植物叶绿素a
獐子岛及邻近海域秋季表、底层小型浮游植物(>20μm)叶绿素a浓度如图3所示。表层小型浮游植物(>20μm)叶绿素a浓度均值为(0.19±0.15)μg/L,浓度范围在0.03—0.81μg/L;而底层均值为(0.22±0.24)μg/L,浓度范围在(0.04—1.04)μg/L。从垂直分布上看,表层小型浮游植物(>20μm)叶绿素a浓度略低于底层,但差异不显著(P>0.05)。从水平分布上看(图3),表层高值区出现在獐子岛西北部及乌蟒岛北部海域,低值区出现在獐子岛东北部海域;底层高值区出现在乌蟒岛北部海域,低值区出现在獐子岛东北部及乌蟒岛南部海域。

表1 獐子岛及邻近海域秋季相关环境理化因子
TN: 总氮, Total nitrogen; TP: 总磷, Total phosphorus; DIN: 溶解无机氮, Dissolved inorganic nitrogen; 表中相同处理之间带有不同字母的数据表示相互之间差异显著
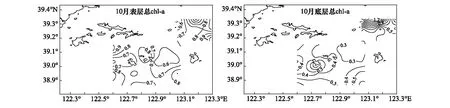
图2 獐子岛海域秋季表层和底层总叶绿素a浓度Fig.2 The chlorophyll-a of surface and bottom layer in autumn in Zhangzidao Island
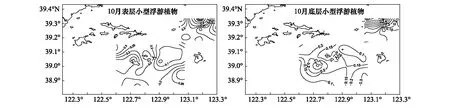
图3 獐子岛海域秋季表层和底层小型浮游植物(>20μm)叶绿素a浓度Fig.3 The microphytoplankton chlorophyll-a of surface and bottom layer in autumn in Zhangzidao Island
2.3.2 微型浮游植物叶绿素a
獐子岛及邻近海域秋季表、底层微型浮游植物(2—20μm)叶绿素a浓度如图4所示。表层微型浮游植物(2—20μm)叶绿素a浓度均值为(0.53±0.11)μg/L,浓度范围在0.33—0.91μg/L;而底层均值为(0.24±0.09)μg/L,浓度范围在(0.08—0.47)μg/L。从垂直分布上看,表层微型浮游植物(2—20μm)叶绿素a浓度显著高于底层。从水平分布上看(图4),表层高值区出现在獐子岛西南部及乌蟒岛东南部海域,低值区出现在乌蟒岛西北部海域;底层高值区出现在獐子岛中部及乌蟒岛西北部海域,低值区出现在獐子岛西南部海域。
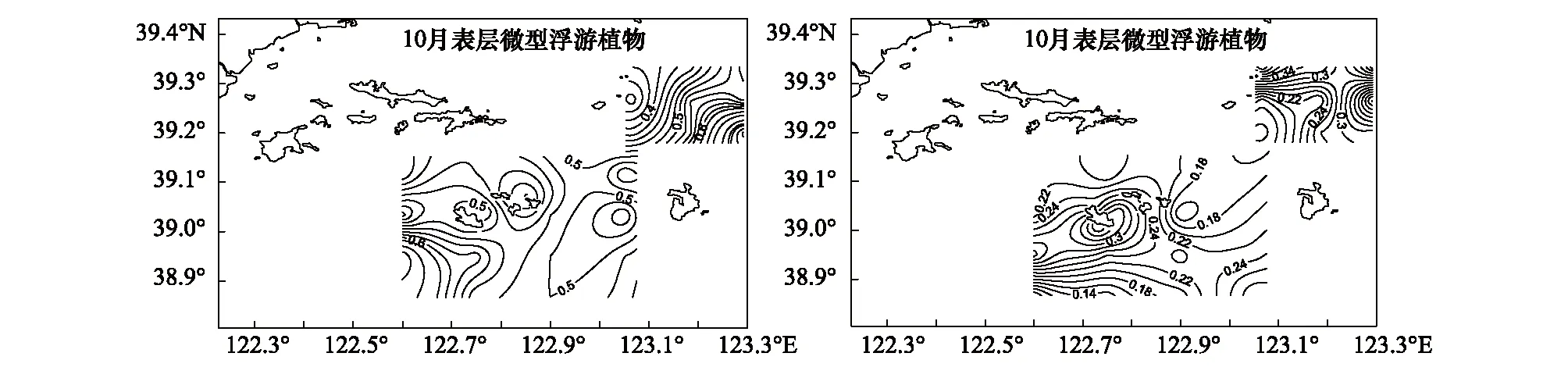
图4 獐子岛海域秋季表层和底层微型浮游植物(2—20μm)叶绿素a浓度Fig.4 The nanophytoplankton chlorophyll-a of surface and bottom layer in autumn in Zhangzidao Island
2.3.3 微微型浮游植物叶绿素a
獐子岛及邻近海域秋季表层微微型浮游植物(0.45—2μm)叶绿素a浓度如图5所示。表层微微型浮游植物(0.45—2μm)叶绿素a浓度均值为(0.03±0.03)μg/L,浓度范围在0—0.09μg/L;秋季底层仅41#检测出微微型浮游植物,浓度为0.02μg/L,其余站位底层水样中均未检测出微微型浮游植物叶绿素a浓度,鉴于此,未给出獐子岛秋季底层微微型浮游植物水平分布图。从垂直分布上看,表层微微型浮游植物(0.45—2μm)叶绿素a浓度显著高于底层(P<0.05)。从水平分布上看(图5),表层高值区出现在乌蟒岛西北部海域,低值区出现在獐子岛东部海域。
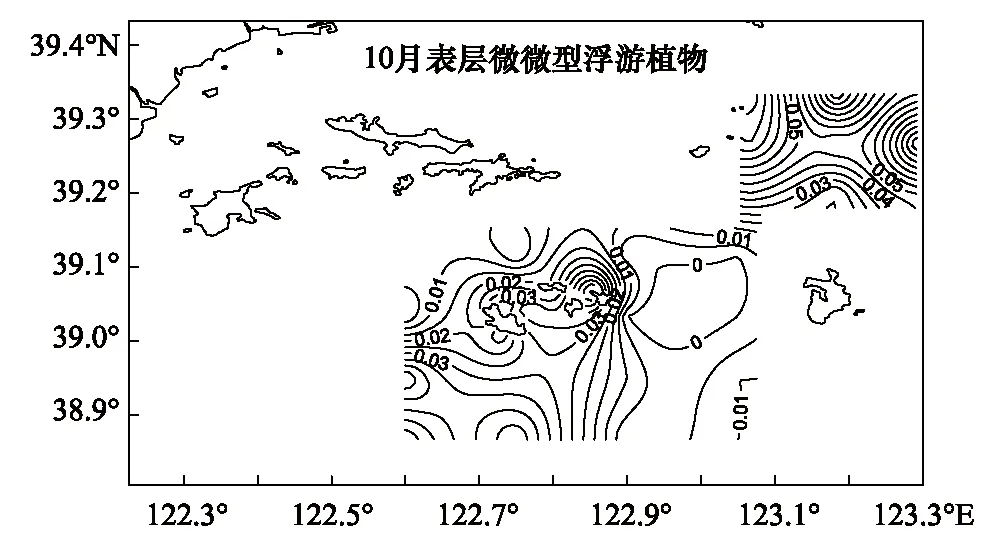
图5 獐子岛海域秋季表层和底层微微型浮游植物(0.45—2μm)叶绿素a浓度Fig.5 The picophytoplankton chlorophyll-a of surface and bottom layer in autumn in Zhangzidao Island
2.4 分级叶绿素a贡献率
獐子岛及邻近海域秋季浮游植物不同粒级的贡献率见图6。表层小型、微型和微微型浮游植物粒级叶绿素a对叶绿素a总量的平均贡献率分别为23.77%、72.66%和3.98%,范围分别为:5.36%—64.80%,34.40%—94.55%,0%—15.38%。表层3种粒级叶绿素a对总量叶绿素a的贡献率顺序为:微型>小型>微微型。底层小型、微型和微微型浮游植物粒级叶绿素a对叶绿素a总量的平均贡献率分别为41.46%、58.50%和0.05%,范围分别为:16.67%—74.24%,25.76%—83.33%,0—4.76%。底层3种粒级叶绿素a对总量叶绿素a的贡献率顺序为:微型>小型>微微型。獐子岛及邻近海域秋季微型和小型浮游植物占据主导地位。
2.5 分级叶绿素a影响因素
Pearson相关分析显示(表2),獐子岛及邻近海域秋季表层微型浮游植物(2—20μm)叶绿素a浓度与盐度呈正相关。而底层总叶绿素a浓度与磷酸盐浓度呈正相关,小型浮游植物(>20μm)浓度与磷酸盐和硅酸盐浓度均表现为正相关,微型浮游植物(2—20μm)浓度与温度呈正相关,而微微型浮游植物(0.45—2μm)浓度与硅酸盐浓度呈正相关。

图6 獐子岛海域秋季表层和底层浮游植物不同粒级贡献率Fig.6 The contribution rate of different sized chlorophyll-a of surface and bottom layer in autumn in Zhangzidao Island
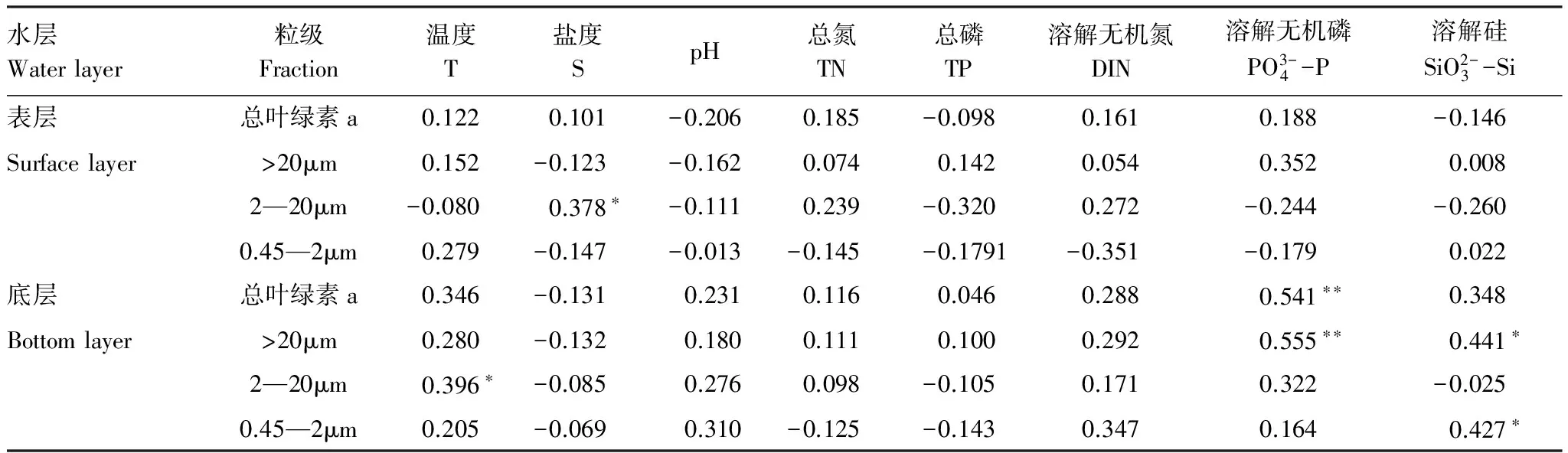
水层Waterlayer粒级Fraction温度T盐度SpH总氮TN总磷TP溶解无机氮DIN溶解无机磷PO3-4-P溶解硅SiO2-3-Si表层总叶绿素a0.1220.101-0.2060.185-0.0980.1610.188-0.146Surfacelayer>20μm0.152-0.123-0.1620.0740.1420.0540.3520.0082—20μm-0.0800.378∗-0.1110.239-0.3200.272-0.244-0.2600.45—2μm0.279-0.147-0.013-0.145-0.1791-0.351-0.1790.022底层总叶绿素a0.346-0.1310.2310.1160.0460.2880.541∗∗0.348Bottomlayer>20μm0.280-0.1320.1800.1110.1000.2920.555∗∗0.441∗2—20μm0.396∗-0.0850.2760.098-0.1050.1710.322-0.0250.45—2μm0.205-0.0690.310-0.125-0.1430.3470.1640.427∗
TN: 总氮, Total nitrogen; TP: 总磷, Total phosphorus; DIN: 溶解无机氮, Dissolved inorganic nitrogen; *表示差异显著,**表示差异极显著
3 讨论
3.1 浮游植物粒级结构的分布特征
獐子岛海域位于黄海北部外长山群岛的最南端,属于温带海域。相关研究表明,浮游植物粒级结构中粒径较大的小型(>20μm)和微型(2—20μm)浮游植物浓度随着纬度的升高而增加,而微微型(0.45—2μm)浮游植物的浓度则随纬度的升高而减小[7-8,11-12]。本研究表明,獐子岛海域秋季小型和微型浮游植物粒级组成占主导地位,而微微型浮游植物对总量的贡献率低于5.45%,基本符合这一规律(表3)。
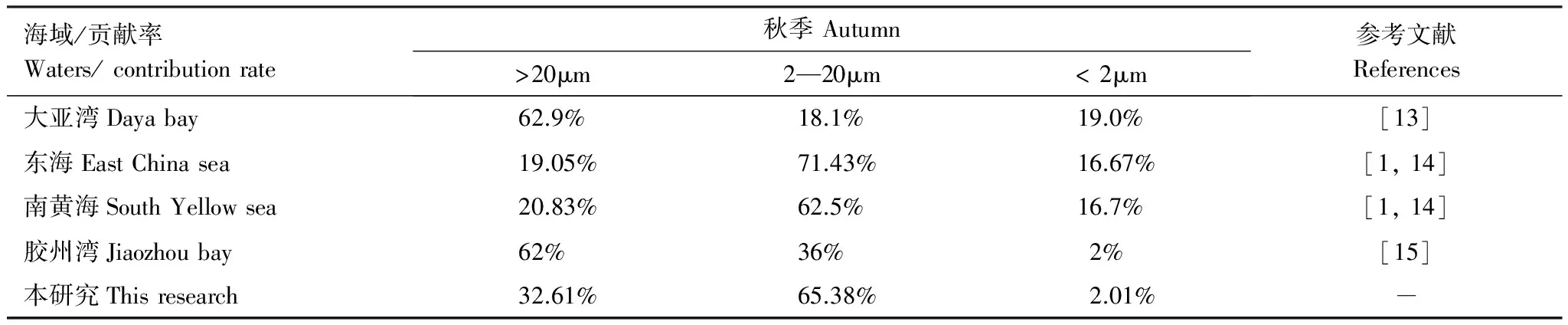
表3 不同纬度海域浮游植物粒级结构比较
宋伦等对辽东湾网采浮游植物的粒级结构研究表明,秋季浮游植物的粒径主要集中在中等粒径范围[16]。张雪对獐子岛海域浮游植物群落结构研究表明,秋季浮游植物主要有优势种为具槽帕拉藻、米氏凯伦藻及硅藻类等粒径较大的藻类[17]。本航次鉴定出獐子岛及邻近海域浮游植物硅藻45种、甲藻21种、硅鞭藻2种,优势种为具槽帕拉藻、海链藻、圆海链藻、离心列海链藻、菱形藻、斜纹藻和米氏凯伦藻等,浮游植物总丰度为7.5个/mL,其中硅藻丰度为6.9个/mL,甲藻丰度为0.6个/mL,硅藻类占优势地位(待发表数据)。而本研究表明,獐子岛及邻近海域秋季小型(>20μm)和微型浮游植物(2—20μm)的平均贡献率分别为32.62%和65.38%,占据优势地位,且对该季节浮游植物优势种鉴定发现,较大粒级的硅藻类[17]占据优势地位,与以上研究结果相一致,进一步说明在温度较低的冷水海域中,粒级较大的浮游植物(>20μm和2—20μm)的比例相应较高[15]。
北黄海海域的生态环境受到大陆气候、黄海暖流、陆源冲淡水和季节性冷水团的影响,其浮游植物群落结构呈现出不同的区系分布特征[16-18]。王俊研究表明,低盐、高营养的渤海沿岸水与高盐、低营养的黄海水导致浮游植物高度分布不均匀[19-20]。许澄源研究表明,辽南沿岸流包括鸭绿江、大洋河、庄河、碧流河等大量径流入海,给长海县海域增添了一部分营养盐,使之呈现由北向南递减之势[21]。本研究表明,总叶绿素a及3种粒级浮游植物浓度的表、底层空间分布趋势相近,高值区均出现在乌蟒岛海域,低值区均出现在獐子岛南部海域,且表层高于底层,乌蟒岛海域地理位置靠北,其温度和营养盐水平整体高于獐子岛海域(表4),从而引起其浮游植物叶绿素a浓度水平高于獐子岛海域,说明温度和营养盐是影响獐子岛及邻近水域浮游植物粒级空间分布的重要因素。
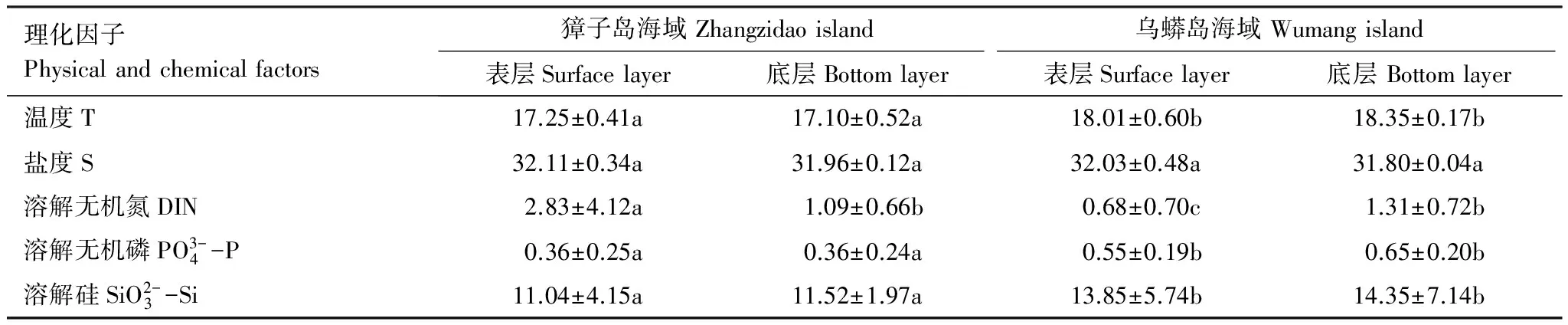
表4 獐子岛及邻近海域秋季相关环境理化因子
DIN: 溶解无机氮, Dissolved inorganic nitrogen;表中相同处理之间带有不同字母的数据表示相互之间差异显著
3.2 浮游植物粒级结构的影响因素
海水中的营养盐浓度通常是浮游植物生长的重要限制因子,营养盐浓度的高低很大程度上调控着浮游植物生物量的粒级结构及其分布。已有研究表明,温度、盐度、营养盐浓度以及浮游动物摄食是决定浮游植物粒级结构组成的关键环境因子[22-23]。其中营养盐对于浮游植物群落结构的影响是迅速和灵敏的[24]。N、P、Si是海洋浮游植物生长必不可少的营养盐,由于不同海区的状况不同,以上几项营养盐都有可能成为浮游植物生长的限制因子[23]。本研究结合Fisher等和Justic等提出的两种方法来判断獐子岛及邻近海域的浮游植物是否受到营养盐的限制[22,25-26],獐子岛及邻近海域秋季底层DIN<2μmol /L,且DIN/P<10,Si/N>1(表1),结果表明獐子岛及邻近海域秋季底层营养盐存在氮限制,无机氮是影响獐子岛秋季浮游植物生长和群落结构的主要因子,与王勇和焦念志[27],张继红等[9]研究结果相一致。
浮游植物粒级结构的分布与水域中被其直接利用的营养盐的含量分布和变化密切相关。从营养盐水平分析来看,獐子岛水域常年属于国家一类海水水质标准,多数时间属贫营养水平[9],磷酸盐浓度低于国家一类水质标准且Si/P=43>22, 存在磷元素潜在限制,本研究结果显示秋季底层总叶绿素a浓度以及小型浮游植物(>20μm)浓度与磷酸盐浓度均表现为正相关,表明磷酸盐可能成为秋季小型浮游植物(>20μm)生长的限制因子。张雪等研究结果表明,秋季獐子岛海域底层浮游植物优势种主要为硅藻、甲藻和金藻,各占 6 种、2种和1 种,其中硅藻占优势地位[17],而硅酸盐是硅藻的必需营养元素[28],硅藻喜低温,最适合的温度通常低于18℃[29],而本研究表明底层小型浮游植物(>20μm)浓度与硅酸盐浓度呈正相关,表明硅酸盐可能成为影响秋季獐子岛海域小型浮游植物(>20μm)生长的重要因子。
浮游植物的粒级结构除主要受营养盐的上行效应影响之外,大规模养殖滤食性贝类及浮游动物大量摄食的下行效应也能对浮游植物的粒级结构产生较大压力[9,30-31]。张雪[17]对獐子岛秋季底播虾夷扇贝胃含物的浮游植物种类组成研究发现,优势种为具槽帕拉藻、圆筛藻、海链藻、曲舟藻、辐射圆筛藻和小等刺硅鞭藻,其中具槽帕拉藻的优势度显著高于其他种类。McQuoid等对具槽帕拉藻的粒径研究表明,其粒径范围在8—48μm,而10—18μm范围的藻细胞占据了优势地位[32],李扬对海链藻与圆筛藻的形态学比较研究表明,绝大多数海链藻种类的细胞直径在3—20μm,而圆筛藻的细胞直径变化范围较大,大部分范围集中在40—100μm之间[33]。而本研究结果表明,秋季底层总叶绿素a浓度低于表层,底层微型(2—20μm)浮游植物浓度显著低于表层,且表层微型(2—20μm)浮游植物的贡献率(72.66%)显著高于底层(58.50%),秋季的水温处于虾夷扇贝生长的最适温度范围内,其摄食、生长的能力强[9],由此推测,獐子养殖水域虾夷扇贝摄食的下行效应可能是影响该海域秋季底层浮游植物粒级结构变化的重要因素。
致谢:感谢獐子岛集团赵学伟经理及“辽长渔科研19”号全体船员在航次调查和样品采集中给予的帮助。
[1] 傅明珠, 孙萍, 王宗灵, 李艳, 李瑞香. 黄海冷水团水域浮游植物群落粒级结构的季节变化. 海洋学报, 2010, 32(1): 120- 129.
[2] Takahashi M, Bienfang P K. Size structure of phytoplankton biomass and photosynthesis in subtropical Hawaiian Waters. Marine Biology, 1983, 76(2): 203- 211.
[3] Kormas K A, Garametsi V, Nicolaidou A. Size-fractionated phytoplankton chlorophyll in an Eastern Mediterranean coastal system (Maliakos Gulf, Greece). Helgoland Marine Research, 2002, 56(2): 125- 133.
[4] 刘诚刚, 宁修仁, 孙军, 蔡昱明, 曹建平. 2002年夏季南极普里兹湾及其邻近海域浮游植物现存量、初级生产力粒级结构和新生产力研究. 海洋学报, 2004, 26(6): 107- 117.
[5] 蔡昱明, 宁修仁, 朱根海, 史君贤. 南极普里兹湾浮游植物现存量与初级生产力粒级结构和新生产力研究. 海洋学报, 2005, 27(4): 135- 147.
[6] 邹芳睿. 渤海湾分级叶绿素对营养盐浓度变化的响应. 天津: 天津大学, 2009: 14- 32.
[7] 邓春梅, 于志刚, 姚鹏, 陈洪涛, 薛春勇. 东海、南黄海浮游植物粒级结构及环境影响因素分析. 中国海洋大学学报, 2008, 38(5): 791- 798, 756.
[8] 孙晓霞, 任琳琳, 郑珊, 文斐, 赵永芳, 孙松. 2011年春夏季黄、东海浮游植物粒级结构. 海洋与湖沼, 2012, 43(3): 419- 428.
[9] 张继红, 方建光, 蒋增杰, 王巍, 王诗欢, 孙松. 獐子岛养殖水域叶绿素含量时空分布特征及初级生产力季节变化. 海洋水产研究, 2008, 29(4): 22- 28.
[10] 郝林华, 孙丕喜, 郝建民, 杜蓓蓓, 张新军, 徐玉珊, 毕进红. 桑沟湾海域叶绿素a的时空分布特征及其影响因素研究. 生态环境学报, 2012, 21(2): 338- 345.
[11] Agawin N S R, Duarte C M, Agustí S. Nutrient and temperature control of the contribution of picoplankton to phytoplankton biomass and production. Limnology and Oceanography, 2000, 45(3): 591- 600.
[12] Andersson A, Haecky P, Hagström Å. Effect of temperature and light on the growth of micro- Nano- and Pico-plankton: impact on algal succession. Marine Biology, 1994, 120(4): 511- 520.
[13] 李丽, 江涛, 吕颂辉. 大亚湾海域夏、秋季分粒级叶绿素a分布特征. 海洋环境科学, 2013, 32(2): 185- 189.
[14] 黄邦钦, 刘媛, 陈纪新, 王大志, 洪华生, 吕瑞华, 黄凌风, 林以安, 魏皓. 东海、黄海浮游植物生物量的粒级结构及时空分布. 海洋学报, 2006, 28(2): 156- 164.
[15] 孙晓霞, 孙松. 胶州湾浮游植物粒级结构及其时空变化. 海洋与湖沼, 2012, 43(3): 411- 418.
[16] 宋伦, 宋广军, 王年斌, 赵海勃, 田金, 杨爽, 杜静. 辽东湾网采浮游植物粒级结构的胁迫响应. 中国环境科学, 2015, 35(9): 2764- 2771.
[17] 张雪. 獐子岛邻近水域浮游植物群落结构及其与虾夷扇贝(Patinopectenyessoensis)食性关系的研究. 上海: 上海海洋大学, 2013: 8- 69.
[18] 郭世鑫. 近百年来北黄海浮游植物生产力和种群结构变化的生物标志物记录及影响因素. 青岛: 中国海洋大学, 2015: 3- 54.
[19] 王俊. 黄海春季浮游植物的调查研究. 海洋水产研究, 2001, 22(1): 56- 61.
[20] 王俊. 黄海秋、冬季浮游植物的调查研究. 海洋水产研究, 2003, 24(1): 15- 23.
[21] 许澄源. 辽宁省长海县近海生态特点与渔业. 水产科学, 1985, 4(1): 32- 36.
[23] Uye S I. Replacement of large copepods by small ones with eutrophication of embayments: cause and consequence. Hydrobiologia, 1994, 292- 293(1): 513- 519.
[24] 王资生. 海水营养盐及其对浮游植物的影响. 盐城工学院学报, 2001, 14(2): 40- 43, 49.
[25] Fisher T R, Peelel E R, Ammerman J W, Harding L W Jr. Nutrient limitation of phytoplankton in Chesapeake Bay. Marine Ecology Progress Series, 1992, 82(1): 51- 63.
[26] 吴文广, 张继红, 王巍, 房景辉, 刘毅, 牛亚丽, 高振锟. 桑沟湾水域叶绿素a在海带收获前后的变化及其影响因素. 水产学报, 2015, 39(8): 1178- 1186.
[27] 王勇, 焦念志. 北黄海浮游植物营养盐限制的初步研究. 海洋与湖沼, 1999, 30(5): 512- 518.
[28] 梁君荣, 陈丹丹, 高亚辉, 程金凤. 海洋硅藻硅质细胞壁结构的形成机理研究概述. 海洋学报, 2010, 32(5): 1- 8.
[29] Wasmund N, Tuimala J, Suikkanen S, Vandepitte L, Kraberg A. Long-term trends in phytoplankton composition in the western and central Baltic Sea. Journal of Marine Systems, 2011, 87(2): 145- 159.
[30] Dame R F, Prins T C. Bivalve carrying capacity in coastal ecosystems. Aquatic Ecology, 1997, 31(4): 409- 421.
[31] Smaal A, van Stralen M, Schuiling E. The interaction between shellfish culture and ecosystem processes. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(5): 991- 1002.
[32] McQuoid M R, Nordberg K. The diatomParaliasulcataas an environmental indicator species in coastal sediments. Estuarine, Coastal and Shelf Science, 2003, 56(2): 339- 354.
[33] 李扬. 海链藻(Thalassiosira)与圆筛藻(Coscinodiscus)的形态学比较研究. 植物研究, 2009, 29(3): 282- 288.

