丛枝菌根真菌生物地理学研究进展
陈保冬, 李雪静,徐天乐, 谢 伟
1 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 2 中国科学院大学,北京 100049
生物地理学是生物学与地理学的交叉学科,是研究生物(包括物种、种群、群落、生态系统、景观等不同层次)的时空分布、演化格局及其成因的科学,旨在揭示生物多样性的产生与维持机制,如物种形成、灭绝、扩散与种间相互作用等[1-2]。大型动植物的地带性分布规律和地理分布格局已广为人知,而土壤微生物由于数量大、体积小,世代周期短,对其群落分布的描述不能像动植物一样定量化和可视化,因而物种鉴定一直是微生物地理学研究的一大挑战[3]。近年来,分子生物学技术尤其是高通量测序的出现,绕过了对单个物种的鉴定,直接从基因水平上考查物种多样性,从而使得对微生物空间分布格局及其成因的系统深入研究成为可能[4]。传统上认为土壤微生物在全球范围内随机分布,其群落结构受到所处生境中环境因子的制约[5],即符合Baas-Becking提出假说“Everything is everywhere, but the environment selects”[6]。然而,随着研究的不断深入,研究者们发现微生物具有比Baas-Becking假说更复杂的生物地理分布模式,但对于微生物是否也有与大型动植物相似的地带性分布规律仍然存在广泛争议[7]。
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是陆地生态系统中分布最广的一类共生真菌[8],能够与绝大多数陆地植物形成菌根共生体系。AMF从宿主植物中获取碳源,作为回报,AMF帮助植物从土壤中吸收矿质养分和水分[9-10],通过多种途径增强宿主植物的抗病性[11-12],提高植物对各种逆境胁迫的耐受能力[12-13]。AMF没有严格的宿主专一性,可通过根外菌丝网络实现同种或不同种植物之间资源的再分配,进而影响植物的种间关系和植物群落的物种多样性,维系生态系统结构和功能的稳定性[14-15]。显而易见,对AMF生物多样性和生态分布的研究对于认识AMF的生态重要性和发掘利用AMF生物资源具有重要意义。过去AMF多样性研究大多基于孢子形态鉴定,鉴定效率和辨识度较低,目前仍有很多物种未能被鉴定[16-17],而近年来分子生物学技术特别是高通量测序的发展与应用全面推动了AMF生物地理学研究的发展。Öpik等[18]通过总结已公开发表文章中的Glomeromycota DNA序列数据,建立了“MaarjAM”数据库,使用虚拟种(virtual taxa, VT)来表示AMF物种。目前该数据库中已有348种AMF的VT被描述[19]。将测序数据与GenBank和MaarjAM数据库里的数据进行比对,即可在分子水平对AMF物种进行鉴定。高通量测序和AMF序列数据库的建立无疑为AMF生物地理学研究带来极大的便利。
在概念上,AMF生物地理学主要研究AMF地理分布格局和群落构建机制,包括不同空间和时间尺度下的AMF多样性格局和群落演替规律,及其群落结构和功能的形成、维持和演变机制。很多研究表明,AMF的地理分布格局和群落构建机制依赖于研究的尺度,扩散限制、环境过滤和生物相互作用等过程在AMF群落构建过程中的相对重要性尚无定论[20]。目前,基于高通量测序手段在各个尺度对AMF地理分布格局及影响因素的研究已有较多报道,但缺乏对相关研究结果的总结。基于此,本文在介绍AMF地理分布与群落构建机制假说的基础上,综述国内外有关AMF生物地理学的最新研究成果,总结不同尺度下AMF群落地理分布格局的影响因素,初步提出AMF生物地理学研究理论框架,并对未来的研究进行展望,以期推动AMF生物地理学研究进展。
1 AMF地理分布与群落构建机制
群落结构是指特定时间段内的群落组成和数量特征,主要用丰富度、多度、优势度和重要值等参数来描述[21],群落构建则是指群落中物种多样性的形成和维持机制[22],是生物地理学研究的核心内容之一。目前用于解释AMF群落构建机制的假说主要包括:中性理论(Neutral theory)[23]、生态位理论(Ecological niche theory)[24]和生态位-中性连续统(Niche-neutral continuum)假说[25]。
1.1 中性理论
以Hubbell为代表的生态学家根据种群遗传学的中性理论提出了群落中性理论,该理论认为生态系统中所有物种在功能上都是等价的,物种的分布是广泛和随机的,受地理距离和扩散限制的影响[23,26]。有研究认为AMF群落在自然界中的分布是广泛和随机的,主要受地理距离和扩散限制的影响,因而有理由认为中性理论在AMF群落构建中占据主导地位[27]。如前所述AMF广泛分布于全球各个生境中,并符合种-面积关系和距离-衰减关系,说明中性随机过程在AMF群落构建中发挥着至关重要的作用。van der Gast在研究AMF空间分布的影响因素时发现,扩散限制在很大程度上决定着AMF群落中物种的相对多度。很多研究表明,当研究的生境具有较大的空间尺度和环境梯度时,中性理论在AMF群落组成和地理分布格局中起到重要作用[27,29]。
1.2 生态位理论
Grinell最早将生态位定义为被一个物种(或亚种)所占据的限制性环境因子单元,用来划分环境的空间单位和一个物种在环境中的地位[30]。生态位理论以确定过程为基础,确定过程(土壤性质、气候、物种相互作用等)决定了群落在经过竞争排斥或生态位分化后以某种方式存在于自然生态系统中[31-32],环境过滤和竞争排斥对群落组成起主导作用。已有大量研究表明,环境因子和宿主植物会显著影响AMF群落结构,暗示生态位对AMF多样性维持起着重要作用。Kohout等[33]对温带草原AMF群落的研究发现,尽管AMF群落结构受采样点空间距离的影响,但土壤环境因子和宿主植物生长阶段(营养期/生殖期)是决定AMF群落结构的关键因子;Fitzsimons等[34]分析宿主植物、土壤理化因子、干扰历史在影响AMF群落结构强弱程度时发现,土壤理化因子(尤其是pH和硝态氮含量)能很好地预测AMF群落组成。这些研究表明AMF的群落组成与其所处生境的环境因子及宿主植物特征有关,生态位理论在AMF群落构建中占重要地位。
1.3 生态位-中性连续统假说
尽管生态位理论和中性理论明显不同,但是它们都成功地被用于解释AMF群落构建与多样性分布格局[25,35]。Gravel等[25,36]整合生态位理论与中性随机理论提出生态位-中性连续统假说,认为群落构建可能既含有中性过程,同时又受到生态位的影响,它们的相对作用变化形成了从中性一端到生态位一端的连续谱带。近年来越来越多的研究发现AMF群落结构应该是由扩散限制、环境过滤和物种相互作用共同塑造的结果,但在不同生态系统或不同研究尺度中这些作用的相对重要性不同。例如Hazard等[37]研究发现AMF的群落结构是由局地环境因子与地理距离共同决定的,即生态位理论和中性理论在解释AMF群落构建中的作用是密不可分的。也有研究认为,生态位理论和中性理论在决定AMF群落构建机制中的相对重要性可能会随着环境的变化而发生转换。如Shi等[38]分析了高山草甸生态系统中AMF群落组成情况,发现随着有毒植物蔓延程度的加剧,AMF群落组成从系统发育随机过渡成系统发育聚集,即在没有有毒植物的生境中,AMF群落组成是由随机过程决定的;当有毒植物存在时,环境过滤成为影响AMF群落组成的主要因素。上述结果表明任何生境下AMF群落构建都很难用单一理论来解释,AMF群落构建可能是随机的遗传漂变和生态位分化共同作用的过程。生态位理论和中性理论分别位于生态位-中性连续统的两个极端,更多的研究将中性理论和生态位理论融合,试图将两个理论的合理部分整合到AMF生物地理学理论研究框架中,从而加深对AMF地理分布规律和群落构建机制的认识。
2 不同尺度下AMF地理分布格局与群落构建机制
尺度是自然和社会科学的基本概念,是对某一研究对象(现象)在空间或时间上的量度,分为空间尺度和时间尺度[39]。作为生态学的重要范式,尺度是连接格局和过程的桥梁和纽带[40-41]。一般认为,地理距离和环境因子对微生物分布格局的相对贡献具有尺度依赖性。AMF的群落结构、物种丰富度和多样性随着空间距离或环境因子的变化而呈现某种规律性的分布,但不同尺度下地理距离和环境变量在AMF地理分布格局影响因素中的相对重要性并不相同。目前,国内外对AMF地理分布格局的研究在全球尺度(global scale)、区域尺度(regional scale)、局地尺度(local scale)、小尺度(small scale)上均有报道,在不同尺度下探讨AMF群落地理分布格局及影响因素是目前AMF生物地理学研究的前沿和热点。
2.1 全球尺度
全球尺度的生物地理学研究主要比较分析不同大陆板块、气候带和生态系统的生物群落分布格局,覆盖较大的地理范围。有研究表明全球尺度下AMF群落分布显示出较低的异质性[19]。除南极洲外,其余各大洲均发现了AMF的存在,但受扩散限制的影响,不同的气候带、大陆、生态系统间AMF的群落组成存在显著差异[19,27,42]。Davison等[19]对全球尺度1014个根系样品的分析结果表明,AMF的地理分布可能得益于非生物和生物途径的有效传播而在全球尺度表现出较低的异质性,但不同生境中AMF群落结构则与环境因子和空间距离密切相关,即AMF全球分布符合Baas-Becking假说:AMF的扩散不受地理距离的限制,但局域环境因子决定了其在特定生境中的群落结构。同一生境中的AMF类群在系统发育上是聚集的,生境过滤和扩散限制是影响AMF群落组成的重要因子,群落间物种组成的相似度(β多样性)随地理距离的增加而降低,符合生物地理学的距离-衰减模式[20],由此进一步证实全球尺度下AMF的分布格局主要受地理距离和扩散限制的影响。总体上,全球尺度下中性理论在解释AMF地理分布和群落构建中占主导地位。
2.2 区域尺度
研究人员一般认为区域尺度具有一定的地理跨度,气候、植被等因素变化幅度较大,包括许多地区或由许多斑块联结而成,通常覆盖一个国家或一个较大范围的区域[15,43- 44]。研究发现区域尺度AMF地理分布格局除受到地理距离和扩散限制的影响外,还与土壤理化因子密切相关。Xu等[45]在中国北部的研究结果表明地理距离能最好地解释AMF的系统发育格局,表明AMF群落受到扩散限制的影响,中性理论在其群落构建中占据主导地位。Jansa等[15]在瑞士开展的区域尺度下的研究发现土壤AMF群落主要受地理因子如纬度和地理距离的影响,影响强度超过了土地管理模式。van der Gast等[28]首次报道了AMF具有种-面积关系和距离-衰减关系,并发现环境异质性是AMF在区域尺度分布格局的主要驱动因子。这些研究表明,区域尺度下中性理论在AMF的群落构建中占据主导地位。与此同时,气候因子(如:温度、降水等)和土壤因子(如:pH、土壤有机碳、有效磷等)在决定AMF群落结构中有重要作用。Xiang等[46]发现中国北方农牧交错带不同AMF类群对气候因子有不同的响应,土壤AMF多样性对降水量表现出高度依赖性。Hazard等[37]在爱尔兰通过调查40个代表不同土地利用方式和不同土壤类型的样点发现AMF群落受降水、土壤pH和土壤类型的影响。Hu等[47]在中国北方干旱半干旱草地的研究发现AMF的分布格局受多个环境因子的影响,AMF菌丝密度与年平均温度、土壤粘粒含量、土壤pH显著正相关,而与土壤有机碳和土壤有效氮显著负相关。这些研究结果表明区域尺度下AMF的地理分布格局受地理距离、气候因子和土壤理化因子的综合影响。
2.3 局域尺度
局域尺度的研究往往关注气候条件较为一致,植被、土壤等因素具有一定变化的较小区域[33,48]。一般认为局域尺度下土壤因子和宿主植物是决定AMF空间分布的主要驱动因子[28]。对埃塞俄比亚阿拉伯咖啡树下AMF群落的研究发现,土壤pH、含氮量、有效磷强烈影响AMF群落组成,空间位置或海拔对AMF群落没有影响,即土壤理化因子对AMF的群落结构起着主导作用[49]。Rodríguez-Echeverría等[50]对热带非洲的戈伦戈萨国际公园五种不同植被类型的研究发现植被类型和土壤因子(如pH、土壤含氮量和土壤含碳量等)是决定AMF群落组成的最重要环境因子。魏雪峰[51]在典型干旱荒漠区4个样地研究了AMF多样性及影响因素,发现土壤含水量、土壤pH值、土壤全钙和土壤全镁是影响干旱区AMF群落结构的主要因子。除土壤理化因子外,宿主植物的变化也能改变土壤中的AMF群落组成。Lekberg等[52]在分析入侵植物对AMF群落的影响时发现,菌根植物的入侵能增加AMF丰富度和多度。Hiiesalu等[53]研究发现加拿大萨斯喀彻温本土AMF的丰富度与植物物种丰富度显著正相关,并且AMF丰富度与地下植物丰富度的相关性比与地上植物丰富度的相关性更高,AMF的丰富度与地下生物量以及总的植物生物量负相关。总体上,局域尺度下AMF群落结构与土壤理化因子和宿主植物关系密切,即生态位理论在决定AMF群落构建中占主导地位。
2.4 小尺度
小尺度的研究主要在一些固定的样地开展,面积有限,具有一致的气候、植被条件,物种受扩散限制的影响较小[54- 55]。研究人员对某些研究区域进行长期动态监测,即属于小尺度的研究。小尺度下,在不受人为干扰的自然生境中,由于有较小的地理距离和相似的环境因子,AMF群落多呈现空间自相关[56- 57]。小尺度下AMF群落结构会对环境变化做出响应,表明生态位理论在塑造AMF群落中的重要作用。例如,Yang等[57]比较了短期(15天)淹水前后AMF的群落组成,发现淹水增加了宿主植物根系AMF丰富度。Chen等[58]在我国北方温带草原六年的施肥试验结果也表明施加N肥显著改变了土壤中AMF群落结构。Klabi等[59]研究发现草地上增加固氮豆科植物能提高土壤中的AMF多样性。此外,小尺度的研究还发现环境变化会使AMF群落构建机制发生转变,如Liu等[54]研究表明AMF群落在未施肥和施肥处理后分别呈现系统发育聚集和系统发育随机分布的状态。这些研究表明,自然环境中AMF的群落构建机制并不是一成不变的,AMF群落能够对环境变化做出敏感的响应。当外界环境发生改变时,AMF群落通过调整群落结构来适应环境,进一步表明了生态位理论在决定AMF群落构建中的重要作用,以及AMF群落结构可能对环境变化具有很好的指示作用。
2.5 海拔梯度和时间尺度下AMF群落分布格局及构建机制
目前对海拔梯度和时间尺度下AMF群落分布格局及构建机制的研究还比较少。普遍认为AMF群落结构在不同海拔间存在差异,中海拔地区的AMF群落丰富度高于低海拔和高海拔地区,呈单峰分布[60- 62]。也有研究表明,AMF多样性随着海拔的升高而降低[63]。海拔梯度下AMF群落结构的差异可能是由不同海拔的土壤理化因子和宿主植物群落差异导致的。Li等[64]比较青藏高原不同海拔两种宿主植物根部AMF物种丰富度发现Kobresiasp.根中AMF物种丰富度在不同海拔没有显著差异,而P.centrasiaticum根中AMF物种丰富度在中海拔显著高于低海拔和高海拔。时间尺度上,AMF群落结构表现出季节差异和年际变化[65-66]。季节性差异可能与季节变化造成的气候因子(温度和日照时间等)与土壤理化因子差异有关,而年际变化主要与生态系统演替造成的环境变化有关。在2007年5月、8月、10月对宁夏沙坡头地区豆科植物沙冬青的根围土壤AMF的比较分析中发现,AMF各物种在3个时期均有分布,并且孢子密度和泡囊定殖率在8月份最高,菌丝侵染率和总定殖率在10月份最高[67]。Escudero等[68]在温带草原沿水分梯度研究四个地点AMF季节变异时发现,孢子密度在夏季最高,冬季最低。Bainard等[69]研究发现根和土壤中的AMF群落组成在生长季期间(6月、7月、8月)发生变化,而且在根中表现尤其明显。Cui等[70]在中国华东地区沿海盐碱地带4种植被3个复垦阶段AMF群落组成和多样性的研究中发现,植被演替过程中AMF的多样性指数和丰富度指数下降,AMF群落结构发生改变。这些研究结果表明AMF群落结构在海拔梯度和时间尺度下的变化可能是由该生境下的环境因子和宿主植物共同决定的,即在海拔梯度和时间尺度下AMF表现出明显的生态位分化现象。
3 总结和展望
3.1 总结
AMF在自然界中并非简单随机分布,而是受环境因子和宿主植物的影响,呈现某种非随机性的分布规律,并且不同尺度下AMF地理分布格局的主要驱动因子以及群落构建机制不同。总结近年来AMF生物地理学研究结果,在此初步构画了AMF生物地理学研究理论框架(图1),认为从全球尺度到小尺度,AMF群落结构均是由生态位理论和中性理论共同塑造的,符合生态位-中性连续统假说。宿主植物、地理因子、气候因子和土壤因子共同决定了AMF的群落结构,但不同尺度下这些驱动因子的相对重要性不同。中性理论和生态位理论分别位于生态位-中性连续统假说的两端,在全球尺度和区域尺度,AMF的地理分布格局主要受空间地理距离和气候因子的影响,中性理论的作用大于生态位理论。随着空间尺度的缩减,宿主植物和环境因子对AMF群落的影响胜过地理距离和扩散限制的作用,生态位理论取代中性理论在AMF群落构建中占优势。某一生境中AMF群落构建机制并不是一成不变的,而是受到外界环境变化的影响,外界环境可能改变中性理论和生态位理论在决定AMF群落结构中的相对重要性。需要注意的是,限于已开展研究工作的有限性,对于AMF群落可能还存在一些未被充分认识的驱动因子,因而还需进一步系统深入的研究来完善AMF生物地理学研究理论框架。
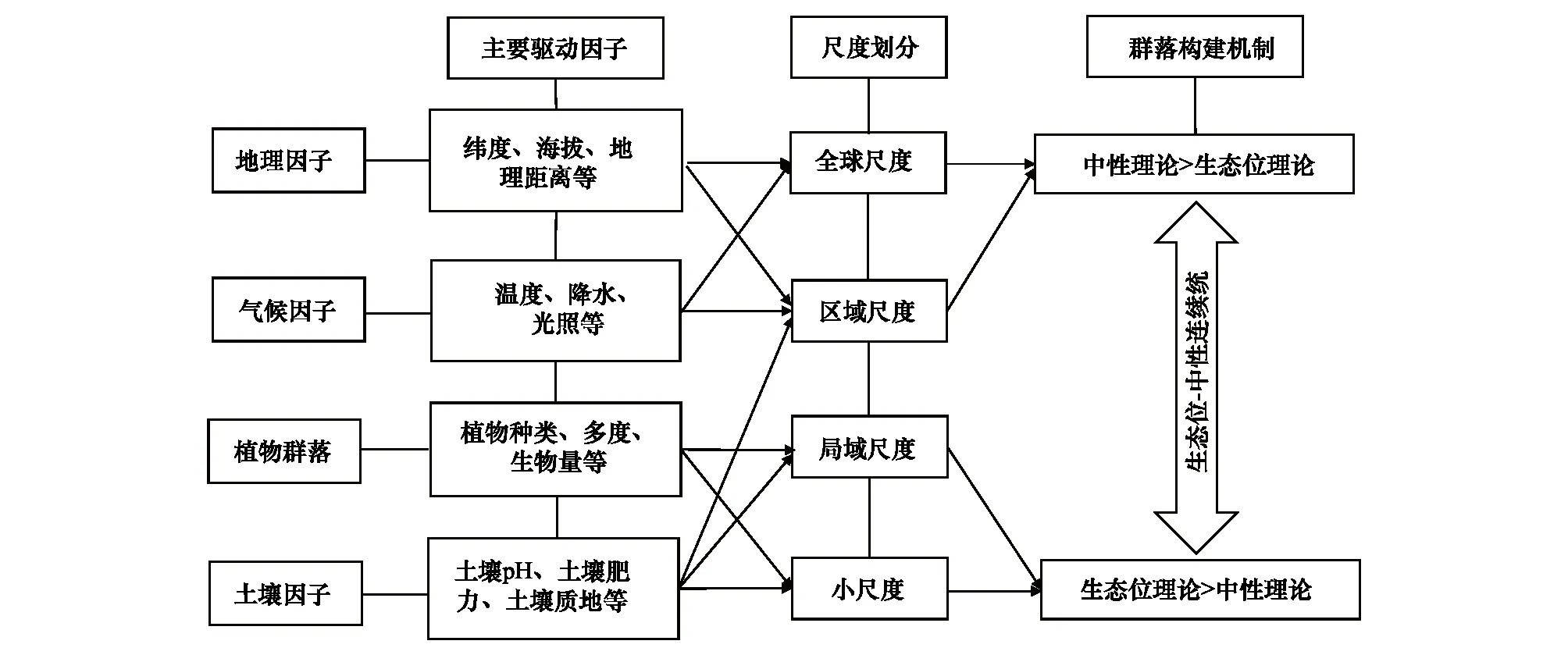
图1 AMF生物地理学研究理论框架Fig.1 Theoretical framework for the studies on biogeography of arbuscular mycorrhizal fungi
3.2 展望
AMF生物地理学研究主要依赖于土壤样品的采集和物种鉴定,分子生物学特别是高通量测序技术的出现极大方便了AMF生物地理学研究。未来的研究中应同时进行大规模的野外调查、多因子模拟实验和室内培养实验,系统深入地探讨不同生境中影响AMF群落结构的关键因子和调控途径,建立物种-生境数据库,这对于AMF的资源管理和生态应用具有重要意义。随着不同尺度和不同生态系统AMF多样性研究结果的积累,公共数据挖掘和文献整合将成为探讨AMF生物地理分布格局及影响因素的便捷手段。基于数据整合,同时借鉴传统生物地理学模型(种-面积关系、距离-衰减关系、岛屿生物地理学理论),建立解释AMF群落构建机制的模型,可望全面揭示AMF生物地理分布规律及形成机制。
迄今为止,AMF生物地理学研究主要集中在空间尺度,而在时间尺度和海拔梯度上的报道尚少。AMF在植物群落演替中扮演着重要角色,有必要在小尺度下研究不同植被演替阶段AMF群落的变化,保存同一研究地点不同时期的土壤样品,用于时间尺度下AMF群落动态的研究。全面认识和理解AMF群落的时空动态有利于更好地预测未来环境变化对生态系统结构和功能的影响,并有助于制定环境变化应对策略。总之,今后对AMF生物地理学的研究应将时间尺度和空间尺度结合起来,以便更全面地认识AMF地理分布格局和群落构建机制,从而进一步丰富和完善AMF生物地理学理论。
[1] Crisp M D, Trewick S A, Cook L G. Hypothesis testing in biogeography. Trends in Ecology & Evolution, 2011, 26(2): 66- 72.
[2] Martiny J B H, Bohannan B J M, Brown J H, Colwell R K, Fuhrman J A, Green J L, Horner-Devine M C, Kane M, Krumins J A, Kuske C R, Morin P J, Naeem S, Øvreås L, Reysenbach A L, Smith V H, Staley J T. Microbial biogeography: putting microorganisms on the map. Nature Reviews Microbiology, 2006, 4(2): 102- 112.
[3] Fitter A H, Heinemeyer A, Husband R, Olsen E, Ridgway K P, Staddon P L. Global environmental change and the biology of arbuscular mycorrhizas: gaps and challenges. Canadian Journal of Botany, 2004, 82(8): 1133- 1139.
[4] 贺纪正, 葛源. 土壤微生物生物地理学研究进展. 生态学报, 2008, 28(11): 5571- 5582.
[5] O′Malley M A. The nineteenth century roots of ‘everything is everywhere’. Nature Reviews Microbiology, 2007, 5(8): 647- 651.
[6] De Wit R, Bouvier T. ‘Everythingiseverywhere, but,theenvironmentselects’; what did Baas Becking and Beijerinck really say? Environmental Microbiology, 2006, 8(4): 755- 758.
[7] Lugo M A, Ferrero M, Menoyo E, Estévez M C, Sieriz F, Anton A. Arbuscular mycorrhizal fungi and rhizospheric bacteria diversity along an altitudinal gradient in South American Puna grassland. Microbial Ecology, 2008, 55(4): 705- 713.
[8] Harley J L, Smith S E. Mycorrhizal Symbiosis[M]. London: Academic Press Inc., 1983.
[9] Hill J O, Simpson R J, Ryan M H, Chapman D F. Root hair morphology and mycorrhizal colonisation of pasture species in response to phosphorus and nitrogen nutrition. Crop and Pasture Science, 2010, 61(2): 122- 131.
[10] Augé R M. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis. Mycorrhiza, 2001, 11(1): 3- 42.
[11] Johnson N C, Wilson G W T, Bowker M A, Wilson J A, Miller R M. Resource limitation is a driver of local adaptation in mycorrhizal symbioses. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(5): 2093- 2098.
[12] Sikes B A, Cottenie K, Klironomos J N. Plant and fungal identity determines pathogen protection of plant roots by arbuscular mycorrhizas. Journal of Ecology, 2009, 97(6): 1274- 1280.
[13] Li T, Hu Y J, Hao Z P, Li H, Wang Y S, Chen B D. First cloning and characterization of two functional aquaporin genes from an arbuscular mycorrhizal fungusGlomusintraradices. New Phytologist, 2013, 197(2): 617- 630.
[14] van der Heijden M G A, Klironomos J N, Ursic M, Moutoglis P, Streitwolf-Engel R, Boller T, Wiemken A, Sanders I R. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 1998, 396(6706): 69- 72.
[15] Jansa J, Erb A, Oberholzer H R,milauer P, Egli S. Soil and geography are more important determinants of indigenous arbuscular mycorrhizal communities than management practices in Swiss agricultural soils. Molecular Ecology, 2014, 23(8): 2118- 2135.
[16] Senés-Guerrero C, Schüßler A. DNA-based characterization and identification of arbuscular mycorrhizal fungi species // Martin F, Uroz S, eds. Microbial Environmental Genomics (MEG). New York: Springer, 2016, 1399: 101- 123.
[17] Krüger M, Krüger C, Walker C, Stockinger H, Schüßler A. Phylogenetic reference data for systematics and phylotaxonomy of arbuscular mycorrhizal fungi from phylum to species level. New Phytologist, 2012, 193(4): 970- 984.
[18] Öpik M, Vanatoa A, Vanatoa E, Moora M, Davison J, Kalwij J M, Reier Ü, Zobel M. The online database MaarjAMreveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi (Glomeromycota). New Phytologist, 2010, 188(1): 223- 241.
[19] Davison J, Moora M, Öpik M, Adholeya A, Ainsaar L, BA, Burla S, Diedhiou A G, Hiiesalu I, Jairus T, Johnson N C, Kane A, Koorem K, Kochar M, Ndiaye C, Partel M, Reier Ü, Saks Ü, Singh R, Vasar M, Zobel M. Global assessment of arbuscular mycorrhizal fungus diversity reveals very low endemism. Science, 2015, 349(6251): 970- 973.
[20] Kivlin S N, Hawkes C V, Treseder K K. Global diversity and distribution of arbuscular mycorrhizal fungi. Soil Biology and Biochemistry, 2011, 43(11): 2294- 2303.
[21] 李岩, 焦惠, 徐丽娟, 赵洪海, 刘润进. AM真菌群落结构与功能研究进展. 生态学报, 2010, 30(4): 1089- 1096.
[22] 牛克昌, 刘怿宁, 沈泽昊, 何芳良, 方精云. 群落构建的中性理论和生态位理论. 生物多样性, 2009, 17(6): 579- 593.
[23] Hubbell S P. The Unified Neutral Theory of Biodiversity and Biogeography. Princeton and Oxford: Princeton University Press, 2001.
[24] Dumbrell A J, Nelson M, Helgason T, Dytham C, Fitter A H. Relative roles of niche and neutral processes in structuring a soil microbial community. The ISME journal, 2010, 4(3): 337- 345.
[25] Gravel D, Canham C D, Beaudet M, Messier C. Reconciling niche and neutrality: the continuum hypothesis. Ecology Letters, 2006, 9(4): 399- 409.
[26] Bell G. The distribution of abundance in neutral communities. The American Naturalist, 2000, 155(5): 606- 617.
[27] 杨海水, 熊艳琴, 王琪, 郭伊, 戴亚军, 许明敏. AM真菌物种多样性: 生态功能、影响因素及维持机制. 生态学报, 2016, 36(10): 2826- 2832.
[28] van der Gast C J, Gosling P, Tiwari B, Bending G D. Spatial scaling of arbuscular mycorrhizal fungal diversity is affected by farming practice. Environmental Microbiology, 2011, 13(1): 241- 249.
[29] Öpik M, Zobel M, Cantero J J, Davison J, Facelli J M, Hiiesalu I, Jairus T, Kalwij J M, Koorem K, Leal M E, Liira J, Metsis M, Neshataeva V, Paal J, Phosri C, Põlme S, Reier Ü, Saks Ü, Schimann H, Thiéry O, Vasar M, Moora M. Global sampling of plant roots expands the described molecular diversity of arbuscular mycorrhizal fungi. Mycorrhiza, 2013, 23(5): 411- 430.
[30] Grinnell J. The niche-relationships of the California Thrasher. The Auk, 1917, 34(4): 427- 433.
[31] McGill B J. A test of the unified neutral theory of biodiversity. Nature, 2003, 422(6934): 881- 885.
[32] Leibold M A, McPeek M A. Coexistence of the niche and neutral perspectives in community ecology. Ecology, 2006, 87(6): 1399- 1410.
[33] Kohout P, Doubková P, Bahram M, Suda J, Tedersoo L, Voríšková J, Sudová R. Niche partitioning in arbuscular mycorrhizal communities in temperate grasslands: a lesson from adjacent serpentine and nonserpentine habitats. Molecular Ecology, 2015, 24(8): 1831- 1843.
[34] Fitzsimons M S, Miller R M, Jastrow J D. Scale-dependent niche axes of arbuscular mycorrhizal fungi. Oecologia, 2008, 158(1): 117- 127.
[35] Powell J R, Karunaratne S, Campbell C D, Yao H Y, Robinson L, Singh B K. Deterministic processes vary during community assembly for ecologically dissimilar taxa. Nature Communications, 2015, 6: 8444.
[36] Ai D, Chu C J, Ellwood M D F, Hou R, Wang G. Migration and niche partitioning simultaneously increase species richness and rarity. Ecological Modelling, 2013, 258: 33- 39.
[37] Hazard C, Gosling P, Van der Gast C J, Mitchell D T, Doohan F M, Bending G D. The role of local environment and geographical distance in determining community composition of arbuscular mycorrhizal fungi at the landscape scale. The ISME Journal, 2013, 7(3): 498- 508.
[38] Shi G X, Liu Y J, Mao L, Jiang S J, Zhang Q, Cheng G, An L Z, Du G Z, Feng H Y. Relative importance of deterministic and stochastic processes in driving arbuscular mycorrhizal fungal assemblage during the spreading of a toxic plant. PLoS One, 2014, 9(4): e95672.
[39] 赵文武, 傅伯杰, 吕一河, 陈利顶. 多尺度土地利用与土壤侵蚀. 地理科学进展, 2006, 25(1): 24- 33.
[40] Peterson D L, Parker V T. Ecological Scale: Theory and Applications. New York: Columbia University Press, 1998.
[41] 吕一河, 傅伯杰. 生态学中的尺度及尺度转换方法. 生态学报, 2001, 21(12): 2096- 2105.
[42] Soudzilovskaia N A, Douma J C, Akhmetzhanova A A, van Bodegom P M, Cornwell W K, Moens E J, Treseder K K, Tibbett M, Wang Y P, Cornelissen J H C. Global patterns of plant root colonization intensity by mycorrhizal fungi explained by climate and soil chemistry. Global Ecology and Biogeography, 2015, 24(3): 371- 382.
[43] Xiang D, Verbruggen E, Hu Y J, Veresoglou S D, Rillig M C, Zhou W P, Xu T L, Li H, Hao Z P, Chen Y L, Chen B D. Land use influences arbuscular mycorrhizal fungal communities in the farming-pastoral ecotone of northern China. New Phytologist, 2014, 204(4): 968- 978.
[44] Bouffaud M L, Bernaud E, Colombet A, van Tuinen D, Wipf D, Redecker D. Regional-scale analysis of arbuscular mycorrhizal fungi: the case of Burgundy vineyards. OENO One, 2016, 50(1): 1- 8.
[46] Xiang D, Veresoglou S D, Rillig M C, Xu T L, Li H, Hao Z P, Chen B D. Relative importance of individual climatic drivers shaping arbuscular mycorrhizal fungal communities. Microbial Ecology, 2016, 72(2): 418- 427.
[47] Hu Y J, Rillig M C, Xiang D, Hao Z P, Chen B D. Changes of AM fungal abundance along environmental gradients in the arid and semi-arid grasslands of northern China. PLoS One, 2013, 8(2): e57593.
[48] Alguacil M M, Torrecillas E, Lozano Z, Roldán A. Arbuscular mycorrhizal fungi communities in a coral cay system (Morrocoy, Venezuela) and their relationships with environmental variables. Science of the Total Environment, 2015, 505: 805- 813.
[49] de Beenhouwer M, Muleta D, Peeters B, Van Geel M, Lievens B, Honnay O. DNA pyrosequencing evidence for large diversity differences between natural and managed coffee mycorrhizal fungal communities. Agronomy for Sustainable Development, 2015, 35(1): 241- 249.
[50] Rodríguez-Echeverría S, Teixeira H, Correia M, Timóteo S, Heleno R, Öpik M, Moora M. Arbuscular mycorrhizal fungi communities from tropical Africa reveal strong ecological structure. New Phytologist, 2017, 213(1): 380- 390.
[51] 魏雪峰. 干旱区水盐梯度下植物与AM真菌物种多样性耦合关系研究[D]. 乌鲁木齐: 新疆大学, 2014.
[52] Lekberg Y, Gibbons S M, Rosendahl S, Ramsey P W. Severe plant invasions can increase mycorrhizal fungal abundance and diversity. The ISME Journal, 2013, 7(7): 1424- 1433.
[53] Hiiesalu I, Pärtel M, Davison J, Gerhold P, Metsis M, Moora M, Öpik M, Vasar M, Zobel M, Wilson S D. Species richness of arbuscular mycorrhizal fungi: associations with grassland plant richness and biomass. New Phytologist, 2014, 203(1): 233- 244.
[54] Liu Y J, Mao L, Li J Y, Shi G X, Jiang S J, Ma X J, An L Z, Du G Z, Feng H Y. Resource availability differentially drives community assemblages of plants and their root-associated arbuscular mycorrhizal fungi. Plant and Soil, 2015, 386(1/2): 341- 355.
[55] Horn S, Caruso T, Verbruggen E, Rillig M C, Hempel S. Arbuscular mycorrhizal fungal communities are phylogenetically clustered at small scales. The ISME Journal, 2014, 8(11): 2231- 2242.
[56] Toljander J F, Eberhardt U, Toljander Y K, Paul L R, Taylor A F S. Species composition of an ectomycorrhizal fungal community along a local nutrient gradient in a boreal forest. New Phytologist, 2006, 170(4): 873- 884.
[57] Yang H S, Koide R T, Zhang Q. Short-term waterlogging increases arbuscular mycorrhizal fungal species richness and shifts community composition. Plant and Soil, 2016, 404(1/2): 373- 384.
[58] Chen Y L, Chen B D, Hu Y J, Li T, Zhang X, Hao Z P, Wang Y S. Direct and indirect influence of arbuscular mycorrhizal fungi on abundance and community structure of ammonia oxidizing bacteria and archaea in soil microcosms. Pedobiologia, 2013, 56(4/6): 205- 212.
[59] Klabi R, Bell T H, Hamel C, Iwaasa A, Schellenberg M, Raies A, St-Arnaud M. Plant assemblage composition and soil P concentration differentially affect communities of AM and total fungi in a semi-arid grassland. FEMS Microbiology Ecology, 2015, 91(1): 1- 13.
[60] Coutinho E S, Fernandes G W, Berbara R L L, Valério H M, Goto B T. Variation of arbuscular mycorrhizal fungal communities along an altitudinal gradient in rupestrian grasslands in Brazil. Mycorrhiza, 2015, 25(8): 627- 638.
[61] Yang R, Li S M, Cai X B, Li X L, Christie P, Zhang J L, Gai J P. Responses of arbuscular mycorrhizal symbionts to contrasting environments: field evidence along a Tibetan elevation gradient. Mycorrhiza, 2016, 26(7): 623- 632.
[62] Wahl A L, Spiegelberger T. Arbuscular mycorrhizal fungi in changing mountain grassland ecosystems: a challenge for research. Botany, 2016, 94(6): 435- 458.
[63] Gai J P, Tian H, Yang F Y, Christie P, Li X L, Klironomos J N. Arbuscular mycorrhizal fungal diversity along a Tibetan elevation gradient. Pedobiologia, 2012, 55(3): 145- 151.
[64] Li X L, Gai J P, Cai X B, Li X L, Christie P, Zhang F S, Zhang J L. Molecular diversity of arbuscular mycorrhizal fungi associated with two co-occurring perennial plant species on a Tibetan altitudinal gradient. Mycorrhiza, 2014, 24(2): 95- 107.
[65] Sommerfeld H M, Díaz L M, Alvarez M, Villanueva C A, Matus F, Boon N, Boeckx P, Huygens D. High winter diversity of arbuscular mycorrhizal fungal communities in shallow and deep grassland soils. Soil Biology and Biochemistry, 2013, 65: 236- 244.
[66] Helgason T, Feng H Y, Sherlock D J, Young J P W, Fitter A H. Arbuscular mycorrhizal communities associated with maples (Acerspp.) in a common garden are influenced by season and host plant. Botany, 2014, 92(4): 321- 326.
[67] 贺学礼, 刘雪伟, 李英鹏. 沙坡头地区沙冬青AM真菌的时空分布. 生态学报, 2010, 30(2): 370- 376.
[68] Escudero V, Mendoza R. Seasonal variation of arbuscular mycorrhizal fungi in temperate grasslands along a wide hydrologic gradient. Mycorrhiza, 2005, 15(4): 291- 299.
[69] Bainard L D, Bainard J D, Hamel C, Gan Y T. Spatial and temporal structuring of arbuscular mycorrhizal communities is differentially influenced by abiotic factors and host crop in a semi-arid prairie agroecosystem. FEMS Microbiology Ecology, 2014, 88(2): 333- 344.
[70] Cui X C, Hu J L, Wang J H, Yang J S, Lin X G. Reclamation negatively influences arbuscular mycorrhizal fungal community structure and diversity in coastal saline-alkaline land in Eastern China as revealed by Illumina sequencing. Applied Soil Ecology, 2016, 98: 140- 149.

