基于功能性状评价5种植物对热带珊瑚岛环境的适应性
罗 琦,刘 慧,吴桂林,贺鹏程,华 雷,朱丽薇,张 辉,刘 楠,简曙光,叶 清,*
1 中国科学院华南植物园退化生态系统植被恢复与管理重点实验室, 广州 510650 2 中国科学院华南植物园广东省应用植物学重点实验室,广州 510650 3 中国科学院大学,北京 100049
随着全球经济的快速发展和陆地资源的日渐枯竭,海洋开发已经成为许多发达国家的重要战略。海岛作为海洋系统的重要组成部分,资源价值巨大,合理开发利用海岛资源关系到国家未来的可持续发展,已引起政府和学术界高度关注[1]。与此同时,海岛作为重要的旅游资源,可以极大满足人们日益增长的休闲娱乐需求。因此,海岛资源开发利用已成为21世纪社会、发展重要条件之一[1]。但由于热带珊瑚岛基质具有缺少土壤结构、缺养分、盐碱度高、含水量极低等特点[2-3],加上当地高温、强光等气候环境条件,自然情况下无法形成植被及相应的宜居环境,难以支撑岛礁上的生存、生活、生产等活动及实现可持续发展的生态岛目标。因此,在热带珊瑚岛进行植被新建具有重要意义[4]。物种选择是热带珊瑚岛植被新建成功与否的关键,除此之外,还受到土壤、水分条件、人工护理、物种选择等各方面的影响。干旱胁迫是热带珊瑚岛地区存在的主要的环境问题之一,严重影响热带珊瑚岛植物的存活率,因此有必要针对植物的生理生态特性开展研究,通过测定植物的光合/水力功能性状,评价不同物种对热带珊瑚岛干旱环境的适应性。
植物在漫长的进化过程中,逐步形成了有效适应干旱环境的机制。植物抗旱策略有气孔调节与非气孔调节两种方式。气孔调节是气孔通过生理学途径对植物的蒸腾作用进行调节,主要表现在气孔特征构造差异和气孔对环境诱导的反馈机制上[5]。非气孔调节主要包括叶片导水率(Kleaf)、膨压丧失点(Ψtlp)、比叶面积(SLA)的改变等,帮助植物适应干旱胁迫。叶片导水阻力在整株阻力中具有较高的比重(>30%),是植物水分传输的瓶颈[6]。叶片导水率反映植物水分传输速率和效率,与植物叶片光合作用密切相关[7-8]。膨压丧失点表征植物抗旱能力,是植物耐水分胁迫的重要指标,Ψtlp越低说明植物维持膨压的能力越强[9]。比叶面积是指单位干重的鲜叶表面积,与植物抗旱性紧密相关,较低比叶面积的植物将更多的物质用于构建保卫构造,可以有效的减小蒸腾和叶片过度失水[10- 14]。
国内外对热带珊瑚岛生态方面的研究多集中在环境评估、资源调查、群落动态等方面[15-17],而热带珊瑚岛适生植物对逆境的生理生态适应机制方面的研究却鲜见报道。李婕等[18]从植物存活率及碳同化角度研究了7种植物对热带珊瑚岛的生态适应性,但并未考虑植物的水力性状及抗旱策略之间的差异。草海桐、厚藤、木麻黄、花生、椰子是广泛分布于热带海滨地区的植物,具有较高的抗旱、耐盐能力[3,19]。本研究以从海南省文昌市苗圃移植到热带珊瑚岛上的这5种植物为研究对象,通过对比植物在两地的光合及水力特性,评价其对为热带珊瑚岛干旱环境的适应性。
1 材料与方法
1.1 研究地概况
本实验苗圃位于海南省文昌市郊区(110°45′ E,19°31′N),地势低平,海拔约10m;属热带海洋性季风气候,年平均气温约24℃,年降水量约1800mm,土壤类型为滨海沉积物沙壤土。本研究的热带珊瑚岛海拔约5m,属热带海洋性季风气候。光照强烈,年平均气温约28℃,年平均降水量约2800mm,但降水量分配不均,旱季时间长;现有土壤基质为珊瑚沙,具有干旱、盐碱和贫瘠等极端环境特点,几乎无植物生长。
1.2 实验材料及方法
基于前期对西沙群岛的植物调查及研究[3,19],本研究针对热带珊瑚岛特殊生境(高温、强光、高碱和贫瘠等)的5种潜在适生植物,即:草海桐(Scaevolataccada)、厚藤(Ipomoeapescaprae)木麻黄(Casuarinaequisetifolia)、花生(Arachishypogaea)、椰子(Cocosnucifera)。本实验中海岛上的植株均于2015年5月移植自文昌苗圃,除移植时使用少量客土以提高存活率之外,后期没有对种植在两地植株进行额外的人工护理;而环境因子的差异,如水分条件和光照辐射等,对植物功能性状的影响正是本文关注的重点,也是开展对比研究的出发点。测量时选取完全展开、长势良好的成熟叶片,于2016年6月测定其光合作用/水分运输相关功能性状。
1.2.1 光合作用
最大光合速率(Amax)、蒸腾速率(Tr)、气孔导度率(gs)的测定选择晴天的9:00—11:00进行。选取向阳生长的枝条,使用光合仪(LI- 6400,LI-COR,Nebraska,USA)进行原位测定,光照强度设定为1500μmol m-2s-1;参比室CO2通量为400μmol/mol,待数据稳定后(一般3—5min)记录。叶片瞬时水分利用效率(WUE)根据WUE=Amax/Tr计算得到。
1.2.2 叶片膨压丧失点
于16:00—18:00从野外采集阳生的叶片,迅速放入水桶内,用黑色塑料袋密封,防止蒸腾作用,带回实验室过夜,使叶片吸水饱和。取生长状况良好的叶片,迅速测定其饱和鲜重(SW)。用PMS压力室(PMS,Corvallis,Oregon,USA)测定其水势,然后测定该水势相对应的鲜重(FW)。将叶片放置在实验台上待水势下降0.3MPa左右,再次测定其水势和重量,如此重复测定直至叶片水势下降不明显为止。测定完成后将叶片放到65℃的烘箱中48h,测其干重(DW),计算叶片的相对含水量[20]:RWC=100×(FW-DW)/(SW-DW)。通过拟合叶片水势和相对含水量曲线的程序,计算叶片膨压丧失点的水势[21]。
1.2.3 叶片导水率
叶片水力导度(Kleaf)的测定采用Franks[22]的方法。Kleaf= Δν/ (10× Aleaf× (Ψ1-Ψ2)),其中Δν为从压力势(Ψ1)迅速升高到压力势(Ψ2)时前10秒的水流量,Ψ1等于饱和叶片的水势;Aleaf是叶片的面积;压力势Ψ2比Ψ1高约0.5MPa。
1.2.4 比叶面积
用叶面积仪(Li- 3000A,Li-Cor,Lincoln,NE,USA)测量植物叶片面积(LA)。测量后的叶片置于65℃烘箱中烘干测定干重(DW)。比叶面积(SLA)计算方法为[23]:SLA = LA/DW。
1.2.5稳定性碳同位素含量(δ13C)及叶片碳含量(LC)
将烘干的样品研磨后送往华南植物园公共实验室,对稳定性碳同位素含量(δ13C)及叶片碳含量(C)进行测定,测定仪器为稳定同位素质谱仪(IsoPrime100, IsoPrime, Manchester, UK)。稳定性碳同位素含量(δ13C)是判断植物长期水分利用效率的可靠指标,δ13C越高(负值越小)植物叶片长期水分利用率越高[24]。
1.3 数据分析
用SPSS 18.0软件对生长在不同生境的同种苗木的性状进行t检验,利用Origin 16.0作图。
2 结果分析
2.1 光合速率与叶片经济学性状
图1为5种植物在文昌和海岛两地最大光合速率(Amax)、蒸腾速率(Tr)、比叶面积(SLA)及叶片干物质含量(LC)的比较。与生长在文昌苗圃的植物相比,热带珊瑚岛地区的草海桐、厚藤、木麻黄最大光合速率(Amax)均显著升高,而花生、椰子没有显著差异(图1)。热带珊瑚岛地区木麻黄的蒸腾速率(Tr)显著升高,除木麻黄外,其余植物的蒸腾速率(Tr)在两地间均无显著差异(图1)。与文昌苗圃的植物相比,热带珊瑚岛地区椰子的比叶面积(SLA)没有显著变化,其余4种植物的比叶面积(SLA)较文昌苗圃的植物均显著降低(图1)。与文昌苗圃的植物相比,热带珊瑚岛地区5种植物的叶片碳含量均有所下降,其中草海桐、花生、椰子与文昌相比差异明显(图1)。
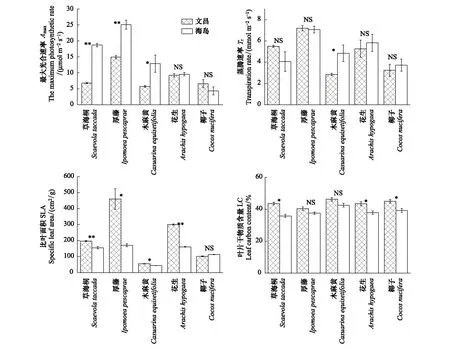
图1 5种植物在热带珊瑚岛和文昌的最大光合速率Amax,蒸腾速率Tr,比叶面积SLA,叶片碳含量LC(平均值±标准误差)Fig.1 Comparison of Amax, Tr, SLA, LC value (Means±SE) of five plant species planted in Wenchang nursery and island*表示两地值差异显著(P<0.05);**表示两地值差异极显著(P<0.01);NS表示两地值无显著差异
2.2 植物水分利用效率
图2为5种植物在文昌和海岛两地瞬时水分利用效率(WUE)和稳定碳同位素(δ13C)的比较。热带珊瑚岛地区草海桐、厚藤的瞬时水分利用(WUE)效率显著高于文昌苗圃的植物,而其余3种植物WUE在两地差异不显著(图2)。与文昌相比,热带珊瑚岛地区除椰子外的其余4种植物稳定碳同位素含量均有上升,其中木麻黄和花生与文昌苗圃的植物相比差异显著(图2)。
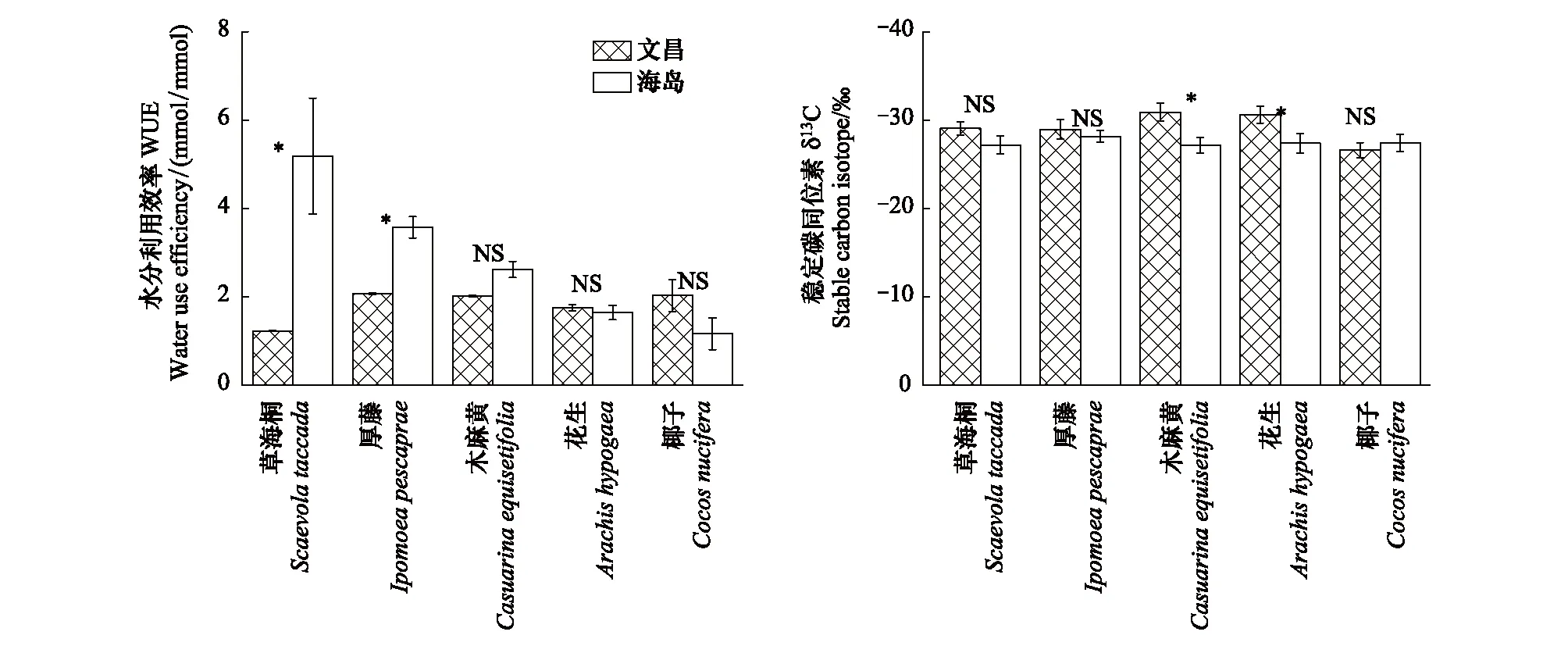
图2 5种植物在热带珊瑚岛和文昌的瞬时水分利用效率WUE,稳定碳同位素含量δ13C (平均值±标准误差)Fig.2 Comparison of WUE, δ13C of five plant species planted in Wenchang nursery and island
2.3 水力性状
图3为5种植物在文昌和海岛两地气孔导度(gs)、叶片导水率(Kleaf)、膨压丧失点处的水势(Ψtlp)的比较。热带珊瑚岛地区厚藤、木麻黄的气孔导度(gs)显著上升,而其余3种植物gs没有显著变化(图3);厚藤、木麻黄、椰子3种植物的叶片导水率(Kleaf)较文昌地区显著上升,花生的叶片导水率(Kleaf)显著下降,草海桐的叶片导水率(Kleaf)无显著差异(图3);与文昌相比,热带珊瑚岛地区厚藤和花生膨压丧失点处的水势(Ψtlp)显著降低,而其余3种植物膨压丧失点处的水势(Ψtlp)无显著差异(图3c);
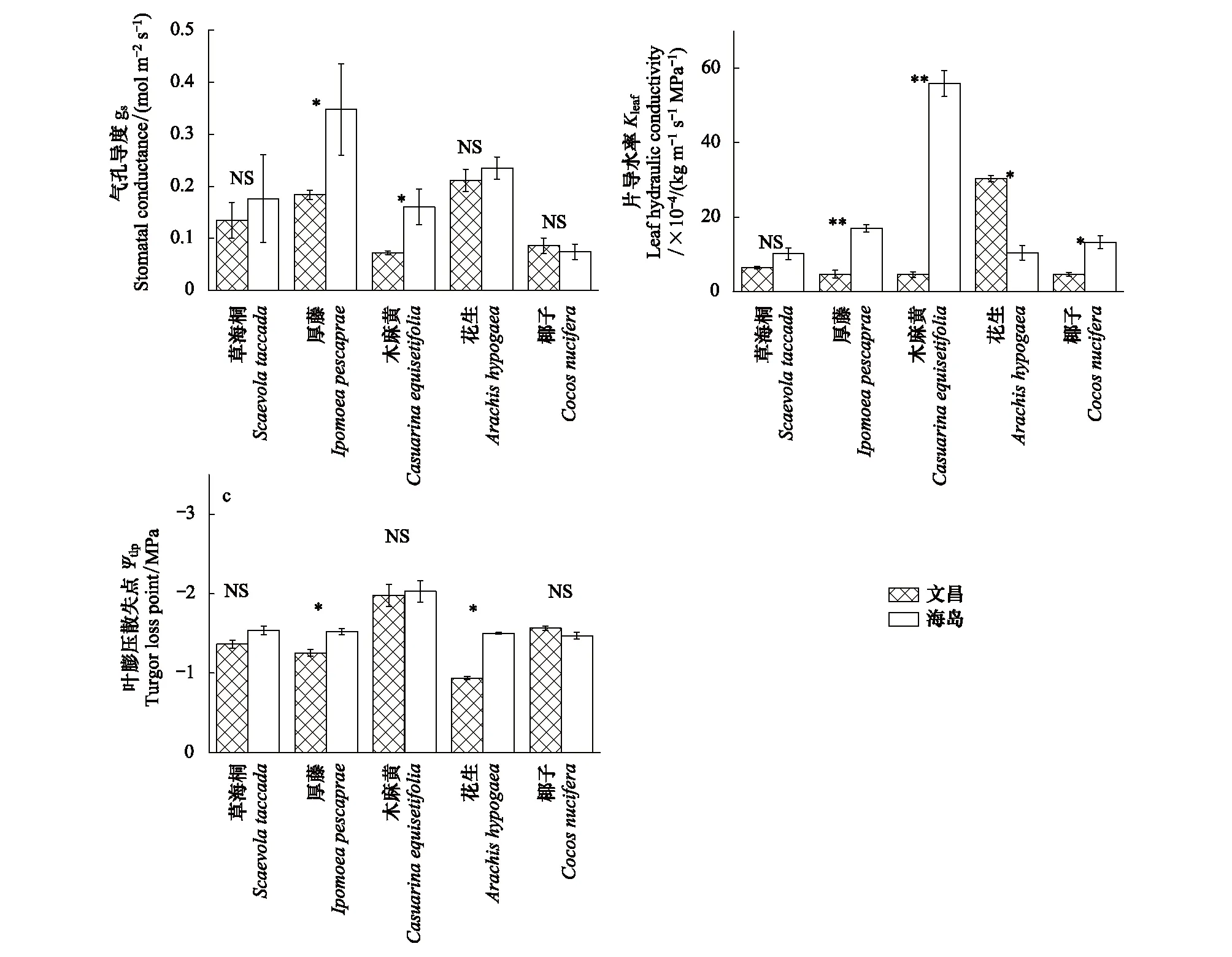
图3 5种植物在热带珊瑚岛和文昌的气孔导度gs,叶片导水率Kleaf,膨压丧失点Ψtlp (平均值±标准误差)Fig.3 Comparison of gs, Kleaf, Ψtlp value of fiveplant species planted in Wenchang nursery and island (Mean±SE)
3 讨论
3.1 光合速率和叶片经济学性状
光合速率反映植物碳同化的能力,可以表征植物的生长状况,因此一般将最大光合速率作为判断植物对环境综合适应能力的重要指标之一[25]。本研究发现,移植于热带珊瑚岛上的草海桐、厚藤、木麻黄3种植物的最大光合速率均高于文昌苗圃的植物,花生、椰子在两地间没有显著差异,表明草海桐、厚藤、木麻黄这3种植物对热带珊瑚岛环境均具有较强的适应能力。李捷[18]的研究结果显示,热带珊瑚岛地区的草海桐具有较低的最大光合速率,这与本实验结果有差异。前人的研究发现苗木移植过程可划分为耐受期、恢复期和稳定期3个时期,移植苗木在3个时期中存在不同的生理反应[26],因此,李捷等[18]报道的较低的光合速率可能是由于移植的草海桐幼苗前期对热带珊瑚岛环境没有完全适应而导致的。
比叶面积(SLA)是指单位干重的鲜叶面积,与植物抗旱性、光合能力等紧密相关[11]。比叶面积较低的植物将很大一部分物质用于构建保卫构造或者增加叶肉细胞密度以防止过度失水[12]。张林和罗天祥[13]、李明财等[14]研究发现叶片可以通过降低SLA来避免强光辐射和过度失水(减小蒸腾)。本实验中的热带珊瑚岛具有强光照、干旱等气候特点,移植于热带珊瑚岛的草海桐、厚藤、木麻黄、花生这4种植物的SLA均显著降低,说明热带珊瑚岛强光条件促进大多数植物将更多的能量用于叶片的构建,降低SLA以避免强光辐射对植物的伤害,并防止植物过度失水。
叶片碳含量(LC)表示单位叶片干物质碳元素的含量,它代表了植物叶片的构建成本。Wright等[27]提出“叶片经济学谱”的概念(Leaf economics spectrum),认为叶片重要的性状指标能反映出植物偿还叶片养分和干物质投资时间的快慢。在“快速偿还”一端,植物往往有低的叶植物叶片碳含量(LC)和高的最大净光合速率,而在“慢速偿还”的一端则有相反特征[28]。“叶片经济学谱”各个性状之间的相关性实质上反映了叶片成本(构建叶片所需要的能量投资)和收益(光合能力)之间的权衡关系。与文昌苗圃的植物相比,热带珊瑚岛地区5种植物的叶片碳含量均有下降(其中草海桐、花生、椰子降低显著),说明这5种植物将更多的能量用于提高光合能力而非投资到叶片构建当中,草海桐、厚藤、木麻黄这3种植物光合速率显著升高也验证这一观点。
3.2 植物水分利用效率
水分利用效率(WUE),指植物消耗单位水量产出的同化量,是反映植物生长中能量转化效率的重要指标[29],以光合速率(Amax)与蒸腾速率(Tr)之比(Amax/Tr)来表示植物的瞬时水分利用效率。植物叶片碳稳定性同位素组成(δ13C)被认为是估算植物长期水分利用效率的有效途径[30]。许多研究表明δ13C和WUE之间有很好的相关性[31],但由于δ13C值是植物长期生理生态过程的综合指标,综合了植物生长周期中各组织的所有碳吸收, 反应的是植物长期水分利用效率, 而WUE值代表测定时植物瞬时的水分利用效率[32],所以他们的测量结果可能并不完全重叠。热带珊瑚岛地区的草海桐、厚藤、木麻黄的瞬时水分利用效率(WUE)均高于文昌苗圃的植物,而花生和椰子在两地间没有显著差异;除椰子外,热带珊瑚岛地区其余4种植物碳稳定性同位素组成(δ13C)与文昌苗圃的植物相比均有上升(其中木麻黄、花生在两地差异显著),说明这几种植物的长期水分利用效率有所提高。任书杰等[33]的研究表明,干旱会导致叶片碳稳定性同位素组成(δ13C)上升,这与本实验结果相一致。因此,这4种植物均可以通过提高叶片长期水分利用效率来适应热带珊瑚岛干旱环境。
3.3 气孔调节与非气孔调节
气孔是外界CO2与叶片内水汽交换的通道,气孔调节对植物调控水分散失与碳同化的平衡具有重要意义[34- 36]。本研究中,与文昌苗圃的植物相比,移植于热带珊瑚岛上的厚藤、木麻黄具有更高的气孔导度,其光合速率也相应较高,实验结果表明热带珊瑚岛的胁迫环境可以激发厚藤、木麻黄进行气孔调节,提高植物光合速率。此外,本研究中,热带珊瑚岛地区的厚藤虽然具有更高的气孔导度,但其蒸腾速率并没有上升,这与王健林[37]的实验结果不一致。杨惠敏[38]和王玉珏[39]等的研究结果发现干旱条件下,植物气孔减小,密度增大,分布趋向均匀,在保持光合的同时减小水分的散失。因此,本实验结果中蒸腾速率没有升高可能是由于气孔结构调整所致,即热带珊瑚岛的胁迫环境可以激发厚藤进行气孔结构调整,提高植物光合速率的同时减小植物体失水,但这一假设需要进一步解剖结构的相关研究来证实。
此外,本研究发现,与文昌苗圃的植物相比,热带珊瑚岛地区的厚藤、木麻黄、椰子的叶片导水率均显著升高。有研究表明,在一定范围内,Kleaf与Amax存在正相关关系[40- 43],这与本实验中厚藤、木麻黄、的结果一致。因此,厚藤、木麻黄、椰子均可以通过提高叶片导水率(Kleaf)这一非气孔调节方式来提高植物光合作用以适应热带珊瑚岛环境。而花生的叶片导水率显著降低,可能是该物种在热带珊瑚岛上受到的胁迫已经使其丧失了正常的复水能力,进而导水效率和光合能力都受到抑制。
本实验中,热带珊瑚岛上厚藤、花生的Ψtlp较文昌显著降低。王爱英等[44]的实验结果显示:干旱条件下植物Ψtlp会上升,这与本实验结果一致。本研究表明:热带珊瑚岛干旱的环境可以激发厚藤、花生自主进行渗透调节(非气孔调节),提高植物抗旱能力以适应热带珊瑚岛干旱的气候条件。
另一方面,降低比叶面积可以有效的减小蒸腾和叶片过度失水,提高叶片的渗透调节能力[13- 14]。本实验中除椰子外其他植物的SLA均显著降低,表明这4种植物均可以通过调节SLA(非气孔调节),以避免强光辐射对植物的伤害,防止植物过度失水以及提高植物渗透调节能力。
4 结论
综上所述,草海桐、椰子、花生主要通过提高Kleaf,降低Ψtlp及SLA等非气孔调节方式适应热带珊瑚岛干旱的环境;厚藤、木麻黄同时通过气孔调节(降低gs)及非气孔调节(提高Kleaf、降低Ψtlp、SLA)两种途径促进植物碳同化和水分利用,以适应热带珊瑚岛生态环境。与文昌苗圃的植物相比,移植于热带珊瑚岛的草海桐、厚藤、木麻黄均具有更高的光合能力,表现出良好的适应性,可以用于热带珊瑚岛生态系统的恢复。本实验综合植物光合、气孔导度、水分利用与传导、抗旱性等数据即等数据考量5种潜在适生植物对热带热带珊瑚岛严苛环境条件的适应性,为热带热带珊瑚岛适生植物选择、提供科学依据。然而,由于植物对环境的适应性是一个长期的过程,因此,提高热带珊瑚岛新建植被生态系统的服务与功能,须对更多适生植物的生理生态适应性进行长期观测和研究。
[1] 杨红, 苏婷, 戴小杰. 上海市无居民岛土地资源开发适宜性研究.上海海洋大学学报, 2012, 21(1): 92- 96.
[2] 廖彬彬. 热带珊瑚岛礁生态系统风险评价与管理研究. 上海: 华东师范大学, 2013.
[3] 张浪, 刘振文, 姜殿强. 西沙群岛植被生态调查. 中国农学通报, 2011, 27(14): 181- 186.
[4] 陈慧英, 汤坤贤, 孙元敏, 蔡鹭春, 宋晖, 涂武林. 海岛植被修复中的耐旱植物筛选及抗旱技术研究. 应用海洋学学报, 2016, 35(2): 223- 228.
[5] 奚如春, 马履一, 王瑞辉, 徐军亮. 林木耗水调控机理研究进展. 生态学杂志, 2006, 25(6): 692- 697.
[6] Sack L, Holbrook N M. Leaf hydraulics. Annual Review of Plant Biology, 2006, 57: 361- 381.
[7] Scoffoni C, McKown A D, Rawls M, Sack L. Dynamics of leaf hydraulic conductance with water status: quantification and analysis of species differences under steady state. Journal of Experimental Botany, 2012, 63(2): 643- 658.
[8] Brodribb T J, Holbrook N M. Changes in leaf hydraulic conductance during leaf shedding in seasonally dry tropical forest. New Phytologist, 2003, 158(2): 295- 303.
[9] Sack L, Frole K. Leaf structural diversity is related to hydraulic capacity in tropical rain forest trees. Ecology, 2006, 87(2): 483- 491.
[10] 张建国, 李吉跃, 姜金璞. 京西山区人工林水分参数的研究(Ⅰ). 北京林业大学学报, 1994, 16(1): 1- 12.
[11] Bucci S J, Goldstein G, Meinzer F C, Scholz F G, Franco A C, Bustamante M. Functional convergence in hydraulic architecture and water relations of tropical savanna trees: from leaf to whole plant. Tree Physiology, 2004, 24(8): 891- 899.
[12] Reich P B, Walters M B, Ellsworth D S, Vose J M, Volin J C, Gresham C, Bowman W D. Relationships of leaf dark respiration to leaf nitrogen, specific leaf area and leaf life-span: a test across biomes and functional groups. Oecologia, 1998, 114(4): 471- 482.
[13] 张林, 罗天祥. 植物叶寿命及其相关叶性状的生态学研究进展. 植物生态学报, 2004, 28(6): 844- 852.
[14] 李明财, 朱教君, 孙一荣. 东北次生林主要树种比叶面积对光照强度的响应. 生态学杂志, 2009, 28(8): 1437- 1442.
[15] Smith Jr K L, Baldwin R J, Kaufmann R S, Sturz A. Ecosystem studies at Deception Island, Antarctica: an overview. Deep Sea Research Part II: Topical Studies in Oceanography, 2003, 50(10/11): 1595- 1609.
[16] 周厚诚, 任海, 彭少麟. 广东南澳岛植被恢复过程中的群落动态研究. 植物生态学报, 2001, 25(3): 298- 305.
[17] 陈彬, 俞炜炜. 海岛生态综合评价方法探讨. 台湾海峡, 2006, 25(4): 566- 571.
[18] 李婕, 刘楠, 任海, 申卫军, 简曙光. 7种植物对热带珊瑚岛环境的生态适应性. 生态环境学报, 2016, 25(5): 790- 794.
[19] 童毅, 简曙光, 陈权, 李玉玲, 刑福武. 中国西沙群岛植物多样性. 生物多样性, 2013, 21(3): 364- 374.
[20] Tyree M T, Richter H. Alternative methods of analysing water potential isotherms: some cautions and clarifications: I. the impact of non-ideality and of some experimental errors. Journal of Experimental Botany, 1981, 32(3): 643- 653.
[21] Schulte P J, Hinckley T M. A comparison of pressure-volume curve data analysis techniques. Journal of Experimental Botany, 1985, 36(10): 1590- 1602.
[22] Franks P J. Higher rates of leaf gas exchange are associated with higher leaf hydrodynamic pressure gradients. Plant, Cell & Environment, 2006, 29(4): 584- 592.
[23] Gower S T, Kucharik C J, Norman J M. Direct and indirect estimation of leaf area index,fAPAR, and net primary production of terrestrial ecosystems. Remote Sensing of Environment, 1999, 70(1): 29- 51.
[24] 陈世苹, 白永飞, 韩兴国. 稳定性碳同位素技术在生态学研究中的应用. 植物生态学报, 2002, 26(5): 549- 560.
[25] Lambers H, Chapin III F S, Pons T L. Plant Physiological Ecology. 2nd ed. New York: Springer, 2008: 11- 99.
[26] 毕会涛. 枣苗对移栽胁迫的生理响应与抗蒸腾剂减缓胁迫的生理基础[D]. 郑州: 河南农业大学, 2008.
[27] Wright I J, Reich P B, Westoby M, Ackerly D D, Baruch Z, Bongers F, Cavender-Bares J, Chapin T, Cornelissen J H C, Diemer M, Flexas J, Garnier E,Groom P K, Gulias J, Hikosaka K, Lamont B B, Lee T, Lee W, Lusk C, Midgley J J, Navas M L, Niinemets U, Oleksyn J, Osada N, Poorter H, Poot P, Prior L, Pyankov V I, Roumet C, Thomas S C, Tjoelker M G, Veneklaas E J, Villar R. The worldwide leaf economics spectrum. Nature, 2004, 428(6985): 821- 827.
[28] 宋娟, 李荣华, 朱师丹, 叶清. 鼎湖山季风常绿阔叶林不同生境蕨类植物的叶片功能性状研究. 热带亚热带植物学报, 2013, 21(6): 489- 495.
[29] 王建林, 于贵瑞, 房全孝, 姜德锋, 齐华, 王秋凤. 不同植物叶片水分利用效率对光和CO2的响应与模拟. 生态学报, 2008, 28(2): 525- 533.
[30] Farquhar G D, O′Leary M H, Berry J A. On the relationship between carbon isotope discrimination and the intercellular carbon dioxide concentration in leaves. Australian Journal of Plant Physiology, 1982, 9(2): 121- 137.
[31] Saugier B, Ehleringer J R, Hall A E, Farquhar G S. Stable Isotopes and Plant Carbon-Water Relations. San Diego, United States: Elsevier, 2012.
[32] 陈英华, 胡俊, 李裕红, 薛博, 严重玲. 碳稳定同位素技术在植物水分胁迫研究中的应用. 生态学报, 2004, 24(5): 1027- 1033.
[33] 任书杰, 于贵瑞. 中国区域478种C3植物叶片碳稳定性同位素组成与水分利用效率. 植物生态学报, 2011, 35(2): 119- 124.
[34] Meinzer F C, Grantz D A. Coordination of stomatal, hydraulic, and canopy boundary layer properties: do stomata balance conductances by measuring transpiration? Physiologia Plantarum, 1991, 83(2): 324- 329.
[35] Meinzer F C, Goldstein G, Holbrook N M, Jackson P, Cavelier J. Stomatal and environmental control of transpiration in a lowland tropical forest tree. Plant, Cell & Environment, 1993, 16(4): 429- 436.
[36] Héroult A, Lin Y S, Bourne A, Medlyn B E, Ellsworth D S. Optimal stomatal conductance in relation to photosynthesis in climatically contrastingEucalyptusspecies under drought. Plant, Cell & Environment, 2013, 36(2): 262- 274.
[37] 王建林, 杨新民. 气孔导度和叶片内部导度制约C3和C4作物光合作用的比较分析. 东北农业大学学报, 2011, 42(1): 129- 132.
[38] 杨惠敏, 王根轩. 干旱和CO2浓度升高对干旱区春小麦气孔密度及分布的影响. 植物生态学报, 2001, 25(3): 312- 316.
[39] 王玉珏, 付秋实, 郑禾, 温常龙, 程琳, 赵冰, 郭仰东. 干旱胁迫对黄瓜幼苗生长、光合生理及气孔特征的影响. 中国农业大学学报, 2010, 15(5)12- 18.
[40] Brodribb T J, Holbrook N M, Zwieniecki M A, Palma B. Leaf hydraulic capacity in ferns, conifers and angiosperms: impacts on photosynthetic maxima. New Phytologist, 2005, 165(3): 839- 846.
[41] Brodribb T J, Feild T S, Jordan G J. Leaf maximum photosynthetic rate and venation are linked by hydraulics. Plant Physiology, 2007, 144(4): 1890- 1898.
[42] Brodribb T J, Jordan G J. Water supply and demand remain balanced during leaf acclimation ofNothofaguscunninghamiitrees. New Phytologist, 2011, 192(2): 437- 448.
[43] Holloway-Phillips M M, Brodribb T J. Minimum hydraulic safety leads to maximum water-use efficiency in a forage grass. Plant, Cell & Environment, 2011, 34(2): 302- 313.
[44] 王爱英, 姜艳娟, 郝广友, 曹坤芳. 季节性干旱胁迫对石灰山三种常绿优势树种的水分和光合生理的影响. 云南植物研究, 2008, 30(3): 325- 332.
——柄果海桐

