树麻雀表型的环境适应进化
兰敏敏, 范龙梅, 刘方庆, 文陇英,景 鑫, 朱 诚, 王 玲, 胡梦英,祖晓晴
乐山师范学院生命科学学院,西南山地濒危鸟类保护四川省高等学校重点实验室, 乐山 614000
近百年来,全球气候发生了明显的变化,由气候变化所引发的一系列生态反应和变化已经引起了学者的广泛关注[1- 2]。气候变化影响动植物种群的地理分布、种群大小、物候及动物行为等,而动植物种群通过三种策略应对全球气候变化:灭绝、改变分布范围和适应新的环境(由基因或可塑性决定),物种的分布和丰富度变化作为监测气候变化的指标在许多动植物种群中已经得到验证[3- 5],对于气候变暖和物种物候学变化的关系也有大量相关研究[1- 2,6- 9],气候变化伴随的体型大小问题也受到了越来越多关注[10- 11]。如纬度差异[12-13]、海拔差异[14-16]与身体大小之间的关系,贝格曼规律认为:生活在寒冷地区的恒温动物体型较大[17-18],在鸟类中有76%的种类其身体大小随着纬度的升高而变大[19]。一般情况下,海拔每升高100m,气温就下降约0.6℃[20],温度也会随纬度的增加而降低[21- 24]。阿伦规律认为:随着纬度的增加,恒温动物体表突出部分变短[25- 27],该规律在鸟类群体也有不少例证[27- 30],这是因为恒温动物通过减少身体表面的附件如耳朵、尾巴、喙或四肢等与外界环境的接触面积来减少热量的损失[31]。此外,许多因素也可以改变物种表型,如食物可利用性[32]和种群密度[33]。
大量研究表明,鸟类在种群动态、生活史特征以及地理分布范围等方面对全球气候变化作出了相应的反应[34- 36],气候变化不仅直接对鸟类的行为产生影响,也会通过纬度、降水量、温度、日照时数等环境的变化改变鸟类的生活方式及其分布范围从而间接影响它们的生活[37- 38]。
树麻雀(Passermontanus)隶属于雀形目(Passseriformes)雀科(Passeridae),为广布种、古北型留鸟[39],北起俄罗斯、南到马来半岛和印度尼西亚、东自日本、西至欧洲的广大地区都能见到它们的踪迹[40],栖息地海拔高度300—2500m,甚至可高达4500m。由于其分布范围广,数量丰富,因此是研究环境变化与形态特征差异关系的良好材料。尤其是树麻雀是人类活动的伴随物种,在有人类集居的地方多有分布,因此通过研究环境因子对树麻雀的影响间接反映对人类的影响。目前国内对树麻雀的研究多见于繁殖生物学[41]、遗传结构[42]和生理生化[43]等方面。本文以树麻雀为研究对象,通过分析不同地理种群形态特征与环境变化的关系,以及体质和飞行能力受环境的影响;验证其是否符合贝格曼规律和阿伦规律;并进一步探讨树麻雀对环境的适应性能力。
1 材料与方法
通过收集中国科学院动物研究所、中国科学院昆明动物研究所、华南濒危动物研究所以及野外采集到的样本共837只成年树麻雀的形态数据,由于树麻雀雌雄个体没有显著的性二态差异,因此没有对雌雄分类处理。
使用游标卡尺(精确度0.1mm)测量其形态指标,便携式电子天平(精确度0.1g)称量体重。收集的树麻雀样本经纬度范围为76.17—129.17°E,18.53—52.97°N,海拔范围为2—4472m(表1)。
选择体重(BW)、体长(BL)、嘴峰(CUL)、嘴裂(RL)、翅长(WL)、尾长(TL)、跗跖长(TAL)、脑骨长(SL)、脑骨宽(SW)、眼间距(ID)等10个形态特征。为了测定树麻雀的体质和飞行能力,将体重与跗跖长的比值(BW/TL)定义为体质[44],翅长与体重的比值(WL/BW)定义为飞行能力[45]。
样本地区的气象数据为采样当年的值,所有气象数据均来自于中国国家气象数据中心。选择16个环境因子(经度,纬度,海拔,极端最高温,极端最低温,最低温度,最高温度,降水量,气压,平均温度,风速,水汽压,气温距平,相对湿度,日照比,日照时数),通过主成分分析提取主要环境因子,用Pearson相关分析分析重要环境因子与各个形态特征的相关性,通过偏相关分析,分析经度、纬度、海拔和各形态指标之间的关系,以验证贝格曼规律和阿伦规律。所有数据均采用SPSS 20.0进行分析,0.05为显著水平,0.01为极显著水平。
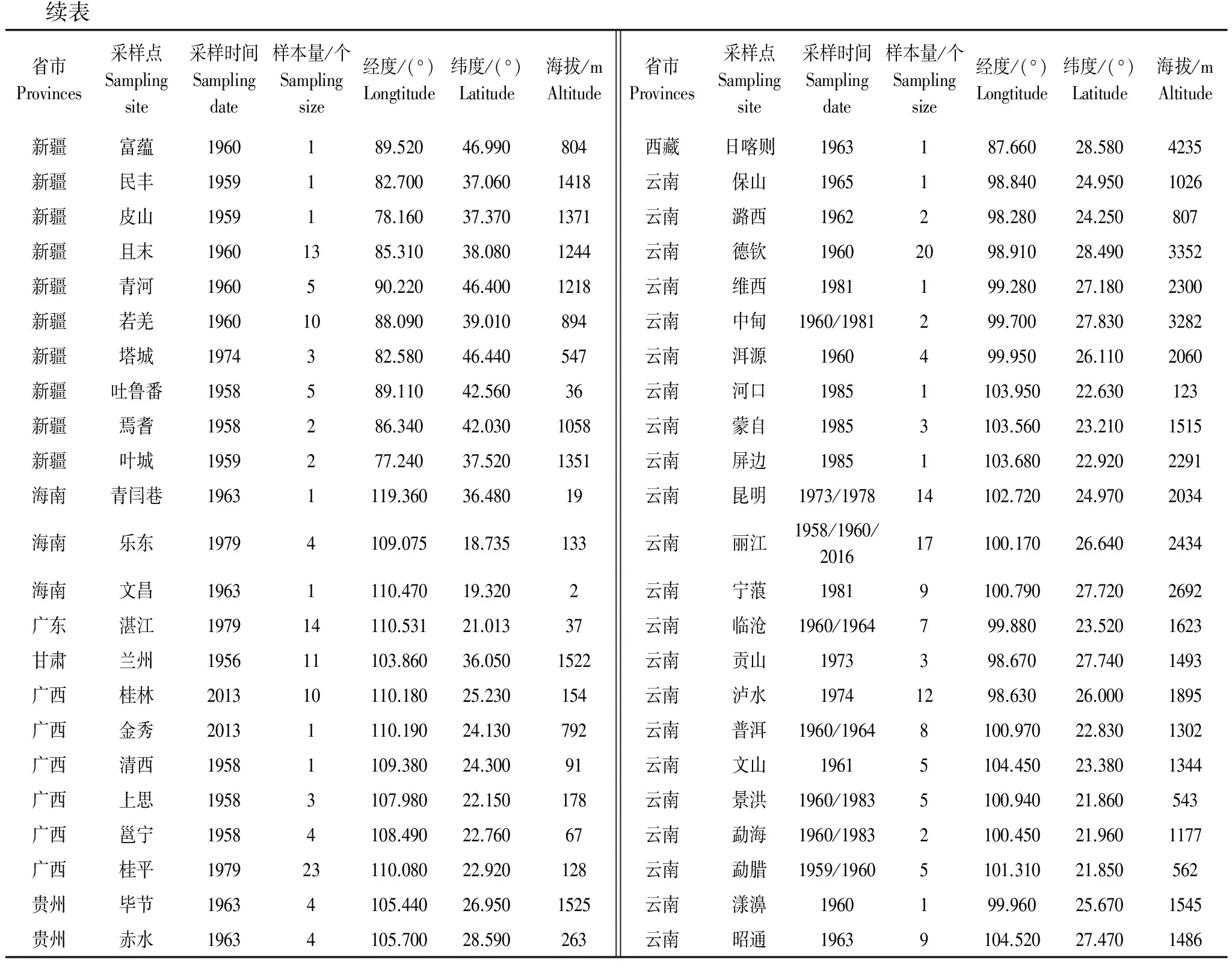
续表省市Provinces采样点Samplingsite采样时间Samplingdate样本量/个Samplingsize经度/(°)Longtitude纬度/(°)Latitude海拔/mAltitude省市Provinces采样点Samplingsite采样时间Samplingdate样本量/个Samplingsize经度/(°)Longtitude纬度/(°)Latitude海拔/mAltitude新疆富蕴1960189.52046.990804西藏日喀则1963187.66028.5804235新疆民丰1959182.70037.0601418云南保山1965198.84024.9501026新疆皮山1959178.16037.3701371云南潞西1962298.28024.250807新疆且末19601385.31038.0801244云南德钦19602098.91028.4903352新疆青河1960590.22046.4001218云南维西1981199.28027.1802300新疆若羌19601088.09039.010894云南中甸1960/1981299.70027.8303282新疆塔城1974382.58046.440547云南洱源1960499.95026.1102060新疆吐鲁番1958589.11042.56036云南河口19851103.95022.630123新疆焉耆1958286.34042.0301058云南蒙自19853103.56023.2101515新疆叶城1959277.24037.5201351云南屏边19851103.68022.9202291海南青闫巷19631119.36036.48019云南昆明1973/197814102.72024.9702034海南乐东19794109.07518.735133云南丽江1958/1960/201617100.17026.6402434海南文昌19631110.47019.3202云南宁蒗19819100.79027.7202692广东湛江197914110.53121.01337云南临沧1960/1964799.88023.5201623甘肃兰州195611103.86036.0501522云南贡山1973398.67027.7401493广西桂林201310110.18025.230154云南泸水19741298.63026.0001895广西金秀20131110.19024.130792云南普洱1960/19648100.97022.8301302广西清西19581109.38024.30091云南文山19615104.45023.3801344广西上思19583107.98022.150178云南景洪1960/19835100.94021.860543广西邕宁19584108.49022.76067云南勐海1960/19832100.45021.9601177广西桂平197923110.08022.920128云南勐腊1959/19605101.31021.850562贵州毕节19634105.44026.9501525云南漾濞1960199.96025.6701545贵州赤水19634105.70028.590263云南昭通19639104.52027.4701486
2 结果
2.1 环境因子与形态特征的关系
16个环境因子通过主成分分析得出4个主要的环境因子:温度因子(0.895)、日照因子(-0.872)、海拔因子(-0.898)和风速因子(0.869),4个主成分因子能够解释16个环境因子变异的83.20%。
4个主要环境因子分别与树麻雀各形态特征相关分析的结果表明:体重与温度、日照和海拔因子呈显著负相关(P<0.05),体长与海拔因子呈显著负相关(P<0.01),嘴峰与温度因子呈显著正相关(P<0.05),嘴裂与日照因子呈显著负相关(P<0.05),翅长与温度、日照和海拔因子呈显著负相关(P<0.05),尾长与日照、海拔和风速因子呈极显著负相关(P<0.01),跗跖与日照和海拔因子呈显著负相关(P<0.05),脑骨长与温度因子呈极显著负相关(P<0.01),脑骨宽与日照因子呈极显著正相关(P<0.01),眼间距与日照因子呈极显著负相关(P<0.01)(表2)。
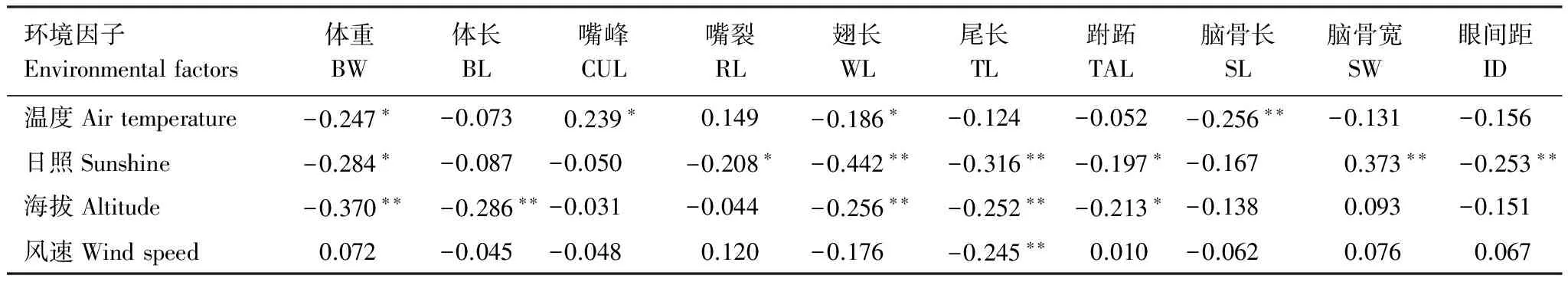
表2 环境因子与形态特征的关系
BW: 体重Body weight; BL: 体长Body length; CUL: 嘴峰长Culmen length; RL: 嘴裂长Rictus length; WL: 翅长Wing length; TL: 尾长Tail length; TAL: 跗跖长Tarsus length; SL: 脑骨长Skull length; SW: 脑骨宽Skull width; ID: 眼间距Interorbital distance;n= 126; 表中数据为相关系数r值;*代表0.05显著水平,**代表0.01显著水平
2.2 经典理论的验证
2.2.1 贝格曼规律
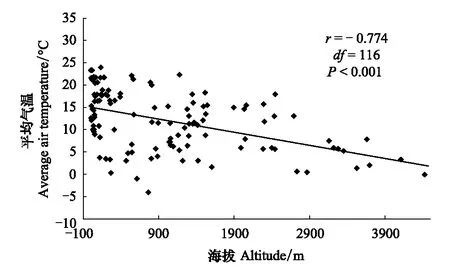
图1 平均气温随海拔的变化Fig.1 Relationship between air temperature and latitude
通过控制纬度,分析海拔和平均气温的相关性,结果表明海拔与气温呈极显著负相关(r=-0.774,df=116,P<0.001),即随着海拔的升高,气温呈极显著下降的趋势(图1)。
通过控制经度和海拔两个变量,对体重、体长、翅长、脑骨长、脑骨宽以及眼间距与纬度之间的相关分析,结果表明,体重与纬度呈极显著正相关(r=0.311,df=109,P=0.001),体长与纬度无显著相关(r=0.056,df=109,P=0.560),翅长与纬度呈显著正相关(r=0.320,df=109,P=0.001),脑骨长和脑骨宽均与纬度呈显著正相关(P<0.05),眼间距与纬度无显著相关性(r=0.169,df=109,P=0.077),鸟类通常以翅长代表身体大小,随着纬度升高,树麻雀体重、翅长逐渐增大,符合贝格曼规律(图2,图3)。
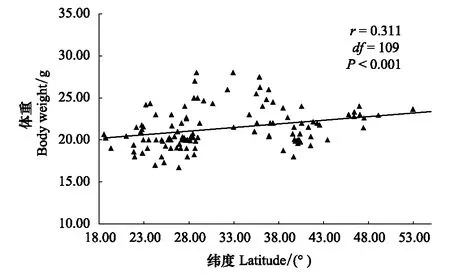
图2 树麻雀体重随纬度的变化 Fig.2 Relationship between body weight and latitude of P. montanus
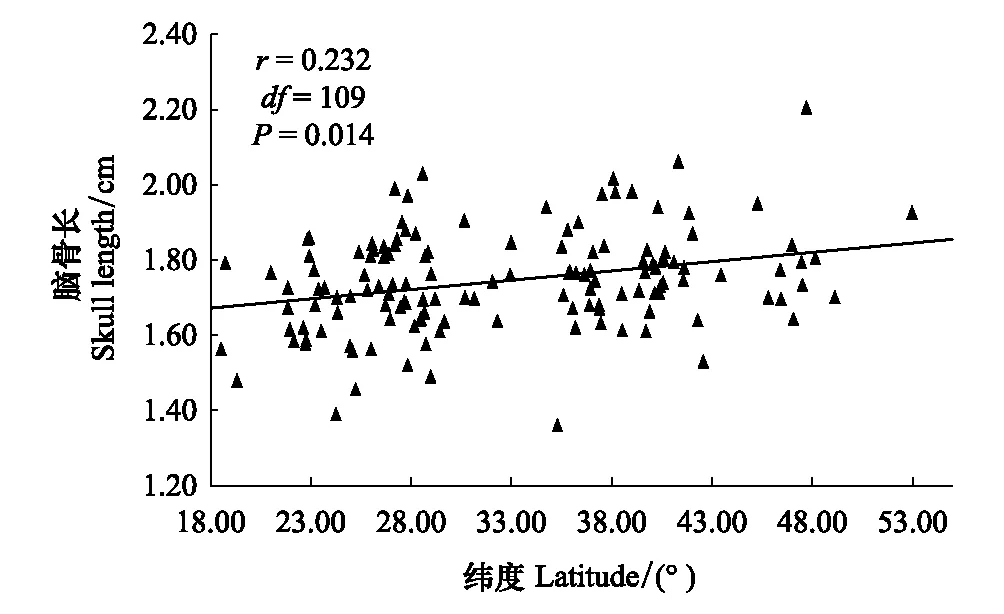
图3 树麻雀脑骨长随纬度的变化 Fig.3 Relationship between Skull length and latitude of P. montanus
2.2.2 阿伦规律
通过控制经度和海拔两个变量,分别进行嘴峰、嘴裂、爪长与纬度之间的偏相关分析,结果表明,嘴峰与纬度呈极显著负相关(r=-0.277,df=109,P=0.003),嘴裂与纬度呈显著负相关(r=-0.225,df=109,P<0.017),即随着纬度的升高,树麻雀嘴峰和嘴裂有逐渐减小的趋势,符合阿伦规律(图4,图5)。
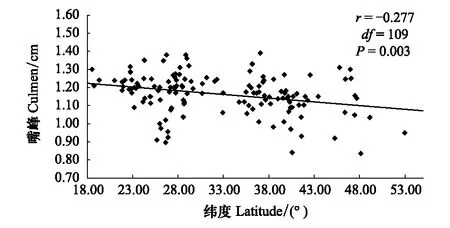
图4 树麻雀嘴峰随纬度的变化Fig.4 Relationship between culmen length and latitude of P. montanus
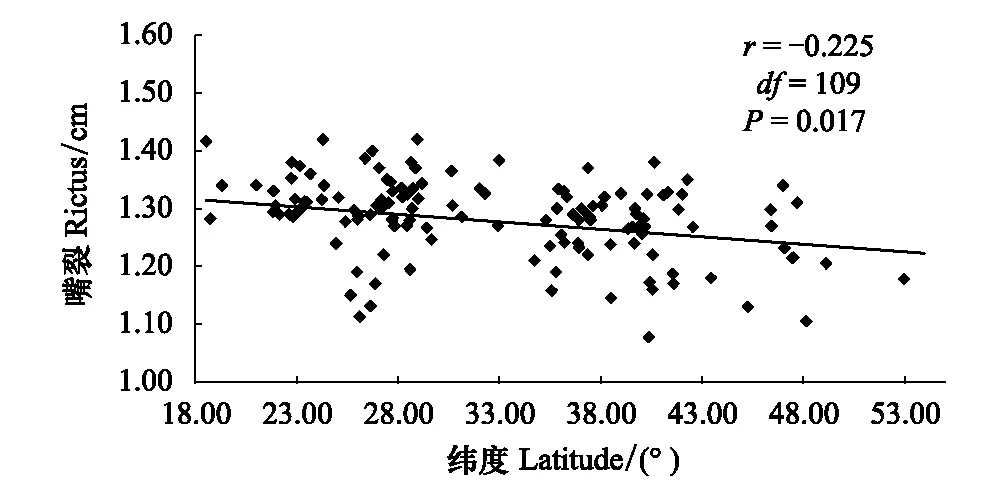
图5 树麻雀嘴裂随纬度的变化Fig.5 Relationship between rictus length and latitude of P. montanus
2.3 树麻雀体能与环境因子的关系
温度、日照、海拔和风速四个环境因子分别与体质和飞行能力的相关分析表明,树麻雀体质与温度、日照和海拔因子均呈显著负相关(P<0.05),与风速无显著相关性(P>0.05);飞行能力与海拔因子呈显著正相关(n=92,r=0.217,P=0.038)。
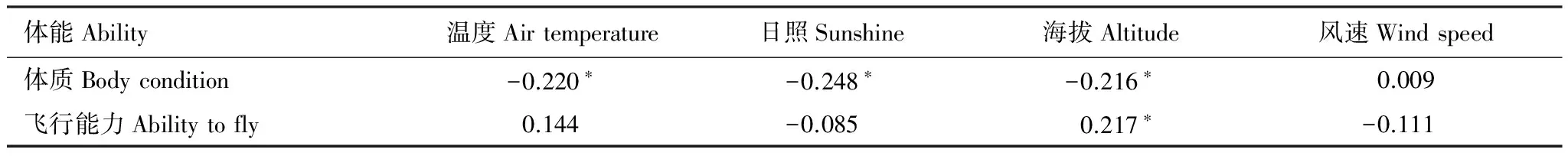
表3 树麻雀的体能与环境因子之间的相关性分析(Pearson)
体质按照体重/跗跖长计算,飞行能力按照翅长/体重计算;表内值为Pearson相关系数:n= 103; *表示P<0.05,**表示P<0.01
3 讨论
通常将生理可塑性称作对环境变化的适应性[46-47],研究结果表明,树麻雀形态特征受日照影响最大,其次是海拔,再次是温度因子,受风速影响最不明显(表2)。其中体重和翅长同时与这3个环境因子显著负相关,鸟类身体大小会受到食物可利用性和种间竞争的影响[31,48],在任何环境中,初级生产力与个体体型大小呈显著正相关[49]。在高海拔地区,环境的初级生产力较低,以及高海拔地区缺氧,导致树麻雀在高海拔地区体重(n=92,r=-0.370,P<0.01)、体长(n=92,r=-0.286,P<0.01)、翅长(n=112,r=-0.256,P<0.01)、尾长(n=112,r=-0.252,P<0.01)以及跗跖(n=112,r=-0.213,P=0.025)显著降低。树麻雀脑骨长与温度和日照因子呈显著负相关(P<0.05),表明树麻雀头骨在低温和日照较少的地区较大,虽然高海拔地区气温较低,但树麻雀头骨大小并不随海拔的变化而显著变化(P>0.05),因此,海拔因子并不影响其头骨大小,沿海拔梯度头骨相对稳定。
体型大小可以通过多个指标来估算,例如翅长、头骨尺寸或者体重[50-51],在许多研究中,多个形态特征数据来自同一个种群,并且不同的趋势依赖于形态特征而测得,这表明形态指标的选择对观察到的响应的种类有极大影响。因此,相矛盾的选择压力可能是由不同的形态特征决定。虽然树麻雀体长与纬度未表现出显著相关性(r=0.056,df=109,P=0.560),但体重、翅长以及头骨大小均与纬度呈显著正相关(P<0.05),通常鸟类是以翅长表示身体大小的,因此,其身体大小的变化对环境的适应符合贝格曼规律(图2,图3)。鸟类556项研究中有60%的研究结果支持贝格曼规律[52],鸟类的这种趋势则可以被解释为对气候变化的适应,且这种适应遵循贝格曼规律的原始机制[53]。贝格曼规律可能不会为体型随气候变化而变化的研究提供最合适的框架,当在大区域内或大陆内做研究时,纬度越高体型越大的模式在大多数哺乳动物和鸟类上都符合[13,23,54]。贝格曼规律背后的机理仍然有争议,并且尚不清楚是否贝格曼规律能够扩展到预测气候变化的影响[52]。
此研究结果表明,树麻雀体表突出部分——嘴峰和嘴裂随纬度的增高而表现出显著减小的趋势(图4,图5),即高纬度寒冷地区体表突出部分缩短,其形态特征对环境的适应符合阿伦规律。在鸟类进化历程中,喙的形状变化是进化多样性的一个经典例子,被广泛运用于形态变化的检测[55],并且在鸟类进化中具有重要地位,例如有学者研究了鸟类喙的尺寸,并且发现喙的尺寸随着最低温度的降低而变短[27],在夏威夷研究者发现随着海拔梯度的变化蚋鹟属(Chasiempis)喙变短的现象[56]。本研究结果表明,树麻雀的喙对于周围环境变化应答灵敏,在温度较低的高纬度地区,较小的嘴型能够减少散热,更好地适应周围环境。此外,鸟类体型大小与食物供给有关,而食物供给通常受环境初级生产力的影响,高温和足够的降水量能够影响环境的初级生产力,从而影响其嘴的形态变化以形成更加利于摄取食物的嘴型[57]。因此树麻雀喙的可塑性变化说明其对环境的适应性进化。
树麻雀体质分别与温度、日照及海拔3个环境因子显著负相关(表3),表明随着环境温度升高、日照增强、海拔升高,树麻雀体质下降,这是因为高海拔地区环境恶劣、缺氧、受到低温、干旱及强光辐射等各种胁迫,身体机能耗费过度所致。由于树麻雀是人类的伴随物种,可以间接地反映居住在高海拔地区的人类体质较弱。树麻雀的飞行能力与海拔因子呈显著正相关(n=92,r=0.217,P=0.038),体质和飞行能力都与风速没有显著相关性,除尾长外各形态指标也都与风速没有显著相关性,与此相一致,树麻雀在高海拔地区具有强的飞行能力,由此可见全球变暖对树麻雀的分布也许不会产生影响。另外树麻雀体重、翅长、尾长分别与除风速外的3个环境因子显著相关,且嘴型与温度和纬度显著相关,表明树麻雀的形态指标易随环境因子的变化而变化,其对环境具有高度的适应性,这也许是它成为广布种的重要原因。
致谢:感谢中国科学院动物研究所雷富民研究员、中国科学院昆明动物研究所杨晓君研究员、华南濒危动物研究所邹发生研究员为样本量度给予的帮助,感谢刘丹、叶丽佳、张建男、杨玉凤、谢文菊、陈灵对样本采集所做的工作。
[1] Dawson T P, Jackson S T, House J I, Prentice I C, Mace G M. Beyond predictions: biodiversity conservation in a changing climate. Science, 2011, 332(6025): 53- 58.
[2] Bellard C, Bertelsmeier C, Leadley P, Thuiller W, Courchamp F. Impacts of climate change on the future of biodiversity. Ecology Letters, 2012, 15(4): 365- 377.
[3] Parmesan C, Yohe G. A globally coherent fingerprint of climate change impacts across natural systems. Nature, 2003, 421(6918): 37- 42.
[4] Wolkovich E M, Cook B I, Allen J M, Crimmins T M, Betancourt J L, Travers S E, Pau S, Regetz J, Davies T J, Kraft N J B, Ault T R, Bolmgren K, Mazer S J, McCabe G J, McGill B J, Parmesan C, Salamin N, Schwartz M D, Cleland E E. Warming experiments underpredict plant phenological responses to climate change. Nature, 2012, 485(7399): 494- 497.
[5] Velásquez-Tibatá J, Salaman P, Graham C H. Effects of climate change on species distribution, community structure, and conservation of birds in protected areas in Colombia. Regional Environmental Change, 2013, 13(2): 235- 248.
[6] Bradshaw W E, Holzapfel C M. Evolutionary response to rapid climate change. Science, 2006, 312(5779): 1477- 1478.
[7] Parmesan C. Ecological and evolutionary responses to recent climate change. Annual Review of Ecology, Evolution, and Systematics, 2006, 37: 637- 669.
[8] Boutin S, Lane J E. Climate change and mammals: evolutionary versus plastic responses. Evolutionary Applications, 2014, 7(1): 29- 41.
[9] Charmantier A, Gienapp P. Climate change and timing of avian breeding and migration: evolutionary versus plastic changes. Evolutionary Applications, 2014, 7(1): 15- 28.
[10] Gardner J L, Peters A, Kearney M R, Joseph L, Heinsohn R. Declining body size: a third universal response to warming? Trends in Ecology & Evolution, 2011, 26(6): 285- 291.
[11] Sheridan J A, Bickford D. Shrinking body size as an ecological response to climate change. Nature Climate Change, 2011, 1(8): 401- 406.
[12] Angilletta Jr M J, Niewiarowski P H, Dunham A E, Leaché A D, Porter W P. Bergmann′s clines in ectotherms: illustrating a life-history perspective with sceloporine lizards. The American Naturalist, 2004, 164(6): E168-E183.
[13] Sears M W, Angilletta Jr M J. Body size clines inSceloporuslizards: proximate mechanisms and demographic constraints. Integrative and Comparative Biology, 2004, 44(6): 433- 442.
[14] Kingsolver J G, Huey R B. Size, temperature, and fitness: three rules. Evolutionary Ecology Research, 2008, 10(2): 251- 268.
[15] Atkinson D, Sibly R M. Why are organisms usually bigger in colder environments? Making sense of a life history puzzle. Trends in Ecology & Evolution, 1997, 12(6): 235- 239.
[16] Angilletta Jr M J, Dunham A E. The temperature-size rule in ectotherms: simple evolutionary explanations may not be general. The American Naturalist, 2003, 162(3): 332- 342.
[17] Bergmann C. About the relationships between heat conservation and body size of animals. Goett Stud, 1847, 1: 595- 708.
[18] Mayr E. Geographical character gradients and climatic adaptation. Evolution, 1956, 10(1): 105- 108.
[19] Ashton K G. Patterns of within-species body size variation of birds: strong evidence for Bergmann′s rule. Global Ecology and Biogeography, 2002, 11(6): 505- 523.
[20] Rundel P W. Tropical alpine climates // Rundel P W, Smith A P, Meinzer F C, eds. Tropical Alpine Environments: Plant form and Function. Cambridge: Cambridge University Press, 1994.
[21] Berteaux D, Humphries M M, Krebs C J, Lima M, McAdam A G, Pettorelli N, Réale D, Saitoh T, Tkadlec E, Weladji R B, Stenseth N C. Constraints to projecting the effects of climate change on mammals. Climate Research, 2006, 32(2): 151- 158.
[22] Millien V, Lyons S K, Olson L, Smith F A, Wilson A B, Yom-Tov Y. Ecotypic variation in the context of global climate change: revisiting the rules. Ecology Letters, 2006, 9(7): 853- 869.
[23] Chown S L, Hoffmann A A, Kristensen T N, Angilletta Jr M J, Stenseth N C, Pertoldi C. Adapting to climate change: a perspective from evolutionary physiology. Climate Research, 2010, 43(1/2): 3- 15.
[24] Kerr J T, Dobrowski S Z. Predicting the impacts of global change on species, communities and ecosystems: it takes time. Global Ecology and Biogeography, 2013, 22(3): 261- 263.
[25] Allen J A. The influence of physical conditions in the genesis of species. Radical Review, 1877, 1: 108- 140.
[26] Serrat M A, King D, Lovejoy C O. Temperature regulates limb length in homeotherms by directly modulating cartilage growth. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(49): 19348- 19353.
[27] Symonds M R E, Tattersall G J. Geographical variation in bill size across bird species provides evidence for Allen′s rule. The American Naturalist, 2010, 176(2): 188- 197.
[28] Tattersall G J, Andrade D V, Abe A S. Heat exchange from the toucan bill reveals a controllable vascular thermal radiator. Science, 2009, 325(5939): 468- 470.
[29] Nudds R L, Oswald S A. An interspecific test of Allen′s rule: evolutionary implications for endothermic species. Evolution, 2007, 61(12): 2839- 2848.
[30] Greenberg R, Danner R M. The influence of the California marine layer on bill size in a generalist songbird. Evolution, 2012, 66(12): 3825- 3835.
[31] Scholander P F. Evolution of climatic adaptation in homeotherms. Evolution, 1955, 9(1): 15- 26.
[32] McAdam A G, Boutin S. Effects of food abundance on genetic and maternal variation in the growth rate of juvenile red squirrels. Journal of Evolutionary Biology, 2003, 16(6): 1249- 1256.
[33] Damuth J. Population density and body size in mammals. Nature, 1981, 290(5808): 699- 700.
[34] Huntley B, Collingham Y C, Green R E, Hilton G M, Rahbek C, Willis S G. Potential impacts of climatic change upon geographical distributions of birds. IBIS, 2006, 148(S1): 8- 28.
[35] Both C, Artemyev A V, Blaauw B, Cowie R J, Dekhuijzen A J, Eeva T, Enemar A, Gustafsson L, Ivankina E V, Järvinen A, Metcalfe N B, Nyholm N E I, Potti J, Ravussin P A, Sanz J J, Silverin B, Slater F M, Sokolov L V, Török J, Winkel W, Wright J, Zang H, Visser M E. Large-scale geographical variation confirms that climate change causes birds to lay earlier. Proceedings of the Royal Society B: Biological Sciences, 2004, 271(1549): 1657- 1662.
[36] Gasner M R, Jankowski J E, Ciecka A L, Kyle K O, Rabenold K N. Projecting the local impacts of climate change on a Central American montane avian community. Biological Conservation, 2010, 143(5): 1250- 1258.
[37] 石建斌, 李迪强, 肖文发. 气候变化对鸟类影响: 长期研究的意义(英文). 动物学研究, 2006, 27(6): 637- 646.
[38] Hughes L. Biological consequences of global warming: is the signal already apparent? Trends in Ecology & Evolution, 2000, 15(2): 56- 61.
[39] 郑光美. 中国鸟类分类与分布名录 (第二版). 北京: 科学出版社, 2011: 265- 265.
[40] 张荣祖. 中国动物地理. 北京: 科学出版社, 1999.
[41] 解生彬, 王立波, 沈华, 原宝东. 树麻雀(Passermontanus)巢特征与巢址选择的初步研究. 黑龙江畜牧兽医, 2016, (11): 234- 237.
[42] 张苗苗. 树麻雀的遗传多样性分析及亚种分化的初步研究[D]. 石家庄: 河北师范大学, 2009.
[43] 徐兴军, 邵淑丽, 张伟伟, 王维禹, 李旭艳, 柳劲松, 吕建伟, 李铁, 李怀永. 春季树麻雀体内几种消化酶活性研究. 四川动物, 2012, 31(5): 782- 785.
[44] Jakob E M, Marshall S D, Uetz G W. Estimating fitness: a comparison of body condition indices. Oikos, 1996, 77(1): 61- 67.
[45] Sun Y F, Ren Z P, Wu Y F, Lei F M, Dudley R, Li D M. Flying high: limits to flight performance by sparrows on the Qinghai-Tibet Plateau. Journal of Experimental Biology, 2016, 219(22): 3642- 3648.
[46] Rezende E L, Gomes F R, Ghalambor C K, Russell G A, Chappell M A. An evolutionary frame of work to study physiological adaptation to high altitudes. Revista Chilena de Historia Natural, 2005, 78(2): 323- 336.
[47] Garland Jr T, Kelly S A. Phenotypic plasticity and experimental evolution. Journal of Experimental Biology, 2006, 209(12): 2344- 2361.
[48] McNab B K. On the ecological significance of Bergmann′s rule. Ecology, 1971, 52(5): 845- 854.
[49] Rosenzweig M L. Net primary productivity of terrestrial communities: prediction from climatological data. The American Naturalist, 1968, 102(923): 67- 74.
[50] Damuth J, MacFadden B J. Body Size in Mammalian Paleobiology: Estimation and Biological Implications. Cambridge: Cambridge University Press, 1990: 1- 10.
[51] Yom-Tov Y, Geffen E. Recent spatial and temporal changes in body size of terrestrial vertebrates: probable causes and pitfalls. Biological Reviews, 2011, 86(2): 531- 541.
[52] Teplitsky C, Millien V. Climate warming and Bergmann′s rule through time: is there any evidence? Evolutionary Applications, 2014, 7(1): 156- 168.
[53] Yom-Tov Y. Global warming and body mass decline in Israeli passerine birds. Proceedings of the Royal Society B: Biological Sciences, 2001, 268(1470): 947- 952.
[54] Meiri S, Dayan T. On the validity of Bergmann′s rule. Journal of Biogeography, 2003, 30(3): 331- 351.
[55] Wu P, Jiang T X, Suksaweang S, Widelitz R B, Chuong C M. Molecular shaping of the beak. Science, 2004, 305(5689): 1465- 1466.
[56] VanderWerf E A. Ecogeographic patterns of morphological variation in elepaios (Chasiempisspp.): Bergmann′s, Allen′s, and Gloger′s rules in a microcosm. Ornithological Monographs, 2012, 73: 1- 34.
[57] Wigginton J D, Dobson F S. Environmental influences on geographic variation in body size of western bobcats. Canadian Journal of Zoology, 1999, 77(5): 802- 813.

