高盐胁迫对凡纳滨对虾消化及免疫相关酶活力的影响
李 娜,赵玉超,王仁杰,沈 敏,李玉全
青岛农业大学海洋科学与工程学院,青岛 266109
凡纳滨对虾(Litopenaeusvannamei)是原产于中南美太平洋海岸的热带、亚热带、暖温带、温带海域的大型虾类,具有非常广的耐盐性,可耐受2—78盐度范围[1],在淡水、半咸水、海水、高盐水中均可存活和生长。1988年引入我国,并在不同盐度水体进行了大面积的养殖生产。
盐度是易变化的水质因子之一。它可以直接影响水生生物的渗透调节、代谢和能量收支,从而影响其生长和存活。目前,国内外关于盐度对凡纳滨对虾的影响研究主要集中于低盐[2- 6],盐度对虾类生理和免疫方面影响的研究主要集中于盐度突变[7-8]和盐度的长期效应[9-10]两方面。我国沿海或西北地区还存在大量的高盐水体,如山东盐场盐度30—70的水域面积约14万hm2。这些水域可以发展凡纳滨对虾养殖,并且也有不少高盐水体已经开展了相关的养殖生产,但单位面积产量一般不高于400kg/hm2,远低于其他盐度水体。高盐环境下,对虾养殖能否获得高产,需要进行相关的基础研究,而关于高盐度对对虾生长、代谢、理化及分子指标的影响研究甚少。本实验拟以凡纳滨对虾为实验材料,分析高盐胁迫对对虾血淋巴、肌肉、肝胰脏等组织消化相关酶和免疫相关酶活力的影响,以期丰富对虾逆境生物学理论,并为高盐水域利用提供参考。
1 材料与方法
1.1 材料来源、暂养与驯化
实验所用凡纳滨对虾购自昌邑市海丰水产养殖有限责任公司,挑选体长(7.84±0.68)cm、无病、无外伤的个体为研究对象。实验用虾运至青岛农业大学实验室后,暂养于水族箱(30cm×40cm×30cm)中。暂养期间用加热棒将温度控制在(27±0.5)℃,24h充气泵充氧,每日换水2次,换水量为30%。暂养7d,筛选相近规格的凡纳滨对虾(体长(7.84±0.68)cm体重(3.98±0.71)g),以每天盐度5的速度由盐度30驯化至实验设计梯度,驯化至实验设计盐度后暂养5d后进行试验。高盐度海水由天然海水(盐度30左右)与粗盐调配而成。
1.2 实验设计和管理
实验设置30、40、50和60共4个盐度处理,每个处理放养10尾凡纳滨对虾,设3个平行组。每天7:00和19:00投喂配合饲料(粗蛋白质43%、粗灰分15%、粗纤维5%、总磷0.9%、粗脂肪5%、赖氨酸2.2%、水分12%),60min后吸底换水,每次换水量为30%,所换海水为提前加热到适宜温度和设计盐度的海水,日投喂量为对虾体重的3%—5%,其他控制条件同暂养条件。实验历时30d。
1.3 样品的采集
实验结束后每个处理随机取6尾凡纳滨对虾,用l.0mL一次性注射器从对虾心脏抽取血淋巴,收集于1.5mL的Eppendorf管中,4℃过夜后4000r/min离心15min,收集血清并置-20℃冰箱保存备用。取其肝胰脏、肌肉组织放入离心管中,迅速投入液氮冷冻,再转移到-80℃冰箱保存,以上操作均在冰盘中进行。组织样品先用剪刀剪碎,准确称重后置于玻璃匀浆管中,加入9倍体积的生理盐水,匀浆机匀浆,后冷冻离心机3000r/min离心10min,分别稀释至所需浓度后进行酶活的测定。
1.4 酶活的测定
实验测定肝胰脏中对虾胃蛋白酶、脂肪酶、淀粉酶的活性,测定肝胰脏、肌肉和血淋巴中对虾的超氧化物歧化酶(SOD,superoxide dismutase)活力,过氧化氢酶(CAT,catalase)活力、碱性磷酸酶(AKP,alkaline phosphatase)活力及酸性磷酸酶(ACP,acid phosphatase)活力。
所有酶活力及蛋白含量(蛋白的测定采用考马斯亮蓝法)的测定均采用南京建成生物研究所研制的检测试剂盒,按照操作步骤进行操作。
1.5 数据处理
所得数据采用SPSS 19.0软件进行方差分析(ANOVA)及Duncan多重比较,以P<0.05作为差异显著。
2 结果与分析
2.1 高盐度对凡纳滨对虾消化酶活力的影响
从图1可以看出,随着盐度的升高,对虾淀粉酶、胃蛋白酶、脂肪酶活力呈显著下降的趋势。淀粉酶活力表现为盐度为30时最高(P<0.05),盐度60时最低(P<0.05),盐度40和50处理组间差异不显著(P>0.05);胃蛋白酶活力表现为盐度30、40和50处理组间差异显著(P<0.05),盐度50到60处理组间差异不显著(P>0.05);脂肪酶活力在盐度30、40和50处理组间差异不显著(P>0.05),与盐度60处理组间均差异显著(P<0.05)。
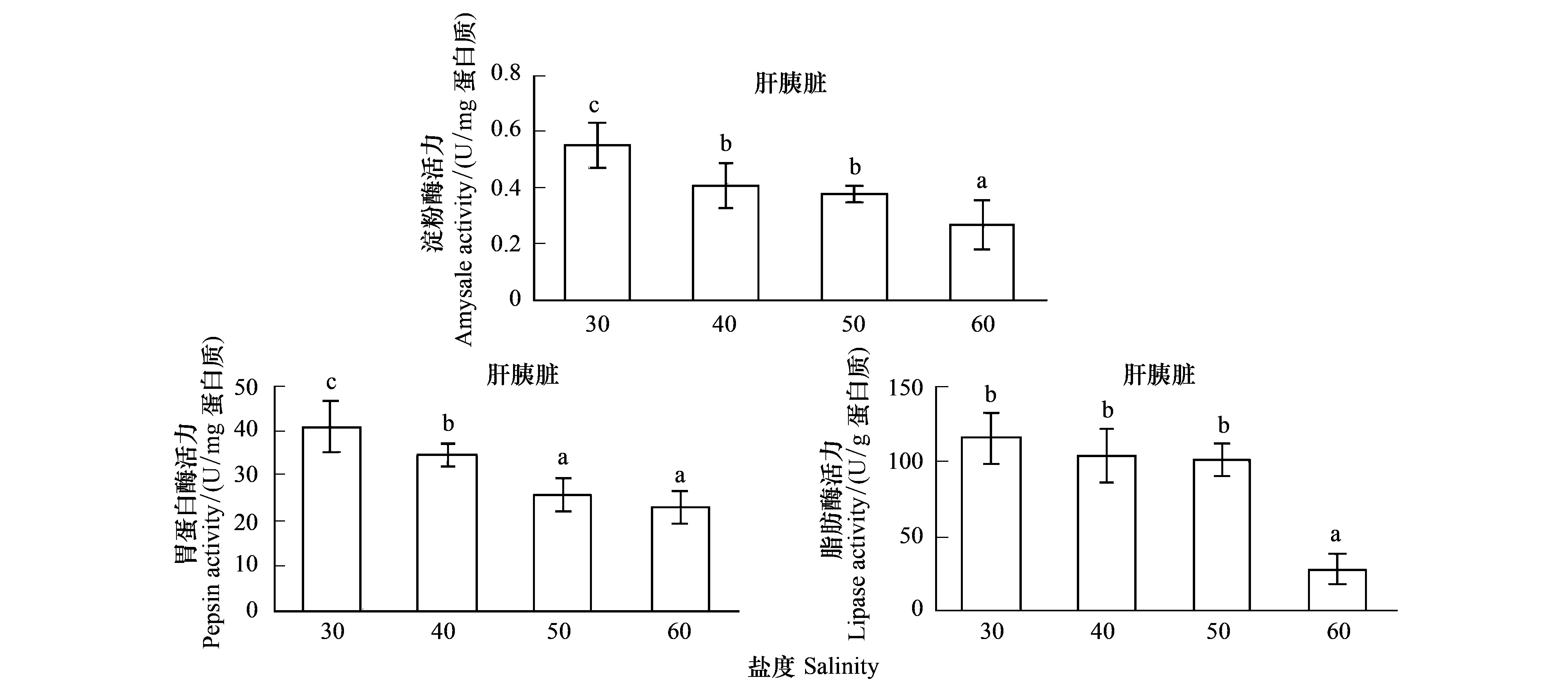
图1 高盐对凡纳滨对虾消化酶活力的影响Fig.1 Effect of high salinity on digestive enzyme activities in L. vannamei字母不同表示处理组间有显著差异(P<0.05)
2.2 高盐度对凡纳滨对虾AKP活力的影响
从图2可以看出,随着盐度的升高,血淋巴 AKP活力呈上升趋势,尤其是盐度从30到40,酶活力迅速升高(P<0.05),盐度40和50处理间差异不显著(P>0.05),盐度60处理组AKP活力显著高于其他处理(P<0.05);肌肉组织AKP活力呈现升高降低再升高的变化趋势,盐度30和50处理组酶活力降低,且处理间差异不显著(P>0.05),盐度40和60处理组酶活力显著高于盐度30和50处理组(P<0.05);肝胰脏AKP酶活力变化趋势与肌肉组织相反,为先降低升高再降低,盐度30和50处理间差异不显著(P>0.05),盐度40和50处理间差异不显著(P>0.05)。
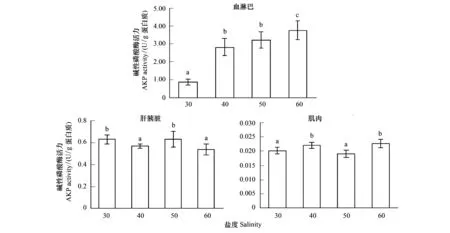
图2 高盐对凡纳滨对虾AKP活力的影响Fig.2 Effect of high salinity on AKP activity of different tissues in L. vannameiAKP: 碱性磷酸酶Alkaline phosphatase; 字母不同表示处理组间有显著差异(P<0.05)
2.3 高盐度对凡纳滨对虾ACP活力的影响
从图3中可以看出,随着盐度的升高,血淋巴ACP活力呈上升后降低的趋势,盐度40处理组ACP活力显著高于其他处理(P<0.05);肌肉组织ACP活力呈现升高后降低的变化趋势,盐度50时达到最高值;肝胰脏ACP活力呈现降低趋势,盐度30处理组ACP活力显著高于其他处理组(P<0.05),盐度40、50、60处理组间差异不显著(P>0.05)。
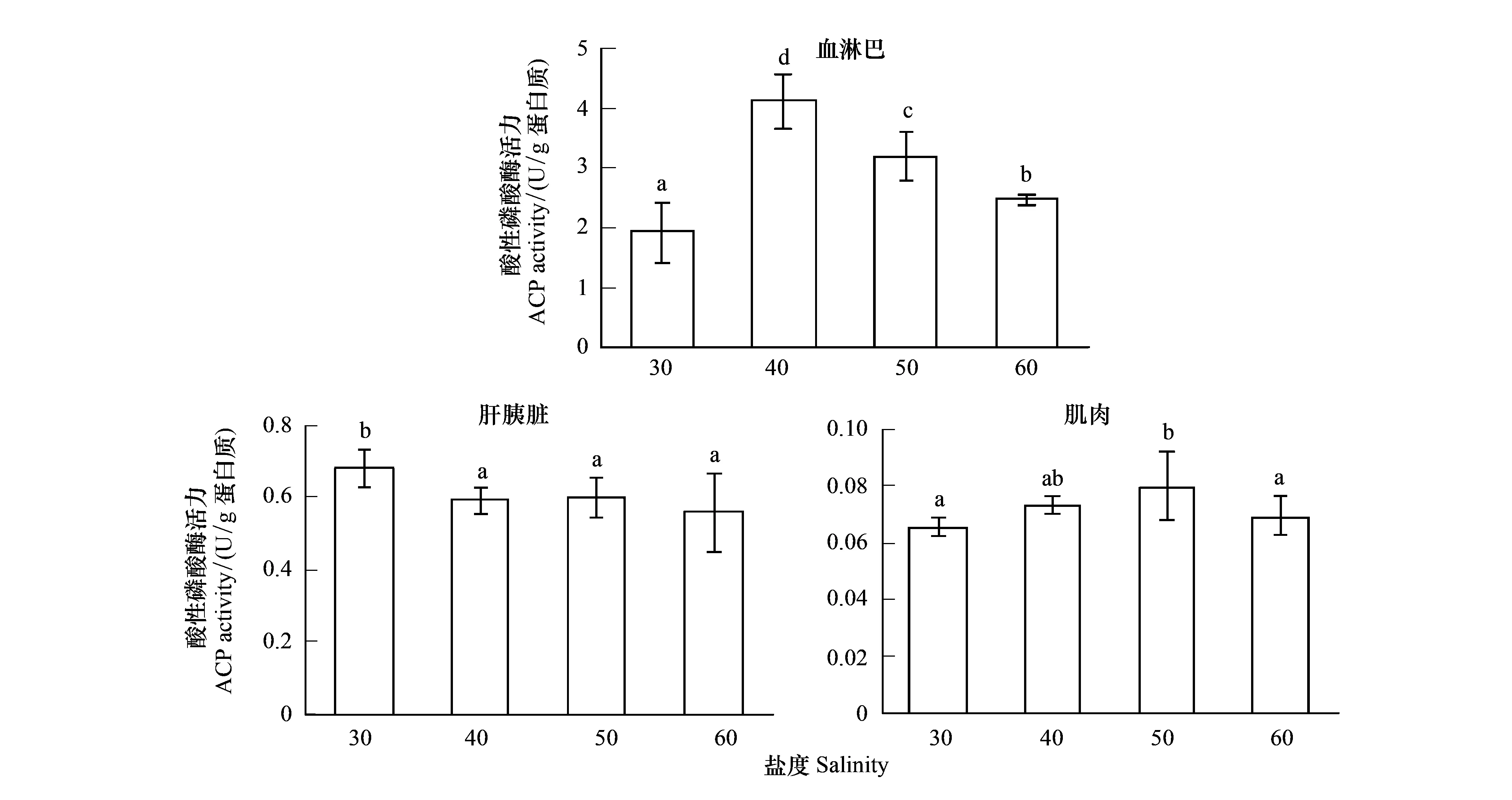
图3 高盐对凡纳滨对虾ACP活力的影响Fig.3 Effect of high salinity on ACP activities of different tissues in L. vannameiACP:酸性磷酸酶Acid phosphatase
2.4 高盐度对凡纳滨对虾CAT活力的影响
从图4中可以看出,随着盐度的升高,血淋巴CAT活力呈现先升高后降低的变化趋势,盐度50处理组CAT活力显著高于其他处理(P<0.05),盐度40处理组CAT活力显著低于盐度50、60处理(P<0.05),与盐度30处理组间差异不显著(P>0.05);肌肉组织CAT活力无明显的变化趋势,盐度30、40、60处理组间差异不显著(P>0.05),盐度30、50、60处理组间差异不显著(P>0.05);肝胰脏组织CAT活力呈现降低后升高的变化趋势,盐度30和60处理组CAT活力显著高于盐度40和50处理组(P<0.05),盐度40与50处理间差异不显著(P>0.05)。
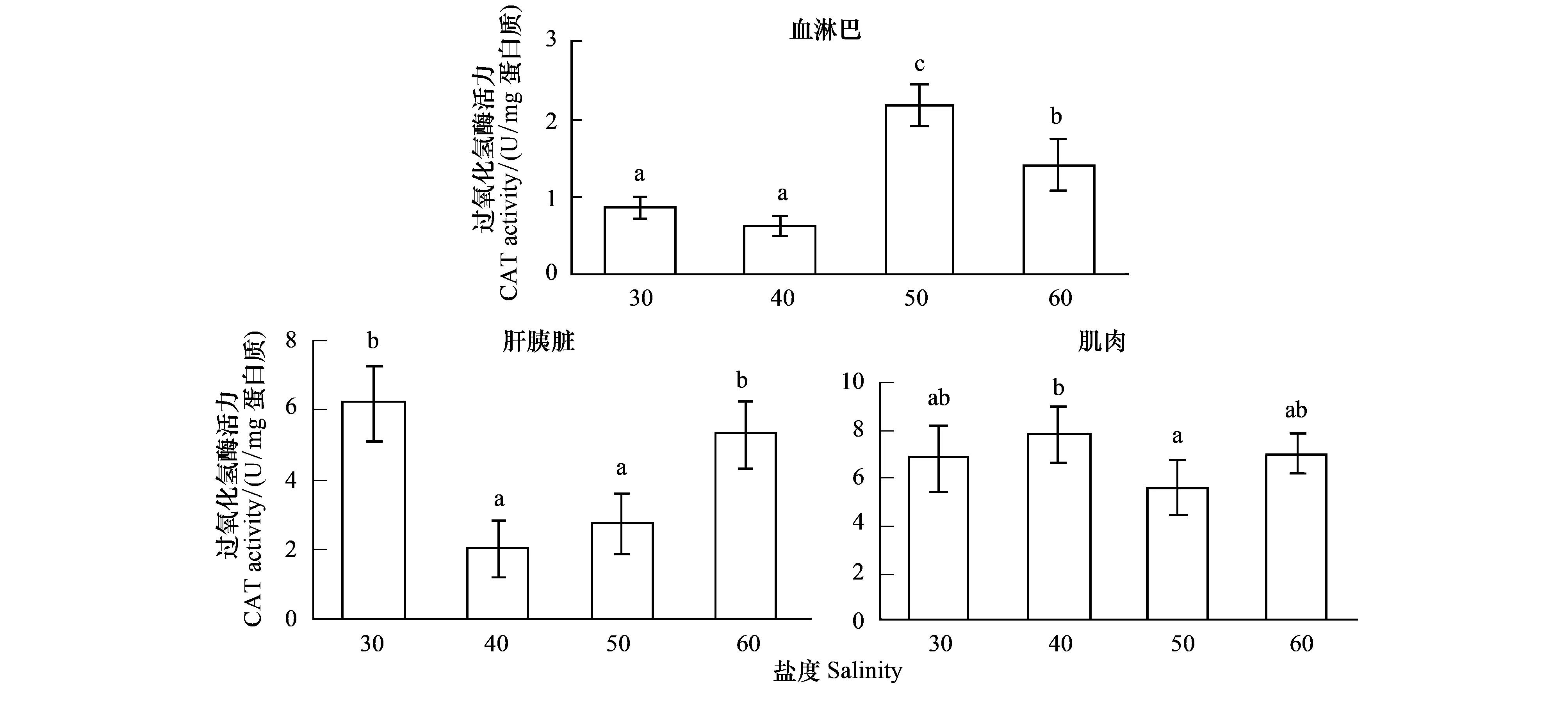
图4 高盐对凡纳滨对虾CAT活力的影响Fig.4 Effect of high salinity on CAT activity of different tissues in L.vannameiCAT:过氧化氢酶Catalase
2.5 高盐度对凡纳滨对虾SOD活力的影响
从图5可以看出,随着盐度的升高,血淋巴SOD活力呈现升高后降低的变化趋势,盐度40处理组SOD活力显著高于其他处理组(P<0.05),盐度30和50处理组间差异不显著(P>0.05),盐度60处理组酶活力显著低于其他处理组(P<0.05);肌肉组织SOD活力变化趋势与血淋巴相同,同样在盐度40时达到最大值,盐度50和60处理组差异不显著(P>0.05);肝胰脏组织中SOD酶活力呈现逐渐降低的变化趋势,盐度30和40处理组之间差异不显著(P>0.05),其他处理间差异均达到显著水平(P<0.05)。
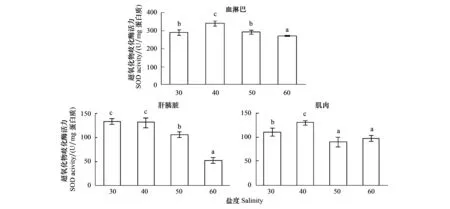
图5 高盐对凡纳滨对虾SOD活力的影响Fig.5 Effect of high salinity on SOD activity of different tissues in L. vannameiSOD: 超氧化物歧化酶Superoxide dismutase
3 讨论
3.1 高盐度对凡纳滨对虾消化酶活力的影响
凡纳滨对虾消化酶活力的相关研究报道较多,但对高于正常海水盐度(盐度约30)的消化酶活力方面却未见相关报道。Dalla Via[11]研究发现,当环境盐度降低时,对虾需要消耗大量的能量来调节体内的渗透压和离子平衡。刘国兴[12]分析了0—30盐度对克氏原螯虾(Procambarusclarkii)肝胰脏中胃蛋白酶、脂肪酶、淀粉酶活力的影响,发现随着盐度的升高,这几种酶的活力逐渐下降。Babink 等[13]研究发现几种消化酶的浓度具有整体效应,即当其中一种酶活力提高时,其他消化酶的活力也同时提高,当其中一种酶活力减弱时,其他消化酶的活力也随之减弱。对虾主要通过离子调节方式来调节自身的渗透压,以适应外界环境盐度变化[14-15],与此同时,对虾机体消化酶的激活或抑制可以借助体内金属离子含量变化得以调控,因此,不同盐度下的钠离子含量不同,可能对消化酶活力也产生了一定影响。本实验发现,随着盐度的升高,凡纳滨对虾的消化酶活力逐渐降低,这与刘国兴对低盐度消化酶的研究结果相一致,同时与消化酶整体效应相一致,说明随着盐度的升高,凡纳滨对虾的消化吸收能力呈现降低的趋势,可能会影响对虾的生长,这与生产中高盐度下对虾生长较慢的情况相符。
3.2 高盐度对凡纳滨对虾免疫酶活力的影响
相关研究表明,盐度胁迫对水生动物的抗氧化系统功能具有显著的影响[16]。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是机体内重要的抗氧化酶,二者互相作用可以清除细胞内产生的过量氧自由基,对机体具有重要保护功能,其活性与动物体免疫性能和环境胁迫有关[17-18]。本实验发现,不同组织中,SOD、CAT活力变化有所不同。CAT在肝胰脏和肌肉中活力较高,SOD在血淋巴中活力较高。说明,CAT主要作用部位是肌肉和肝胰脏,而SOD的主要作用部位为血淋巴。SOD和CAT活力的峰值出现在不同盐度,总体基本上都呈现先升高后降低的变化趋势,CAT活力在30到50盐度之间维持在较高水平,SOD活力在30到40盐度时达到最大值。说明盐度胁迫会对凡纳滨对虾机体抗氧化酶产生激活作用,从而增强了机体抵抗盐度胁迫的能力,然而当盐度继续升高,抗氧化酶能力反而受到了抑制,凡纳滨对虾抗氧化能力显著下降。邓平平等[19]发现的大菱鲆(Scophthalmusmaximus)幼鱼肝脏和鳃的抗氧化酶活力会随着盐度的改变而发生适应性变化,而凡纳滨对虾SOD和CAT盐度的波浪式变化充分说明了对盐度变化的适应。总的来说,凡纳滨对虾在盐度30到40时具有较高的抗氧化能力。
碱性磷酸酶(AKP)和酸性磷酸酶(ACP)对钙质吸取、骨骼形成、磷酸钙化、甲壳素分泌形成都具有重要作用,对虾在生长过程中要经历蜕壳过程,因此,磷酸酶对于虾的生存具有特别重要意义。酸性磷酸酶是吞噬溶酶体的重要组成部分,在血细胞进行吞噬和包囊反应中,会伴随有酸性磷酸酶的释放[20-21]。因此,通过探讨盐度变对AKP和ACP活力的影响,有助于了解盐度对机体的营养物质消化、吸收、运输以及生物体内抗氧化系统的影响。刘存歧等[22]分析了金属离子对中国对虾幼体体内碱性磷酸酶的影响,发现外界环境因子变化及海水中Cu2+、Co2+、Mn2 +的浓度会影响磷酸酶的活力,认为磷酸酶活力的高低可作为判别机体免疫能力的指标。王庚申等[23]研究发现ACP和 AKP两种酶的活力肝胰腺高于肌肉。本实验中,盐度变化对AKP和ACP活力产生显著影响,不同部位的变化也不相同,两种酶在不同组织中活力的高低为:血淋巴>肝胰脏>肌肉,说明两种酶主要在血淋巴和肝胰腺中发挥作用,这与王庚申的研究结果相一致。据ACP和AKP两种酶的变化过程分析,各盐度组的ACP、AKP活力变化原因可能是随着盐度的升高,机体通过消耗更多的ATP去调节渗透压来适应外界环境中盐度变化影响,而ATP合成所需的无机磷酸可由ACP、AKP催化磷酸酯类水解产生,从而造成了ACP、AKP活力的升高,但盐度高到一定程度,两种酶的活力又受到了抑制,活力下降。ACP在30—40盐度时具有较高的活力,AKP在40—50盐度时具有较高的活力。
综上,本研究以淀粉酶、胃蛋白酶、脂肪酶、CAT、SOD、ACP 和AKP 作为评价凡纳滨对虾对高盐度长期适应的消化和免疫指标,证明其活性与养殖水体盐度密切相关,盐度30—40左右活力最高,盐度过高会降低其活力。因此,从免疫方面考虑,建议在凡纳滨对虾养殖中,尽量保持水体盐度不高于50盐度。
[1] 张伟权. 世界重要养殖品种——南美白对虾生物学简介. 海洋科学, 1990, (3): 69- 73.
[2] 申玉春, 陈作洲, 刘丽, 李再亮, 吴灶和. 盐度和营养对凡纳滨对虾蜕壳和生长的影响. 水产学报, 2012, 36(2): 290- 299.
[3] Bray W A, Lawrence A L, Leung-trujillo J R. The effect of salinity on growth and survival ofPenaeusvannamei, with observations on the interaction of HHN virus and salinity. Aquaculture, 1994, 122(2/3): 133- 146.
[4] Roy L A, Davis D A, Saoud I P, Boyd C A, Pine H J, Boyd C E. Shrimp culture in inland low salinity waters. Aquaculture, 2010, 2(4): 191- 208.
[5] 查广才, 周昌清, 黄建荣, 何建国, 麦雄伟. 凡纳对虾淡化养殖虾池微型浮游生物群落及多样性. 生态学报, 2004, 24(8): 1752- 1759.
[6] 戴习林, 张立田, 臧维玲, 邓平平, 邹卫丽, 丁福江. Ca2+、Mg2+、盐度对凡纳滨对虾存活、生长及风味的影响. 水产学报, 2012, 36(6): 914- 921.
[7] Moullac G L, Haffner P. Environmental factors affecting immune responses in crustacea. Aquaculture, 2000, 191(1/3): 121- 131.
[8] 李玉全, 李永生, 赵法箴. 盐度、盐度渐变与骤变对脊尾白虾渗透、代谢及免疫相关酶活力的影响. 生态学报, 2015, 35(21): 7229- 7235.
[9] Cheng W, Chen J C. Effects of pH, temperature and salinity on immune parameters of the freshwater prawnMacrobrachiumrosenbergii. Fish & Shellfish Immunology, 2000, 10(4): 387- 391.
[10] Vargas-Albores F, Hinojosa-Baltazar P, Portillo-Clark G, Magallon-Barajas F. Influence of temperature and salinity on the yellowleg shrimp,PenaeuscalifornieinsisHolmes, prophenoloxidase system. Aquaculture Research, 1998, 29(8): 549- 553.
[11] Dalla Via C J. Salinity responses of the juvenile penaeid shrimpPenaeusjaponicus: I. Oxygen consumption and estimations of productivity. Aquaculture, 1986, 55(4): 297- 306.
[12] 刘国兴. 饥饿、盐度和密度胁迫对克氏原螯虾行为和生理功能的影响[D]. 扬州: 扬州大学, 2011: 21- 27.
[13] Bakbin B P. Secretory Mechanism of the Digestive Glands. 2nd ed. New York: P.B. Hoeber, 1950.
[14] Wheatly M G, Henry R P. Branchial and antennal gland Na+/K+-dependent ATPase and carbonic anhydrase activity during salinity acclimation of the euryhaline crayfish pacifastacus leniusculus. Journal of Experimental Biology, 1987, 133(1): 73- 86.
[15] Furriel R P M, McNamarab J C, Leone F A. Characterization of (Na+/K+)-ATPase in gill microsomes of the freshwater shrimpMacrobrachiumolfersii. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2000, 126(3): 303- 315.
[16] 王芸, 李正, 李健, 牛津, 王珺, 黄忠, 林黑着. 绿原酸对凡纳滨对虾抗氧化系统及抗低盐度胁迫的影响. 生态学报, 2013, 33(18): 5704- 5713.
[17] Hernández I, Pérez-Pastor A, Lloréns J L P. Ecological significance of phosphomonoesters and phosphomonoesterase activity in a small Mediterranean river and its estuary. Aquatic Ecology, 2000, 34(2): 107- 117.
[18] 赵磊, 龙晓文, 吴旭干, 何杰, 施永海, 张根玉, 成永旭. 水体盐度对中华绒螯蟹成体雄蟹渗透压调节和生理代谢的影响. 水生生物学报, 2016, 40(1): 27- 34.
[19] 邓平平, 施永梅, 汪洋, 徐嘉波, 谢永德, 刘永士, 税春. 盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响. 大连海洋大学学报, 2016, 31(5): 533- 537.
[20] Lai-Fook J. The structure of the haemocytes ofCalpodesethlius(Lepidoptera). Journal of Morphology, 1973, 139(1): 79- 103.
[21] Rowley A F, Ratcliffe N A. An ultrastructural and cytochemical study of the interaction between latex particles and the haemocytes of the wax mothGalleriamellonellain vitro. Cell and Tissue Research, 1979, 199(1): 127- 137.
[22] 刘存歧, 王安利, 王维娜, 刘媛. 海水中几种金属离子对中国对虾幼体体内碱性磷酸酶和ATPase 的影响. 水产学报, 2001, 25(4): 298- 303.
[23] 王庚申, 谢建军, 施慧, 张涛, 许文军. 不同盐度对脊尾白虾非特异性免疫及抗氧化酶活性的影响. 浙江海洋学院学报: 自然科学版, 2013, 32(6): 499- 502.

