人工固沙植被恢复对地表节肢动物群落组成及多样性的影响
刘继亮,赵文智,*,李锋瑞,潘成臣
1 中国科学院西北生态环境资源研究院,临泽内陆河流域研究站, 兰州 730000 2 中国科学院内陆河流域生态水文重点实验室, 兰州 730000 3 中国科学院西北生态环境资源研究院,奈曼沙漠化研究站, 兰州 730000
人工绿洲是我国内陆河流域主要的自然景观之一,它的面积所占比重很小,但却是人类活动的主要场所[1-2]。近年来,随着社会、经济发展速度加快,绿洲化进程也不断加快,这在黑河流域中游表现尤为明显[3-5]。绿洲化顾名思义就是绿洲不断向外围扩张的过程,主要表现为荒漠或人工固沙植被转变为农田,而又在农田外围栽植大面积人工固沙植被用以保护农田不受风沙侵害[6-8]。天然固沙植被转变为人工固沙植被显著改变植被、土壤及地表水文环境,这必然会对地表节肢动物多样性产生深刻影响,从而影响土壤动物多样性及其生态功能[8-10]。天然植被群落转变为人工植被群落通常会降低节肢动物多样性,然而在干旱区由于受土壤水分及资源限制,节肢动物对植被变化的响应可能与湿润地区不同。绿洲外围的人工固沙植被群落(主要是灌丛植被)面积较大,它对保护和维持荒漠生态系统动植物多样性具有重要的意义。然而,我们对人工固沙灌木群落恢复对地表节肢动物群落组成及多样性的影响的认识还很有限,尚不清楚人工植被恢复对节肢动物群落结构及多样性的影响,也不清楚不同节肢动物类群如何响应植被和土壤环境变化。
地表节肢动物作为干旱区最活跃、物种最丰富和数量最多的类群,既是荒漠生态系统重要的消费者又是重要的捕食者,同时也是特殊的分解者[11-14]。此外,它也作为主要的食物资源维持着沙蜥、鼠类及鸟类的多样性[13-14]。干旱区土壤动物受水分限制,土壤线虫和原生动物等小型土壤动物仅仅在湿季短期活动,而地表节肢动物在干季和湿季均非常活跃,其群落结构及多样性变化可以用来指示干旱区人类活动驱动的植被和土壤环境变化[15-16]。绿洲的防护林外围通过栽植耐旱灌木构建了人工固沙植被带,人工固沙植被群落与天然固沙植被群落相比,植被盖度显著提高,土壤理化性质也发生明显变化[17]。然而,我们对其如何影响地表节肢动物群落的认识还很有限。人工固沙植被恢复对地表节肢动物的影响因气候背景、地域差异、植被类型及恢复方式不同而异。本文通过对黑河中游荒漠绿洲过渡区的两种人工固沙植被群落(梭梭林和柽柳林)和天然固沙植被群落的地表节肢动物群落进行系统调查,揭示天然和人工固沙植被群落中地表节肢动物群落组成及多样性的差异,确定不同节肢动物类群对固沙植被变化的响应规律。
1 材料与方法
1.1 研究区概况
研究区属于大陆性干旱荒漠气候。冬季漫长寒冷,春季干旱少雨,降雨主要集中在7、8、9三个月,秋季比较湿润。年平均降水量117mm(主要集中在7—9月),年平均蒸发量2390mm,年平均气温7.6℃,≥ 10℃年积温3085℃,无霜期165d。年均日照时数为3045h,太阳辐射总量为611272.8J cm-2a-1,本区冬季盛行西北风。年均风速3.2m/s,最大风速可达21.0m/s,≥ 8级以上大风年均15d左右,且集中于3—5月。
天然固沙植被以甘肃沙拐枣(CalligonumchinenseLosinsk.)、沙拐枣 (CalligonummongolicumTurcz.)、泡泡刺(NitrariasphaerocarpaMaxim.)为主,伴生少量的小果白刺(NitrariasibiricaPall.)等。草本植物有沙蓬(Agriophyllumsquarrosum(L.) Moq.)、砂蓝刺头(EchinopsgmeliniiTurcz.)、白茎盐生草(Halogetonglomeratus)、雾冰藜(Bassiadasyphylla(Fisch. & C. A. Mey.) Kuntze)、距果沙芥(PugioniumcalcaratumKom.)和少量的虎尾草(ChlorisvirgataSw.)等。灌木盖度较低(15.8%±0.6%),草本物种数较人工固沙植被多(2.1%±0.1%)。土壤属于风沙土,土壤砂的含量高达98.8%±0.4%,土壤pH呈强碱性(9.0±0.1),土壤有机碳((0.49±0.06)g/kg)、全氮((0.05±0.01)g/kg)和电导率((108.9±14.2)μs/cm)含量较低。
人工梭梭林栽植的灌木主要为梭梭(Haloxylonammodendron(C. A. Mey.) Bunge),伴有少量的沙拐枣和泡泡刺。草本主要有沙蓬、白茎盐生草和雾冰藜等。土壤属于风沙土,土壤砂的含量高达98.7%±0.3%,土壤pH降低(8.7±0.2),但电导率增加((264.5±58.9)μs/cm)。土壤有机碳((0.65±0.13)g/kg)和全氮((0.07±0.02)g/kg)含量略有增加。人工柽柳林栽植的灌木主要是柽柳(TamarixramosissmaLedeb.),伴有少量的泡泡刺。草本植物有骆驼蓬(PeganumharmalaL.)、萝摩(Metaplexisjaponica(Thunb))、滨藜(Atriplex)和大蓟属(Cirsium)草本等。土壤属于风沙土,土壤砂的含量高达97.3%±0.5%,土壤pH降低(8.4±0.2),但土壤电导率显著增加((411.3±100.4)μs/cm)。土壤有机碳((0.52±0.07)g/kg)和全氮((0.05±0.01)g/kg)含量略有增加。
1.2 试验设计及样品采集
本研究区位于黑河中游张掖绿洲外围的荒漠绿洲过渡区(39°22′—39°22′N,100°08′—100°09′E)。近年来,随着绿洲化进程的加快,绿洲外围的荒漠绿洲过渡区破碎化和片段化现象十分明显。大面积的人工固沙植被开垦成农田或改造成水渠或村庄,从而使绿洲外围连片的固沙植被变成面积大小不等的植被斑块。黑河中游人工固沙植被主要由梭梭和柽柳林组成,梭梭或柽柳通常单独栽植形成面积大小不同的灌丛斑块。在绿洲外围选择分别选取3个相对独立的人工梭梭和柽柳植被斑块,梭梭和柽柳的栽植年限接近20a。同时,在人工固沙植被外围选择保护较好的3块天然固沙植被群落进行比较。每个植被斑块随机选择3块面积30m×50m的区域作为地表节肢动物样品采集区,每个动物样品采集区布设10个陷阱收集器(其中5个位于灌丛下,5个位于灌丛间),陷阱之间距离≥10m。
1.3 地表节肢动物样品采集及鉴定
研究区降雨的季节变化明显,气候分明显的干季(4—6月)和湿季(7—9月)。2013年干季(5月下旬)和湿季(8月中旬)对土壤动物群落进行系统调查,每次动物样品采集时间为7d。干旱区特别是在绿洲外围的荒漠及荒漠绿洲过渡区受水分和食物资源限制,大多数土壤动物在地表活动,短期栖居在土壤中,陷阱法与采土分离相比对土壤动物采集效率较高,因而土壤动物调查使用陷阱法(保存液使用加有少量甘油的75%酒精溶液)。采集到的土壤动物样品保存在50mL的PET样品瓶中(装有75%的酒精溶液)带回实验室,利用体视显微镜和生物显微镜进行分拣、种类鉴定和数量统计。地表节肢动物的分类鉴定主要依据《昆虫分类》、《The Spider of China》和《中国荒漠半荒漠区拟步甲科动物》等分类著作,研究中所有节肢动物样品鉴定到科[18-20]。
1.4 数据分析
首先使用用Berger-Parker优势度指数计算天然和人工固沙植被群落中地表节肢动物群落组成,优势度划分5个等级(D≥0.1 时为优势类群,D在0.05—0.1时为丰盛类群,D在0.01—0.05 之间为常见类群,D在0.001—0.01 为偶见类群,D低于0.001者则为稀少或罕见类群)。3种生境5月和8月样品合并统计后,计算地表节肢动物类群丰富度的稀度曲线(估计值,基于采样数量)和类群累积曲线(观测值)。统计5月和8月3种生境地表节肢动物的活动密度(每个收集器捕获动物的个体数量)、类群丰富度(每个收集器采集区采集的动物类群数)和多样性指数(Shannon-Wiener指数)。统计分析使用EstimateS软件包[21]。采用二因素方差分析(GLM模型)比较两个采样期天然和人工固沙植被群落地表节肢动物的活动密度、类群丰富度(和多样性指数的差异,然后使用单因素方差分析不同采样期地表节肢动物群落活动密度、类群丰富度和多样性指数。利用单因素方差比较不同植被类型下主要地表节肢动物类群的差异(稀少和罕见类群除外)和环境变量的差异。方差分析使用SPSS 21.0软件包。
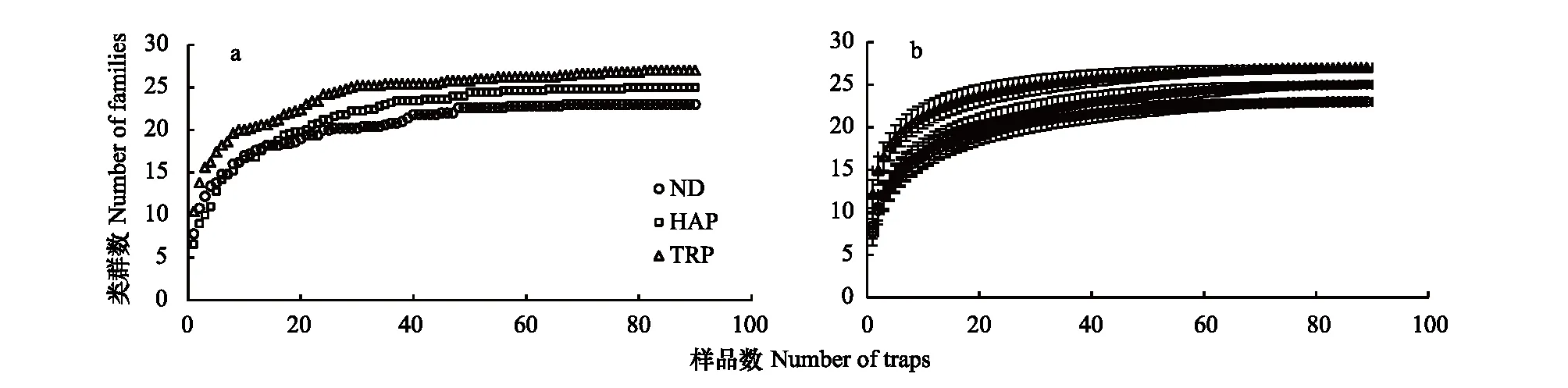
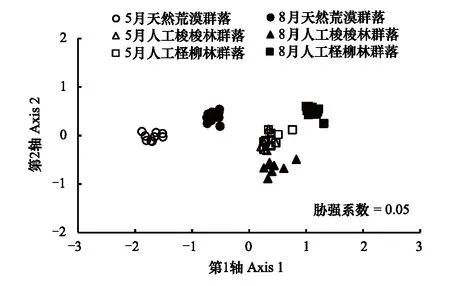
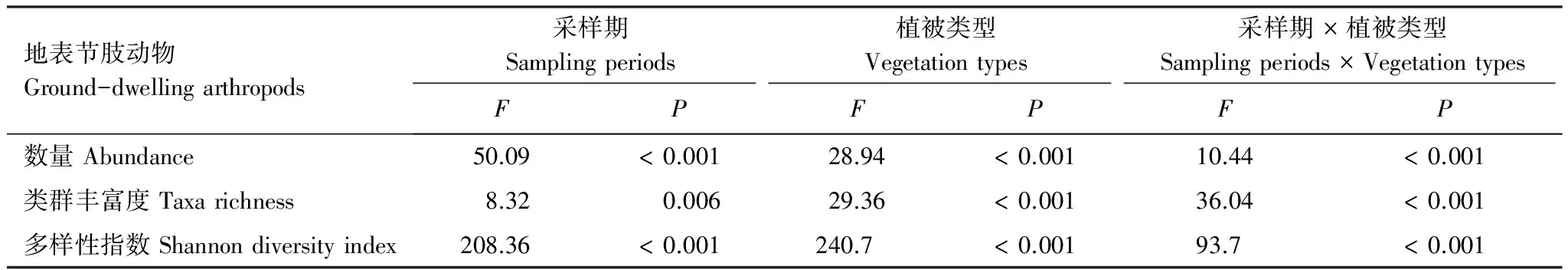
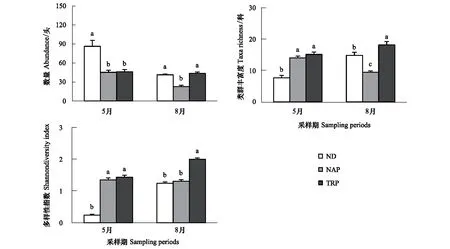
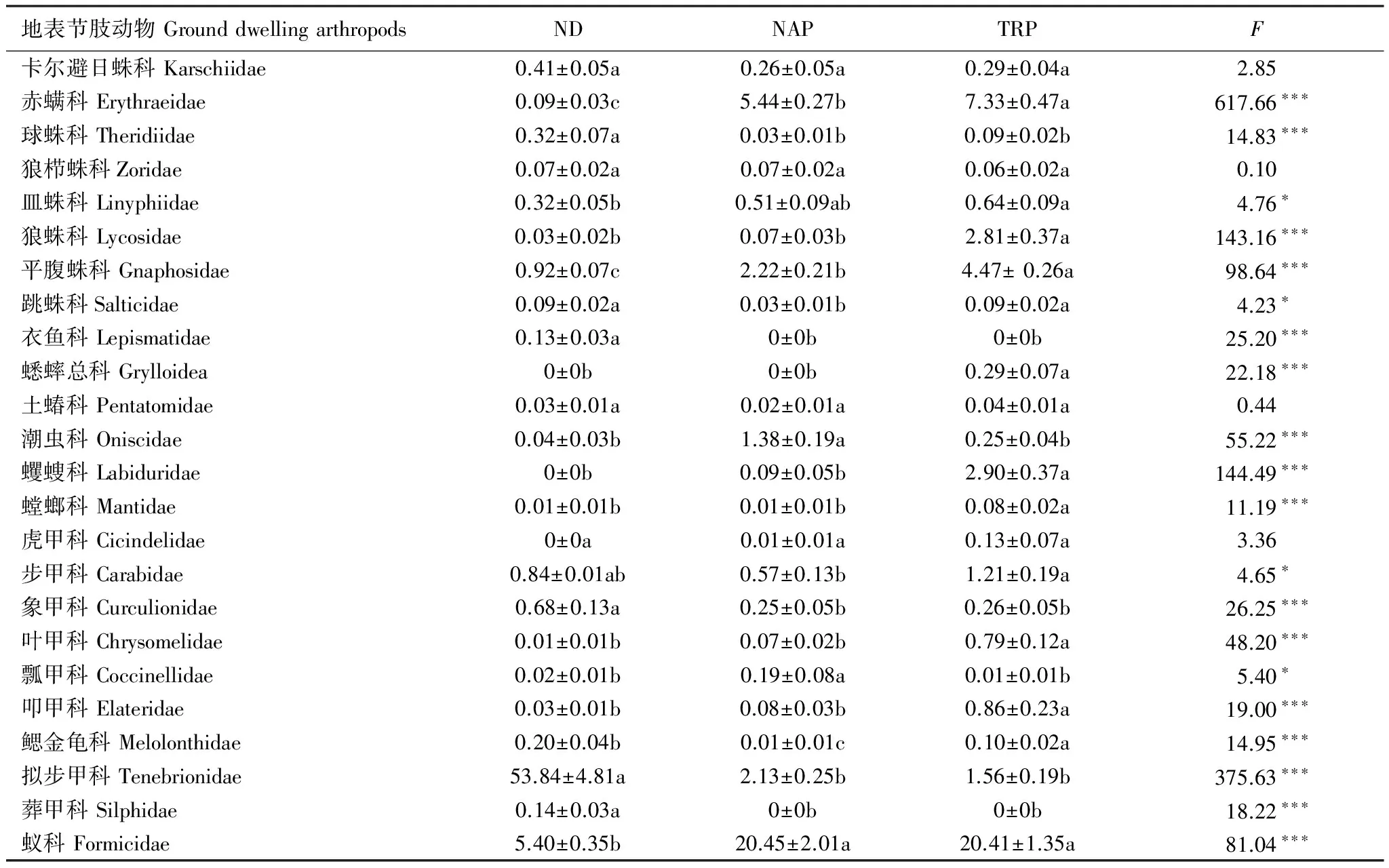
利用非线性多维标定排序(NMDS)和ANOSIM 检验比较5月和8月3种生境间地表节肢动物群落差异(使用每个采样地点10个陷阱合并数据)。排序结果采用胁强系数(stress)衡量NMDS 分析结果的优劣,其中stress<0.01,完全可信;0.01 天然固沙植被群落2个采样期180个收集器共采集11464头地表节肢动物,分属23个科,其中拟步甲科(其个体数量约占总个体数量的84.4%)、蚁科(8.5%)、平腹蛛科(1.5%)、步甲科(1.3%)和象甲科(1.3%)是主要动物类群,而逍遥蛛科、衣鱼科和葬甲科仅在天然固沙植被群落中收集到。人工固沙植被主要由梭梭林和柽柳林群落组成。人工梭梭林群落 2个采样期90个收集器共采集6112头地表节肢,分属25个科,其中蚁科(60.2%)、赤螨科(16.0%)、平腹蛛科(6.5%)、拟步甲科(6.3%)、潮虫科(4.1%)、步甲科(1.7%)和皿蛛科(1.5%),而隐翅虫科仅在梭梭林群落中收集到。人工柽柳林群落2个采样期90个收集器共采集8056头地表节肢,分属27个科,其中蚁科(45.6%)、赤螨科(16.4%)、平腹蛛科(10.0%)、蠼螋科(6.5%)、狼蛛科(6.3%)、拟步甲科(3.5%)、步甲科(2.7%)、叩甲科(1.9%)、叶甲科(1.8%)和皿蛛科(1.4%),而蟋蟀总科、丽金龟科和谷盗科仅在柽柳林群落中收集到。 地表节肢动物类群丰富度的累积和稀疏度估计曲线分析的结果表明,3条曲线均接近水平说明采样代表性较好。3种群落中地表节肢动物类群数的观测值和估计值均表明人工固沙植被群落地表节肢动物丰富度均高于天然固沙植被群落,而人工柽柳林群落地表节肢动物丰富度又高于人工梭梭林群落(图1)。 图1 天然固沙植被群落、人工梭梭和柽柳林群落地表节肢动物类群丰富度的累积曲线和稀度估计曲线Fig.1 Observed and estimated taxa richness of ground-dwelling arthropods based on species accumulation curves and rarefaction methods in the natural desert (ND), Haloxylon ammodendron planted (HAP) and Tamarix ramosissima planted (TRP) 图2 5月和8月天然固沙植被、人工梭梭和柽柳林群落地表节肢动物的NMDS排序图Fig.2 NMDS plots indicating 2-dimensional distances of soil animals in May and August of the natural desert, Haloxylon ammodendron planted and Tamarix ramosissima planted 5月和8月两个采样期天然和人工固沙植被群落地表节肢动物的NMDS排序的结果表明,天然和人工固沙植被群落地表节肢动物群落存在明显差别,而两种人工固沙植被群落地表节肢动物群落也存在一定差异并随采样期变化(图2)。5月人工梭梭林和柽柳林群落地表节肢动物群落相差较小,而8月人工梭梭林和柽柳林群落地表节肢动物群落相差较大(图2)。5月和8月两个采样期天然和人工固沙植被群落地表节肢动物的ANOSIM相似性检验发现植被类型(GlobalR=0.855,P<0.001)和采样期(GlobalR=0.951,P<0.001)均对地表节肢动物分布有显著影响。进一步分下发现5月3种植被类型间地表节肢动物相似性较小(GlobalR=0.710,P<0.001),天然固沙植被群落地表节肢动物与人工梭梭林(R=0.999,P<0.001)和柽柳林群落(R=0.999,P<0.001)存在显著差异,而人工梭梭林和柽柳林群落地表节肢动物相差较小(R=-0.047,P= 0.719)。8月与5月不同,3种植被类型间地表节肢动物相似性较小(GlobalR=0.999,P<0.001),天然和人工梭梭林、柽柳林群落间地表节肢动物也存在明显差别(R=0.999,P<0.001;R=0.999,P<0.001;R=0.999,P<0.001)。 2个采样期天然和人工固沙植被群落地表节肢动物群落的二因素方差分析结果表明,采样期和植被类型均对地表节肢动物数量、类群丰富度和多样性指数有显著影响,同时采样期和植被类型对地表节肢动物数量、类群丰富度和多样性指数有显著的交互影响(表1)。5月天然固沙植被群落地表节肢动物数量显著高于人工梭梭和柽柳林群落,而天然固沙植被群落类群丰富度和多样性指数均显著低于人工梭梭和柽柳林群落(图3)。8月地表节肢动物群落变化与5月不同,人工梭梭林群落土壤动物数量和类群丰富度显著低于天然固沙植被和人工柽柳林群落,人工柽柳林群落土壤动物多样性显著高于天然固沙植被和人工柽柳林群落(图3)。 表1天然(ND)、人工梭梭林(HAP)和柽柳林(TRP)群落地表节肢动物数量、类群丰富度和多样性指数二因素方差分析 Table1Theresultsoftwo-wayANOVAs(GLM)onabundance,taxarichnessandShannondiversityindexofground-dwellingarthropodsinnaturaldesert(ND),Haloxylonammodendronplanted(HAP)andTamarixramosissimaplanted(TRP) 地表节肢动物Ground-dwellingarthropods采样期Samplingperiods植被类型Vegetationtypes采样期×植被类型Samplingperiods×VegetationtypesFPFPFP数量Abundance50.09<0.00128.94<0.00110.44<0.001类群丰富度Taxarichness8.320.00629.36<0.00136.04<0.001多样性指数Shannondiversityindex208.36<0.001240.7<0.00193.7<0.001 图3 5月和8月天然和人工固沙植被群落地表节肢动物数量、类群丰富度和多样性指数比较Fig.3 The abundance, taxa richness and Shannon diversity index in May and August of the ground-dwelling arthropods among natural desert (ND), Haloxylon ammodendron (HAP) and Tamarix ramosissma planted (TRP) 不同地表节肢动物类群对固沙植被变化的响应模式不同。狼栉蛛科、土蝽科和虎甲科3个类群受植被变化影响较小,天然和人工固沙植被群落间捕获的数量没有显著差异(表 2)。天然固沙植被群落转变为人工固沙植被群落,赤螨科、平腹蛛科和蚁科3个捕获数量显著增加,其中赤螨科、平腹蛛科在柽柳林群落捕获的数量又显著高于梭梭林群落;球蛛科、衣鱼科、象甲科、拟步甲科、葬甲科和蚁科捕获的数量显著降低(表2)。人工固沙植被类型不同,地表节肢动物的响应模式也存在一定差别。皿蛛科、狼蛛科、蠼螋科、叶甲科和叩甲科在人工柽柳林群落捕获的数量显著高于天然固沙植被群落,潮虫科和瓢甲科在人工梭梭林群落捕获的数量显著高于天然固沙植被群落,而跳蛛科和鳃金龟科在在人工梭梭林群落捕获的数量显著低于天然固沙植被和人工柽柳林群落(表2)。 表2天然(ND)、人工梭梭林(HAP)和柽柳林(TRP)群落不同地表节肢动物类群数量比较 Table2AstatisticofMean±SEonground-dwellingarthropodsinnaturaldesert(ND),Haloxylonammodendronplanted(HAP)andTamarixramosissimaplanted(TRP)pooledtwosamplingperiodsin2013 地表节肢动物GrounddwellingarthropodsNDNAPTRPF卡尔避日蛛科Karschiidae0.41±0.05a0.26±0.05a0.29±0.04a2.85赤螨科Erythraeidae0.09±0.03c5.44±0.27b7.33±0.47a617.66∗∗∗球蛛科Theridiidae0.32±0.07a0.03±0.01b0.09±0.02b14.83∗∗∗狼栉蛛科Zoridae0.07±0.02a0.07±0.02a0.06±0.02a0.10皿蛛科Linyphiidae0.32±0.05b0.51±0.09ab0.64±0.09a4.76∗狼蛛科Lycosidae0.03±0.02b0.07±0.03b2.81±0.37a143.16∗∗∗平腹蛛科Gnaphosidae0.92±0.07c2.22±0.21b4.47±0.26a98.64∗∗∗跳蛛科Salticidae0.09±0.02a0.03±0.01b0.09±0.02a4.23∗衣鱼科Lepismatidae0.13±0.03a0±0b0±0b25.20∗∗∗蟋蟀总科Grylloidea0±0b0±0b0.29±0.07a22.18∗∗∗土蝽科Pentatomidae0.03±0.01a0.02±0.01a0.04±0.01a0.44潮虫科Oniscidae0.04±0.03b1.38±0.19a0.25±0.04b55.22∗∗∗蠼螋科Labiduridae0±0b0.09±0.05b2.90±0.37a144.49∗∗∗螳螂科Mantidae0.01±0.01b0.01±0.01b0.08±0.02a11.19∗∗∗虎甲科Cicindelidae0±0a0.01±0.01a0.13±0.07a3.36步甲科Carabidae0.84±0.01ab0.57±0.13b1.21±0.19a4.65∗象甲科Curculionidae0.68±0.13a0.25±0.05b0.26±0.05b26.25∗∗∗叶甲科Chrysomelidae0.01±0.01b0.07±0.02b0.79±0.12a48.20∗∗∗瓢甲科Coccinellidae0.02±0.01b0.19±0.08a0.01±0.01b5.40∗叩甲科Elateridae0.03±0.01b0.08±0.03b0.86±0.23a19.00∗∗∗鳃金龟科Melolonthidae0.20±0.04b0.01±0.01c0.10±0.02a14.95∗∗∗拟步甲科Tenebrionidae53.84±4.81a2.13±0.25b1.56±0.19b375.63∗∗∗葬甲科Silphidae0.14±0.03a0±0b0±0b18.22∗∗∗蚁科Formicidae5.40±0.35b20.45±2.01a20.41±1.35a81.04∗∗∗ 字母不同代表植被间不同地表节肢动物类群存在显著差异;*P<0.05, **P<0.01, ***P<0.001 指示种分析的结果表明,一些动物类群对3种植被类型有较强的指示性。拟步甲科(IV=93.6,P<0.001)、衣鱼科(IV=88.9,P<0.001)、葬甲科(IV=77.8,P<0.001)、球蛛科(IV=72.5,P<0.001)、象甲科(IV=61.2,P<0.001)、鳃金龟科(IV=57.1,P<0.001)和卡尔避日蛛科(IV=42.6,P=0.042)对天然固沙植被群落有较强的指示性。潮虫科(IV=82.4,P<0.001)、瓢甲科(IV=66.4,P=0.003)和蚁科(IV=44.2,P=0.037)对人工梭梭林群落有较强的指示性。蠼螋科(IV=96.8,P<0.001)、狼蛛科(IV=96.4,P<0.001)、叶甲科(IV=91.1,P<0.001)、蟋蟀总科(IV=88.9,P<0.001)、叩甲科(IV=88.6,P<0.001)、螳螂科(IV=60.5,P=0.002)、平腹蛛科(IV=58.8,P<0.001)、赤螨科(IV=57.0,P<0.001)、虎甲科(IV=51.3,P=0.022)、步甲科(IV=46.2,P=0.018)、丽金龟科(IV=44.4,P=0.023)对人工柽柳林群落有较强的指示性。 干旱区、半干旱区土地利用变化引起的植被变化强烈影响土壤动物多样性及生态功能,不同地域生物多样性对土地利用变化的响应模式也因气候、植被和土壤等生境条件不同存在一定差异[24- 26]。天然植被群落转变为有灌溉的人工林地或农田,随着地表生态水文环境的改善土壤节肢动物的种类和数量均显著增加,而地表节肢动物的多样性也明显增加,但地表节肢动物的数量明显降低。李锋瑞等[27]和Li等[28]在黑河中游巴丹吉林沙漠边缘的张掖绿洲研究揭示,人工植被恢复提高地表和土壤节肢动物的多样性,土壤节肢动物数量也显著增加,而地表节肢动物的数量显著降低。Cook和 Faeth[29]在美国索纳塔荒漠(Sonoran desert)的研究发现,绿洲内部农业用地和和较湿的居住地支持了更多的地面节肢动物数量和类群,但荒漠生境包含一些适应荒漠极端条件的特有节肢动物种类。由此可见,水是干旱区影响土壤动物活动的主要环境因子,而一些适应荒漠环境特有的节肢动物类群会随着地表水文环境的改变而丧失,这也导致土壤动物群落的结构和功能发生转变。天然植被群落转变为无灌溉的人工林地,植被的物种多样性略有降低,植被盖度、凋落物的种类、数量均显著增加,这也改善了地表节肢动物的栖居环境,从而提高了地表节肢动物的多样性。然而,干旱区人工栽植的灌木(如梭梭和柽柳)显著改变了盐碱环境,促进物理结皮的发育,抑制草本生长,林地在发育中后期也会产生退化,这也限制了一些地表节肢动物的生存和繁殖[30-31]。李岳诚等[32]及刘任涛和朱凡[33]在宁夏对的研究发现,天然沙地与人工柠条林地相比土壤动物数量较高,而动物群落丰富度和多样性均较低,这与我们在黑河中游的研究结果相近。此外,我们的研究还发现,两种人工植被群落地表节肢动物群落明显不同,人工柽柳林群落地表节肢动物的数量、类群丰富度和多样性在8月均显著高于人工梭梭林群落。灌木种类不同既能改变食物资源的数量及质量,它也能对土壤环境产生影响,这些生物、非生物环境的改变直接、间接影响了地表节肢动物的活动,进而改变群落组成及多样性[34]。天然植被群落转变为人工植被群落、退化生境人工植被恢复等利用多种植被恢复营建复杂的景观环境对维持蜘蛛和甲虫的多样性具有重要的生态意义,这也有利于维持干旱区绿洲生态系统的安全与稳定[35- 36]。 不同地表节肢动物类群对人工植被恢复的响应模式存在明显差别。蜘蛛是研究区主要的捕食性地表节肢动物类群(约占总捕获量的9.1%),大多数蜘蛛类群在人工固沙植被捕获的数量要高于天然固沙植被。人工植被恢复提高了植被盖度或生物量,减少了极端环境和天敌等对蜘蛛的影响,随着植被生产力的增加,蜘蛛的数量及多样性均增加[37]。然而,植被恢复也强烈影响一些适应原有植被环境的蜘蛛类群(如球蛛科等),随着植被变化它们的种类显著降低或消失,这与姚润枝等[38]关于退耕还林对蜘蛛群落影响的研究结果接近,退耕还林也导致一些适应农田环境的蜘蛛类群的丧失。不同蜘蛛类群对人工植被的恢复还可能与蜘蛛的捕食行为有关,任海庆等[39]的研究发现,结网型蜘蛛偏好选择灌木盖度较低的生境,而游猎型蜘蛛更多选择在植盖度较高的人工生境活动,伏击型蜘蛛受植被盖度变化影响较小,不同蜘蛛类群的取食及繁殖导致它们对生境条件变化的响应模式不同。本研究也发现人工植被恢复降低了结网型的球蛛科的数量而,游猎型蜘蛛狼蛛科、平腹蛛科和皿蛛科等数量均增加,伏击型蜘蛛跳蛛科数量变化较小,不同蜘蛛类群的取食及繁殖策略不同导致它们对植被恢复引发的生境条件变化的响应模式不同。甲虫是研究区最大的土壤动物类群(约占总捕获量的45.0%),它们对环境变化的适应能力较强。研究发现不同甲虫类群对固沙植被恢复的响应不同,这可能与地域差异和甲虫的生理生态特征有关;然植被群落替代人工植被群落后拟步甲科、象甲科甲虫数量显著降低,而步甲科的数量显著增加。李岳诚等[32]研究发现在宁夏白芨滩国家级自然保护区地表甲虫多样性在相对湿润的人工林最高,而流动沙地最低。娄巧哲等[40]在新疆古尔班通沙漠南缘对地表甲虫多样性的研究发现,荒漠中拟步甲科的数量要高于交错区,而象甲科甲虫在交错区的物种数及活动频率最高。贺奇等[41]在宁夏盐池荒漠草地的研究发现主要步甲科甲虫在8月份以后活动,中度干扰的荒漠草地步甲科多样性高于高度和低干扰荒漠草地。总之,一些腐食性或植食性荒漠甲虫种类或数量随着生境条件的改变而降低,而一些捕食性甲虫(步甲科)种类或数量则随着生境条件改善而增加,这也会改变地表节肢动物群落营养结构及功能。此外,研究还发现,人工植被恢复显著增加了蚁科的数量,这与Liu等[42]在内蒙古科尔沁沙地的研究结果相近,人工植被恢复增加了食物资源,这也为杂食性的蚁科提供了充足的食物资源。 人工植被恢复强烈影响了地表节肢动物的组成及多样性,地表节肢动物群落和一些关键类群的数量变化对植被恢复有较强的指示性,它们可以用来指示或评估由植被恢复引起的生境条件变化。拟步甲科和衣鱼科等地表节肢动物类群对天然荒漠生境有较强的指示性。荒漠植被改变后一些拟步甲科种栖息地或产卵地丧失等导致其种类和数量逐渐降低[43-44]。潮虫科等地表节肢动物类群对人工梭梭林生境有较强的指示性。潮虫科动物对人工梭梭林群落的偏好可能与林下结皮的发育及微生物的活动有关,它影响了菌食性潮虫科动物的取食和栖居[45]。蠼螋科和狼蛛科等地表节肢动物类群对人工柽柳林生境有较强的指示性。蠼螋科和狼蛛科对人工柽柳林群落的偏好可能与食物资源的数量及质量有关,二者均属于捕食性类群,一些小型节肢动物(如螨和跳虫)的种类及数量变化可能影响其数量。总之,人工固沙植被恢复驱动了植被和土壤环境变化,它们与降雨变化一起调控了地表节肢动物群落及关键类群变化,而不同土壤动物类群对环境变化的响应模式不同,从而决定了地表节肢动物营养功能群组成及以碎屑为基础的食物网结构的动态变化。此外,一些地表节肢动物类群对人工固沙植被恢复变化有强烈的指示作用,这可以评估或监测人工植被恢复过程中植被或土壤环境变化[44,46]。 干旱区人工固沙植被恢复强烈影响了地表节肢动物群落结构及多样性,而植被类型不同对地表节肢动物群落的组成影响也存在一定差异。天然固沙植被群落转变为人工固沙植被群落显著降低了地表节肢动物数量,但提高了地表节肢动物类群丰富度和多样性,这在5月份表现尤为明显。此外,植被类型对地表节肢动物群落的影响不同,人工柽柳林群落地表节肢动物活动密度、类群丰富度和多样性均显著高于人工梭梭林群落。不同地表节肢动物类群对植被恢复的响应不同,人工固沙植被恢复显著降低了适应荒漠环境的拟步甲科和象甲科甲虫的数量,而蚁科、步甲科和大多数蜘蛛类群的数量显著增加。此外,研究还发现一些地表节肢动物类群对不同生境具有强烈的指示作用,如拟步甲科等指示荒漠生境,潮虫科等指示梭梭林生境,而蠼螋科和狼蛛科等指示柽柳林生境。综上所述,人工栽植固沙恢复导致了一些适应荒漠环境的节肢动物类群(拟步甲科)的数量降低,但也提高了一些捕食性节肢动物(步甲科和蜘蛛)的数量,这也能为绿洲农田提供更多的害虫天敌。 [1] 赵文智, 杨荣, 刘冰, 杨淇越, 李芳. 中国绿洲化及其研究进展. 中国沙漠, 2016, 36(1): 1- 5. [2] 常学礼, 韩艳, 孙小艳, 张宁. 干旱区绿洲扩展过程中的景观变化分析. 中国沙漠, 2012, 32(3): 857- 862. [3] 王涛. 干旱区绿洲化、荒漠化研究的进展与趋势. 中国沙漠, 2009, 29(1): 1- 9. [4] 廖杰, 王涛, 薛娴. 近55a来黑河流域绿洲演变特征的初步研究. 中国沙漠, 2012, 32(5): 1426- 1441. [5] 钱大文, 巩杰, 贾珍珍. 绿洲化-荒漠化土地时空格局变化对比研究——以黑河中游临泽县为例. 干旱区研究, 2016, 33(1): 80- 88. [6] 李新荣, 赵洋, 回嵘, 苏洁琼, 高艳红. 中国干旱区恢复生态学研究进展及趋势评述. 地理科学进展, 2014, 33(11): 1435- 1443. [7] 赵哈林, 赵学勇, 张铜会, 李玉霖, 苏永中. 北方农牧交错区沙漠化的生物过程研究. 中国沙漠, 2002, 22(4): 309- 315. [8] 李新荣, 张志山, 黄磊, 王新平. 我国沙区人工植被系统生态-水文过程和互馈机理研究评述. 科学通报, 2013, 58(5/6): 397- 410. [9] 王蕙, 赵文智. 绿洲化过程中绿洲土壤物理性质变化研究. 中国沙漠, 2009, 29(6): 1109- 1115. [10] 邵元虎, 张卫信, 刘胜杰, 王晓丽, 傅声雷. 土壤动物多样性及其生态功能. 生态学报, 2015, 35(20): 6614- 6625. [11] Yin X Q, Song B, Dong W H, Xin W D, Wang Y Q. A review on the eco-geography of soil fauna in China. Journal of Geographical Sciences, 2010, 20(3): 333- 346. [12] Whitford W G. The importance of the biodiversity of soil biota in arid ecosystems. Biodiversity and Conservation, 1996, 5(2): 185- 195. [13] Shachak M, Gosz J R, Pickett S T A, Perevolotsky A. Biodiversity in Drylands: Toward A Unified Framework (Long-Term Ecological Research Network Series). New York: Oxford University Press, 2005. [14] Ayal Y. Trophic structure and the role of predation in shaping hot desert communities. Journal of Arid Environments, 2007, 68(2): 171- 187. [15] Nielsen U N, Ball B A. Impacts of altered precipitation regimes on soil communities and biogeochemistry in arid and semi-arid ecosystems. Global Change Biology, 2015, 21(4): 1407- 1421. [16] 刘继亮, 赵文智, 李锋瑞. 黑河中游荒漠地面节肢动物分布特征. 干旱区研究, 2015, 32(6): 1192- 1200. [17] Su Y Z, Zhao W Z, Su P X, Zhang Z H, Wang T, Ram R. Ecological effects of desertification control and desertified land reclamation in an oasis-desert ecotone in an arid region: a case study in Hexi Corridor, northwest China. Ecological Engineering, 2007, 29(2): 117- 124. [18] 郑乐怡, 归鸿. 昆虫分类. 南京: 南京师范大学出版社, 1999. [19] Song D X, Zhu M S, Chen J. The Spiders of China. Shijiazhuang: Hebei Science and Technology Publishing House, 1999. [20] 任国栋, 于有志. 中国荒漠半荒漠的拟步甲科昆虫. 保定: 河北大学出版社, 1999. [21] Colwell R K. EstimateS: Statistical estimation of species richness and shared species from samples. Version 9.1.0. User′s Guide and Application. 2013. http://viceroy.colorado.edu/estimates. [22] Clarke K R, Gorley R N. PRIMER V6: User Manual/Tutorial (Plymouth Routines in Multivariate Ecological Research). Plymouth: Primer-E Ltd, 2006. [23] Mccune B, Mefford M J. Multivariate Analysis of Ecological Data, Version 4.25. Gleneden Beach, Oregon: MjM Software, 1999. [24] Foley J A, DeFries R, Asner G P, Barford C, Bonan G, Carpenter S R, Chapin F S, Coe M T, Daily G C, Gibbs H K, Helkowski J H, Holloway T, Howard E A, Kucharik C J, Monfreda C, Patz J A, Prentice I C, Ramankutty N, Snyder P K. Global consequences of land use. Science, 2005, 309(5734): 570- 574. [25] Blankinship J C, Niklaus P A, Hungate B A. A meta-analysis of responses of soil biota to global change. Oecologia, 2011, 165(3): 553- 565. [26] Tsiafouli M A, Thébault E, Sgardelis S P, De Ruiter P C, Van Der Putten W H, Birkhofer K, Hemerik L, De Vries F T, Bardgett R D, Brady M V, Bjornlund L, Jørgensen H B, Christensen S, D′Hertefeldt T, Hotes S, Hol W H G, Frouz J, Liiri M, Mortimer S R, Setälä H, Tzanopoulos J, Uteseny K, Pižl V, Stary J, Wolters V, Hedlund K. Intensive agriculture reduces soil biodiversity across Europe. Global Change Biology, 2015, 21(2): 973- 985. [27] Li F R, Feng Q, Liu J L, Sun T S, Ren W, Guan Z H. Effects of the conversion of native vegetation to farmlands on soil microarthropod biodiversity and ecosystem functioning in a desert oasis. Ecosystems, 2013, 16(7): 1364- 1377. [28] 李锋瑞, 刘继亮, 化伟, 牛瑞雪, 刘七军, 刘长安. 地面节肢动物营养类群对土地覆被变化和管理扰动的响应. 生态学报, 2011, 31(15): 4169- 4181. [29] Cook W M, Faeth S H. Irrigation and land use drive ground arthropod community patterns in an urban desert. Environmental Entomology, 2006, 35(6): 1532- 1540. [30] Xiao B, Hu K L. Moss-dominated biocrusts decrease soil moisture and result in the degradation of artificially planted shrubs under semiarid climate. Geoderma, 2017, 291: 47- 54. [31] 刘继亮, 李锋瑞, 牛瑞雪, 刘七军, 秦彧, 刘长安. 黑河中游不同土地利用方式地面节肢动物对土壤盐渍化的响应. 土壤学报, 2011, 48(6): 1242- 1252. [32] 李岳诚, 张大治, 贺达汉. 荒漠景观固沙柠条林地地表甲虫多样性及其与环境因子的关系. 林业科学, 2014, 50(5): 109- 117. [33] 刘任涛, 朱凡. 荒漠草原区人工柠条林地面节肢动物群落月动态变化. 草业学报, 2014, 23(2): 296- 304. [34] Liu J L, Zhao W Z, Li F R. Effects of shrub presence and shrub species on ground beetle assemblages (Carabidae, Curculionidae and Tenebrionidae) in a sandy desert, northwestern China. Journal of Arid Land, 2015, 7(1): 110- 121. [35] 郑国, 杨效东, 李枢强. 西双版纳地区六种林型地表蜘蛛多样性比较研究. 昆虫学报, 2009, 52(8): 875- 884. [36] 刘云慧, 宇振荣, 王长柳, 李良涛, 常虹. 坝上地区农田和恢复生境地表甲虫多样性. 生态学报, 2011, 31(2): 465- 473. [37] Shochat E, Stefanov W L, Whitehouse M E A, Faeth S H. Urbanization and spider diversity: influences of human modification of habitat structure and productivity. Ecological Applications, 2004, 14(1): 268- 280. [38] 姚润枝, 周在豹, 闫国增, 田作宝, 王朔, 李凯. 退耕还林对地面蜘蛛种群的影响. 生态学报, 2016, 36(22): 7393- 7400. [39] 任海庆, 陈建, 袁兴中, 刘杰. 海南天然林与橡胶林蜘蛛多样性比较. 生态学报, 2016, 36(6): 1774- 1781. [40] 娄巧哲, 徐养诚, 马吉宏, 吕昭智. 古尔班通古特沙漠南缘地表甲虫物种多样性及其与环境的关系. 生物多样性, 2011, 19(4): 441- 452. [41] 贺奇, 王新谱, 杨贵军. 宁夏盐池荒漠草原步甲物种多样性. 生态学报, 2011, 31(4): 923- 932. [42] Liu R T, Zhao H L, Zhao X Y. Effect of vegetation restoration on ant nest-building activities following mobile dune stabilization in the Horqin Sandy Land, Northern China. Land Degradation & Development, 2009, 20(5): 562- 571. [43] 吕昭智, 钟晓英, 苏延乐, 梁红斌. 中华漠王Platyopeproctoleucachinensis(鞘翅目: 拟步甲科)对微生境的选择. 生态学杂志, 2010, 29(11): 2199- 2203. [44] 张大治, 陈曦, 贺达汉. 荒漠景观拟步甲科昆虫多样性及其对生境的指示作用. 应用昆虫学报, 2012, 49(1): 229- 235. [45] Segoli M, Groner E, Ayal Y. The importance of plant cover and predation in shaping a desert community. Journal of Arid Environments, 2016, 135: 33- 38. [46] 李迎运, 张大治. 荒漠生境拟步甲科指示性昆虫的初步筛选. 生态科学, 2016, 35(1): 67- 74.2 结果与分析
2.1 天然和人工固沙植被群落地表节肢动物群落的组成与数量特征
2.2 天然和人工固沙植被群落地表节肢动物群落结构及相似性比较
2.3 天然和人工固沙植被群落不同地表节肢动物类群比较
3 讨论
4 结论

