基于微宇宙试验的不同营养级景观湖泊营养盐变化的研究
李 霞,于 淼,林 欣,王 蕊,石宇亭,孙 玥
(天津理工大学环境科学与安全工程学院,天津 300384)
景观湖泊作为城市的基础设施,具有景观和生态双重功能,然而,目前大多景观湖泊存在富营养化问题.水体的富营养化会对人体健康和水体的生态系统产生威胁.富营养化会使水体的浊度升高,使植物的光合作用降低,造成水中溶解氧降低以及水中部分溶解氧过度饱和,这两种状态会对水中的生物造成威胁,导致水中的活鱼数量的减少.富营养化还会使水中藻类数量增加,形成水华、赤潮现象.水中的缺氧状态还会产生有毒气体,对环境产生危害.人类误食来自污染水体的水产,会产生严重的安全隐患[1-2].
近些年来,利用微宇宙试验模拟河流/湖泊/水库等水体中富营养进程,逐渐成为了解富营养过程中生物和水质相互作用的有效手段.由于微宇宙主要是应用于实验室或中小生态系统条件下的试验技术,且具有较好的可控性及应用性,在水体富营养化中应用较广泛.
早在1969年,Abbott[3-4]在其发表论文中利用微宇宙方法对港湾水域内的营养盐进行分析,指出微宇宙系统中磷酸盐和硝酸盐浓度长时间处于比较高的状态.1990年Taylor[5]使用微宇宙试验方法测试藻类生长潜力,发现藻类生长潜力受到采样时水中营养物质形态和组成的影响.Oberholster等[7]在研究中基于微宇宙方法模拟了无机磷酸盐和浮游动物间的关系,并分析出不同磷酸盐浓度对应的浮游动物优势种类.2000年以来,微宇宙试验中营养盐从概化的总氮和总磷到细化的无机盐(氨氮/硝态及亚硝态氮/磷酸盐等),且增加了pH、金属离子等影响因子,试验范围从单纯的分析藻类与水体中营养元素间关系到模拟水体与底泥间营养元素的交换过程,详见 Fyson[8]、Yamada[9]和Zhang[10]等文献.
基于生态营养级角度考虑,近年来微宇宙试验方法也在不断地深化,从一级营养级模型(浮游植物—营养盐模型)到二级营养级模型(浮游动物—浮游植物—营养盐模型)再到三级营养级富营养化模型(浮游动物—浮游植物—营养盐模型)等.Kilham[11]在其研究中,通过对比氮限制、磷限制和无营养限制环境,对浮游动物与水质之间的关系进行了试验,研究表明营养盐限制状态会对浮游动物的丰度有较大影响.Ristau[12]在微宇宙试验模拟中设置不同的营养盐浓度,水体变化从贫营养到富营养化过程中浮游植物和浮游动物的种群变化过程.Starling[13]在其研究中对热带富营养化水库中的浮游植物和水质变化进行了微宇宙试验,试验采用三种兼食性鱼和一种专食性鱼,结果表明专食性鱼可降低水中藻类浓度从而改善水质.Edgar[14]在其微宇宙试验分析浮游植物、浮游动物和鱼类间的相互作用,对比分析了浮游植物和浮游动物在不同微宇宙试验环境下的数量及结构形态.Mckee等[15]在其研究中基于微宇宙方法探究不同季节下温度对浮游植物、浮游动物和鱼类的影响,结果表明温度提高会使富营养化加重.Milstein等[16]为了研究浮游动物的种类和形态能否满足鱼苗捕食生长,使用微宇宙试验模拟浮游动物组成对鱼苗捕食强度的影响,展示出了鱼苗捕食生长需要在浮游动物较高的浓度下才能进行.
根据以往的试验研究,本研究决定采用微宇宙试验方法来探究富营养化的问题,设定一级营养级微宇宙系统、两级营养级微宇宙系统、三级营养级微宇宙系统,并针对不同营养级水体的营养盐浓度及其他影响因素进行测定分析及总结,提出富营养化湖泊控制的建议和措施,促进水体的良性可持续发展.本微宇宙系统未在水族箱内设置底泥,是因为试验目的是不同营养级下水体相关富营养化参数变化,加入底泥会复杂化系统中营养盐的迁移转化过程,降低系统可控性,从而影响试验结果.
1 微宇宙试验方法与材料
1.1 试验目的
采用微宇宙试验装置模拟景观水体.通过对水中营养级的控制,及水中各指标的测定对比,对不同营养级景观湖泊营养盐的变化进行分析,来研究景观水体富营养化的机理.
1.2 试验地点与装置
试验地点选择在实验室中进行,试验水源为天津理工大学明理湖,明理湖的年平均气温约为14℃,最高温度为28℃出现在七月.明理湖的水源补给主要靠雨水径流.
采用微宇宙试验水族箱(如图1所示),水族箱材质为有机玻璃,尺寸为长100 cm、宽50 cm、高50 cm,数量设置为4个.试验过程中加入水样200 L,其中水位高40 cm,水面上方余10 cm.
为提高系统的可控性,将微宇宙试验水族箱放置在室内,光照模仿室外条件,由日光灯提供,每天照射时间为7:00-21:00,光照与黑暗周期比为14/10 hr;温度尽量保持与取样景观湖水温一致,水族箱内设温度计和温控加热器;水位控制借由试验箱外贴的刻度尺实现,通过水位测量计算补水量从而保持水位.
水族箱内需设循环泵(过滤棉去掉),并设曝气装置,主要起充氧和循环扰动作用,促进营养物质的循环和避免浮游生物的下沉.
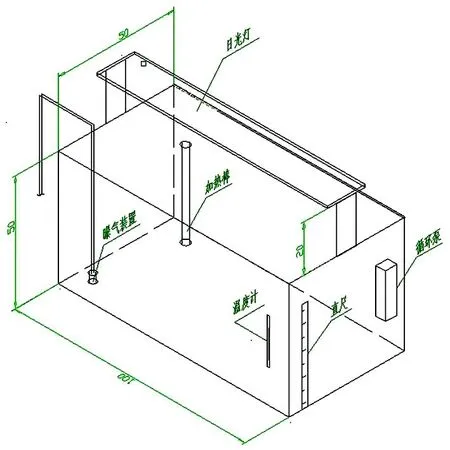
图1 微宇宙水族箱系统设计Fig.1 Microcosm aquarium design
1.3 试验材料
本试验的浮游植物采用斜生栅列藻(Scenedesmus Obliquus),该藻为栅藻科,栅藻属.在各种静止水体中分布广泛,为标准试验用藻之一.浮游动物采用蚤科蚤属的大型蚤(Daphniamagna),该蚤在水草生长茂盛的富营养化水体中广泛分布.鱼类采用两种鱼类鲫鱼(Carassiusauratus)与金鱼(Carassiusauratus),鲫鱼属鲤形目、鲤科、鲫属,杂食性鱼类,大鲫鱼与小鲫鱼的食性有所不同,本试验采用小鲫鱼,小鲫鱼喜食浮游动物.金鱼又称“金鲫鱼”,由鲫鱼进化而成,喜食浮游动物的杂食性观赏鱼类.
1.4 试验方法
试验最初进行原水试验,以处理后的明理湖原水作试验用水,虽然水体中的生物种群与营养物质与湖泊水体更加接近,但是湖泊原水的生物成分复杂,影响因素较多.于是进行了第二部分的配水试验,配水试验的营养物质与生物构成简单,更易控制,影响因素少,使结果更明显.
1.4.1 原水试验
原水试验于4月13日开始,结束于5月22日,分为两个阶段.
(1)将四个水族箱编号为1、2、3、4.取湖水并过滤,利用不同孔径的生物网创造不同的营养级环境.1、2水族箱利用25号生物网孔径0.064 mm过滤掉大多数浮游动物,创造只剩浮游植物的一级营养级环境.3、4水族箱利用13号生物网孔径0.112 mm创造含有浮游植物与浮游动物的两级营养级系统.注水后打开照明系统与曝气系统.正常运行48小时后,分别从水族箱中取水测各指标值作为基准.
(2)第一阶段的试验为期二十一天,分为:第一组1、2只有浮游植物的一级营养级系统,另一组为3、4有浮游植物与浮游动物的二级营养级系统,可以观察浮游动物对浮游植物的影响.第二阶段为期14天,向1、2、3、4各加4条鲫鱼.两个阶段都需要对四个水族箱的各指标进行测定.为保证水生生物维持正常生活,每次试验结束后加入蒸馏水补充水族箱及微量元素(MgCl20.08 g/L,CaCl20.03 g/L,KCl 0.035 g/L).
1.4.2 配水试验
(1)取湖水水样,测定其各指标作为试验用水配置的参照.
(2)试验采用三个水族箱,编号为5、6、7,分别向三个水族箱注入自来水,并以湖水的参照值向水中添加药品(硝酸钾,氯化铵,磷酸二氢钾),以保证水中营养元素与湖水中相似.后开启照明系统与曝气系统.正常运行48小时后,分别从水族箱里取水测各指标值作为基准值.
(3)将6作为有浮游植物与浮游动物的二级营养级系统.7作为有浮游植物、浮游动物与鱼的三级营养级系统.而5作为只有浮游植物的一级营养级,试验测定与原水试验相同.
2 试验结果与分析
2.1 原水试验
2.1.1 叶绿素a
根据两个阶段试验对于叶绿素的检测可以看出有浮游动物的水体与一级只有浮游植物的水体的叶绿素a的总体走势一致,而有浮游动物的水体叶绿素a含量总体比只有藻类的水体低,说明富营养化水体中的浮游动物和鱼类量的缺少可能是导致其富营养化持续的原因之一(见图2).
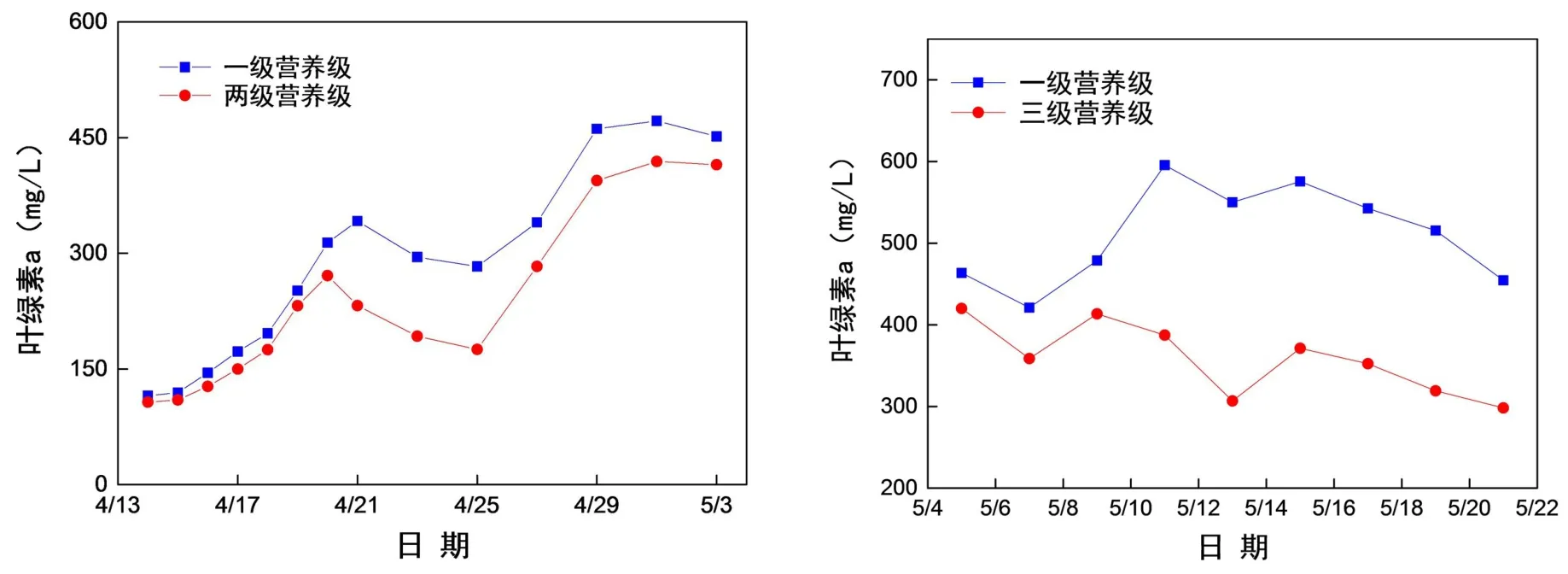
图2 一级、两级和三级营养级叶绿素a指标对比Fig.2 Chl-a comparison during one trophic level,two trophic levels and three trophic levels
2.1.2 氮元素
由两个阶段的氮元素检测可以看出,有无浮游动物水体的氮元素趋势基本上一致,并且含有浮游动物的两级营养级系统氮元素浓度与一级营养级虽有降低,但是不很显著,浮游动物对于水中氮元素的影响不太明显.而有鲫鱼的水体的氮元素浓度总体比只有藻类的高,因为鲫鱼的粪便可视为水中氮元素来源,并且其代谢作用加速了机氮转化为无机氮排放入水体中的进程,所以导致有鲫鱼的三级营养级系统的氮元素总体偏高的状况(见图3).
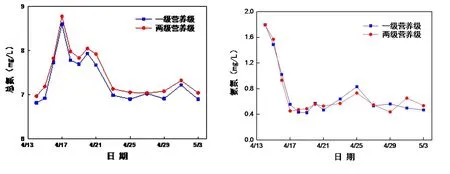
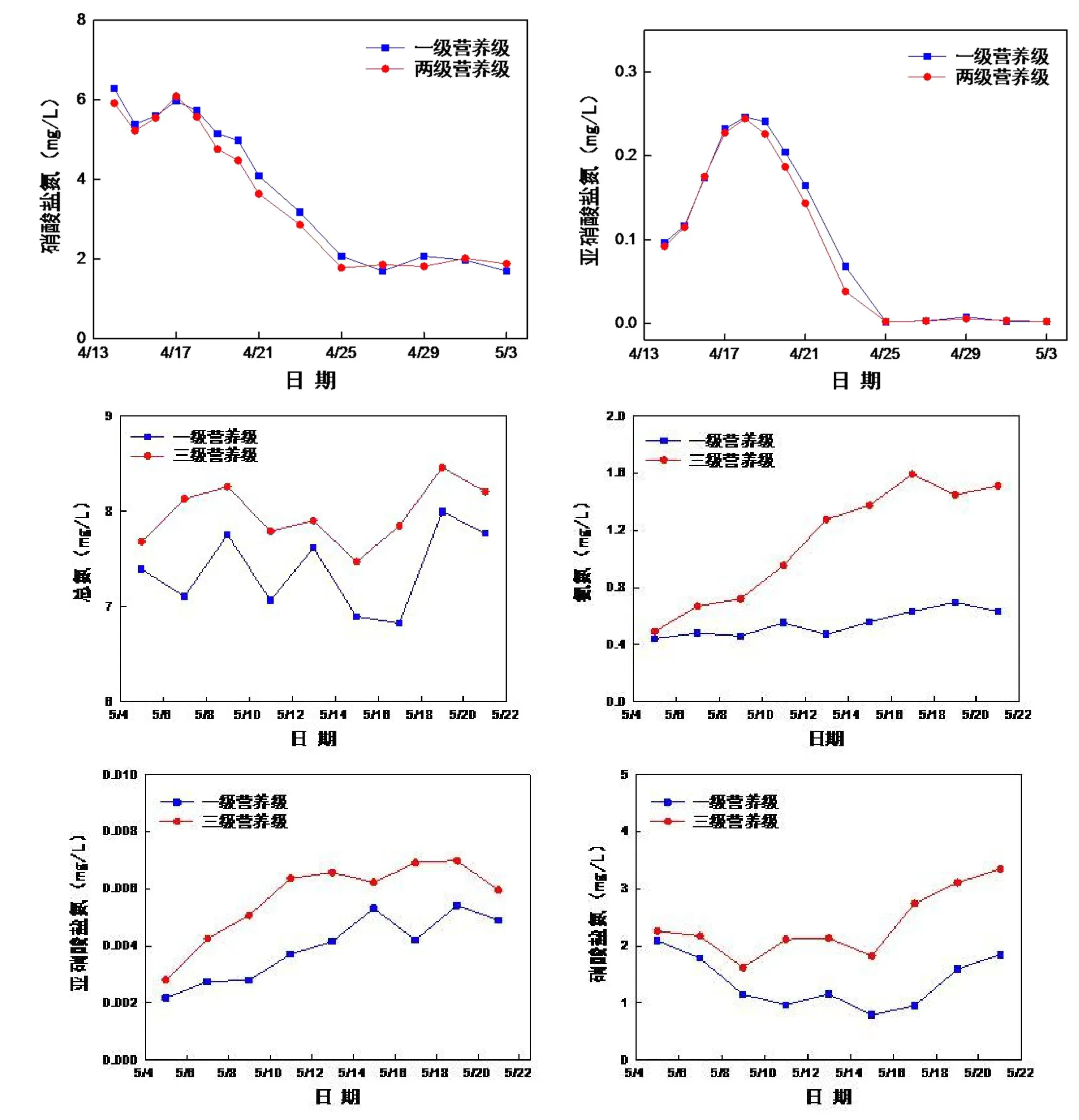
图3 一级、两级和三级营养级氮元素指标对比Fig.3 Nitrogen comparison during one trophiclevel,two trophic levels and three trophic levels
2.1.3 磷元素
由两阶段对于磷元素的测定可看出浮游动物对于水体中磷元素的作用不明显,而有鲫鱼的水体总磷浓度总体要低于只有藻类的水体,说明鲫鱼由于捕食作用吸收并储存了一部分磷在体内,所以水体中的总磷浓度才降低了,但是由于鲫鱼的代谢使有机磷转化成为了无机磷,所以使水体中磷酸盐的含量升高了.所以由此可知水中的鲫鱼可能会使磷酸盐含量升高(见图4).
2.2 配水试验
2.2.1 浊度
浊度的变化趋势与叶绿素a的变化趋势相似,最初浊度的升高是藻类大量生长的结果,浊度的降低也是因为藻类由于营养物质的耗尽而大量死亡导致的.然而三级营养级系统因为有金鱼的存在,使有机营养物质转化为无机营养物质从而提供了藻类生长的营养物质,并且捕食浮游生物从而减轻了藻类被捕食的压力,从而导致浊度要高于另外两个营养级系统(见图5).
2.2.2 温度
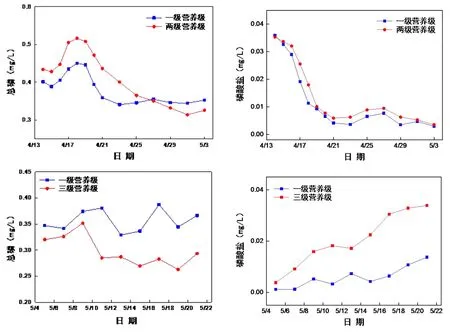
图4 一级、两级和三级营养级磷元素指标对比Fig.4 Phosphorus comparison during one trophic level,two trophic levels and three trophic levels
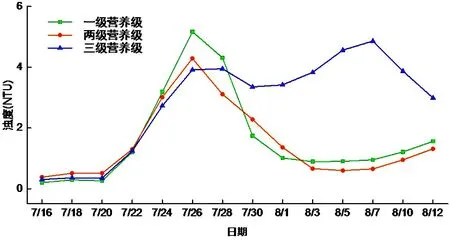
图5 浊度随时间的变化Fig.5 Turbidity changes with time
试验中水体的温度变化范围为28.5~31.5℃,比较适宜藻类的生长繁殖,但是试验后期水温高于30℃,过高的温度会抑制藻类的生长繁殖(见图6).
2.2.3 pH
前期的pH降低是因为前期水体中有机质含量较充足,导致细菌生长繁殖较旺,会产生二氧化碳,因此水体的pH值降低.之后的升高则是因为水中藻类的生长会消耗二氧化碳进行光合作用.之后pH值的降低则是因为水中营养物质的降低导致藻类的死亡,从而光合作用分解二氧化碳降低,并且藻类死亡后会被微生物分解从而产生酸性物质.一级微宇宙系统pH值波动范围8.58~8.99,二级微宇宙系统pH值波动范围8.56~9.00,三级微宇宙系统的波动范围8.63~8.99,三级营养级系统相对另两个营养级系统的波动要小一些,这说明水中的鱼类对水体的pH值有一定的缓冲作用(见图7).
2.2.4 溶解氧
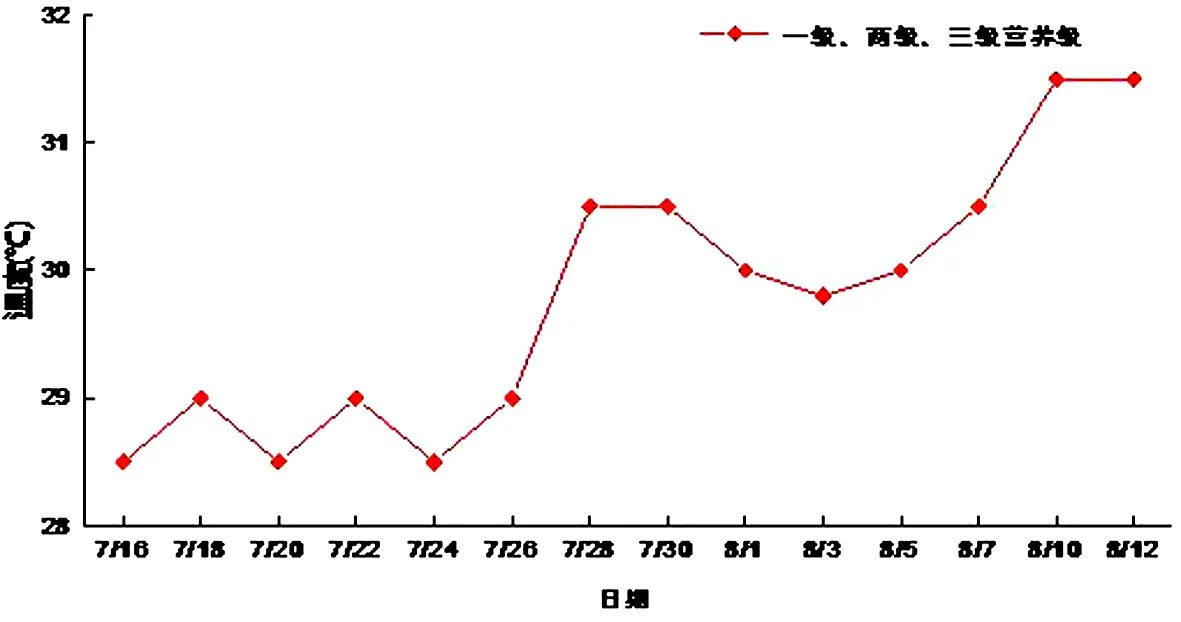
图6 温度随时间的变化Fig.6 temperature changes with time
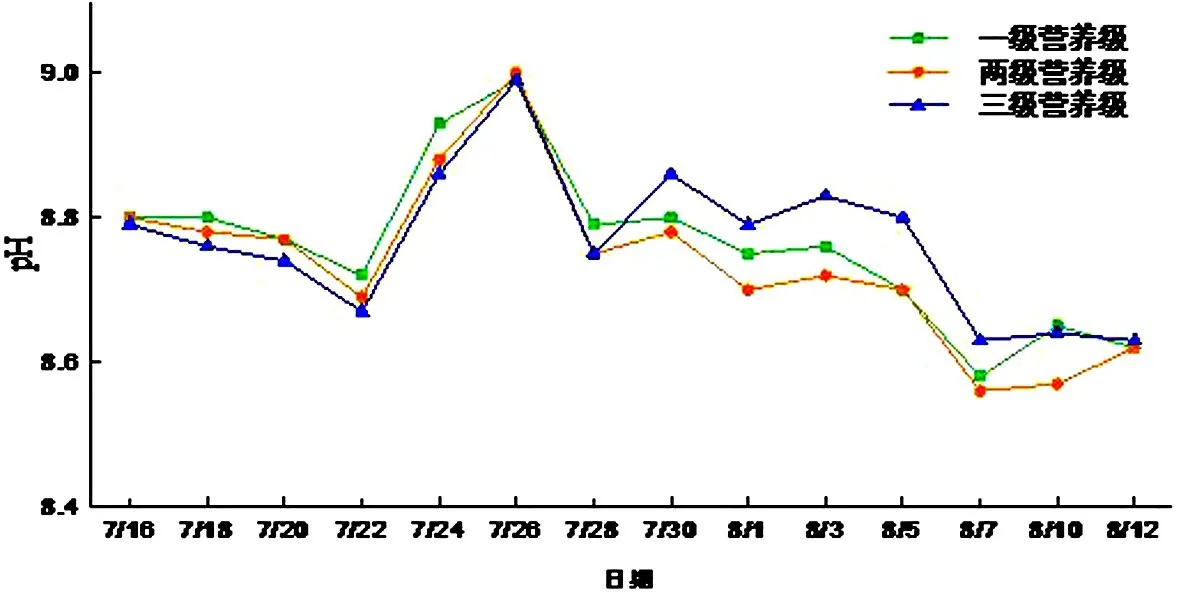
图7 pH随时间变化Fig.7 pH changes with time
初期的溶解氧含量增高是因为向水中曝气增加了水体中溶解氧的含量,而随后的降低则是因为水体中藻类的大量生长繁殖消耗大量的溶解氧所致.溶解氧再次升高则是因为藻类的大量死亡,使水中氧消耗量减小,水中溶解氧浓度回升.三个水族箱溶解氧浓度差别不是很大,但是有金鱼的三级营养级系统比另两个营养级系统的溶解氧浓度低,是因为鱼类也会消耗水中的氧导致(见图8).
2.2.5 叶绿素a
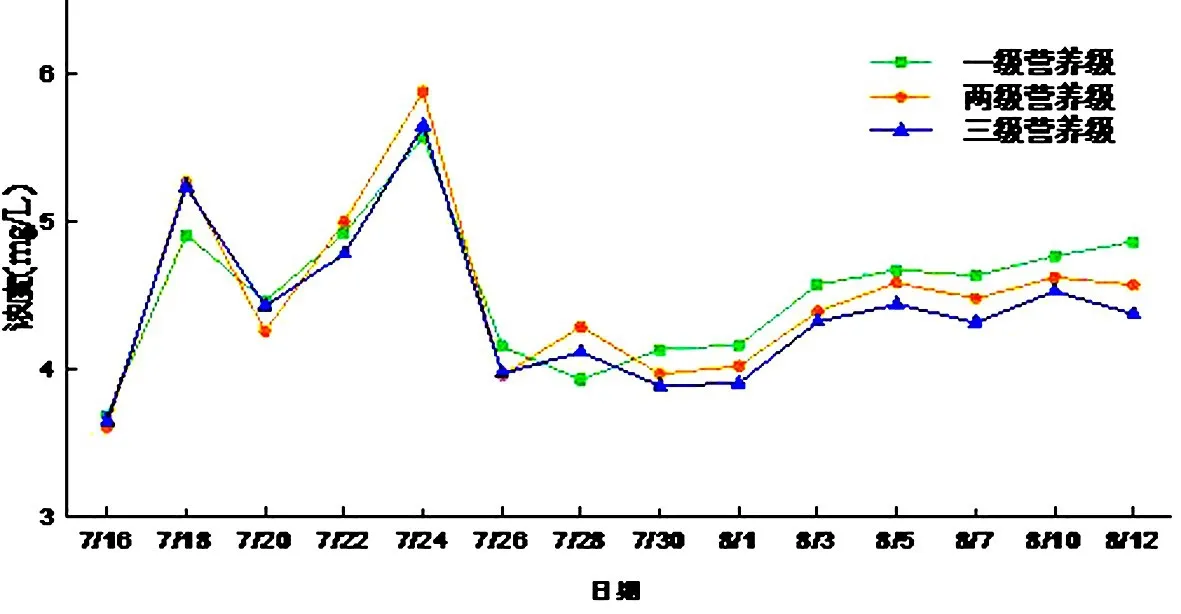
图8 溶解氧随时间的变化Fig.8 DO changes with time
有浮游动物和只有藻类的水体系统的叶绿素a浓度均呈现了先上升后下降的趋势.这因为营养物质充足时浮游植物增长,叶绿素a含量则升高,而随着藻类的大量增长,水体中营养物质不足,藻类开始大量死亡,叶绿素a的浓度则迅速下降.三个微宇宙系统中一级营养级的叶绿素 a浓度峰值最大,达到28.96 mg/L,与该系统内浮游植物没有天敌,生长不受限制有关,从而导致水体严重富营养化.而加入浮游动物的系统的峰值浓度为21.06 mg/L,表明浮游动物对浮游植物的捕食,可对浮游植物的生物量增长产生抑制.加入了金鱼的三级营养级系统峰值浓度为24.84 mg/L,由于金鱼的捕食作用,导致一开始浮游植物的量相对一级、两级营养级系统要少,然而由于金鱼的代谢作用使有机营养物质转化为无机营养物质可以供浮游植物生存,并且由于金鱼是杂食性鱼类,对于浮游动物的捕食减少了浮游植物被捕食的压力,所以有金鱼的水体叶绿素a的峰值要比另两个水体迟(见图9).
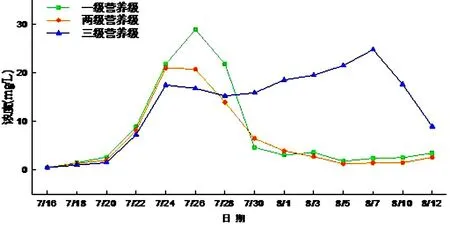
图9 叶绿素a浓度随时间的变化Fig.9 Chl-a content changes with time
2.2.6 氮元素
(1)总氮
三个水族箱的总氮趋势都为先下降后上升再下降,一级营养级总氮浓度波动范围为5.91~10.96 mg/L,二级系统浓度波动范围为6.95~10.60 mg/L,三级系统浓度波动范围为6.76~10.08 mg/L,最初浓度上升是因为浮游植物的固氮作用会将大气中的氮吸收转化为硝态氮释放入水体内,并会随浮游植物量的增加而升高.后随着藻类的死亡而降低,固氮作用降了下来,致使总氮含量的降低.三级营养级系统相对其他两个营养级系统的总氮平稳一些,可能是因为金鱼的代谢作用会加速氮元素的循环.三级微宇宙总氮均值浓度最高,但峰值浓度最低;一级系统谷值浓度最低.由此可见,生态系统结构越复杂,氮波动性更小(见图10).
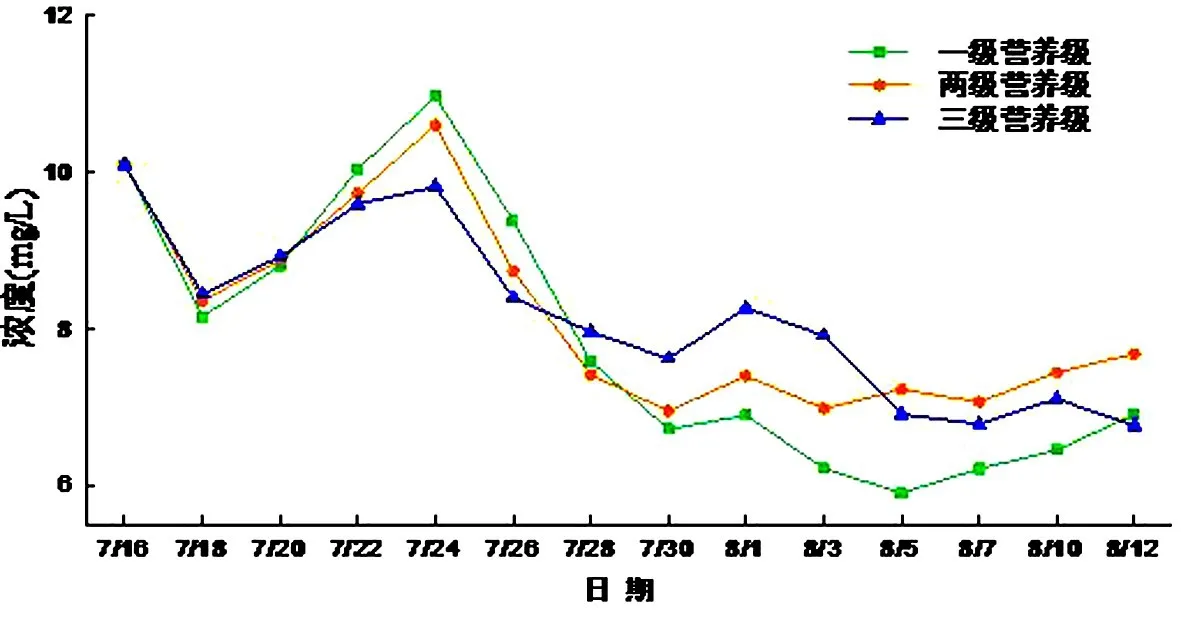
图10 总氮浓度随时间的变化Fig.10 TN changes with time
(2)氨氮
一级微宇宙氨氮浓度变化范围0.21~3.75 mg/L,二级微宇宙浓度变化范围0.28~3.76 mg/L,三级微宇宙浓度变化范围0.14~3.75 mg/L,对于三个水族箱在初期氨氮含量的急剧下降,是因为藻类的活动耗水体中大量的氨氮.后期随着藻类的死亡细菌分解藻类的有机氮,使其转化为氨氮的含量.后期三级营养级系统氨氮的增长幅度小于另两个营养级系统,表明水中加入金鱼对氨氮有消减作用(见图11).
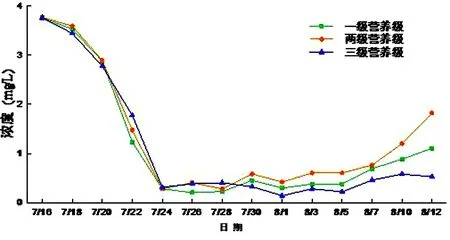
图11 氨氮浓度随时间的变化Fig.11 NH3-N content changes with time
(3)亚硝态氮
一级微宇宙的亚硝酸盐浓度变化范围1.01~2.87 mg/L,二级微宇宙的浓度变化范围1.79~4.24 mg/L,三级微宇宙的浓度变化范围0.62~3.32 mg/L,三个水族箱的亚硝态氮在初期都有一个快速的升高,可能是因为气温高,曝气又为微宇宙环境提供了充足的溶解氧,适宜亚硝化反应.所以适宜的环境会导致水体中亚硝化反应加强,氨氮转化成亚硝态氮.亚硝态氮浓度下降可能是因为亚硝化作用所需的氨氮含量过低,促使反应平衡向硝态氮转换.后期有金鱼的水体的亚硝态氮浓度最低,说明金鱼对于浮游动物的捕食分担了藻类被捕食的压力,藻类会吸收硝态氮作为养料,使得反应平衡向硝态氮移动,导致亚硝态氮的降低(见图12).
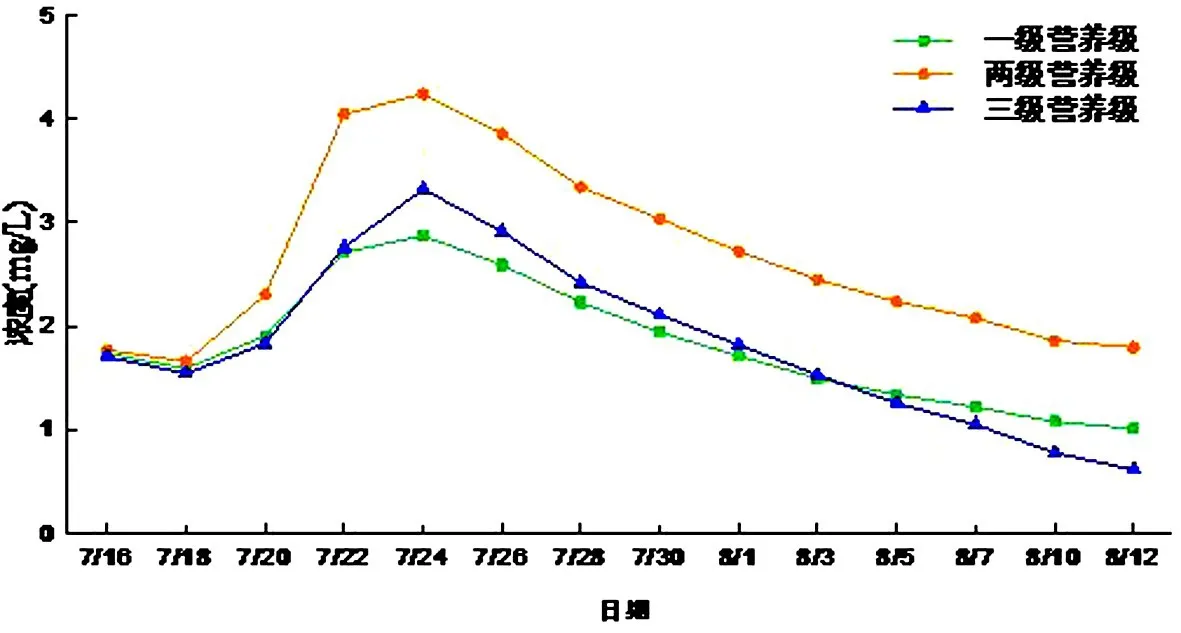
图12 亚硝态氮浓度随时间的变化Fig.12 NO2-N content changes with time
(4)硝态氮
一级微宇宙的硝态氮浓度变化范围5.21~8.02 mg/L,二级微宇宙浓度变化范围6.07~8.13 mg/L,三级微宇宙浓度变化范围4.76~8.05 mg/L,在初期硝态氮小幅的增长是因为水体中不稳定的亚硝态氮在好氧的条件下转化为硝态氮.后出现硝态氮浓度的下降是因为水体中的氨氮浓度过低导致水中的藻类以硝态氮为主要氮源消耗维持正常生理活动,从而导致其浓度降低.后期三级系统的硝态氮浓度低于其他两个营养级浓度,可能是因为三级营养级系统中藻类的量较大,藻类以硝酸盐为养料(见图13).
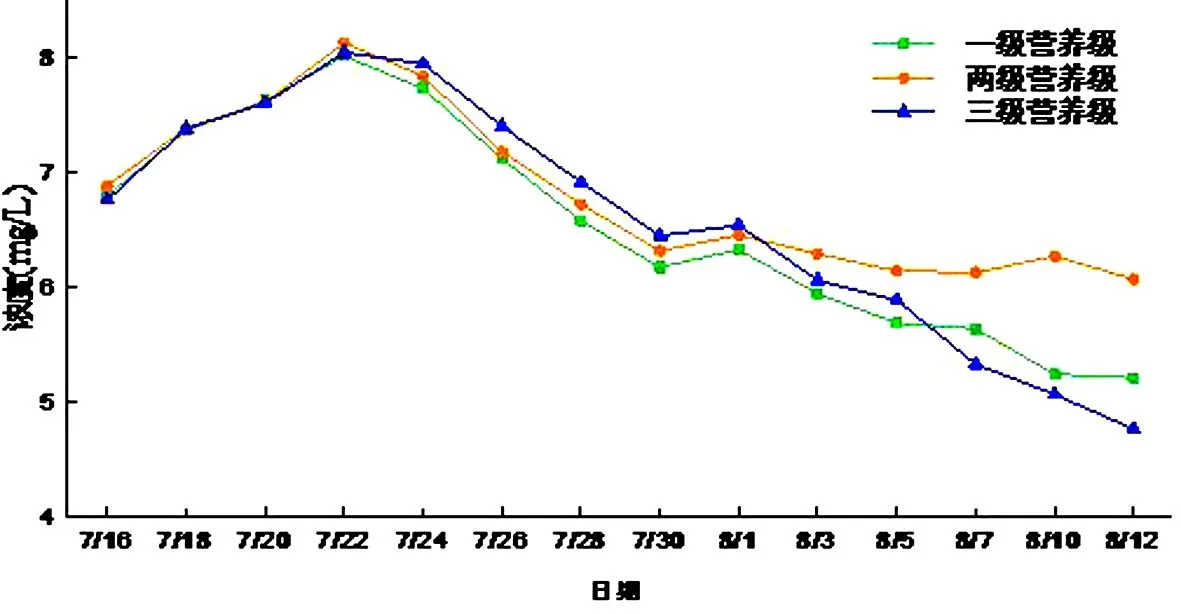
图13 硝态氮浓度随时间的变化Fig.13 NO3-N content changes with time
2.2.7 磷元素
(1)总磷
对于三个营养级系统,总磷的浓度都是在减少的,一级微宇宙的总磷浓度变化范围0.01~0.11 mg/L,两级微宇宙浓度变化范围0.02~0.12 mg/L,三级微宇宙浓度变化范围0.04~0.12 mg/L,由于鱼类的捕食作用及碎屑沉降等原因,导致水体中总磷的浓度降低了.但是由于金鱼的代谢作用会使有机磷转化为磷酸盐排放入水体中,所以导致有金鱼的三级营养级系统的总磷含量总体高于另两个营养级系统(见图14).
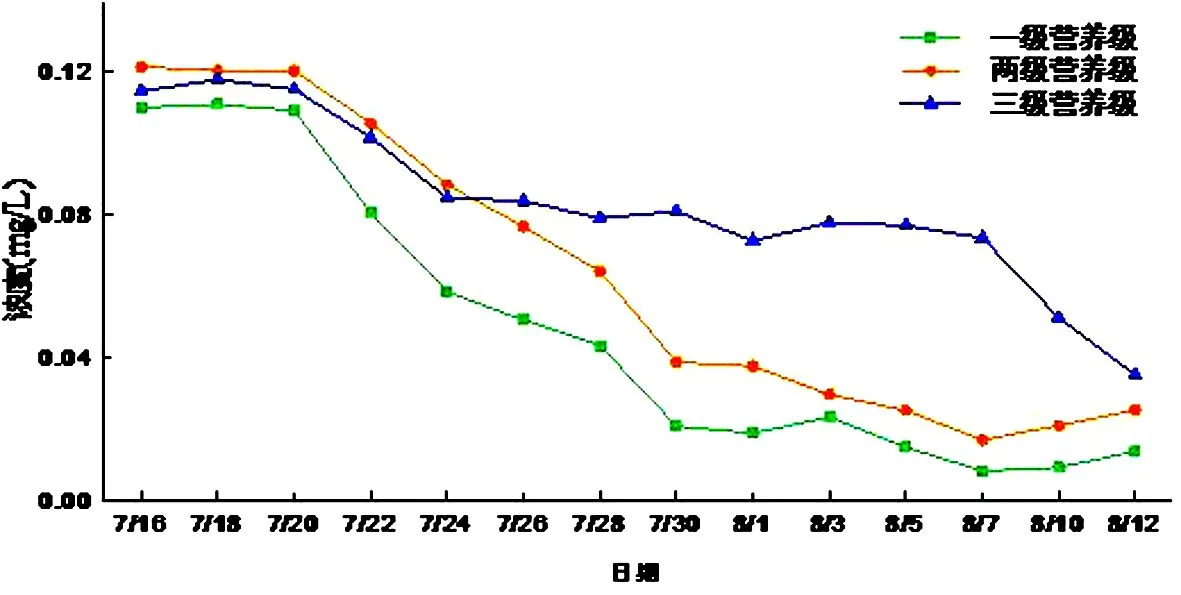
图14 总磷浓度随时间的变化Fig.14 TP changes with time
(2)磷酸盐
磷酸盐的变化趋势与总磷的变化趋势相似,一级微宇宙的磷酸盐浓度变化范围0.003~0.032 mg/L,两级微宇宙浓度变化范围0.005~0.032 mg/L,三级微宇宙浓度变化范围0.013~0.032 mg/L,水体中的藻类生长吸收了磷酸盐,导致磷酸盐浓度的下降.而由于金鱼的代谢作用会加速磷的循环,有机磷转化成磷酸盐排入水体中,所以有金鱼存在的三级营养级系统的磷酸盐浓度要高于另两个营养级系统.说明水中 金鱼对于磷酸盐的影响较大(见图15).
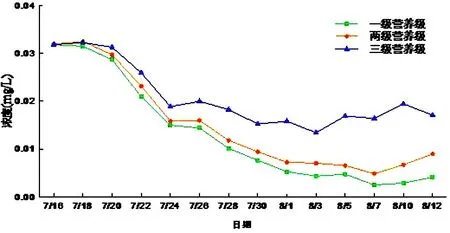
图15 磷酸盐浓度随时间变化Fig.15 phosphate content changes with time
2.3 试验总结
根据两个试验对叶绿素a、氮元素、磷元素等的测定可知:三级营养级微宇宙系统控藻效果不理想,对于水中的营养元素的影响较大,可能会加重水体中氮、磷的升高,这与鲫鱼、金鱼的食性有关,它们都为杂食性鱼类,杂食性鱼类捕食水体中的浮游动物与浮游植物后会由于代谢作用,将有机营养物质转化为无机营养物质排放入水体中.无机营养盐则会作为藻类的生长所需营养来源供藻类的生长繁殖.两级营养级微宇宙系统对叶绿素a、浊度的控制效果较好,对于浮游植物生物量有较强的控制能力.可通过对湖泊投放捕食浮游植物效率较高的枝角类等浮游动物,增强对水中浮游植物捕食作用.
基于试验分析及文献查阅可对水体富营养化控制提出以下建议:(1)向水中投放滤食性的鱼类,通过鱼类的滤食作用约束藻类的生长.(2)合理决定鱼类投加密度,适当密度的鱼类对于藻类的控制起着事半功倍的效果.(3)采用生物浮岛的方法治理水中的富营养化的问题,使水体建立良性循环可持续发展.
3 结论与建议
本文分析国内外的研究现状并结合试验对景观水体富营养化机理做了初步的研究.通过试验中营养盐分析可以得出,对于一级和两级营养级系统,硝态氮是水体中的主要限制性元素,无机氮盐含量对水中浮游植物生物量至关重要,因此以一级营养级和两级营养级为主的景观湖泊中,应加强水中氮元素管理,通过控制氮含量以预防和控制水体富营养化.在三级系统中,氨氮与磷元素间相关性最大,因此以三级营养级为主的景观湖泊中,应重点控制水中氨氮、磷元素浓度,进而有效控制水体富营养化.
试验所采用的两种杂食性的鱼会加重水体中营养盐的浓度,使藻类大量生长繁殖,这是因为杂食性的鱼类的食性,使它们通过代谢作用将有机营养物质转化为无机营养盐释放进水中.水中氮、磷元素的升高会促使水体富营养化的加重.所以若是想利用生物操纵的方法控制水体富营养化问题,建议不可单纯投加杂食性鱼类.
[1]张欢.城市生态小区景观水体富营养化控制措施研究[D].天津:天津科技大学,2013.
[2]刘春光,王雯,庄源益.湖泊富营养化控制理论与技术[J].干旱环境监测,2004,18(01):16-19.
[3]ABBOTT W.Microcosm studies on estuarine waters I.the replicability of microcosms[J].Journal of Water Pollution Control Federation,1966,28(2):258-270.
[4]ABBOTT W.High levels of nitrate and phosphate in carboy microcosm studies[J].Journal of Water Pollution Control Federation,1969,41(10):1748-1751.
[5]TAYLOR M F,CLARK W J,HO L.Nutrient availability and the algal growth potential(agp)in a small microcosm[J].Water Research,1990,24(4):529-532.
[6]HOLZ J C,HOAGLAND K D.Experimental microcosm study of the effects of phosphorus reduction on plankton community structure[J].Canadian Journal of Fisheries and Aquatic Sciences,1996,53(8):1754-1764.
[7]OBERHOLSTER P J,ASHTON P J,BOTHA A M,et al.Phytoplankton yield changes after enrichment in microcosm experiments:applications for predicting progressive eutrophication in a mesotrophic lake,south africa[J].African Journal of Biotechnology,2012,11(90):15678-15689.
[8]FYSON A,NIXDORF B,KALIN M.The acidic lignite pit lakes of germany-microcosm experiments on acidity removal through controlled eutrophication[J].Ecological Engineering,2006,28(3):288-295.
[9]YAMADA T M,SUEITT A P E,BERALDO D A S,et al.Calcium nitrate addition to control the internal load of phosphorus from sediments of a tropical eutrophic reservoir:microcosm experiments[J].Water Research,2012,46(19):6463-6475.
[10]ZHANG X,LIU Z,GULATI R D,et al.The effect of benthic algae on phosphorus exchange between sediment and overlying water in shallow lakes:a microcosm study using 32p as a tracer[J].Hydrobiologia,2013,710(1):109-116.
[11]KILHAM S S,KREEGER D A,GOULDEN C E,et al.Effects of algal food quality on fecundity and population growth rates of daphnia[J].Freshwater Biology,1997,38(3):639-647.
[12]RISTAU K,FAUPEL M,TRAUNSPURGER W.Effects of nutrient enrichment on the trophic structure and species composition of freshwater nematodes- a microcosm study[J].Freshwater Science,2013,32(1):155-168.
[13]STARLING F L R M.Experimental study of the impacts of planktivorous fishes on plankton community and eutrophication of a tropical brazilian reservoir[J].Hydrobiologia,1990,200-201(1):581-591.
[14]EDGAR G J,AOKI M.Resource limitation and fish predation:their importance to mobile epifauna associated with japanesesargassum[J].Oecologia,1993,95(1):122-133.
[15]MCKEE D,ATKINSON D,COLLINGS S E,et al.Response of freshwater microcosm communities to nutrients,fish,and elevated temperature during winter and summer[J].Limnology and Oceanography,2003,48(2):707-722.
[16]MILSTEIN A,VALDENBERG A,HARPAZ S.Fish larvae:zooplankton relationships in microcosm simulations of earthen nursery ponds.ii.brackish water system[J].Aquaculture International,2006,14(5):431-442.

