中华蜜蜂促分裂原活化蛋白激酶ERK-A基因的克隆与低温表达分析
陈文凤 张卫星 王红芳 胥保华
(山东农业大学动物科技学院,泰安 271018)
细胞对环境变化的反应部分是由一系列胞内信号途径来诱导的,信号通路接替、放大并整合来自胞外刺激的信号,最终导致基因和生理的改变。昆虫为适应极端环境,体内会启动一系列代谢和调控反应。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路参与细胞的生长、发育、分化、凋亡等多种生理过程,不仅应答生物胁迫中的病原体感染,也对盐、高温、低温、干旱等非生物胁迫有响应[1,2]。MAPK信号通路主要由ERK(extracellular signalregulated kinases)、JNK(The c-Jun amino-terminal kinases)和p38等并行的几条信号通路组成。JNK主要参与细胞的转录调控,p38主要参与细胞对炎症因子和环境胁迫(UV、温度、缺血缺氧)的响应,而ERK信号通路主要参与调控细胞分裂过程。ERK信号通路在MAPK信号通路中最早被发现且研究得最为深入。ERK包括ERK-1和ERK-2两种激酶,该途径主要介导有丝分裂信号向胞内和核内传递,调控细胞的生长过程[3]。
应激反应是受细胞内信号系统调节的复杂过程,MAPK、G蛋白耦联受体以及TGF-β等信号通路都参与应激反应[4,5]。当动物处于冷应激条件下时,动物机体作为一个整体发生反应,其神经内分泌系统、心血管系统、消化系统以及免疫系统等均发生一系列多系统、多层次的协调效应,以提高机体的适应能力和维持内环境的相对稳定。动物应激及动物对应激原的适应具有分子基础,可以认为是一种基因行为[6,7]。任何机体酶和蛋白质的差异,其根本原因是基因表达的差异。在冷应激过程中主要表现为蛋白合成率的总体下降,但是某些蛋白的合成反而上升或严重下降,说明他们的表达受到了冷应激的特异性调节,并可能在冷应激过程中扮演重要角色[8]。ERK-A信号通路可将胞外刺激与胞内功能联系起来,通过研究ERK信号通路调节机制可以了解冷应激对细胞活动的影响。研究发现,ERK通路通过调节类固醇和山梨醇的合成来终止家蚕幼虫的滞育过程,表明ERK通路参与了昆虫在低温条件下的代谢调节[9,10]。
虽然对蜜蜂抵抗低温的生理生化机制已有很多研究[11],但信号通路在中华蜜蜂低温响应机制中的作用还鲜有报道,本研究通过将中华蜜蜂成虫置于4℃环境下4 h,并在处理过程中取样,取样在3 min内完成,取样后立即将蜜蜂放回原处理条件下。利用实时定量PCR检测ERK-A基因的表达量,探讨ERK-A基因是否在中华蜜蜂适应低温环境中发挥作用。
1 材料与方法
1.1 供试蜂种
中华蜜蜂(简称中蜂,A.cerana cerana),饲养于山东农业大学实验研究基地。
1.2 主要试剂
BL21(DE)和感受态细胞DH5α购自北京全式金生物技术有限公司,克隆载体pEasy-T3购于TransGen公司,原核表达载体Pet-30a(+)由本实验室提供。TaqDNA聚合酶、T4 DNA连接酶、dNTP、DNA Marker、SYBR PrimeScriptTM RT-PCR Kit、各种限制性内切酶购于宝生物工程(大连)有限公司(TaKaRa);琼脂糖凝胶DNA回收试剂盒购于Solarbio公司;质粒提取试剂盒Plasmid Mini Kit购于OMEGA公司;引物合成和测序由上海生工生物工程股份有限公司完成。
1.3 PCR引物(表1)

表1 PCR引物
1.4 中华蜜蜂ERK-A基因的生物信息学分析
利用DNAMAN 6.0软件将ERK-A基因的开放读码框翻译成氨基酸序列,得到蛋白,在NCBI网站(http://www.ncbi.nlm.nih.gov/)上将ERK-A同其它物种进行Blast同源比对。在亚细胞定位预测网站(http://psort.hgc.jp/form.html)上预测该蛋白质在细胞中的位置,利用MEGA 5软件对不同物种ERK-A基因序列进行多重比对,通过NJ(neighbor joining)方法构建系统进化树。
1.5 中华蜜蜂的低温处理
选取正常蜂群中的中华蜜蜂320只,分成4组,每组80只,随机选取三组在4℃冰箱中放置15 min、30 min、1 h、2 h、2.5 h、3 h、4 h,另一组放置于25℃恒温恒湿培养箱中,处理后直接将蜜蜂冻存在液氮中,将25℃饲养的蜜蜂成虫作为对照,不作低温处理直接冻存在液氮中,以单只蜜蜂为一个样品,每个处理共3只蜜蜂(即3次重复)。
1.6 中华蜜蜂总RNA的提取、cDNA的合成以及实时荧光定量PCR
每群选取2只蜜蜂液氮研磨,Trizol法提取总mRNA,然后使用反转录试剂盒(TaKaRa:DRR037A)立即反转录为cDNA,调节样品cDNA浓度于相同水平后,-20℃保存备用。qRT-PCR取1000 ng cDNA加入到20 μl荧光定量体系中,按照荧光定量试剂盒(TaKaRa)操作指南,用7500 Real-Time PCR仪(ABI 7500,USA)检测目的基因相对表达量。反应程序:预变性95℃,10 s;变性95℃,5 s;退火60℃40 s,40个循环,熔解曲线添加,1个循环。目的基因引物设计参考序列来自于NCBI数据库,以action为内参,采用Primer 5.0进行引物设计,委托生工生物科技有限公司合成引物。
2 结果与分析
2.1 中华蜜蜂ERK-A基因cDNA的克隆(图1)
图1 ERK-A基因克隆
2.2 中华蜜蜂ERK-A基因cDNA的序列分析
通过DNAMAN 6.0软件进行分析获得中华蜜蜂ERK-A基因的开放读码框,含有1098 bp的碱基,编码365个氨基酸,编码蛋白质命名为ERK-A,其分子量为42 kDa,等电点为6.03。ERK-A1/2 是细胞对外界信号产生应答的上游枢纽,通过亚细胞定位预测(http://psort.hgc.jp/form.html),ERK-A主要存在于细胞质中,且无信号肽编码序列,无跨膜结构(图2)。ERK-A具有MAPK超家族的序列特征,即存在激酶的保守区和磷酸化位点(下划线标的TEY序列)。

图2 中华蜜蜂ERK-A的核酸与氨基酸序列
2.3 中华蜜蜂ERK-A蛋白的同源性分析

图3 中华蜜蜂与其他物种的同源比对
将ERK-A的氨基酸序列在NCBI网站进行Blast比对,结果表明ERK-A与同为蜜蜂科Apis mellifera(GenBank登录号:XP_393029.2)的相似性最高,一致性99.18%,与Harpegnathos saltator (GenBank登录号:XP_017789097.1)的一致性97.81%。与Eufriesea Mexicana和Melipona quadrifasciata的一致性都在97%以上(图3),说明该基因在进化上高度保守。
2.4 中华蜜蜂ERK-A基因的三维结构预测及磷酸化位点分析
MAPK的激活都是通过TEY基序中苏氨酸(T)和酪氨酸(Y)的同时磷酸化实现的。利用SWISSMODEL(http://www.swissmodel.expasy.org/)预测ERK-A激酶的三级结构(图4),可以看出,N端结构域主要由β折叠组成,C端结构域主要由α螺旋组成,两个结构域之间的裂痕(即无规则卷曲)为ATP结合的激活环,TEY基序就位于激活环内[12]。
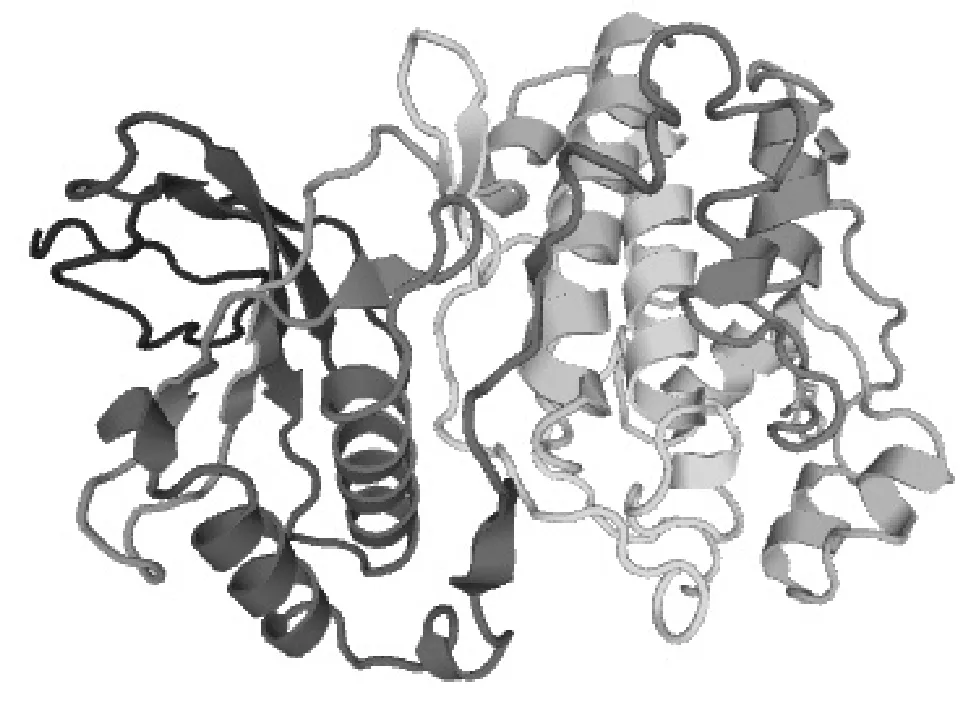
图4 ERK-A的三维结构剖面图
2.5 中华蜜蜂ERK-A激酶与其他物种ERK-A激酶的系统树构建
从NCBI网站下载相近物种的部分ERK-A激酶序列,利用MEGA软件,以酵母Saccharomyces merevisiae的ERK-A作为外群,通过Test Neighbor Joining Tree方法构建以氨基酸序列为基础的系统发生树(图5),结果表明:中华蜜蜂ERK-A和同为蜜蜂科的意大利蜜蜂Apis mellifera的ERK-A聚为一支,与蚁科的收获蚁Pogonomyrmex barbatus和拟步甲科的赤拟谷盗Tribolium castaneum亲缘关系较近。小鼠ERK-A和人ERK-A聚为一支,昆虫ERK-A与哺乳动物ERK-A有更近的起源。

图5 昆虫ERK-A的系统进化树
2.6 低温胁迫下中华蜜蜂ERK-A基因的表达规律
为了研究ERK-A基因的表达是否对低温胁迫做出响应,进行实时荧光定量PCR检测。荧光实时定量PCR结果显示,在低温胁迫下ERK-A的表达均有显著上调。在4℃胁迫30 min后,ERK-A的表达量就达到对照的2倍,2 h时达到最高峰是对照的4倍,此后虽有下降,但仍保持较高水平(图6)。低温表达分析说明,ERK-A基因的表达受到低温的诱导,可能在中华蜜蜂应对低温胁迫时发挥对细胞的调控作用。
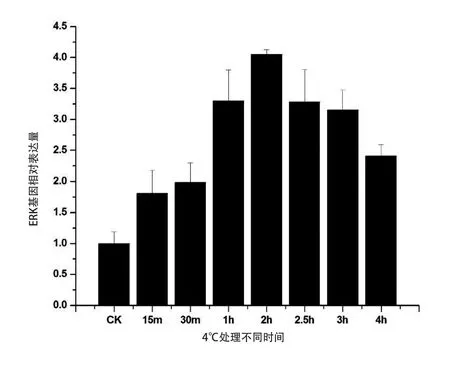
图6 低温条件下ERK-A基因表达的变化
我们从蜜蜂转录组数据库中获得ERK-A基因的cDNA序列的完整开放阅读框长1098 bp,编码365个氨基酸,编码蛋白ERK-A的分子量为42 kDa,等电点为6.03。同源性分析发现,该基因在进化上十分保守,在氨基酸水平上,与相近物种的ERK-A的一致性都达到97%以上,与意大利蜜蜂ERK-A的一致性达99.18%,表明ERK-A在生物体中都具有重要功能。本研究发现ERK-A在4℃呈上调表达,说明ERK-A通路可能参与了中华蜜蜂耐寒机制的调控。
3 结论与讨论
真核细胞已经形成了特殊的信号转导通路来响应细胞外的各种刺激,丝裂原蛋白激酶MAPK组成了一个丝氨酸/苏氨酸蛋白激酶家族,通过磷酸化作用激活受体,调节细胞的增殖、分化和胁迫响应[13]。在比较生物化学领域,MAPK信号通路在代谢调节和生化适应方面的研究还比较少见,最初关于MAPK信号通路在缺氧状态、热应激和冷应激等方面的代谢应答的研究也仅仅触及其表面[14]。
通常认为,ERK通路主要参与细胞存活和生长繁殖,其有效激活信号分子包括生长因子、激素、神经递质、钙离子等[15],而p38和JNK主要参与生长抑制和细胞凋亡,其有效激活因素有温度、缺血缺氧等各种环境刺激[16]。ERK主要被生长因子、多肽类激素以及神经递质激活,控制细胞增殖、分化、生存和凋亡。本研究中,ERK-A基因的表达受低温诱导,可能与ERK、p38和JNK三条通路的相互作用有关[17,18]。
本研究从中华蜜蜂转录组数据中获得ERK-A基因的cDNA,该基因在低温条件下上调表达,说明在中华蜜蜂中ERK通路可能参与了低温下的信号转导。昆虫的一生会经常性受到来自环境的各种各样的刺激,昆虫的诱导表达适应机制提示人们,昆虫对环境的适应是一个能动的过程。昆虫通过启动与抗低温有关的基因并使之表达,给出逆境保护措施,从而协助昆虫度过难关或逆境。因此,研究与冷应激密切相关的基因,探讨如何迅速诱导昆虫冷适应机制的高效运作,提高昆虫在不利环境下的存活率,将是现在乃至将来昆虫学家应倾力研究的课题。此外,不同类型的应激可以诱导不同的应激蛋白,后者即可用来判断昆虫受到何种应激和应激的程度。研究冷应激过程中发生改变的这些蛋白用以衡量应激的程度,作为指导我们工作和生产的一个标准。因此,从分子水平上研究冷应激的分子机制,将具有极大的基础研究和实践应用价值,研究MAPK信号通路对低温胁迫的调控,有助于全面了解昆虫的耐寒机制。
[1] Atay O, Skotheim J M.Spatial and temporal signal processing and decision making by MAPK pathways [J].Journal of Cell Biology,2017, 216(2):317.
[2] Dent P, Yacoub A, Fisher PB, et al.MAPK pathways in radiation responses [J].Oncogene, 2003, 22(37):5885-5896.
[3] Lim W, Park S, Bazer F W, et al.Apigenin reduces survival of choriocarcinoma cells by inducing apoptosis via the PI3K/AKT and ERK1/2 MAPK pathways [J].Journal of Cellular Physiology, 2016,231(12):2690.
[4] Sonna L A, Fujita J, Gaffin SL, et al.Invited review: Effects of heat and cold stress on mammalian gene expression [J].Journal of Applied Physiology, 2002, 92(4):1725.
[5] 杨发青,钱令嘉,王万银,等.寒冷适应差异表达基因的研究[J].生理学报,2003, 55(3):360-363.
[6] Shinozaki K, Yamaguchishinozaki K, Seki M.Regulatory network of gene expression in the drought and cold stress responses [J].Current Opinion in Plant Biology, 2003, 6(5):410-417.
[7] 柳巨雄,栾新红,杨焕民,等.冷休克蛋白表达的分子机制[J].中国兽医学报,2003, 23(6):607-610.
[8] 姜冬梅,李士泽,姜书磊,等.冷应激动物相关基因表达的研究进展[J].环境与健康杂志,2006, 23(5):471-473.
[9] Fujiwara Y, Tanaka Y, Lwata K, et al.ERK/MAPK regulates ecdysteroid and sorbitol metabolism for embryonic diapause termination in the silkworm, Bombyx mori [J].Journal of Insect Physiology, 2006, 52(6):569-575.
[10] Huang, Hao-Jen, Fu, et al.Expression of Oryza sativa MAP kinase gene is developmentally regulated and stress-responsive [J].Physiologia Plantarum, 2002, 114(4):572.
[11] 陈琳,徐新建,王青,等.低温20℃对意大利蜜蜂未受精卵发育的影响[J].应用昆虫学报,2016, 53(3):574-580.
[12] Widmann C, Gibson S, Jarpe MB, et al.Mitogen-activated protein kinase: conservation of a three-kinase module from yeast to human [J].Physiological Reviews, 1999, 79(1):143-180.
[13] Xu J, Zhang S.Mitogen-activated protein kinase cascades in signaling plant growth and development [J].Trends in Plant Science,2015, 20(1):56-64.
[14] Cowan K J, Storey K B.Mitogen-activated protein kinases: new signaling pathways functioning in cellular responses to environmental stress [J].Journal of Experimental Biology, 2003, 206(Pt 7):1107.
[15] Johnson G L, Lapadat R.Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases [J].Science, 2002, 298(5600): 1911-1912.
[16] Ono K, Han J.The p38 signal transduction pathway: activation and function [J].Cellular Signalling, 2000, 12(1):1-13.
[17] Wang J Y, Chen S P, Gao Y H, et al.Effect of repeated electroacupuncture intervention on hippocampal ERK and p38 MAPK signaling in neuropathic pain rats [J].Evidence-Based Complementray and Alternative Medicine, 2015, 2015(12):641286.
[18] Sinha A K, Jaggi M, Raghuram B, et al.Mitogen-activated protein kinase signaling in plants under abiotic stress [J].Plant Signaling & Behavior, 2011, 6(2):196-203.

