肝癌切除术中Glisson蒂横断与第一肝门阻断的应用比较
周松强,游燊 ,邱福南,陈实 ,黄龙 ,王耀东
(福建省立医院 肝胆外科, 福建 福州 350001)
由于肝脏在人体腹腔所处位置的解剖结构较复杂,导致肝脏手术难度较高。而错误的手术方式可致术中出血量较高[1], 并可能导致患者预后恶化,影响其术后康复,严重者还可导致严重并发症,甚至造成死亡[2]。目前,针对如何有效控制肝脏手术出血量,临床中常采取Pringle法调控入肝血流,其可快速阻断血液流入肝脏内[3],并不会对肝脏另一侧供血动脉 造成损伤,可有效、安全及合理应对紧急肝外伤诱发[4],疗效较佳且技术成熟,故应用最多;然而,该方法也可将肝组织的正常需求的入肝血流同时阻断,形成肝脏缺血再灌注损伤,可致术后易发生肝衰,不适用于合并肝硬化者[5],严重者还可导致死亡,安全性相对较低。随着医学研究的发展,有研究[6]发明Glisson蒂横断式肝切除术,其可降低肝切除手术中出血量,且不会造成肝脏再灌注损伤,但其对肝静脉出血量的控制仍需进一步探讨。笔者回顾肝切除术中采用Glisson蒂血流阻断及第一肝门血流阻断手术治疗的127例肝细胞癌患者临床资料,比较两种血流阻断方式的临床效果,报告如下。
1 资料与方法
1.1 一般资料
选取肝胆外科手术治疗的127例肝细胞癌患者临床资料进行回顾性分析,其中采用Glisson蒂血流阻断肝切除术者62例(Glisson组),采用第一肝门血流阻断肝切除术者65例(传统组)。⑴ Glisson组:62例,男43例,女19例;年龄44~77岁,平均年龄(57.0±9.3)岁;术前肝功能Child-Pugh分级,A级34例,B级28例;肿瘤位于肝右叶24例,肝左叶15例,尾状叶4例,方叶6例;涉及2叶及以上13例;肝癌巴塞罗那(BCLC)分期,0期3例,A期59例;谷丙转氨酶(ALT)(5 5.8±3 1.4)U/L,谷草转氨酶(A S T)(28.2±7.0)U/L;肿瘤最大径(4.51±2.68)cm;合并肝硬化47例,慢性乙型肝炎病史42例。⑵ 传统组:65例,男45例,女20例;年龄43~79岁,平均年龄(59.2±11.6)岁;术前肝功能Child-Pugh分级,A级37例,B级28例;肿瘤位于肝右叶25例,肝左叶18例,尾状叶2例,方叶5例;涉及2叶及以上15例;BCLC分期,0期2例,A期63例;ALT(53.2±34.0)U/L,AST(29.6±6.3)U/L,肿瘤最大径(4.72±2.73)cm;合并肝硬化47例,慢性乙型肝炎病史42例。Glisson组与传统组上述基础资料的构成比较,无统计学差异(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准[7]⑴ 肝细胞癌患者的诊断术前主要依据增强CT、MRI,所有患者均经过术后病理学证实;⑵ 术前行心肺功能检查,无手术禁忌证;⑶ 术前患者未接受放化疗、介入性治疗措施等;⑷ 术前确认患者未发生远处脏器的转移;⑸ 术前均与患者签订知情同意书。
1.2.2 排除标准[8]⑴ 合并严重的肝功能障碍的患者;⑵ 严重的心肺功能不全不宜进行手术治疗的患者;⑶ 术后不能接受随访观察的患者;⑷ 各项临床、手术资料不完整的患者。
1.3 手术方法
两组患者平卧位行全麻,麻醉后插管呼吸,于其腹部取倒T或反L形切口,探测腹腔确定肝脏病变后切除,逐渐分离肝脏周边韧带及肌肉软组织 。Glisson组:进腹后探查,明确肝脏病变能被切除后,逐步游离肝周韧带,若肿瘤巨大,应先切除肝脏肿瘤,再游离肝脏周围韧带。操作时需优先选用手术剪分离肝十二指肠韧带和肝脏间腹膜,将右前肝蒂与右后肝蒂间界限充分分离后,再用钝头直角钳由肝门板顶部轻缓从后下方将其顶出掏出,同法分离、顶出右后肝蒂;再将右侧肝蒂掏出,将阻断带一侧蒂头由十二指肠韧带后侧从右绕左绕住;在肝门静脉矢状左侧观察到数支朝向左外叶的Glisson蒂,后将其逐个掏出。使用细导尿管将蒂头悬吊、收紧、阻断直至可观察到相应缺血线,即表示Glisson蒂阻断 成功。控制肝脏门静脉时,轻缓游离其上下腔静脉,逐个找到右静脉于左中静脉共干间凹陷。先对肝右静脉处理,选择钝头钳经已找到的脉凹陷,后选择贴腔静脉表面从右下方轻轻穿过,可先切穿过位置的厚腔静脉韧带,后右翻转肝脏,紧贴肝尾叶前顶端分离凹陷,若分离困难,应先选择血管阻断钳将静脉纵向钳阻。行肝切除前,可先切断肝蒂、肝静脉,待切除肝脏 肿瘤后,离断静脉。传统组:按Pringle法阻断第一肝门,后顺着Cantial线将肝实质分离,肝门阻断15 min若无法彻底切除肝脏,应解除阻断5 min后再阻断,直到彻底切除肿瘤。术后,全部患者常规行保肝、抗炎,并注射白蛋白保护胃黏膜,服用维生素等药,术后3 d空腹抽血化验肝功能。
1.4 观察指标
⑴ 手术指标: 对比两组患者的手术时间、手术出血量、肝血流阻断时间、术中输血量、术后2 d引流量、住院时间的差异。⑵ 术后实验室指标观察:ALT、AST、总胆红素(TBIL)、白蛋白(ALB)、凝血酶原时间(PT)的变化趋势。⑶ 术后并发症:术后术后胆汁漏(腹腔引流或切口渗漏液证实为胆汁、T管胆道造影检查证实)、术后出血、发热、切口感染的发生率差异。
1.5 统计学处理
数据分析及统计在专业软件SAS 9.0软件包中处理,计量指标采用均数±标准差(±s)表示,Glisson组和传统组之间计量资料比较采用t检验,组内比较采用配对t检验;计数资料采用百分率或构成比(%)表示,比较采用χ2检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 两组患者的围手术期指标比较
Glisson组和传统组患者的手术出血量、肝血流阻断时间、术中出血量差异均无统计学意义(P>0.05);Glisson组患者的手术时间、术后2 d引流量、住院时间均显著的低于传统组患者且差异具有统计学意义(P<0.05)(表1)。
2.2 两组患者的手术前后的部分肝功能指标比较
术前、术后第7天 Glisson组与传统组ALT、AST、TBIL、ALB、PT无统计学差异(P>0.05);术后第1、3天两组的ALT、AST、TBIL、PT较本组术前均显著的提高,同时ALB较术前明显的降低(P<0.05);Glisson组患者术后第1、3天的ALT、AST、PT水平显著的低于传统组患者(P<0.05)(表2)。
表1 Glisson组和传统组患者的围手术期指标比较(±s)

表1 Glisson组和传统组患者的围手术期指标比较(±s)
住院时间(d)Glisson 组 62 89.3±28.5 151.3±34.5 31.3±11.4 200.5±98.7 194.6±51.7 12.3±2.4传统组 65 103.7±31.8 161.2±37.8 29.8±12.0 210.6±95.8 250.3±68.9 14.5±2.6 t 2.683 1.539 0.722 0.585 5.134 4.948 P 0.034 0.084 0.552 0.781 <0.001 <0.001组别 n 手术时间(min)手术出血量(mL)肝血流阻断(min)术中输血量(mL)术后2 d引流量(mL)
表2 两组患者的手术前后的部分肝功能指标比较(±s)

表2 两组患者的手术前后的部分肝功能指标比较(±s)
注:1)与术前比较,P<0.05;2)与Glisson组比较, P<0.05
组别 n 术前 术后第1天 术后第3天 术后第7天ALT(U/L)Glisson 组 62 55.8±31.4 276.0±128.31) 144.5±59.61) 49.8±28.9传统组 65 53.2±34.0 377.5±138.01),2) 177.4±31.01),2) 32.5±9.32)AST(U/L)Glisson 组 62 28.2±7.0 204.6±44.91) 96.8±34.31) 34.5±8.9传统组 65 29.6±6.3 238.6±45.51),2) 113.7±31.81),2) 35.7±10.8 TBIL(umol/L)Glisson 组 62 24.3±3.9 27.9±3.51) 26.6±3.21) 26.1±3.0传统组 65 24.7±3.5 28.5±3.81) 27.0±3.41) 26.5±3.3 ALB(g/L)Glisson 组 62 38.5±4.7 33.1±4.21) 31.2±3.91) 32.8±4.41)传统组 65 39.2±5.0 32.6±4.41) 30.9±4.01) 31.8±4.21)PT(s)Glisson 组 62 12.4±2.1 14.5±2.21),2) 14.1±1.91),2) 13.0±1.81)传统组 65 12.2±1.9 16.4±2.41) 15.3±2.01) 12.6±2.0
2.3 两组患者的手术并发症比较
Glisson组手术并发症率12.90%(8/62),传统组手术并发症率18.46%(12/65),组间差异无统计学意义(P>0.05)(表3)。
2.4 两组患者术后生存率比较
Glisson组与传统组患者的1、3年生存率分别为61.29%、29.03%及67.69%、35.38%,组间比较,无统计学差异(P>0.05)。
3 讨 论
目前,由于肝脏肿瘤的发病率逐年攀升,导致肝脏外科手术较为常见,这是因为肝脏组织内包含丰富的带瘤门静脉分支[9],导致原发性肝癌恶性肿瘤主要通过门静脉血液侵润、转移和扩散至整个肝脏,造成肝癌恶化和发展[10]。在肝脏肿瘤手术中,必须对由荷瘤门静脉支供血的肝脏组织进行彻底切除,实现避免术中出现肿瘤细胞经静脉血管扩散的治疗目的,但这需要手术医师能够对荷瘤门静脉进行完全结扎[11],而后分离癌变的肝实质,但其可致患者肝脏受到极大损伤,并诱发高出血量,造成术后肝脏出现严重并发症、肝功能障碍和切口感染,导致患者预后不良[12]。因此,在肝脏切除手术中,研究者一直将如何有效降低术中出血、防止肝脏内肿瘤细胞侵润及转移和最大限度保存无瘤肝组织作为肝脏外科探讨的热点和重点。
传统肝癌切除手术中通常选择间歇阻断第一肝门血管和部分肝组织血管的方式减少术中出血量[13],但该类方式会造成正常肝组织供血不足而诱发形成肝脏缺血再灌注损伤。目前,Glisson蒂横断式肝切除术被逐渐应用于肝癌治疗中,其将肝门部位及其附近区域内实质内动脉、门静脉及胆总管聚集成束[14],再用韧带包将其包裹构成Glisson鞘。手术过程中,先将Glisson鞘进行预处理,使得肝脏门管连成一束,再分别阻断肝门和(或)肝实质内相对的Glisson鞘[15],最终实现对癌变肝叶、和肝段及小部分肝脏组织切除。相比于Pringle肝脏切除法,其无需阻断整体肝脏流入血流[16],并将三支肝蒂进行总体处理,待将肝蒂切断后,使得相应静脉支配的肝组织缺血,可致左半肝、右前叶及右后叶互相间的缺血线清晰显示[17],使得手术医生能够顺着缺血线精准切除癌变肝叶及阻断肿瘤区内肝蒂,实现有效率的局部切除。其优点包括[18-20]:⑴ 无需阻断整个入肝血流,有效避免健康肝组织出现缺血再灌注损伤;⑵ 通过对肝脏局部供血有限度控制,降低术中出血量,显著减缓胃肠道淤血;⑶ 对肝十二指肠韧分离过程中,对静脉损伤程度较轻;⑷ 离断肝组织的手术过程中,其先将合流门静脉内血流进行阻断,可有效阻止肿瘤细胞通过门静脉扩散至整个肝脏,显著抑制癌症复发;⑸ 手术操作简便,手术时间更短,安全性更高。因此该手术已成为肝脏最佳解剖性切除方式。
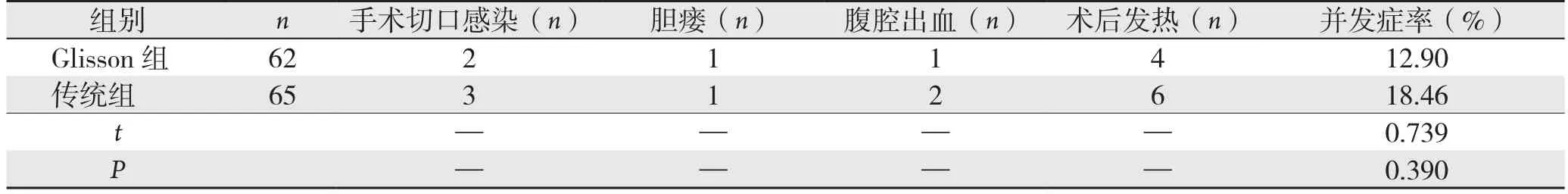
表3 两组患者的手术并发症比较
本资料中,Glisson组与传统组患者的手术出血量、肝血流阻断时间、术中出血量差异均无统计学意义(P>0.05);Glisson组手术时间、术后2 d引流量、住院时间均显著低于传统组(均P<0.05),结果可见肝癌切除术中采用Glisson蒂血流阻断能够获得和传统手术同样优秀阻断效果,患者术中出血量较低,同时,其手术操作更简便,能够显著缩短手术时间,对患者造成损伤程度更轻,使得其恢复速度更快。在各项肝功能指标对比中,两组患者ALT、AST、TBIL、PT较本组术前均显著的提高、同时ALB较术前显著的降低(P<0.05);可见两组阻断方式均可适当肝癌切除手术有效切除癌组织,使得肝功能较手术前有较优改善。而术后第1及3天中,Glisson组患者ALT、AST、PT水平显著低于传统组患者(P<0.05),但7 d后两组患者的ALT、AST、TBIL、ALB、PT差异不具有统计学意义(P>0.05),这是因为Glisson切断方式对正常肝组织供血并没有阻断,有效避免缺血再灌注损伤发生,使得术后初期肝功能受到的侵害更低,但随着时间推移,患者各项肝功能逐渐恢复接近于正常水平,因此,两组患者术后7 d各项指标趋于一致。通过比较Glisson组和传统组手术并发症率,可得两组差异无统计学意义(P>0.05),但前者要略高于后者,这可能与本文选取研究病例较少相关。对比两组患者生存状况发现,Glisson组与传统组患者的1、3年生存率比较,差异无统计学意义(P>0.05),表明两种术式在远期生存率上具有相似疗效。本研究中,笔者发现Glisson蒂横断式肝切除术存在不足,首先其对于手术医生经验和技能要求较高,若操作不当可对胆管及门静脉造成损伤,诱发胆漏或大出血;其也不能降低肝切除过程中所导致肝静脉系统出血量。
综上所述,肝癌切除术中采用Glisson蒂阻断病变侧血流可减轻手术后肝功能损害,促进患者恢复,但手术过程需要医师耐心细致,避免损伤患者胆管及肝组织。
[1] 解云川, 雷正明, 唐光才. 功能 CT 评价肝癌手术风险的研究进展[J]. 放射学实践, 2014, 29(12):1489–1491. doi:10.13609/j.cnki.1000–0313.2014.12.038.Xie YC, Lei ZM, Tang GC. Research advances on functional CT assessment of surgical risk of liver cancer resection[J].Radiologic Practice, 2014, 29(12):1489–1491. doi:10.13609/j.cnki.1000–0313.2014.12.038.
[2] 谭新华, 莫世发, 韦杨年, 等. 美蓝染色标记法联合Glisson蒂横断式肝切除与非规则性肝切除治疗肝癌的临床疗效[J]. 中国癌症防治杂志, 2015, 7(2):104–108. doi:10.3969/j.issn.1674–5671.2015.02.08.Tan XH, Mo SF, Wei YN, et al. Comparison of methylene blue staining notation-Glissonean pedicle transection with irregular liver resection for the treatment of hepatocellular carcinoma[J]. Chinese Journal of Oncology Prevention and Treatment, 2015, 7(2):104–108. doi:10.3969/j.issn.1674–5671.2015.02.08.
[3] 曾尤松. 腹腔镜肝切除治疗原发性肝癌的疗效观察[J]. 现代仪器与医疗, 2015, 21(4):115–116. doi:10.11876/mimt201504046.Zeng YS. Observations on therapeutic effect of laparoscopic liver resection for primary hepatic cancer[J]. Modern Instruments& Mediccal Treatment 2015, 21(4):115–116. doi:10.11876/mimt201504046.
[4] 余钒, 郑树国, 李建伟, 等. Glisson蒂横断式腹腔镜解剖性肝切除术的临床疗效[J]. 中华消化外科杂志, 2015, 14(4):305–309.doi:10.3760/cma.j.issn.1673–9752.2015.04.010.Yu F, Zheng SG, Li JW, et al. Clinical efficacy of laparoscopic anatomical hepatectomy via Glissonean pedicle transection approach[J]. Chinese Journal of Digestive Surgery, 2015,14(4):305–309. doi:10.3760/cma.j.issn.1673–9752.2015.04.010.
[5] 谢飞, 赖良, 牟廷刚, 等. Glisson蒂横断联合前入路绕肝提拉法在肝右叶巨大肝癌切除术中的应用[J]. 肝胆胰外科杂志, 2015,27(4):269–272. doi:10.11952/j.issn.1007–1954.2015.04.002.Xie F, Lai L, Mou TG, et al. The joint application of Glisson pedicle transection and anterior approach of liverhangingmaneuver on hepatectomy for huge hepatic carcinoma on the right lobe[J].Journal of Hepatopancreatobiliary Surgery, 2015, 27(4):269–272.doi:10.11952/j.issn.1007–1954.2015.04.002.
[6] 谭新华, 韦杨年, 莫世发, 等. 美蓝染色标记法联合Glisson蒂横断式肝切除术治疗肝癌的临床应用[J]. 当代医学, 2015, 21(18):55–56. doi:10.3969/j.issn.1009–4393.2015.18.035.Ta XH, Wei YN, Mo SF, et al. Clinical use of methylene blue dye marker combined with transection of Glisson's pedicle procedure for hepatic resection of liver cancer[J].Contemporary Medicine,21(18):55–56. doi:10.3969/j.issn.1009–4393.2015.18.035.
[7] 许鑫森, 陈伟, 张灵强, 等. Glisson蒂横断式肝切除术治疗肝细胞癌[J]. 中华肝脏外科手术学电子杂志, 2014, (4):210–214.doi:10.3877/cma.j.issn.2095–3232.2014.04.004.Xu XS, Chen W, Zhang LQ, et al. Hepatectomy using Glissonean pedicle transection for hepatocellular carcinoma[J].Chinese Journal of Hepatic Surgery, 2014, (4):210–214.doi:10.3877/cma.j.issn.2095–3232.2014.04.004.
[8] 吴飞翔, 黄盛鑫, 向邦德, 等. Glisson蒂横断式腹腔镜肝切除术:附18例报告[J]. 中国普通外科杂志, 2014, 23(7):878–881.doi:10.7659/j.issn.1005–6947.2014.07.003.Wu FX, Huang SX, Xiang BD, et al. Laparoscopic hepatectomy with Glissonean pedicle transection method:a report of 18 cases[J].Chinese Journal of General Surgery, 2014, 23(7):878–881.doi:10.7659/j.issn.1005–6947.2014.07.003.
[9] 宋研, 祁付珍. 完全腹腔镜下 Glisson 蒂横断式左半肝切除的可行性分析[J]. 中国基层医药, 2014, 21(24):3719–3721.doi:10.3760/cma.j.issn.1008–6706.2014.24.016.Song Y, Qi FZ. The feasibility of laparoscopical left hepatectomy with the method of Glisson pedicle transsection[J]. Chinese Journal of Primary Medicine and Pharmacy, 2014, 21(24):3719–3721.doi:10.3760/cma.j.issn.1008–6706.2014.24.016.
[10] Cosma S, Ceccaroni M, Benedetto C. A pseudoneoplastic fi nding of deep endometriosis: laparoscopic triple segmental bowel resection[J]. Wideochir Inne Tech Maloinwazyjne, 2014, 9(3):463–467. doi: 10.5114/wiitm.2014.41617.
[11] 韩福洲, 蒋洪朋, 宋建伟, 等. Glisson蒂横断式原位肝切除在肝细胞癌治疗中的应用[J]. 腹部外科, 2014, 27(6):424–427.doi:10.3969/j.issn.1003–5591.2014.06.009.Han FZ, Jiang HP, Song JW, et al. Retrograde hepatectomy with glissonean pedicle transection in the treatment of hepatocellular carcinoma[J]. Journal of Abdominal Surgery, 2014, 27(6):424–427.doi:10.3969/j.issn.1003–5591.2014.06.009.
[12] 吴宝强, 江勇, 李相成. Glisson蒂横断联合选择性肝静脉阻断技术在肝切除中的应用[J]. 中华外科杂志, 2013, 51(5):467–468.doi:10.3760/cma.j.issn.0529–5815.2013.05.023.Wu BQ, Jiang Y, Li XC. Application of Glisson’s pedicle transection combined with selective hepatic vein occlusion technique during hepatic resection[J]. Chinese Journal of Surgery, 2013,51(5):467–468. doi:10.3760/cma.j.issn.0529–5815.2013.05.023.
[13] Siggers JH, Leungchavaphongse K, Ho CH, et al. Mathematical model of blood and interstitial flow and lymph production in the liver [J]. Biomech Model Mechanobiol, 2014, 13(2):363–378. doi:10.1007/s10237–013–0516-x.
[14] 蔡柳新, 方哲平, 程敏玲, 等. Glisson蒂横断式腹腔镜左肝外叶切除术八例报告[J]. 中华肝胆外科杂志, 2012, 18(6):416–419.doi:10.3760/cma.j.issn.1007–8118.2012.06.006.Cai LX, Fang ZP, Cheng ML, et al. Laparoscopic left lateral sectionectomy using the Glissonian pedicel approach: a study of 8 patients[J]. Chinese Journal of Hepatobiliary Surgery, 2012,18(6):416–419. doi:10.3760/cma.j.issn.1007–8118.2012.06.006.
[15] Nakamura S, Nouso K, Onishi H, et al. Prevention of vagotonia and pain during radiofrequency ablation of liver tumors [J]. Hepatol Res, 2014, 44(13):1367–1370. doi: 10.1111/hepr.12321.
[16] 李秀军, 李文晓, 耿建利, 等. Glisson蒂横断式肝切除术的临床应用体会[J]. 中国现代普通外科进展, 2013, 16(10):803–805.doi:10.3969/j.issn.1009–9905.2013.10.014.Li XJ, Li WX, Geng JL, et al. Experience in clinical use of Glisson’s capsule transection method of hepatectomy [J]. Chinese Journal of Current Advances in General Surgery, 2013, 16(10):803–805. doi:10.3969/j.issn.1009–9905.2013.10.014.
[17] 贾长库, 陈有科, 韩霖, 等. 交替半肝入肝血流阻断解剖性肝中叶切除[J]. 中国普通外科杂志, 2015, 24(1):121–126. doi:10.3978/j.issn.1005–6947.2015.01.023.Jia CK, Chen YK, Han L, et al. Alternating hemi-hepatic vascular inflow occlusion during anatomic middle lobe hepatectomy[J].Chinese Journal of General Surgery, 2015, 24(1):121–126.doi:10.3978/j.issn.1005–6947.2015.01.023.
[18] Li J, Dault D, Nair N, Shanker B. Analysis of scattering from complex dielectric objects using the generalized method of moments[J]. J Opt Soc Am A Opt Image Sci Vis, 2014,31(11):2346–2355. doi: 10.1364/JOSAA.31.002346.
[19] 吴宗杨, 冯济业, 王金波, 等. Glisson蒂横断式肝切除术治疗肝癌的临床研究[J]. 肝胆胰外科杂志, 2014, 26(4):342–344.Wu ZY, Feng JY, Wang JB, et al. Clinical research in Glisson's capsule transection method of hepatectomy for hepatic cancer[J].Journal of Hepatopancreatobiliary Surgery, 2014, 26(4):342–344.
[20] 肖志亚, 陈宏伟, 汪新天, 等. Glisson鞘综合征-胆管梗阻导致门脉高压的机制研究[J]. 中国医师杂志, 2015, 17(5):722–724.doi:10.3760/cma.j.issn.1008–1372.2015.05.023.Xiao ZY, Chen HW, Wang XT, et al. Research on mechanism of portal hypertension due to Glisson's capsule syndrome and biliary obstruction [J]. Journal of Chinese Physician, 2015, 17(5):722–724.doi:10.3760/cma.j.issn.1008–1372.2015.05.023.

