蓝莓花青素对HepG2细胞凋亡及组蛋白乙酰化修饰的影响
詹玮,田甜,余蕾,刘静,廖欣,蔡立君,甄运寰
(贵州医科大学附属医院 1. 普通外科 3. 放射科 4. 神经内科,贵州 贵阳 550004;2. 贵州医科大学 病理生理学教研室,贵州 贵阳 550025)
肝癌在世界上常见恶性肿瘤中排列第5位,且全球发病率不断上升,而我国每年肝癌的发病例数占全世界的55%,并且这一数字还在逐渐增加[1]。研究[2]表明,肿瘤的发生发展、浸润及转移是多个癌基因、抑癌基因及肿瘤生长因子共同造成。不论是否接受药物或手术治疗的肝癌患者,其病死率排列第3位,新近报道[3]全世界每年有大约75万肝癌患者,而其5年生存率仅为0~14%。研究[4]表明,蓝莓是目前水果及蔬菜中花青素含量最高的。花青素是一类天然色素,对人类的健康具有重要意义[5]。本研究自贵州省麻江县蓝莓种植基地采摘的蓝莓提取花青素,并用高效液相色谱法法进行鉴定,用xCELLigence RTCA、免疫荧光、Western blot分析蓝莓花青素对HepG2细胞增殖、凋亡的影响,并从表观遗传学中组蛋白乙酰化探索其在诱导细胞凋亡的可能机制。
1 材料与方法
1.1 实验材料
HepG2细胞为本实验室保存;蓝莓购自贵州省麻江县蓝莓种植基地,品系为杜鹃花科越橘属矮丛蓝莓,品种为巴尔德温,-80 ℃液氮冻存。
1.2 主要试剂
胎牛血清购自G i b c o公司;D M E M培养基购自HyClone公司;DNase I、彩虹Marker购自Solarbio;细胞裂解液、蛋白酶抑制剂、BCA蛋白定量试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、Alexa Fluor488标记山羊抗小鼠IgG(H+L)、DyLight549标记山羊抗兔IgG(H+L)购自上海碧云天生物技术有限公司;H3、H3K9、H3K14、H3K18、H3K27抗体均购自abcam公司。实时无标记细胞分析仪有杭州艾森生物有限公司提供,用于检测(real time cellular analysis,RTCA)。
1.3 实验方法
1.3.1 蓝莓花青素的提取及鉴定 蓝莓自–80 ℃中取出,称重碾磨,用含0.1%盐酸(HCl)的甲醇作为提取溶剂,按蓝莓与提取溶剂1:4的比例,将碾磨后的蓝莓溶于其中2 h。将混合物4 000r/min离心15 min,0.25 µm滤器进行过滤,通过40 ℃旋转蒸发去除残留的盐酸及甲醇。利用大孔树脂AB-8对粗提物进行纯化,纯化后的花青素利用高效液相色谱法(HPLC-MS)鉴定,通过与质谱库中的数据进行比较,分析蓝莓花青素的成分。
1.3.2 细胞培养 用含10%胎牛血清及青、链霉素的DMEM培养基置于5%、37 ℃细胞培养箱内培养,定期换液传代,取对数生长期细胞用于实验。
1.3.3 细胞增殖抑制率的检测 取对数生长期的HepG2细胞,在E-Plate内加入50 µL DMEM,检测基线,确保每个实验孔的Cell Index低于0.063,取出板后,加入调整好不同浓度梯度蓝莓花青素[6](50、100、150、200、300 µg/mL)100 µL 混匀的HepG2细胞悬液加入所需检测板内,使每孔细胞数目在5 000细胞/100 µL,同时设置未用花青素处理细胞的对照组。将E-Plate静置在超净台内30 min后,放入RTCA Station上检测,使用iCELLigenic系统每隔15 min检测细胞的贴壁、生长和增殖过程,监测48 h。传感器检测获得的细胞阻抗参数用细胞指数(cell index)表示,实验重复3次。检测蓝莓花青素对HepG2细胞的半数抑制浓度(IC50)。根据抑制率(%)=(正常组-实验组)/正常组×100%。
1.3.4 Annexin V-FITC/PI双染法检测细胞凋亡取对数生长期的HepG2于3 cm无包被的塑料皿中铺1×105个细胞,置于CO2孵箱中培养,待细胞贴壁80%左右,弃旧培养液,PBS洗3次,加入含胎牛血清10%的全培养液调整好的不同浓度蓝莓花青素培养液(50、100、150、200、300 µg/mL)培养作用于细胞;培养结束后,普通光镜下观察花青素处理后的HepG2细胞形态。按顺序加入Annexin V-FITC 结合液 15 µL/皿,Annexin V-FITC 5 µL/皿,PI 10 µL/皿,室温摇床避光孵育20 min,分别在倒置荧光显微镜下观察细胞形态。
1.3.5 Western blot法 检 测HepG2细 胞 中acH3K9、acH3K14、acH3K18修饰水 平 收集各组细胞,加入蛋白裂解液,冰上裂解10 min,12 000r/min、4 ℃、20 min,弃沉淀,收集上清,使用BCA蛋白定量试剂盒进行蛋白定量,具体操作步骤依照说明书进行。蛋白定量后,取40 µg总蛋白上样,聚丙烯酰胺凝胶电泳,转移蛋白至硝酸纤维素膜,用含5%脱脂奶粉的TBST封闭,分别加入1:5 000稀释的兔抗acH3K9抗体、1:1 000稀释的兔抗acH3K14抗体、1:1 000稀释的兔抗acH3K18抗体,1:1 000稀释的兔抗acH3K18抗体,4℃摇床过夜。第2天,TBST洗膜后加入辣根过氧化物酶标记的二抗(1:4 000)室温孵育90 min,TBST洗膜3次,ECL发光成像,以H3为内参照。条带用Image lab.lnk图像分析软件对每个条带灰度值进行定量分析。
1.4 统计学处理
用SPSS 20.0统计软件进行分析。数据均采用均数±标准差(±s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同蓝莓花青素处理HepG2细胞后的细胞形态
不同浓度蓝莓花青素处理HepG2细胞后,与对照组比较,细胞形态发生显著改变;50 µg/mL蓝莓花青素处理HepG2细胞48 h后,随着蓝莓花青素浓度的不断增加,细胞的体积进一步缩小,漂浮的细胞逐渐增多(图1)。
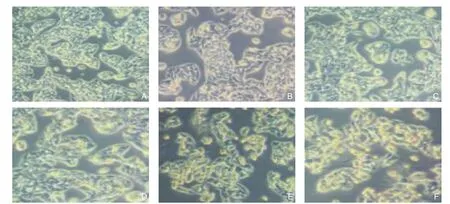
图1 不同蓝莓花青素组处理后的HepG2细胞形态变化(×200) A:对照组;B:花青素50 µg/mL;C:花青素100 µg/mL;D:花青素 150 µg/mL;E:花青素 200 µg/mL; F:花青素 300 µg/mLFigure 1 Morphological changes in HepG2 after treated with different concentrations of blueberry anthocyanin (×200) A: Control group;B: Anthocyanin 50 μg/mL; C: Anthocyanin 100 μg/mL; D: Anthocyanin 150 μg/mL; E: Anthocyanin 200 μg/mL; F: Anthocyanin 300 μg/mL
2.2 蓝莓花青素对HepG2细胞增殖的影响
RTCA结果显示,100、150、200、300 µg/mL的花青素对HepG2细胞均有抑制作用,差异具有统计学意义(均P<0.01),且呈浓度依赖性。除50 µg/mL外,其余浓度组在近48 h后均显示出大于50%的抑制率(图2)。
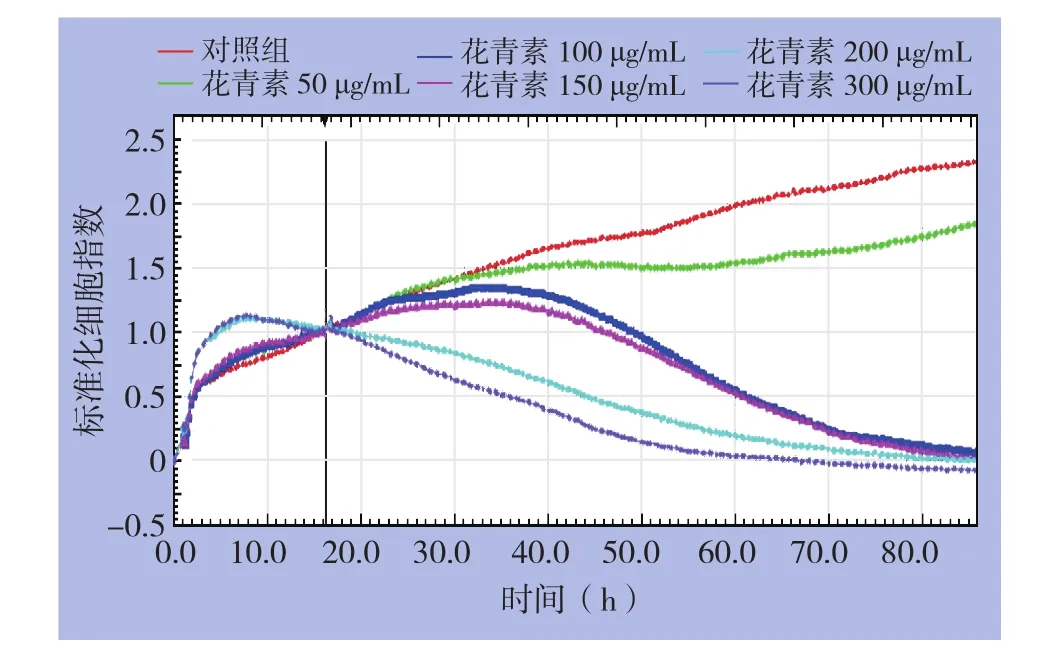
图2 不同浓度蓝莓花青素处理后HepG2增殖的时-效曲线Figure 2 The time-effect curves of HepG2 cells after treatment with different concentrations of blueberry anthocyanin
2.3 荧光显微镜观察花青素对HepG2细胞凋亡的影响
在荧光显微镜下,Annexin V-FITC/PI染色后,观察发现,对照组细胞基本没有荧光信号,蓝莓花青素处理后的HepG2细胞,可见随着浓度的增加,细胞出现凋亡逐渐增多,凋亡细胞早期细胞膜被绿染,随花青素不同浓度处理后的HepG2细胞,凋亡明显增多,细胞核被红染(图3)。
2.4 Western blot法检测蓝莓花青素对HepG2细胞组蛋白乙酰化的影响
Western blot结果显示,与对照组比较,各组蓝莓花青素处理HepG2细胞中acH3K9、acH3K14、acH3K18、acH3K27修饰增加(均P<0.01)(图4)。

图3 不同浓度蓝莓花青素处理HepG2细胞的凋亡情况(×200) A:对照组;B:花青素50 µg/mL;C:花青素100 µg/mL;D:花青素 150 µg/mL;E:花青素 200 µg/mL; F:花青素 300 µg/mLFigure 3 The apoptosis of HepG2 cells after treatment with different concentrations of blueberry anthocyanin (×200) A: Control group; B: Anthocyanin 50 μg/mL; C: Anthocyanin 100 μg/mL; D: Anthocyanin 150 μg/mL; E: Anthocyanin 200 μg/mL;F: Anthocyanin 300 μg/mL
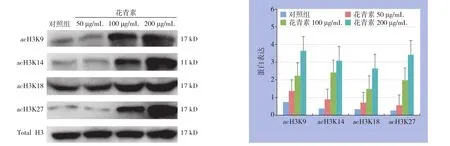
图4 Western blot检测HepG2细胞acH3K9、acH3K14、acH3K18、acH3K27修饰情况Figure 4 Western blot analysis for acetylation of acH3K9, acH3K14, acH3K18, and H3K27 in HepG2 cells
3 讨 论
近年来,将食物中的天然营养成分作为综合防治肿瘤引起了广泛的关注。本研究使用贵州省麻江县蓝莓提取的花青素,有待于阐明其对肝癌细胞在表观遗传学中的组蛋白乙酰化修饰的相应位点抑制肝癌细胞发展进程的潜在关系。
原发性肝癌的主要病因是H B V、H C V及HDV[7]感染、黄曲霉素的接触,过量饮酒,非酒精性脂肪肝及肝硬化[8]。原发性肝癌按组织学分类可分为肝细胞肝癌(hepatocellular carcinoma,HCC),胆管细胞癌(cholangiocarcinoma,CC)和混合型肝癌(mixed carcinoma of liver,MCL),其中以HCC为主要类型[9],具有侵袭性强、进展快、易转移,早期诊断相对困难等特点,但其发病机制尚不明了,过去认为环境因素改变后导致遗传学的改变是肿瘤发生的原因,目前,越来越多的实验证明其发生是一个多步骤、多基因、多阶段与遗传及表观遗传共同参与的复杂过程[10]。有研究[11]表明在体外蓝莓花青素对HBeAg具有一定的抑制作用。
表观遗传是指不通过改变DNA序列就能影响基因表达的、可遗传的遗传修饰,组蛋白修饰包括甲基化、乙酰化、磷酸化、泛素化等[12-13]。然而这些修饰的程度与状态决定着基因是否表达[12]。组蛋白乙酰化修饰是通过组蛋白乙酰基转移酶(histon acetyltransferases,HATs)和组蛋白去乙酰化酶(histone deacetylases,HDACs)联合调控,取决于HAT和HDAC的动态平衡[14]。有研究[15-17]表明高乙酰化可中和组蛋白赖氨酸残基的正电荷,减少组蛋白与DNA的接触,利于转录因子与DNA结合进行转录,而低乙酰化引起相反的效应。组蛋白乙酰化修饰多在H3赖氨酸残基上的9、14、18、23位点和H4精氨酸残基上的5、8、12、16位点,而这些位点可激活基因也可沉默基因[18-19]。组蛋白有多种修饰方式,其中H3K9乙酰化是修饰基因转录调控的重要机制[20]。
蓝莓因富含花青素具有延缓衰老、调节免疫功能及抗癌等多种功效[21]。国内外均有文献[22-23]报道蓝莓可抑制体外HSCs的活化。因此,本研究蓝莓中花青素对肝癌HepG2细胞的细胞凋亡及组蛋白乙酰化修饰某些位点的影响,而目前蓝莓花青素诱导肝癌细胞凋亡的机制尚不明确,是否通过组蛋白乙酰化相关位点进行调控,亟待进一步的研究。
本研究结果显示,与正常对照组相比,蓝莓花青素对肝癌HepG2细胞的细胞学形态及细胞凋亡有着浓度依赖性,随着蓝莓花青素浓度的增加,凋亡逐渐增多,这与Yi等[24-25]发现蓝莓内所含的花青素能抑制Caco-2及HT-29大肠癌细胞株的增生并使其凋亡的研究一致。使用RTCA检测细胞增殖结果显示,100、150、200、300 µg/mL的花青素对HepG2细胞均有抑制作用,差异具有统计学意义,且呈剂量依赖性,其中以加入浓度为100 µg/mL培养48 h后已显示出>50%的抑制率。通过Western blot检测,对照组与100 µg/mL组的HepG2细胞相比,组蛋白乙酰化修饰的相应位点,H3K9、H3K14、H3K18、H3K27的修饰水平是增高了,综合以上实验结果,发现蓝莓中的花青素可以使得肝癌细胞形态学发生改变,促进其死亡,通过凋亡也发现了蓝莓花青素可使肝癌细胞的凋亡增加,使用免疫印迹分析法也发现了在肝癌细胞中的组蛋白乙酰化修饰水平得到了相应的提升。
由于细胞的凋亡是一个复杂的过程,本实验初步探讨了贵州省麻江县蓝莓中花青素对HepG2胞凋亡的作用及少部分组蛋白乙酰化修饰位点的变化情况,具体是否通过该途径引起细胞凋亡,目前尚不清楚,需进一步的深入研究。
[1] 丁研, 吴德华, 刘莉, 等. 肝癌中结缔组织生长因子的研究进展[J].广东医学, 2014, 35(8):1265-1268.Ding Y, Wu DH, Liu L, et al. Research progress of connective tissue growth factor in liver cancer[J]. Guangdong Medical Journal, 2014,35(8):1265-1268.
[2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010,127(12):2893-2917. doi: 10.1002/ijc.25516.
[3] Siegel R, Naishadham D, Jemal A. Cancer statistics,2012[J]. CA Cancer J Clin, 2012,62(1):10-29. doi: 10.3322/caac.20138.
[4] Huang WY, Zhang HC, Liu WX, et al. Survey of antioxidant capacity and phenolic composition of blueberry, blackberry, and strawberry in Nanjing [J]. J Zhejiang Univ Sci B, 2012, 13(2):94-102. doi: 10.1631/jzus.B1100137.
[5] Yoshimura Y, Enomoto H, Moriyama T, et al. Visualization of anthocyanin species in rabbiteye blueberry Vaccinium ashei by matrix-assisted laser desorption/ionization imaging mass spectrometry[J]. Anal Bioanal Chem, 2012, 403(7):1885-1895. doi:10.1007/s00216-012-5876-z.
[6] Zhan W, Liao X, Tian T, et al. Study on the effects of blueberry treatment on histone acetylation modification of CCl4-induced liver disease in rats[J]. Genet Mol Res, 2017, 16(1). doi: 10.4238/gmr16019188.
[7] Abbas Z, Abbas M, Abbas S, et al. Hepatitis D and hepatocellular carcinoma[J]. World J Hepatol, 2015, 7(5):777-786. doi: 10.4254/wjh.v7.i5.777.
[8] Maluccio M, Covery A. Recent progress in understanding,diagnosing, and treating hepatocellular carcinoma[J]. CA Cancer J Clin, 2012, 62(6):394-399. doi: 10.3322/caac.21161.
[9] Huynh H. Molecularly targeted therapy in hepatocellular cancinoma[J]. Biochem Pharmacol, 2010, 80(5):550-560. doi:10.1016/j.bcp.2010.03.034.
[10] Center MM, Jemal A. International trends in liver cancer incidence rates[J]. Cancer Epidemiol Biomarkers Prev, 2011, 20(11):2362-2368. doi: 10.1158/1055-9965.EPI-11-0643.
[11] 杨奎真. 蓝莓花青素体外抑制乙型肝炎病毒的初步研究[J].胃肠病学和肝病学杂志, 2013, 22(4):380-381. doi:10.3969/j.issn.1006-5709.2013.04.024.Yang KZ. The inhibition of Blueberry anthocyanidin on HBV in vitro[J]. Chinese Journal of Gastroenterology and Hepatology,2013, 22(4):380-381. doi:10.3969/j.issn.1006-5709.2013.04.024.
[12] Jenuwein T, Allis CD. Translating the histone code[J]. Science,2001, 293(5532):1074-1080.
[13] Linggi BE, Brandt SJ, Sun ZW, et al. Translating the histone code into leukemia[J]. J Cell Biochem, 2005, 96(5):938-950.
[14] Kouzarides T. Chromatin modi fi cations and their function[J]. Cell,2007, 128(4):693-705.
[15] Fan DN, Tsang FH, Tam AH, et al. Histone lysine methyltransferase,suppressor of variegation 3-9 homolog 1, promotes hepatocellular carcinoma progression and is negatively regulated by microRNA-125b[J]. Hepatology, 2013, 57(2):637-647. doi: 10.1002/hep.26083.
[16] de Ruijter AJ, van Gennip AH, Caron HN, et al. Histone deacetylases (HDACs): characterization of the classical HDAC family[J]. Biochem J, 2003, 370(Pt 3):737-749.
[17] Smith EM, Boyd K, Davies FE. The potential role of epigenetic therapy in multiple myeloma[J]. Br J Haematol, 2010, 148(5):702-713. doi: 10.1111/j.1365-2141.2009.07976.x.
[18] Magerl C, Ellinger J, Braunschweig T, et al. H3K4 dimethylation in hepatocellular carcinoma is rare compared with other hepatobiliary and gastrointestinal carcinomas and correlates with expression of the methylase Ash2 and the demethylase LSD1[J]. Hum Pathol,2010, 41(2):181-189. doi: 10.1016/j.humpath.2009.08.007.
[19] Gong F, Miller KM. Mammalian DNA repair: HATs and HDACs make their mark through histone acetylation[J]. Mutat Res, 2013,750(1/2):23-30. doi: 10.1016/j.mrfmmm.2013.07.002.
[20] Miao F, Wu X, Zhang L, et al. Genome-wide analysis of histone lysine methylation variations caused by diabetic conditions in human monocytes [J]. J Biol Chem, 2007, 282(18):13854-13863.
[21] Papandreou MA, Dimakopoulou A, Linardaki ZI, et al. Effect of a polyphenol-rich wild blueberry extract on cognitive performance of mice, brain antioxidant markers and acetylcholinesterase activity[J]. Behav Brain RES, 2009, 198(2):352-358. doi: 10.1016/j.bbr.2008.11.013.
[22] Wang Y, Cheng M, Zhang B, et al. Dietary supplementation of blueberry juice enhances hepatic expression of metallothionein and attenuates liver fi brosis in rats [J]. PLoS One, 2013, 8(3):e58659.doi: 10.1371/journal.pone.0058659.
[23] Takami Y, Uto H, Takeshita M, et al. Proanthocyanidin derived from the leaves of Vaccinium virgatum suppresses platelet-derived growth factor-induced proliferation of the human hepatic stellate cell line LI90 [J]. Hepatol Res, 2010, 40(4):337-345. doi: 10.1111/j.1872-034X.2009.00589.x.
[24] Yi W, Fischer J, Krewer G, et al. Phenolic compounds from blueberries can inhibit colon cancer cell proliferation and induce apoptosis[J]. J Agric Food Chem, 2005, 53(18):7320-7329.
[25] Kang SY, Seeram NP, Nair MG, et al. Tart cherry anthocyanins inhibit tumor development in Apc(Min) mice and reduce proliferation of human colon cancer cells[J]. Cancer Lett, 2003,194(1):13-19.

