基于人工胃酸水解的黄芪糖指纹图谱的建立及不同种质资源黄芪鉴别△
李晓霞,王迪,王桂臻,刘磊,李震宇,秦雪梅,李科*
(1.山西省果业工作总站,山西 太原 030001;2.山西大学中医药现代研究中心,山西 太原 030006;3.山西大学化学化工学院,山西 太原 030006)
黄芪,作为我国传统的珍贵补益药材之一,使用历史已有2000多年,素有 “十方八芪”之说。中华人民共和国药典(2010版)规定,黄芪为豆科草本植物黄芪属蒙古黄芪Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪 A.membranaceus(Fisch.)Bge.的干燥根[1]。本品具有补气固表、利尿排毒、敛疮生肌等功效[2],用于气虚乏力,食少便溏[3],是一种常见的补益中药。黄芪的主要化学成分包括黄酮类、皂苷类、黄芪多糖、氨基酸等多种成分[4]。其中,黄芪多糖具有增强机体抵抗力、促进抗体生成、促进免疫、双向调节血糖和保护心血管系统等作用[5-8],是黄芪发挥免疫调节活性的主要物质。然而复方中药中黄芪多糖主要经口服进入胃内,在胃酸与胃酶作用下降解为寡糖片段后被吸收利用。这些寡糖化合物分子量分布如何,不同种质资源蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)多糖经胃酸处理后是否存在差异,这些寡糖如何发挥活性作用目前尚不清楚。
近年来关于体外模拟人工胃液实验研究较多,如金晖[9]等通过南瓜多糖在体外模拟人工胃液条件下的水解实验获知,随胃酸与胃酶作用时间的延长,还原糖的量不断缓慢增加,HPLC结果显示作用30 min时出现小分子糖,作用90 min时大分子量多糖出现明显变化,提示南瓜多糖在体外模拟人工胃液环境中随时间作用会发生一定程度的降解,产生还原糖和寡糖片段。陈萍[10]等通过抗氧化活性较好的茶多糖TPF70在体外模拟人工胃液条件下的水解试验获知,茶多糖在体外模拟人工胃液环境中随时间作用会发生一定程度的降解,产生还原糖和寡糖片段。
因此,本研究模拟人工胃酸条件处理不同种质资源蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)细胞可溶性多糖及糖缀合物,获得指纹图谱,分析其降解片段的分子量分布,并用主成分分析找出不同种质资源黄芪差异的糖组分。研究结果不仅为黄芪种质资源鉴别提供了方法,而且为降解产生的黄芪活性寡糖筛选奠定了基础。
1 材料与方法
1.1 植物材料
本实验所需植物材料包括蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)两个种,共24批。购买自河北安国药材市场。将药材保存于阴凉、干燥通风处。药材详细信息如表1所示。将这24批不同种质资源的黄芪药材分别粉碎得到细粉,备用。

表1 黄芪样本信息
1.2 仪器与试剂
DYY-10C型电泳仪电源,DY-C7型电泳仪(北京市六一仪器厂);真空冷冻干燥仪(ZD-A1L);真空旋转蒸发仪RE-52A;高速冷冻离心机(宁波新芝科技有限公司TGL-16型)。
葡萄糖、麦芽糖、棉子糖、麦芽四聚糖、麦芽五聚糖和麦芽六聚糖标准品;亚铁氰化钾、乙酸锌、8-氨基萘-1,3,6-三磺酸(ANTS)、NaCNBH3、丙烯酰胺(Acrylamide)、N,N-亚甲基二丙烯酰胺(Bisacrylamide)、尿素(Urea)、三羟甲基氨基甲烷(Tris)、硼酸(H3BO3)、过硫酸铵(AP)、乙醇等均为分析纯;人工胃酸。
1.3 方法
1.3.1 黄芪多糖的提取和纯化
(1)提取粗多糖将干燥的蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)粉碎成粉末,过100目筛,取黄芪细粉约5 g,精密称定后置于1000 mL圆底烧瓶中,加水500 mL(1∶100),100℃回流提取1 h,降至室温后离心取上清液。残渣再加水400mL(料液比1∶80),重复提取1次,取上清,合并上清。浓缩,用95%的乙醇调节至含醇量为80%。3000 r·min-1离心10min。合并沉淀,冷冻干燥的多糖粗粉。
(2)纯化多糖 将上一步骤得到的多糖粗粉溶于水中,加入各10%体积的10.6%的亚铁氰化钾溶液和21.9%的乙酸锌溶液,振摇后静置30 min,离心得到纯化多糖,冻干,备用。
1.3.2 人工胃液的配制 参照2010年版 《中国药典》规定,取稀盐酸16.4 mL,加约800 mL水及胃蛋白酶10 g,摇匀后加水稀释成1000 mL,即得。
1.3.3 黄芪多糖的酸解和衍生化 蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)多糖约5 mg,置于10 mL具塞玻璃管中,分别用人工胃酸2 mL对四种多糖进行酸解,然后根据最优降解条件,40℃摇床孵育1 h,置于80℃水浴上灭活20 min,离心(3000 r·min-1,5 min),去上清,氮气吹干。将酸解产物溶于200μL的NaCNBH3溶液中,加入200μL的ANTS衍生化试剂,37℃摇床孵育15 h后,将产物用氮气吹干,溶于1 mL的6 mol·L-1的尿素溶液,备用。
1.3.4 黄芪多糖和糖标准品酸解产物电泳分析 采用垂直板凝胶电泳分离糖标准品及黄芪多糖部分酸解衍生化产物,分离胶和浓缩胶分别为0.1 moL·L-1Tris-H3BO3(pH=8.2)溶液配制的30 g·(100 mL)-1和8 g·(100 mL)-1的聚丙烯酰胺凝胶。电泳缓冲液为0.1~0.2 moL·L-1Tris-H3BO3(pH=8.2)。上样量为1~3μL,以溴酚蓝为前沿指示剂,首先采用80 V电压进行电泳分离60 min,随后采用200V电压进行电泳分离120 min。
1.3.5 数据处理 将电泳图导入Quantity One软件,经过扣除背景、手动校正、基线校准等处理后,得到色谱图。色谱图转化为Excel数据后导入SMICA-P 13.0进行分析,然后运用代谢组学分析技术寻找差异代谢物。
2 结果
2.1 蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)多糖酸解产物的电泳指纹图谱

图1 黄芪多糖人工胃酸酸解产物的PACE指纹图谱分析图
2.2 黄芪多糖降解后黄芪寡糖的分子量分布分析
由黄芪多糖部分酸解衍生化产物电泳的Rf值,根据PACE电泳后六种糖标准品的Rf-分子量标准曲线(图2),推出黄芪多糖降解后黄芪寡糖相应的分子量。分子量与Rf值分布如下图2。

图2 葡萄糖、麦芽糖、棉子糖、麦芽四聚糖、麦芽五聚糖和麦芽六聚糖标准品电泳后Rf-分子量标准曲线
2.3 蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)四组多糖酸解产物的电泳指纹图谱多元统计分析
图3中A为蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)多糖酸解产物电泳指纹图谱PCA得分散点图,可见,蒙古芪与膜荚芪可得到较好分离,蒙古移栽芪和野生芪分离明显,膜荚移栽芪和野生芪分离不明显。进行有监督的PLS-DA分析(见图3-B)发现与PCA图基本一致,模型参数为R2=0.425,Q2=-0.639。用外部模型验证方法排列实验来证明模型成立(见图3-C),载荷图分析(见图3-D)可以继续后面部分差异成分的筛选。

图3 蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)多糖人工胃酸酸解产物电泳指纹图谱的多元统计分析
从A图分析,蒙古黄芪和膜荚黄芪种属之间的差异要大于移栽和野生生长方式间差异,野生蒙古黄芪与野生膜荚黄芪分离现象明显,移栽蒙古黄芪与移栽膜荚黄芪分离现象明显,可以对同一生长方式不同种属黄芪进行差异性片段寻找;膜荚黄芪中移栽芪和野生芪分离现象不明显,寻找差异性片段意义不大;蒙古黄芪中移栽芪和野生芪能得到很好的分离,对区分蒙古黄芪移栽和野生的差异性片段进行筛选。
2.4 筛选野生蒙古黄芪与野生膜荚黄芪多糖人工胃酸酸解产物差异性生物标志物
图4中A为野生蒙古黄芪与野生膜荚黄芪多糖酸解产物电泳指纹图谱OPLS-DA散点图,可见,野生蒙古黄芪与野生膜荚黄芪可得到较好分离。用外部模型验证方法排列实验来证明模型成立(见图4-B),载荷图分析(见图4-C)可以进行差异成分的筛选。
由图分析可知,三糖和四糖可以作为区分野生蒙古黄芪与野生膜荚黄芪的主要差异性片段。对该片段分析发现,野生膜荚黄芪中三糖和四糖的含量均高于野生蒙古黄芪的含量。
2.5 筛选移栽蒙古黄芪与移栽膜荚黄芪多糖人工胃酸酸解产物差异性生物标志物
图6中A为移栽蒙古黄芪与移栽膜荚黄芪多糖酸解产物电泳指纹图谱OPLS-DA散点图,可见,野生蒙古黄芪与野生膜荚黄芪可得到较好分离。用外部模型验证方法排列实验来证明模型成立(见图6-B),载荷图分析(见图6-C)可以进行差异成分的筛选。

图4 野生蒙古黄芪与野生膜荚黄芪多糖人工胃酸酸解产物电泳指纹图谱的多元统计分析
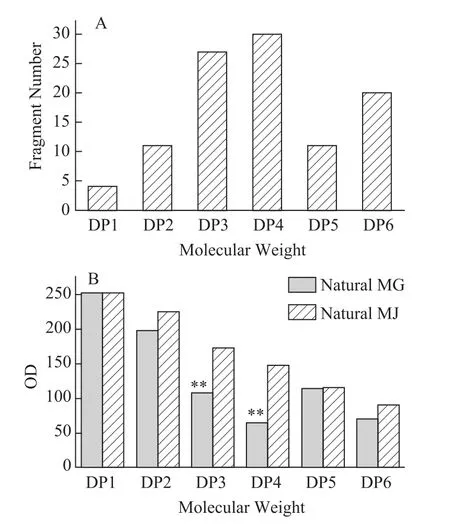
图5 野生蒙古黄芪与野生膜荚黄芪多糖人工胃酸酸解产物差异性糖片段个数(A)和糖片段柱状图(B)

图6 移栽蒙古黄芪与移栽膜荚黄芪多糖人工胃酸酸解产物电泳指纹图谱的多元统计分析
由图分析可知,五糖和六糖可以作为区分移栽蒙古黄芪与移栽膜荚黄芪的主要差异性片段。对该片段分析发现,移栽膜荚黄芪中五糖和六糖的含量均高于移栽蒙古黄芪的含量。
2.6 筛选蒙古黄芪(移栽芪和野生芪)多糖人工胃酸酸解产物差异性生物标志物
图8,为了明确蒙古黄芪(移栽芪和野生芪)多糖人工胃酸酸解产物间的化学差异成分,分组对酸解产物的电泳指纹图谱进行OPLS-DA、模型验证及载荷图分析,筛选生物标志物。
蒙古黄芪(移栽芪和野生芪)多糖人工胃酸酸解产物电泳指纹图谱的OPLS-DA分析结果见图8。图8A显示野生和移栽黄芪多糖酸水解产物得到很明显的分离,其中野生芪位于散点图的右部,而移栽芪位于散点图的左部,表明它们之间存在较大的差异。图8B模型验证采用总解释变量(R2值)和模型可预测性(Q2值)进行评估。回归线纵轴相交并处于零点以下,左端任何一次随机排列产生的R2、Q2均小于右端,且最右端的两个值差距较小。表明模型具有良好的可预测性和拟合度。模型验证结果成立,模型可靠。通过相应的载荷图中距原点较远的点筛选具有潜在贡献的生物标志物(VIP>1)(图8C)。
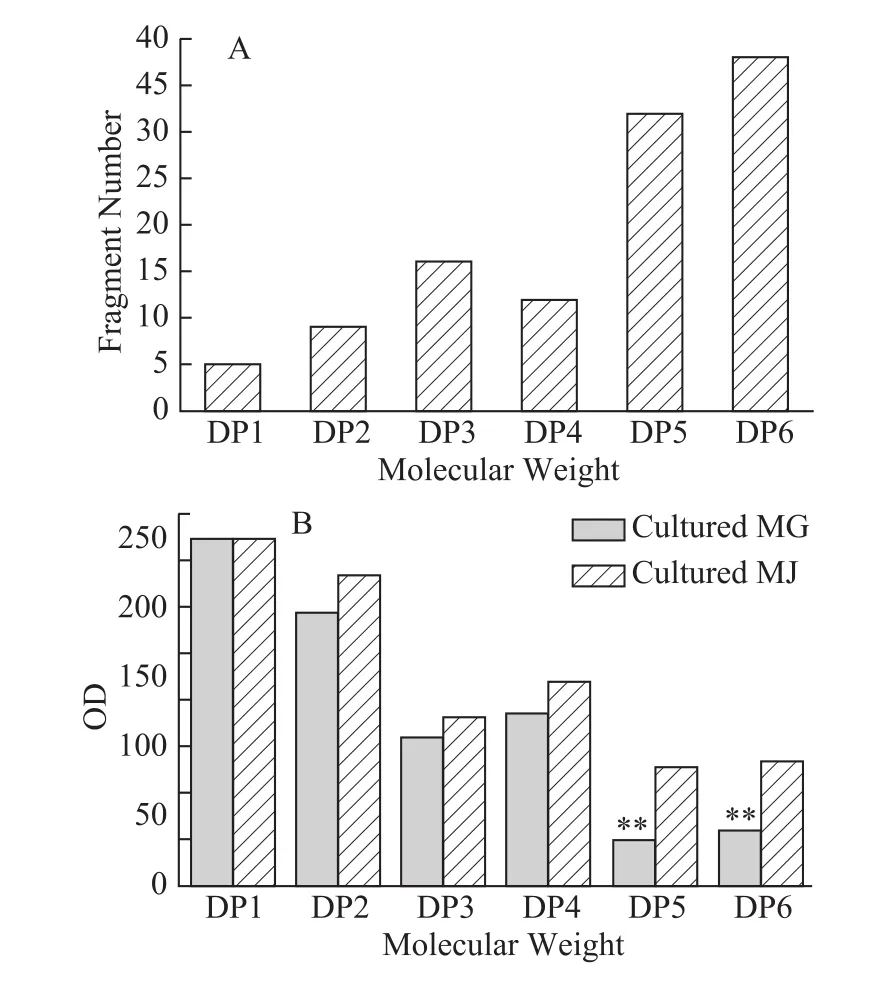
图7 移栽蒙古黄芪与移栽膜荚黄芪多糖人工胃酸酸解产物差异性糖片段个数(A)和糖片段柱状图(B)

图8 蒙古黄芪(移栽芪和野生芪)多糖人工胃酸酸解产物电泳指纹图谱的OPLS-DA散点图(A),模型交叉验证图(B)及Loading图(C)

图9 蒙古黄芪(移栽芪和野生芪)多糖人工胃酸酸解产物差异性糖片段个数(A)和糖片段柱状图(B)
由图分析可知,四糖和六糖可以作为区分蒙古黄芪(移栽芪和野生芪)生长方式的主要差异性片段。对该片段分析发现,野生蒙古黄芪中四糖的含量高于移栽蒙古黄芪含量,移栽蒙古黄芪六糖的含量高于野生蒙古黄芪含量。
3 讨论与结论
在本研究中,野生黄芪选自道地产区山西浑源等地,这些地方多是土质疏松的半坡环境,夏季日照充足,干旱少雨,昼夜温差大,冬季寒冷,野生黄芪在此环境中生长多达5年以上。移栽黄芪则是农户选择肥沃土地,经移栽施肥生长2年后采收。相比之下,野生黄芪受到了更多干旱、低温、营养缺乏等环境胁迫,而移栽黄芪较少受到逆境的影响。大量研究表明,植物通常以细胞和整个生物有机体抵抗胁迫。逆境下,植物会在形态结构、生理生化、渗透调节、植物激素水平、膜保护物质及活性氧平衡、逆境蛋白等诸多环节发生变化,涉及到植物水分、光合、呼吸、物质代谢等多项生理过程[11-15]。已有研究报道,细胞质中游离糖及糖醇成分是植物受到生长胁迫而诱导产生的小分子物质,这些物质在细胞中大量积累,调节细胞渗透压,有利于植物保持水分,抵抗盐碱、低温等多种逆境,对维持植物的正常生理功能具有重要作用[11]。因此,在环境影响下,野生黄芪比移栽黄芪经受更多的胁迫因素,野生黄芪中的多糖含量远远高于移栽黄芪[16]。虽然本研究找出了四糖和六糖可以作为区分蒙古黄芪(移栽芪和野生芪)生长方式的主要差异性片段,然而多糖经人工胃酸水解后的糖片段含量差异,活性如何,是否可以作为评价黄芪种质资源的指标还有待进一步研究。
本实验通过在体外模拟人工胃液条件测定人工胃酸对蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)黄芪多糖的酸解产物,发现基于人工胃酸条件水解能很好的区分蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)。根据PACE电泳后六种糖标准品的Rf-分子量标准曲线(图2),推出黄芪多糖降解后黄芪寡糖相应的分子量及其分布。分析结果显示:膜荚黄芪中移栽芪和野生芪分离现象不明显,寻找差异性片段意义不大,而蒙古黄芪(移栽芪和野生芪)多糖酸解产物中的四糖和六糖可以作为区分生长方式的专属性糖片段,且野生蒙古黄芪中四糖的含量高于移栽蒙古黄芪含量,移栽蒙古黄芪中六糖的含量高于野生蒙古黄芪含量;三糖和四糖可以作为区分野生蒙古黄芪与野生膜荚黄芪的主要差异性片段,对该片段分析发现,野生膜荚黄芪中三糖和四糖的含量均高于野生蒙古黄芪含量;五糖和六糖可以作为区分移栽蒙古黄芪与移栽膜荚黄芪的主要差异性片段,对该片段分析发现,移栽膜荚黄芪中五糖和六糖的含量均高于移栽蒙古黄芪含量。这一指标为蒙古黄芪(移栽芪和野生芪)和膜荚黄芪(移栽芪和野生芪)的鉴别提供了依据,同时也为黄芪药材的品质评价奠定了基础。
[1] 苗明三,李振国.现代实用中药质量控制技术[M].北京:人民卫生出版社,2000:12.
[2] 孙群,阚健全,赵国华,等.活性多糖构效关系研究进展[J].广州食品工业科技,2004,20(1):104-106.
[3] 国家药典委员会编.中华人民共和国药典:一部[M].北京:化学工业出版社,2005.
[4] 孙政华,邵晶,郭玫.黄芪化学成分及药理作用研究进展[J].中医临床研究,2015,(25):22-25.
[5] 蔡莉,朱江.黄芪多糖研究现状与进展[J].中国肿瘤临床.2007,34(15):896-900.
[6] 艾连中,吴艳,郭本恒,等.黄芪多糖的研究进展[J].山东食品发酵,2008(1):39-41.
[7] Hellekant G,Danilova V.Species differences toward sweeteners[J].Food Chemistry,1996,56:223-328.
[8] Glaser D,Wanner M,Tinti JM,et a1.Gustatory responses of pigs to various natural and artificial compounds known to be sweet in man[J].Food Chemistry,2000,68(4):375-385.
[9] 陈萍,张拥军,朱丽云,等.人工胃液作用抗氧化龙井茶多糖的体外模拟研究[J].中国食品学报,2014,14(10):35-41.
[10]金晖,张则鸣,张拥军,等.人工胃液作用南瓜多糖的体外模拟研究[J].食品科技,2012,(4):178-181.
[11]蔡孟深,李中军.糖化学[M].北京:化学工业出版社,2006.
[12]Morcuende R,Krappe A,Hhrry V,et al.Sucrose feeding leads to increased rates of nitrate assimilation,increased rates ofα-oxoglutarate synthesis,and increased synthesis of a wide spectrum of amino acids in tobacco leaves[J].Plants,1998,206:394-409.
[13]Koch K E,Ying Z,Wu Y,et al.Multiple paths of sugarsensing and a sugar/oxygen overlap for genes of sucrose and ethanolmetabolism[J].JExp Bot,2000,51:417-427.
[14]布坎南,格鲁依森姆,琼斯.植物生物化学与分子生物学[M].北京:科学出版社,2004.
[15]苏文华,张光飞,李秀华,等.植物药材次生代谢产物的积累与环境的关系 [J].中草药,2005,36(9):1415-1418.
[16]杜国军.恒山黄芪道地药材质量标准研究[D].太原:山西大学,2013.

