脊柱骨母细胞瘤的诊疗体会
吴昊 孙文超 闫飞飞 许可可 谢远龙 邓洲铭 冯帆 蔡林 雷军
骨母细胞瘤 (osteoblastoma) 也被称为成骨细胞瘤 (osteogenic fibromas of bone),约占所有原发性骨肿瘤的 1%,良性骨肿瘤的 3%。生物学上局部侵袭性高,切除不彻底容易导致术后复发,且有恶变的倾向,故国外也有学者将其定义为交界性骨肿瘤[1-5]。骨母细胞瘤好发于脊柱,约占 30%~40%,但由于脊柱解剖结构的复杂性和特殊性,脊柱骨母细胞瘤的诊断及治疗一直是临床上存在的难题,其临床及影像学表现多样,又缺乏特异性诊断标准,常常造成误诊及漏诊[1,3,6-7]。现对我院 2010 年 3 月至 2017 年 6 月诊治并取得随访的 10 例脊柱骨母细胞瘤患者进行回顾性分析,旨在探讨其临床表现、影像学特征及治疗等。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:(1) 2010 年 3 月至 2017 年 6 月在我院行穿刺活检或切开活检确诊为脊柱骨母细胞瘤者;(2) 术前结合病史,临床表现,影像学特点高度怀疑为骨母细胞瘤或复发型骨母细胞瘤者;(3)均在我院行脊柱肿瘤切除术,术后病检均证实为骨母细胞瘤者。
2. 排除标准:(1) 曾患神经系统疾病并遗留神经功能障碍患者;(2) 严重心、脑、肺、肝、肾等重要脏器功能障碍患者;(3) 有明显智力障碍、精神异常或因合并其它疾病不能合作患者。
二、临床资料
本组 10 例,男 6 例,女 4 例;平均年龄 33.4±16.7 (9~70) 岁;病程 9.2±3.5 (3~15) 个月。发病部位:颈椎 3 例,2 例均累及 C3,1 例累及 C5~6;胸椎 3 例,分别累及 T1~2,T11,T10;腰椎 2 例,分别累及 L2,L4;颈胸段 1 例,累及 C7~T1;骶椎1 例,累及 S1~2。肿瘤主要发生于椎体 3 例,发生于附件 7 例 (其中 2 例同时侵犯椎体) (表1)。
1. 临床表现:本组 10 例术前均有不同程度疼痛症状,伴夜间痛 7 例,4 例口服 NSAIDs 类药物缓解明显。其中 4 例以神经功能损害的症状为主,期间 2 例外院误诊为颈椎病,一直予以理疗等康复治疗,症状缓解不明显,1 例误诊为腰肌劳损;1 例胸椎骨母细胞瘤于外院接受初次治疗后复发转入我院,且合并脊柱侧弯,术前均未行相关放化疗治疗。其余患者未触及体表明显肿块。
2. 影像学检查:本组 10 例均行 X 线片、CT 及MRI 检查。仅 6 例在 X 线片上可发现病变。骨母细胞瘤在 X 线通常表现为膨胀性,溶骨性破坏,病变内常有斑点状或斑片状骨化或钙化影,病灶周围可出现清楚的薄壳,发生于椎体者有时可表现为病理性骨折;CT 可明确显示肿瘤的病变部位、范围及病变特点,CT 主要表现为单椎体或附件溶骨性破坏,本组最大截面直径范围 1.8~4.2 cm,病灶内部为典型的片状或沙粒状骨化或钙化,边缘常有厚薄不一的骨包壳,形成包裹的硬化带,称为牛眼征;有2 例出现连续椎体的骨质破坏,有 3 例出现肿瘤周围大范围的骨质硬化反应区,并可见软组织肿块及浸润,甚至随着椎弓根蔓延至椎体;MRI 可以明确肿瘤的大小,边界,对脊髓的压迫及软组织受累的情况,本组病例主要表现为膨胀性骨质破坏,病变在 T1加权像上,大多表现为低或中等信号;在 T2加权像则表现多样,在不同病例中可表现为低、中或高信号,有 1 例在病变周围表现为环形的低信号带,考虑为骨质硬化带的表现。其中 2 例伴有软组织肿块,1 例伴脊髓受压、变性,表现为相应节段的椎管狭窄,脊髓内出现混杂高信号或异常信号常提示预后不良。3 例行核素骨扫描 (ECT) 检查病损部位均有放射性浓聚。

表1 本组 10 例患者的临床资料Tab.1 Clinical characteristics of a series of 10 patients of spinal osteoblastoma
3. 手术方法:术前尽量明确诊断:有 2 例于术前行穿刺活检,明确诊断为骨母细胞瘤。1 例为复发病例,根据肿瘤部位和范围选择恰当的手术方法。所有患者均行肿瘤 (主要包括,瘤巢及软组织肿块) 扩大切除术,其中 4 例为前路肿瘤切除,肿瘤主要侵犯椎体,1 例伴软组织肿块浸润,肿瘤侵犯横突孔,累及椎动脉,术前行椎动脉栓塞,术中仔细分离椎动脉,并将神经根游离,保护脊髓及血管,完整切除肿瘤,并行前后路联合固定;1 例取自体髂骨支撑,钢板螺钉内固定;3 例行钛网重建支撑,钢板螺钉内固定;5 例行后路肿瘤切除、椎管减压,均采用椎弓根内固定,多数病变累及附件,椎板,关节突等,其中颈椎 2 例,胸椎 3 例,术中完整切除瘤巢及周围硬化骨质,同时采用内固定重建脊柱稳定性;1 例骶椎行前后路联合入路,这例患者伴有软组织肿块,并向椎体前方浸润,累及髂血管及重要脏器 (直肠,膀胱等),骶椎术前已行一侧髂内动脉及部分分支血管栓塞术,术中先行前路游离髂血管及膀胱,直肠,切除部分肿瘤,再后路行椎管减压,肿瘤大部切除及内固定术。
4. 术后处理:伤口留置负压引流,当引流量<50 ml / 24 h 后拔除。术后第 1、5、10 天复查血常规,肝肾糖及电解质。根据个体情况全身给予抗生素 5~7 天。术后 2~3 周可佩戴支具下床活动,并复查手术部分 X 线片。术后均未行放化疗。
三、评价方法
通过记录手术时间、术中出血量、病理结果,随访过程中通过比较术前,术后神经功能 ASIA分级和疼痛视觉模拟评分 (visual analogue scale,VAS),评估手术疗效。大部分患者为门诊复查、信函、电话随访,确认有无复发,进一步治疗情况,观察患者症状疼痛、神经损伤等及影像学的变化(图1~2)。
四、统计学处理
所有数据采用 SPSS 19.0 软件进行统计分析,数据以 x-±s 表示,术前及术后相对应数据采用配对t 检验,P<0.05 为差异有统计学意义。
结 果
一、手术疗效
手术平均时间 3.8 (2.2~5.3) h,平均出血量 1200 (600~2500) ml。术中见肿瘤直径 1.2~2.4 cm,多位骨性,质地较硬,8 例可见瘤巢及边界清除的硬化骨质,术后病理汇报:9 例为骨母细胞瘤,1 例为侵袭性骨母细胞瘤,围手术期间,1 例出现脑脊液漏,经更换抗生素和输注白蛋白后好转,1 例术后出现伤口脂肪液化,分泌物培养示阴性,经彻底清创,予以 VSD 负压吸引后愈合,2 例术后出现神经功能损害加重的症状,考虑术中对脊髓牵拉过度及术后神经根水肿,漂移所致,予以扩管,脱水,营养神经等对症治疗后逐渐缓解,术后 3 个月恢复正常。
二、随访结果
术后 10 例获得随访,平均 32±5 (23~40) 个月,术后疼痛和神经功能损害表现均有明显改善,手术前后神经功能 ASIA 分级 (表2)。术前 VAS 评分 5.1±2.3,术后 3 个月随访 VAS 评分 1.0±0.8,术前与术后 VAS 评分值差异有统计学意义 (P=0.001<0.05)。随访中 1 例于术后 18 个月复发,于我院行二次手术肿瘤切除治疗,术后转入肿瘤科,行放化疗;1 例脊柱侧弯的患者,末次随访时侧弯已矫正。其余末次随访均未见肿瘤复发或恶变,无内固定松动及断裂等并发症。
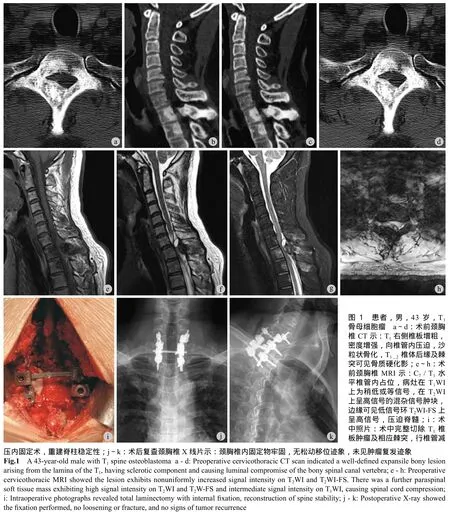
讨 论
一、脊柱骨母细胞瘤的特征
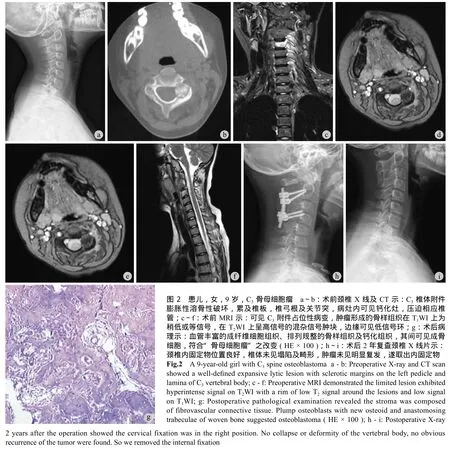

表2 手术前后神经功能 ASIA 分级与 VAS 评分比较Tab.2 Preoperative and postoperative ASIA grade and VAS score
骨母细胞瘤是一类少见的原发性骨肿瘤,约40% 的骨母细胞瘤好发于脊柱,尤其是位于脊柱的后柱,椎板,椎弓根,附件等等,约 3% 的病变可起源于椎体并向椎弓或横突侵犯[8-10]。关于脊柱骨母细胞瘤国内外尚没有多中心、大样本的病例研究和系统回顾[11],国外的一些报道研究显示,骨母细胞瘤在人群中的发病率较低,男性青年多见,男女之比约为 2.5∶1,30 岁之前的青少年及青年约占80%[1,8,17]。本组 10 例,肿瘤主要发生于椎体 3 例,发生于附件 7 例 (其中 2 例同时侵犯椎体),男女比例 3∶2,平均发病年龄为 (33.4±16.7) 岁,年龄偏大,可能原因是本单位主要诊治成年患者及样本量较少。
Lichtenstein[5]首次对骨母细胞瘤进行了详细的研究及报道,随后陆续有不少关于骨母细胞瘤的报道。研究显示:骨母细胞瘤在组织学上,通常与骨样骨瘤难以区分,两者最重要的鉴别点就是肿瘤直径的大小,骨母细胞瘤的直径通常>1.5 cm 甚至2 cm,而骨样骨瘤为 1.5 cm 或更小。与骨样骨瘤相比骨母细胞瘤的发病年龄通常较小,更具有侵袭性及恶变倾向,病灶周围呈膨胀性溶骨改变,硬化不明显,部分病例可见软组织肿块。临床上,部分骨母细胞瘤的边界不清、反应骨不明显且肿瘤突破皮质侵入椎管 / 或累及周围软组织 (即 Enneking S3期),Schajowicz 等[12]将其称之为侵袭性骨母细胞瘤,据 WTO 统计此类肿瘤占原发骨肿瘤的 0.28%,单纯刮除后易复发,多次复发可恶变为骨肉瘤或纤维肉瘤,预后极差,故首次手术治疗需完整切除肿块[13]。本组 10 例,术中均完整切除肿瘤,术中见肿瘤直径 1.2~2.4 cm,多位骨性,质地较硬。本组有 2 例术前误诊为骨样骨瘤,究其原因,可能是此 2 例有明显夜间痛及口服 NSAIDs 类药物有效的病史,且骨质膨胀不明显,肿瘤病灶较小,容易和骨样骨瘤相混淆。1 例结合术中肉眼所见,术后经病理科及影像科会诊,综合考虑为侵袭性骨母细胞瘤。
二、脊柱骨母细胞瘤的诊断
1. 病理诊断:由于脊柱骨母细胞瘤缺乏典型、特异的临床表现,位于椎体者术前穿刺病检风险较高,尤其是颈椎和胸椎,有瘫痪和神经功能损害加重的风险,虽然 Rimondi 等[14]通过研究报道关于 CT引导下脊柱病灶的穿刺阳性诊断率为 90%,诊断准确率为 93%。但本组仅 2 例术前行 CT 引导下穿刺病检,明确诊断,且骨肿瘤由于形态学上的特异性,病理诊断有时也会因为标本量较少和穿刺部位的误差而无法给出明确结果,有时还需要多家医院的病理科会诊,诊断周期长,常引起不必要的纠纷,故在诊断及治疗上造成很大阻碍。本组 4 例术前均有不同程度的神经功能损害,治疗上应尽快行手术治疗,解除脊髓压迫,重建脊柱的稳定性。其余病例常规的做法是行胸腹部 CT 或 PET / CT 排除转移性肿瘤或浆细胞瘤可能。
2. 影像学诊断:脊柱由于解剖位置复杂性和特殊性,脊柱肿瘤无论在诊断还是治疗上都存在许多难点。首先脊柱肿瘤中发病率最高的是转移性肿瘤,约占所有脊柱肿瘤的 45%~75%[14],因此如果经济条件允许,可以建议患者术前行 PET /CT 或 ECT 等全身检查,脊柱骨母细胞瘤一般为局部病灶,很少出现转移灶及跳跃病灶,且文献报道全身骨显像 (ECT) 是骨母细胞瘤最敏感的影像学检查[15-16],检测病变定位准确,但定性困难,在鉴别肿瘤性和非肿瘤性疾病时存在一定困难。本组10 例,术前行 PET / CT 者 2 例,行 ECT 者 3 例,给诊断提供了重要的参考依据,但 PET / CT 费用较高,在对该病的诊断及鉴别上,性价比没有 X 线,CT 及 MRI 高。X 线对病变早期的诊断价值有限,脊柱骨母细胞瘤典型的 X 线表现为椎体或附件局限性膨胀性囊状透亮区,病灶界限清楚,骨皮质受侵犯变薄或不连续,病变内常有斑点状、团片状骨化或钙化改变,病灶周围出现清楚的薄壳为本病特征。但对于病灶较小或早期肿瘤部位比较隐匿 (如椎弓根,椎板等) 的患者无法提供明确的诊断依据,常常导致漏诊或误诊,本组有 2 例早期 X 线均未发现明显骨质破坏的改变,1 例位于颈胸段,1 例位于骶椎。CT 对于骨母细胞瘤的诊断尤为重要,尤其要强调薄层 CT 扫描的重要性,对于早期病变较小或反应区不明显的患者,薄层 CT 往往能准确定位肿瘤的部位及大小,为手术方案的制订提供必要的帮助。脊柱骨母细胞瘤的 CT 主要表现为单椎体或附件溶骨性破坏,呈膨胀性,病灶内部为典型的片状或沙粒状骨化或钙化,边缘常有厚薄不一的骨包壳,形成包裹的硬化带,俗称“蛋壳状硬化环”,也称为牛眼征,但该硬化带没有骨样骨瘤明显,这是两者鉴别的一个要点。还有一部分患者的 CT 上会出现广泛的骨质硬化反应区,累及多个椎体及附件,难以确定主要病椎及病灶的部位,此时薄层 CT 的优势就很明显地体现出来,借助 1 mm 一个层面的薄层扫描,可以仔细寻找瘤巢及病椎,实现精确定位[17-18]。MRI对于脊柱骨母细胞瘤的诊断价值存在一定局限性,脊柱骨母细胞瘤的 MRI 信号并无明显的特异性,肿瘤组织在 T1WI 上为稍低或等信号,T2WI 通常为高信号,也可以呈高、低混杂信号等。对于脊柱骨母细胞瘤,笔者认为,CT 在观察椎管有无狭窄,显示对硬膜囊的压迫等方面均有优势,尤其是对部分病灶内散在小点片状、斑点状钙化或骨化,明显较 MRI 敏感,而 MRI 比 CT 难以显示有重要参考价值的细小钙化或骨化。尽管如此,MRI 具有良好的软组织分辨率,能清楚显示病变与周围重要神经血管的关系,而这些关系均直接影响到肿瘤的临床分期、手术方案的制订。
3. 临床表现:结合本研究收治的 10 例脊柱骨母细胞瘤患者的经验,笔者认为,脊柱骨母细胞瘤的诊断主要依靠临床表现,病史,相关影像学检查 (CT 及 MRI、ECT 等) 及病理检查。尤其要强调病理诊断“金标准”的地位。脊柱骨母细胞瘤的临床表现以局部疼痛,伴或不伴夜间痛为主,文献报道该疼痛多为持续性、逐渐加重的钝痛[1,4,10],多无明显夜间疼痛加重等症状,多数患者口服阿司匹林及其它非甾体类抗炎药效果欠佳,发生于颈椎的骨母细胞瘤,常常漏诊,误以为颈椎病,有时出现神经功能损害的症状时,也被误诊是颈椎病引起的,这类患者由于术前就已经出现了神经功能损害的症状,手术治疗的目的主要以挽救脊髓功能为主,此类患者在术后疼痛和神经功能损害表现均有明显改善;部分胸椎骨母细胞瘤的患者,主要以肋间神经痛为首发症状,由胸背部放射至肋周;还有一部分患者以脊柱侧弯畸形为主要症状入院,这类患者绝大多数为青少年,病史较长,有长期腰背部疼痛的症状,且大部分病变位于胸腰椎,严重者甚至会引起不可逆性的脊柱侧弯畸形,本组 1 例存在脊柱畸形,为胸椎附件的复发型脊柱骨母细胞瘤,在外院切除附肿瘤后行椎板重建术,术后出现脊柱后凸畸形和不全瘫,本例脊柱侧弯,是由于术后脊柱失稳导致,后期手术中行后路椎弓根螺钉固定,横突间植骨融合,术后复查未见肿瘤复发及脊柱畸形,内固定物牢靠,未见断裂及松动。Galgano 等[1]通过回顾文献后,认为脊柱骨母细胞瘤的侵袭性与脊柱侧弯的程度有很大的相关性,且肿瘤一般位于侧弯的凹侧,可能是长期慢性疼痛引起肿瘤同侧的椎旁肌痉挛所致,也可能是病变累及范围较大,存在软组织受累所致。笔者认为对于青少年的长期且持续存在的腰背痛并且对保守措施难以忍受的病例不应该片面地视为炎症刺激或生活姿势的原因,有时甚至被误诊为青少年型的特发性脊柱侧弯,当这种脊柱侧弯持续加重而又没有得到正规有效的治疗,往往会导致进行性的神经功能损害,这类患者预后往往不佳。文献报道约 1 / 3 的案例会出现截瘫甚至瘫痪的风险[1,6],而 1 / 2 的患者可能出现神经根压迫的症状。肿瘤靠近体表者,可见局部肿大或触及肿物,并可伴有压痛[7,9]。研究认为,对出现神经功能损害症状的患者,一定要尽早行手术治疗,术中必须充分减压,将硬膜囊表面的压迫完全去除,这个过程应该尽量避免牵拉硬膜囊及神经根,尤其是颈胸髓。即便如此,本组仍有 2 例术后出现神经功能损害加重的症状,考虑术中对脊髓牵拉过度及术后神经根水肿,漂移所致,予以扩管,脱水,营养神经等对症治疗后逐渐缓解,术后 3 个月恢复正常。位于椎板的骨母细胞瘤,术中可以使用高速磨钻或超声骨刀进行开窗,减少对软组织及神经的损伤,随后行钉棒或钢板内固定技术,重建脊柱的稳定性。
三、脊柱骨母细胞瘤的治疗
对于脊柱骨母细胞瘤,手术切除是首选的治疗方式,有部分复发或无法耐受手术的患者,可以行放化疗治疗[3,7,9]。大多数学者认为对于脊柱骨母细胞瘤应采取根治性的手术切除[2,6]。在随访的研究中也显示此类手术方式,往往能取得良好肿瘤控制率,复发率仅 10%,明显低于行单纯刮除的患者(25%~40%)[3,17-18]。笔者认为脊柱骨母细胞瘤的手术治疗的原则应是:(1) 完整切除肿瘤,并重建脊柱的稳定;(2) 精确定位,切除瘤巢,避免肿瘤切除术后复发;(3) 缓解症状,提高患者的生活质量;(4) 出现神经功能损害时,最大限度地挽救患者脊髓功能;本组 10 例脊柱骨母细胞瘤的患者均采用扩大切除的方式进行手术治疗,术中主要切除瘤巢及软组织肿块,而对于肿瘤周围的反应性骨质硬化区,并未做切除处理。原因在于完整、彻底的切除瘤巢是降低骨母细胞瘤术后局部复发的关键[1,3],反应区往往侵犯面积较大,且均为硬化骨质区,考虑炎性刺激所致。基于 Boraini 等[19]提出的 WBB 分期:根据肿瘤累及部位的不同,采取不同的入路方式:当肿瘤主要累及附件时,可采用单纯后路切除;当主要累及椎体时,采用前路切除;当椎体及附件均受累时,可采取前后路联合会入路切除。当然肿瘤切除,重建脊柱的稳定性也是必要的。而对于术前影像学提示血供丰富的骨母细胞瘤,术前可考虑行血管栓塞或球囊临时阻断技术,以达到减少术中出血、完整切除肿瘤的作用。手术方式的选择对于控制肿瘤局部复发率及后续重建脊柱的稳定性起到了重要作用,且术后必须坚持定期复查与随访,观察患者是否出现肿瘤复发,脊柱是否失稳或是否存在应力过于集中而导致的内固定物断裂、松动等并发症的发生,对于部分青少年型脊柱骨母细胞瘤的患者而言,此类患者的脊柱正处于生长发育的高峰期,过多地切除肿瘤周围反应区很有可能会导致脊柱稳定性丧失及后期脊柱发育的障碍。此外,术中进行融合及内固定对于脊柱长期的稳定及防止畸形也起到了重要作用。本组 10 例术后随访中仅 1 例出现了肿瘤复发,为 1 例颈椎侵袭性骨母细胞瘤的病例。侵袭性脊柱骨母细胞瘤处理起来比较棘手,由于颈椎复杂的解剖结构,如硬膜囊,脊髓,神经根和椎动脉,导致脊椎整体切除较为困难,此外,侵袭性骨母细胞瘤是高度血管化肿瘤,肿瘤血供丰富,肿瘤生长侵袭范围大,故建议术前行核磁共振造影技术-MRA 及椎动脉血管栓塞,以减少术中失血[11,19]。Jiang 等[20]报道对于术前未行栓塞的侵袭性骨母细胞瘤术中出血可达 12 000 ml,其余文献及研究也表明术前栓塞的潜在疗效[1,10]。本组其余患者均未出现肿瘤复发及脊柱失稳、畸形的临床表现。笔者认为对于颈椎侵袭性骨母细胞瘤,由于与神经结构的解剖关系,术前就可能导致严重的神经损伤,且恶变率为 12%~25%[11]。因此,初次手术治疗显得尤为重要,Boraini 等[11]对 40 例 Enneking S3 期的脊柱骨母细胞瘤进行一项长达 26 年的长期随访发现,经根治性切除 / 全脊椎切除的患者术后无一例复发,而经扩大切除或肿瘤边缘切除的患者术后复发率为 7%。因此,Ando 等[13]认为对于侵袭性骨母细胞瘤经肿瘤扩大切除或边缘切除也可以获得良好的肿瘤控制率。由于侵袭性骨母细胞瘤在临床上更为罕见,因此对于怀疑侵袭性骨母细胞瘤,尤其在病变边缘出现软组织肿块时,就更应考虑侵袭性骨母细胞瘤的可能。
近年来随着脊柱外科微创理念和技术的进步,经 CT 引导下射频消融术治疗脊柱骨母细胞瘤,已取得初步临床疗效,可以明显改善患者症状,提高生活治疗。但如何准确放置探头及降低相关脊髓热损伤等并发症仍是后续研究的重点[1,16]。
综上所述,脊柱骨母细胞瘤临床发病率低,诊断较为困难,而对于脊柱骨母细胞瘤的患者来说早期诊断,早期治疗,是防止病情继续发展的关键,CT 和 MRI 检查对诊断脊柱骨母细胞瘤有重要意义,如果患者经济条件允许,PET / CT 及 ECT 也可以更进一步帮助该病的诊断,有一部分病例可通过病史、临床表现、影像学特点及术前穿刺病检得出临床诊断,根据肿瘤的部位,精确的术中定位加上完整的切除是防止肿瘤复发的关键。所以在临床工作中,应加强临床、影像、治疗、随访的合作,避免误诊及漏诊,提高对脊柱骨母细胞瘤的认识及诊断水平。
[1]Galgano MA, Goulart CR, Iwenofu H, et al. Osteoblastomas of the spine: a comprehensive review[J]. Neurosurg Focus, 2016,41(2):E4.
[2]Yin H, Zhou W, Yu H, et al. Clinical characteristics and treatment options for two types of osteoblastoma in the mobile spine: a retrospective study of 32 cases and outcomes[J]. Eur Spine J, 2014, 23(2):411-416.
[3]李广学, 郭卫, 唐顺, 等. 脊柱骨母细胞瘤的诊断与治疗[J]. 中国骨与关节杂志, 2011, 10(2):127-131.
[4]Arkader A, Dormans JP. Osteoblastoma in the skeletally immature[J]. J Pediatr Orthop, 2008, 28(5):555-560.
[5]Lichtenstein L. Benign osteoblastoma. A category of osteoidand bone-forming tumors other than classical osteoid osteoma,which may be mistaken for giant-cell tumor or osteogenic sarcoma[J]. Cancer, 1956, 9(5):1044-1052.
[6]Singh DK, Das KK, Mehrotra A, et al. Aggressive osteoblastoma involving the craniovertebral junction: A case report and review of literature[J]. J Craniovertebr Junction Spine, 2013, 4(2):69-72.
[7]李忠海, 马辉, 付强, 等. 脊柱骨母细胞瘤的临床特点与手术治疗[J]. 中华外科杂志, 2012, 50(2):110-114.
[8]Oliveira CR, Mendonça BB, Camargo OP, et al. Classical osteoblastoma, atypical osteoblastoma, and osteosarcoma: a comparative study based on clinical, histological, and biological parameters[J]. Clinics, 2007, 62(2):167.
[9]Berry M, Mankin H, Gebhardt M, et al. Osteoblastoma: a 30-year study of 99 cases[J]. J Surg Oncol, 2008, 98(3):179-183.
[10]Dickman, Fehlings CA, Gokaslan MG, et al. 3 Pathology of Tumors of the Spinal Cord, Spine, and Paraspinous Soft Tissue[M]. 2006.
[11]Boriani S, Amendola L, Bandiera S, et al. Staging and treatment of osteoblastoma in the mobile spine: a review of 51 cases[J].Eur Spine J, 2012, 21(10):2003-2010.
[12]Schajowicz F, Lemos C. Malignant osteoblastoma[J]. J Bone Joint Surge Br, 1976, 58(2):202-211.
[13]Ando K, Imagama S, Kobayashi K, et al. Aggressive osteoblastoma of the cervical spine involving the canal and vertebral artery: a case report[J]. Eur Spine J, 2016,26(Suppl 1):S111-116.
[14]Rimondi E, Staals EL, Errani C, et al. Percutaneous CT-guided biopsy of the spine: results of 430 biopsies[J]. Eur Spine J,2008, 17(7):975-981.
[15]Bhargava P, Singh R, Garg BB. Dorsal spine osteoblastoma[J].Asian J Neurosurg, 2016, 11(2):180.
[16]Weber MA, Sprengel SD, Omlor GW, et al. Clinical long-term outcome, technical success, and cost analysis of radiofrequency ablation for the treatment of osteoblastomas and spinal osteoid osteomas in comparison to open surgical resection[J]. Skeletal Radiol, 2015, 44(7):981-993.
[17]Kadhim M, Binitie O, O’Toole P, et al. Surgical resection of osteoid osteoma and osteoblastoma of the spine[J]. J Pediatr Orthop B, 2017, 26(4):362-369.
[18]Venugopal SB, Prasad S. Cytological diagnosis of osteoblastoma of cervical spine: a case report with review of literature[J]. Diagn Cytopathol, 2015, 43(3):218-221.
[19]Boriani S, Weinstein JN, Biagini R. Primary bone tumors of the spine. Terminology and surgical staging[J]. Spine, 1997,22(9):1036.
[20]Jiang L, Liu XG, Wang C, et al. Surgical treatment options for aggressive osteoblastoma in the mobile spine[J]. Eur Spine J,2015, 24(8):1778-1785.

