体外模拟消化液对金钗石斛的作用
梅娜娜,娄在祥*,王洪新*,寇兴然,孟映霞
(江南大学食品学院,国家功能食品工程技术研究中心,江苏 无锡 214122)
金钗石斛(Dendrobium nobile Lindl.)茎部表面金黄色或者带绿色,有深纵沟。质硬而脆,断面平坦而疏松;气微、味苦,是常用名贵中药材,为兰科石斛属多年生附生草本植物。其中主要含有多糖、生物碱、酚类和鞣质类等化学成分[1-3]。研究发现金钗石斛具有降血糖血脂[4-5]、抗肿瘤[6]、治疗白内障[7]和护胃[8]等功效[9-10]。《本草纲目》记载其“久服,厚肠胃,补内绝不足,平胃气”。《中华人民共和国药典》(2015版)记载其具有“益胃生津,滋阴清热”之功效。研究表明,在抗肿瘤和对心血管、胃肠道抑制及止痛退热等方面生物碱起着重要的作用,2000年日本学者Morita等[11]发现从金钗石斛中分离得到的Picrotoxane倍半萜型生物碱Flakinins A和B以及Mubironine C具有减轻小鼠白血病L1210细胞毒性的作用,体外半抑制浓度(50% inhibitory concentration,IC50)分别为4.0、8.5、2.6 μg/mL。陈晓梅等[8]研究发现石斛碱能抑制离体兔肠管活动,推测这是由于石斛能使血中胃泌素浓度升高;石斛通过直接刺激G细胞,引起胃泌素的释放增加,使血清中胃泌素的浓度升高,而胃泌素刺激壁细胞,使胃酸分泌增加,从而明显降低小鼠胃肠推动作用。铁皮石斛多糖能够显著提升小白鼠外周白细胞数和促进淋巴细胞产生移动抑制因子,并且能够强有力地消除实验条件下免疫抑制剂环磷酰胺加入所引发的副作用,是一种高价值的中药类免疫增强剂[12]。金钗石斛多糖具有直接促进淋巴细胞有丝分裂的作用[13]。石斛中所含有的石斛酚、杓唇石斛素、1,3-苯二醇、5-[2-(4-羟基-3-甲氧基苯基)乙基](苷类)、玫瑰石斛素、4-羟基-3,3’,4’,5-四甲氧基联苄、2,4,8-三甲氧基菲-3,7-二醇、毛兰菲、4-甲氧基菲-2,5-二醇、皮树脂醇和丁香脂素等酚类化合物具有抗氧化活性,对三价铁硫氰酸盐的抗氧化活性高于丁基羟基茴香醚[14]。
Gullon等[15]用体外模拟消化方法研究了副产品石榴皮粉体外消化液中总酚及总黄酮类物质的稳定性,并得出经体外模拟消化液消化后总酚物质的含量降低,除鞣花酸含量有所增加。袁春龙等[16]利用体外模拟消化液对葡萄籽超微粉进行消化,同时测定多酚类物质和白藜芦醇溶出率。结果表明,多酚、白藜芦醇的溶出率分别为:霞多丽60.87%~67.43%、23.65%~40.64%;赤霞珠60.48%~69.99%、20.63%~43.38%。经模拟肠液消化5~15 h后,多酚、白藜芦醇的溶出率分别为:霞多丽1.96%~17.86%、17.51%~50.25%;赤霞珠3.38%~15.23%、14.02%~44.71%。葡萄籽中多酚物质的消化吸收主要集中在胃环境中,而白藜芦醇在肠、胃环境中的消化吸收几乎各占一半。张冠亚等[17]采用3 种体外模拟消化液对铁皮石斛多糖进行体外模拟消化研究,结果表明,在体外模拟胃肠道的消化体系中,铁皮石斛多糖的分子质量减小,糖苷键发生断裂,但没有游离单糖的释放。然而有关采用模拟胃肠道消化过程来比较研究金钗石斛功能性成分被人体吸收情况鲜有报道;因此,本实验模拟口腔、胃、肠环境条件,体外模拟消化金钗石斛全粉(超微粉/普通粉)、提取物(水提物/醇提物)的消化过程,探究金钗石斛中石斛碱、多糖和其他化学成分(多酚类)在体外模拟消化过程中含量的变化和多糖消化产物,为今后探索金钗石斛功能性的动物实验和金钗石斛保健产品的开发和应用提供实验参考。
体外模拟消化道的实验方法在了解食品或者药物胃肠运行状态中应用广泛。尽管人体营养研究仍是全球普遍采用的方法,但是体外实验具有成本低、快速、便捷和无伦理限制的优势。体外模拟消化的方法包括口腔、胃部和小肠部分,偶尔包括大肠发酵部分[18]。体外模拟消化方法中,研究者尝试着模仿生理学的条件,其中考虑到的因素有消化酶及其浓度、pH值、消化时间、盐浓度和其他因素[19-20]。因此,本实验以人体胃、肠道模拟系统为基础,并加以适当改进[21],希望探索出金钗石斛化学成分在体内的消化情况。
1 材料与方法
1.1 材料与试剂
金钗石斛(茎部)由贵州赤水金钗石斛国礼发展有限公司提供。金钗石斛超微粉(submicron powder,SP)(500 目)由济南纳力德超微粉碎技术公司制得。普通粉(common powder,CP)、水提物(water extract,WE)、醇提物(alcohol extract,AE)、粗石斛碱(dendrobine,D)和粗多糖(polysaccharide,P)均由江南大学食品营养与功能因子实验室自制。
淀粉酶(10 U/mg)、胃蛋白酶(40 U/mg)美国Sigma公司;胰酶、猪胆粉、黏蛋白 上海源叶生物科技有限公司;氯化钠、硝酸铵、磷酸钾、氯化钾、柠檬酸钾、尿酸钠、乳酸钠、盐酸、氢氧化钠等均为分析纯;岩藻糖、氨基葡萄糖、鼠李糖、阿拉伯糖、氨基半乳糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖的标准品 国药集团化学试剂有限公司;芸香叶苷、绿原酸、阿魏酸、对羟基苯甲酸、熊果酸、芹菜素、没食子酸、槲皮素的标准品 上海阿拉丁试剂有限公司。
1.2 仪器与设备
GC7890气相色谱仪 美国安捷伦公司;UV-1800型紫外分光光度计 日本岛津公司;AR224CN电子天平奧豪斯仪器(上海)有限公司;BS-1E温控摇床 瑞华仪器有限公司;GZX-9240MBE电热鼓风干燥箱 上海博迅实业有限公司;TGL-16C台式离心机 上海安亭科学仪器厂;超高效液相色谱串联四极杆质谱联用仪(ultra-high performance liquid chromatographytriple quadrupole mass spectrometry,UPLC-TQD-MS)美国沃特世公司。
1.3 方法
1.3.1 金钗石斛全粉、提取物、粗石斛碱及粗多糖的制备
1.3.1.1 金钗石斛超微粉和普通粉的制备
金钗石斛茎鲜品→去叶、清洗→切段(4~5 cm)→热风干燥(水分低于5%)→粉碎(过60 目)→普通粉→包装备用。超微粉由普通粉经超微粉碎机进一步粉碎制得(500 目)。金钗石斛超微粉和普通粉主要为石斛全粉。
1.3.1.2 金钗石斛水提物和醇提物的制备
水提物:称取金钗石斛干粉160 g,加入3.2 L超纯水,于70 ℃条件下提取2 h后纱布滤过,共提2 次。8 000 r/min离心10 min,再于65 ℃条件下真空旋转蒸发浓缩。浓缩后真空干燥得水提物,主要成分为水溶性成分。
醇提物:称取金钗石斛干粉120 g,加入2.4 L体积分数95%乙醇,按照上述水提物制备方法操作,得醇提物备用,主要成分为醇溶性成分[22]。
1.3.1.3 金钗石斛多糖和石斛碱的提取分离
多糖:向金钗石斛干粉中加入体积分数95%乙醇,在75 ℃条件下搅拌脱脂2 次。经过滤后向所留残渣中加入9 L超纯水,70 ℃条件下提取2 h,共提2 次。纱布过滤后8 000 r/min离心10 min,再于65 ℃条件下真空旋转蒸发浓缩。然后向浓缩后的胶状溶液里加入4 倍体积的纯乙醇,加入的过程中不断搅拌。4 ℃条件下静置24 h后,8 000 r/min离心10 min后取沉淀,并用纯乙醇、丙酮和乙醚进一步冲洗。最终将沉淀物冻干,得到粗多糖[23]。主要成分为粗多糖。
石斛碱:向金钗石斛干粉中加入体积分数95%乙醇4 L,75 ℃条件下提取2 h,共提2 次。纱布过滤后8 000 r/min离心10 min,再于65 ℃条件下真空旋转蒸发浓缩。浓缩后进行真空干燥得粗生物碱备用。将粗生物碱溶于体积分数30%乙醇,8 000 r/min离心5 min后取上清液,用氯仿萃取所得上清液2 次,真空干燥萃取物。经大孔树脂AB-8对石斛碱进行纯化,最后用气相内标法测定石斛碱含量。测得所制石斛碱质量分数为73%。
1.3.2 口腔模拟消化
将体外模拟消化实验分成金钗石斛超微粉、普通粉、水提物、醇提物、粗石斛碱和粗多糖共6 个组,分别记作SP、CP、WE、AE、D和P组。同时各组分成口腔、胃部和肠道3 个组。
人工唾液的配制按照表1所示方法进行制备[24]。根据文献[24]报道5 g/L黏蛋白可以有效模拟人类口腔的黏度,因此实验选取黏蛋白的质量浓度为5 g/L。加入淀粉酶使其浓度为150 U/mL。将配制好的人工唾液用0.1 mol/L盐酸或者氢氧化钠溶液调节pH值至6.8。取50 mL离心管,加入5 mL人工唾液,分别与一定量的金钗石斛超微粉、普通粉、水提物、醇提物、粗石斛碱及粗多糖充分混合后放入摇床,37 ℃、100 r/min条件下振动15 min。

表1 体外消化中人工唾液各类化学组分组成[24]Table1 Chemical composition of artificial saliva used in the in vitro digestion model[24]
1.3.3 胃液模拟消化
将装有经口腔消化后样品的50 mL离心管取出,分别加入按表2配制好的人工胃液10 mL,充分混匀后用1 mol/L的氢氧化钠溶液调节pH值至2.5,放进摇床中于37 ℃、100 r/min条件下继续振荡2 h。

表2 体外模拟消化中人工胃液的化学成分组成[25]Table2 Chemical composition of artificial gastric fluid (SGF) used in the in vitro digestion model[25]
1.3.4 肠液模拟消化
肠液模拟消化参照文献[19]。人工肠液的配制(20 mL):按照5 mL胰酶(5 mg/mL(以胰蛋白酶活力计))、2.5 mL猪胆粉溶液(8 mg/mL)、40 μL氯化钙溶液(0.3 mol/L)、0.15 mL 氢氧化钠溶液(1 mol/L)和12.31 mL水的组成配制人工肠液。将经模拟胃液消化完的样品从摇床中取出,按照20 mL胃腔样品与20 mL人工肠液混匀。最后用1 mol/L的氢氧化钠溶液调节pH值至7.0,放进摇床中于37 ℃、100 r/min条件下继续振荡2 h。
在模拟唾液、胃液和肠液3 步消化后,分别将消化液混合物在4 ℃条件下5 000 r/min离心5 min,取上清液。各个实验组分别定容至50 mL备用。
1.3.5 金钗石斛石斛碱和多糖溶出率的计算
各组消化液(P组除外)中石斛碱含量的测定:取一定量消化液于离心管中,后加入等量氯仿萃取,重复2 次后收集有机相,旋蒸后甲醇定容,加入内标萘后采用气相色谱仪按照《中华人民共和国药典》(2015版)中金钗石斛碱的测定方法进行。
各组消化液(AE、D组除外)中多糖含量的测定:取一定量消化液于离心管中,加入4 倍体积无水乙醇,混匀经醇沉冷藏1 h后,5 000 r/min离心5 min,弃去上清液,加入无水乙醇振荡离心吸去杂质,重复上述步骤2 次。将沉淀的多糖用热水定容后,参考药典中铁皮石斛多糖的测定方法(苯酚-硫酸法)进行测定,溶出率按下式计算。
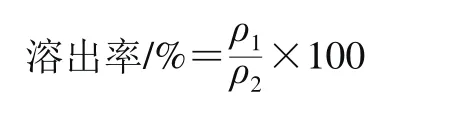
式中:ρ1为消化后上清液中石斛碱或多糖的质量浓度/(mg/mL);ρ2为消化前原料中石斛碱或多糖的质量浓度/(mg/mL)。
1.3.6 金钗石斛粗多糖消化产物的测定
将粗多糖配成2 mg/mL的溶液,按照1.3.2、1.3.3、1.3.4节的方法进行多糖在口腔、胃和肠道的模拟消化实验。取上述模拟消化反应后的样品溶液,4 800 r/min离心10 min后取上清液,用水定容到50 mL备用。然后进行模拟消化后消化产物分子质量、还原糖质量浓度和单糖组成的测定。
模拟消化物还原糖质量浓度的测定:具体方法参照《中华人民共和国药典》(2015版)中槲叶多糖含量测定中还原糖的测定方法(3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法)。精密量取多糖在口腔、胃和肠模拟消化反应后的样品溶液各2 mL,置于25 mL称量瓶中,分别加入DNS 1.5 mL,摇匀,沸水浴中加热5 min,迅速用凉水冷却,加水至刻度,摇匀后在530 nm波长处分别测定吸光度。以2 mL水同法制成空白溶液按上述步骤进行同样操作。
消化产物分子质量的测定:离心过的上清液经0.22 μm水相膜过滤,通过1525高效液相色谱仪(配2414示差折光检测器和Empower3工作站)测定其分子质量的变化。色谱条件为:色谱柱为UltrahydrogelTMLinear(7.8 mm×300 mm,10 μm);流动相为0.1 mol/L NaNO3;流速为0.9 mL/min;柱温35 ℃。
模拟多糖消化物单糖的测定:将剩余上清液全部装入5 00~1 000 Da透析袋后,将透析袋置于含有50 mL生理盐水的烧杯中,使透析时间与模拟消化时间一致。取透析袋外的液体,经0.22 μm水相膜过滤,通过阴离子色谱ICS 5000检测单糖组成。以生理盐水作为空白对照。
离子色谱条件为:C a r b o P a c PA 2 0分析柱(150 mm×3 mm,6.5 μm)和CarboPac PA 20G保护柱(30 mm×3 mm,6.5 μm);流速为0.5 mL/min;进样量25 μL;检测器工作电极为金电极;柱温箱温度为30 ℃;检测器温度为35 ℃[26]。其中,单糖混合标准溶液的配制过程如下:取岩藻糖、氨基葡萄糖、鼠李糖、阿拉伯糖、氨基半乳糖、半乳糖、葡萄糖、木糖、甘露糖、果糖和核糖标准品,用去离子水配制成3.85 mg/L的混标溶液。
1.3.7 模拟消化后金钗石斛酚类物质的成分分析
模拟消化后金钗石斛酚类物质的成分分析参照文献[27-28]。混合标准品的配制:分别精确称取适量的芸香叶苷、绿原酸、阿魏酸、对羟基苯甲酸、熊果酸、芹菜素、没食子酸、槲皮素标准品,用体积分数50%甲醇溶解,配制成混合标准溶液,使得每种标准品的质量浓度均为1 mg/mL。4 ℃条件下保存备用。
色谱条件:色谱柱为HSST3(100 mm×2.1 mm,1.8 μm);流动相A为甲醇,流动相B为水和0.1%甲酸。梯度洗脱(洗脱程序见表3);流速0.3 mL/min;柱温35 ℃。

表3 梯度洗脱参数Table3 Parameters of gradient elution procedure
质谱条件:电喷雾电离离子源(electrospray ionization,ESI)负离子模式(ESI-);离子源温度130 ℃;脱溶剂温度400 ℃;锥孔气流N2流速50 L/h;脱溶剂气流速400 L/h;碰撞气体流量0.12 mL/min;毛细管电泳电压3 500 V;载气为氦气;多反应检测(multiple reaction monitoring,MRM)模式。
1.4 数据分析
以上实验均平行进行3 次,得到的数据经SPSS 20.0软件处理,采用Dunnett’s检验进行显著性差异分析。
2 结果与分析
2.1 金钗石斛石斛碱在口腔、胃和肠道模拟消化过程中溶出率的变化
经人工模拟口腔、胃液和小肠消化后,各个实验组(除P组外)中石斛碱溶出率如图1所示。
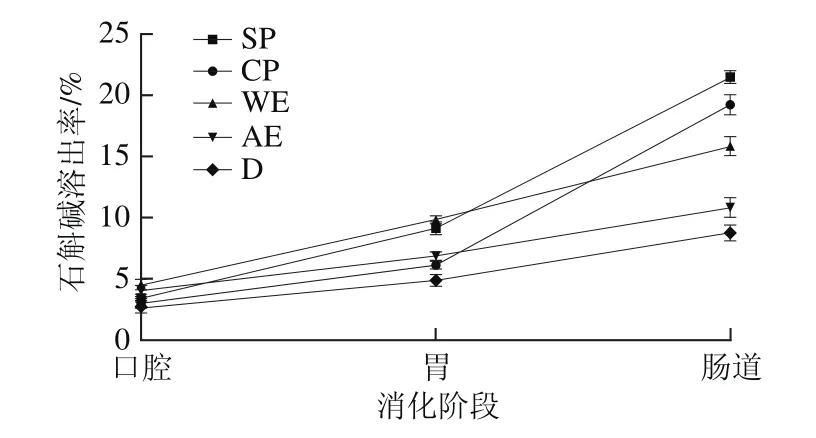
图1 金钗石斛石斛碱溶出率Fig.1 Dissolution rate of dendrobine from D. nobile
由图1中可知,在模拟唾液消化液中,石斛碱溶出率的大小依次是D<CP<SP<AE<WE;在模拟胃消化液中,石斛碱溶出率的大小依次是D<CP<AE<SP<WE;在模拟肠道消化液中石斛碱溶出率大小依次是D<A E<W E<C P<S P;各组之间均有显著性差异(P<0.05)。由此可推测,粗石斛碱在模拟消化中溶出效果较差,与醇提物相比,水提物中的石斛碱更易溶出。最终,在模拟肠道消化液中金钗石斛全粉和提取物(水提物/醇提物)的石斛碱溶出率较粗石斛碱高,且超微粉中石斛碱溶出率((21.46±0.52)%)显著高于普通粉((19.20±0.95)%)(P<0.05)。由此可以得出,金钗石斛超微粉由于粉碎颗粒粒径小,能减少有效成分的溶出阻力,提高有效组分的溶出率,同时表面积增加使金钗石斛粉颗粒分散均匀,能更好地溶解在胃肠液中,同时可以增大颗粒与胃肠黏膜的接触面积,从而有利于药物的吸收,增大药物的生物利用率[29]。
2.2 金钗石斛多糖在口腔、胃和肠道模拟消化过程中溶出率的变化
经人工模拟口腔、胃液和小肠消化后,由于金钗石斛醇提物中多糖质量分数较低,为0.19%,故本实验未考虑醇提物中多糖溶出率的变化。各个实验组(除AE与D外)中多糖溶出率变化如图2所示。
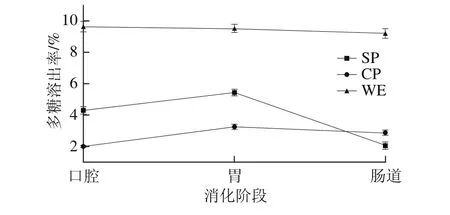
图2 金钗石斛多糖溶出率Fig.2 Dissolution rate of polysaccharide from D. nobile
由图2可知,金钗石斛超微粉在口腔和胃中的多糖溶出率分别为(4.29±0.22)%和(5.43±0.22)%,均高于金钗石斛普通粉((1.9 9±0.0 8)%和(3.25±0.16)%),并且具有显著性差异(P<0.05);说明超微粉中细胞破碎程度更大,粒径较小,使多糖溶出速率加快[30]。而肠道中超微粉的多糖溶出率反而比普通粉较低,可能是因为与普通粉相比,超微粉在模拟消化过程中多糖溶出更早地达到平衡状态且多糖链部分断裂的缘故所致[17]。金钗石斛水提物在口腔、胃和肠道模拟消化过程中多糖溶出率无明显差别,可以得出金钗石斛水提物易释放出多糖组分,在口腔中多糖溶出已达到平衡状态。
2.3 体外模拟口腔、胃和肠道对金钗石斛多糖的消化结果
2.3.1 模拟消化物多糖分子质量和还原糖质量浓度的变化
由表4可知,金钗石斛多糖经模拟唾液、模拟胃液消化的过程中分子质量逐渐减小,即从2 737 Da降低为1 425 Da和386 Da,还原糖质量浓度整体随消化时间的延长而增加(P<0.05),说明多糖分子支链产生变化,糖苷键断裂而导致分子质量降低。消化前多糖溶液中还原糖质量浓度与多糖溶液经模拟唾液消化后产物中还原糖的质量浓度无显著性差异。
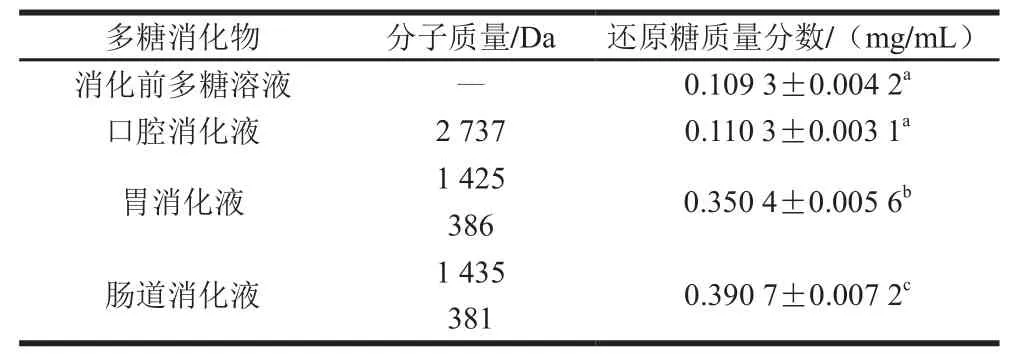
表4 金钗石斛多糖在模拟口腔、胃和肠道消化后多糖分子质量和还原糖质量浓度的变化Table4 Changes in the molecular weight of polysaccharide and reducing sugar content in D. nobile in in vitro digestion model
2.3.2 模拟消化后单糖产生情况
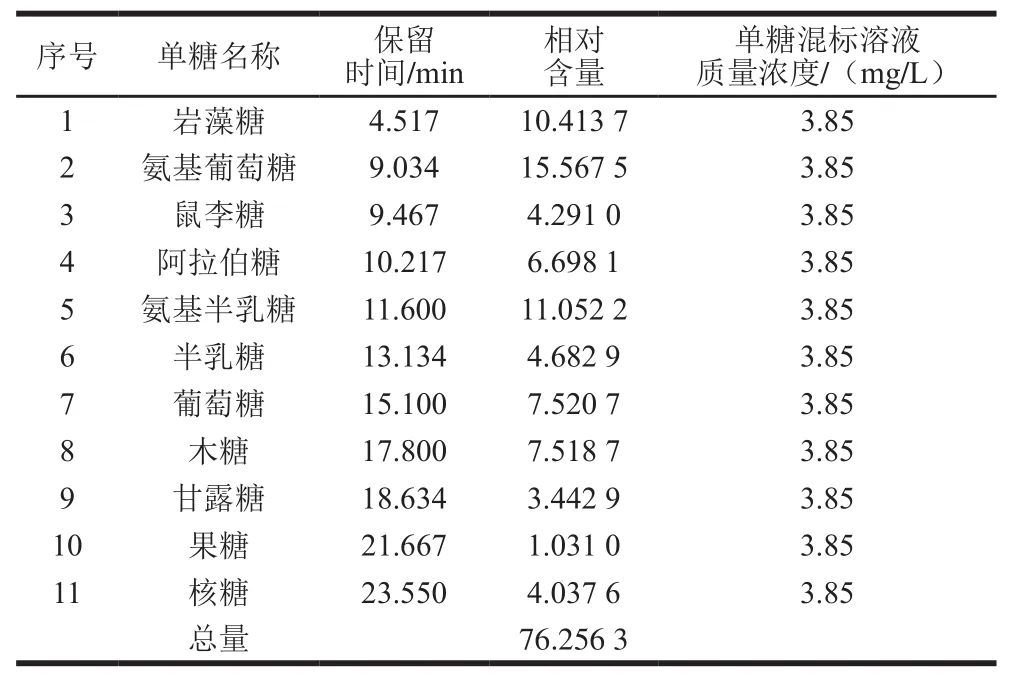
表5 单糖混合标准溶液中单糖组成及质量浓度Table5 Monosaccharide composition and concentrations of mixed standard solution
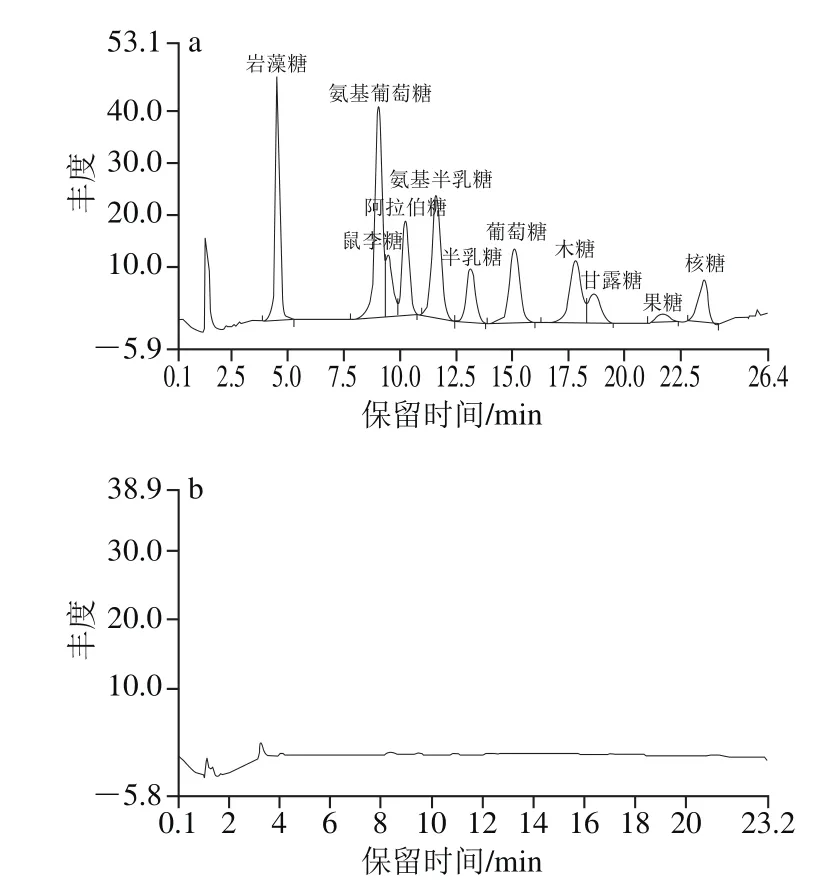
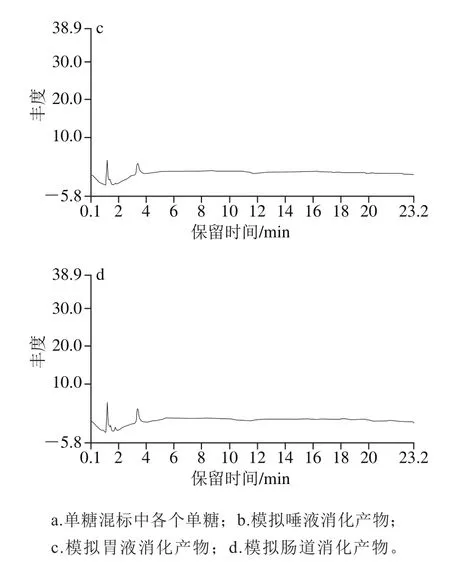
图3 金钗石斛多糖消化后的离子色谱图Fig.3 Ion exchange chromatogram of polysaccharide in in vitro digestion products of D. nobile
多糖经模拟消化后糖苷键发生断裂,可能生成了寡糖或者单糖[31],从而暴露出更多的还原末端,使得还原糖的含量增加。将消化液装入只有小分子多糖、寡糖或者单糖可以自由进出的透析袋(3 500 Da)中进行检测。由图3可知,模拟口腔、胃、肠道消化液中均没有检测到表5中11种单糖,表明消化后没有游离单糖的释放。这与张冠亚等[17]对铁皮石斛多糖体外模拟消化实验的结果是一致的。由此可知,金钗石斛多糖的空间结构复杂,主链和支链都是由糖苷键连接而成,糖苷键的断裂使多糖分子质量减小,所以其性质也可能随之发生改变[32]。
2.4 模拟消化后多酚化学成分变化情况
通过UPLC-TQD-MS分析发现,各组金钗石斛消化液中含有芸香叶苷、绿原酸、阿魏酸、没食子酸和槲皮素5 种化学物质。金钗石斛全粉(超微粉/普通粉)和提取物(水提物/醇提物)中这5 种多酚类物质的质量浓度如图4所示。
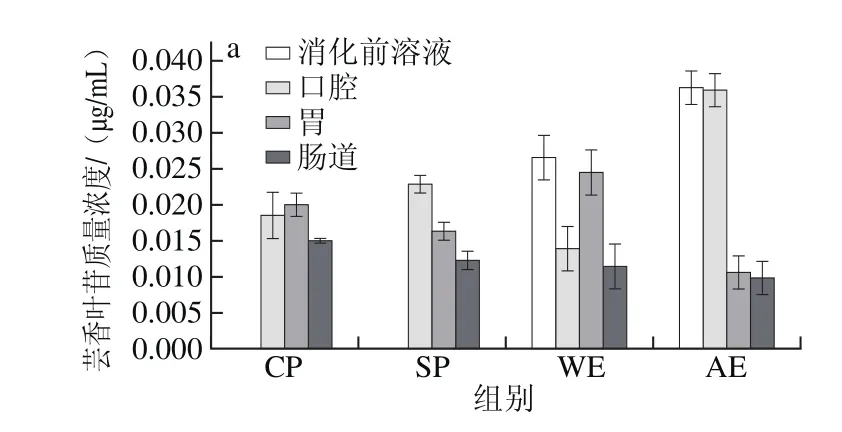
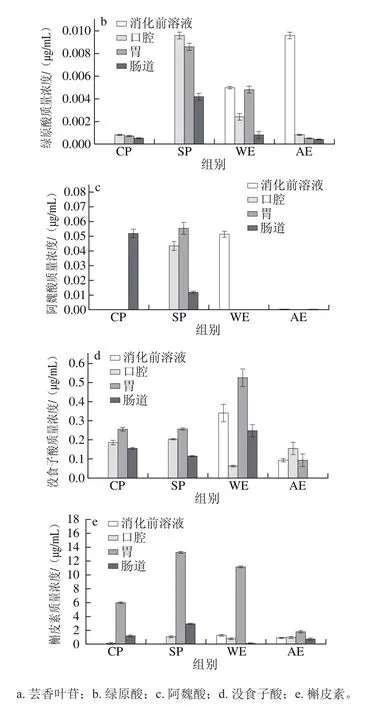
图4 金钗石斛超微粉、普通粉、水提物和醇提物模拟消化液中5 种多酚类物质的质量浓度Fig.4 Polyphenol concentrations in in vitro digestion products of D. nobile
由图4a可知,消化前水提物中芸香叶苷的质量浓度比醇提物中低,分别为0.026 5、0.036 2 μg/mL(P<0.05)。芸香叶苷在普通粉和水提物中释放缓慢,在从模拟唾液到模拟胃液的消化过程中其质量浓度不断增加,经模拟肠道消化后质量浓度降低,可能是受消化液pH值和离子、蛋白质等化学成分的影响[33]。超微粉和醇提物中芸香叶苷释放较快,且在模拟唾液、胃液和模拟肠液中质量浓度逐渐降低。由图4b可知,绿原酸在醇提物中的质量浓度(0.009 6 μg/mL)高于水提物(0.005 0 μg/mL)(P<0.05),且醇提物中绿原酸释放不完全。由图4c~e可知,醇提物中阿魏酸质量浓度(2×10-6μg/mL)较低,而在水提物中的质量浓度相对较高(0.051 μg/mL),但二者在模拟消化液中的质量浓度均很低。没食子酸和槲皮素均表现为水提物中的质量浓度高于醇提物(P<0.05)。随着消化的进行,没食子酸在模拟胃液中的质量浓度比消化前溶液中质量浓度高,可能是由原料和消化液中化学成分的转化和蛋白质、碳水化合物或者糖残基等大分子物质的裂解导致[34]。由图4还可知,金钗石斛超微粉比普通粉更易促使其中的化学成分溶出,主要因为超微粉比普通粉粉碎强度大,细胞内多糖、蛋白质、纤维素等大分子物质更易释出,且大分子物质之间彼此交联形成空间网络结构,使溶液稳定性好,利于人体消化吸收利用。
3 结 论
通过体外模拟人体消化系统(口腔、胃和小肠),分别模拟了唾液、胃液和肠液对金钗石斛超微粉、普通粉、水提物、醇提物、粗石斛碱和粗多糖的消化作用。通过模拟消化实验得出金钗石斛碱和多糖在消化过程中溶出的规律,以及石斛碱、多糖和多酚类物质在模拟消化过程中的变化。金钗石斛全粉(超微粉/普通粉)和提取物(水提物/醇提物)石斛碱在模拟肠道消化液中溶出率大小依次为金钗石斛超微粉>普通粉>水提物>醇提物>粗石斛碱。且石斛碱溶出率在整个模拟消化过程中逐渐增大。金钗石斛多糖在水提物中更易溶出,且在唾液中基本达到溶出平衡的状态,在胃和肠道中溶出率降低。金钗石斛多糖在模拟消化的过程中,在模拟胃部和肠道部分其分子质量降低,还原糖的含量也升高,但经透析后没有检测到单糖。故可以推测,金钗石斛多糖在模拟消化过程中,多糖的糖苷键部分断裂,但是没有释放出游离的单糖。多酚类物质的质量浓度在模拟胃液消化物中最高,在模拟肠道消化物中降低。
[1] 汪代芳, 侴桂新, 赵宁毅, 等. 金钗石斛茎的化学成分研究[J]. 中草药, 2012, 43(8): 1492-1495.
[2] 刘宁. 金钗石斛质量控制方法研究[D]. 北京: 北京中医药大学,2009: 7-15.
[3] 郑晓珂, 曹新伟, 匡海学. 金钗石斛的研究进展[J]. 中国新药杂志,2005, 14(7): 826-829. DOI:10.3321/j.issn:1003-3734.2005.07.007.
[4] 蔡伟. 金钗石斛化学成分和降血糖作用初步研究[D]. 北京: 北京中医药大学, 2011:20-30.
[5] 李菲, 黄琦, 冯卫生, 等. 金钗石斛提取物对肾上腺素所致血糖升高的影响[J]. 遵义医学院学报, 2008, 31(1): 11-12. DOI:10.3969/j.issn.1000-2715.2008.01.005.
[6] LEE Y H, PARK J D, BAEK N I, et al. In vitro and in vivo antitumoral phenanthrenes from the aerial parts of Dendrobium nobile[J]. Planta Medica, 1995, 61(2): 178-180. DOI:10.1055/s-2006-958043.
[7] 李旻, 刘友平, 张玲, 等. 石斛属药用植物研究进展[J]. 现代中药研究与实践, 2009, 23(5): 73-76. DOI:10.13728/j.1673-6427.2009.05.009.
[8] 陈晓梅, 郭顺星. 石斛属植物化学成分和药理作用的研究进展[J]. 天然产物研究与开发, 2001, 13(1): 70-75. DOI:10.3969/j.issn.1001-6880.2001.01.020.
[9] 张晓敏, 孙志蓉, 陈龙, 等. 金钗石斛的化学成分和药理作用研究进展[J]. 中国现代应用药学, 2014, 31(7): 895-899. DOI:10.13748/j.cnki.issn1007-7693.2014.07.033.
[10] 李明元, 邓维泽, 唐显福, 等. 金钗石斛功能性成分及保健食品开发研究现状[J]. 食品与生物技术学报, 2014, 33(12): 1233-1238.
[11] MORITA H, FUJIWARA M, YOSHIDA N, et al. New picrotoxini-type and dendrobine-type sesquiterpenoids from Dendrobium Snowflake‘RedStar’[J]. Tetrahedron, 2000, 56(32): 5801-5805. DOI:10.1016/S0040-4020(00)00530-5.
[12] 黄民权, 蔡体育, 刘庆伦. 铁皮石斛多糖对小白鼠白细胞数和淋巴细胞移动抑制因子的影响[J]. 天然产物研究与开发, 1996, 8(3): 39-41.
[13] 赵武述, 李洁. 植物多糖提取物致有丝分裂反应的分析[J]. 中华微生物学和免疫学杂志, 1992, 11(6): 381.
[14] ONE M, ITO Y, MASUOKA C, et al. Antioxidative constituents from Dendrobii Herba (stems of Dendrobium spp.)[J]. Food Technol, 1995,1(2): 115-120. DOI:10.3136/fsti9596t9798.1.115.
[15] GULLON B, PINTADO M E, FERMANDEZ-LÓPEZ J, et al. In vitro gastrointestinal digestion of pomegranate peel (Punica granatum) fl our obtained from co-products: changes in the antioxidant potential and bioactive compounds stability[J]. Journal of Functional Foods, 2015,19: 617-628. DOI:10.1016/j.jff.2015.09.056.
[16] 袁春龙, 李华, 张予林, 等. 葡萄籽超微粉在模拟人体肠胃环境中的吸收状况[J]. 中国食品学报, 2011, 11(1): 14-19. DOI:10.3969/j.issn.1009-7848.2011.01.003.
[17] 张冠亚, 黄晓君, 聂少平, 等. 体外模拟3 种消化液对铁皮石斛多糖的消化作用[J]. 食品科学, 2014, 35(23): 279-283. DOI:10.7506/spkx1002-6630-201423054.
[18] XU D X, YUAN F, GAO Y X, et al. Inf l uence of whey protein-beet pectin conjugate on the properties and digestibility of β-carotene emulsion during in vitro digestion[J]. Food Chemistry, 2014, 156(156):374-379. DOI:10.1016/j.foodchem.2014.02.019.
[19] MINEKUS M, ALMINGER M, et al. A standardised static in vitro digestion method suitable for food: an international consensus[J]. Food and Function, 2014, 5(6): 1113-1124. DOI:10.1039/c3fo60702j.
[20] LI Q, CHEN J, LI T, et al. Impact of in vitro simulated digestion on the potential health benefits of proanthocyanidins from Choerospondias axillaris peels[J]. Food Research International, 2015, 78: 378-387.DOI:10.1016/j.foodres.2015.09.004.
[21] CHEN J S, GAIKWAD V, HOLMES M, et al. Development of a simple model device for in vitro gastric digestion investigation[J].Food and Function, 2011, 2(3/4): 174-182. DOI:10.1039/c0fo00159g.
[22] POOL H, MENDOZA S, XIAO H, et al. Encapsulation and release of hydrophobic bioactive components in nanoemulsion-based delivery systems: impact of physical form on quercetin bioaccessibility[J].Food and Function, 2012, 4(1): 162-174. DOI:10.1039/c2fo30042g.
[23] WEI W, FENG L, NIE S P, et al. Structure characterization and immunomodulating effects of polysaccharides isolated from Dendrobium off i cinale[J]. Journal of Agricultural and Food Chemistry,2016, 64(4): 881-889. DOI:10.1021/acs.jafc.5b05180.
[24] GAL J Y, FOVET Y, ADIBYADZI M. About a synthetic saliva for in vitro studies[J]. Talanta, 2001, 53(6): 1103-1115. DOI:10.1016/S0039-9140(00)00618-4.
[25] BEYSSERIAT M, DECKER E A, MCCLEMENTS D J. Preliminary study of the influence of dietary fiber on the properties of oilin-water emulsions passing through an in vitro human digestion model[J]. Food Hydrocolloids, 2006, 20(6): 800-809. DOI:10.1016/j.foodhyd.2005.08.001.
[26] 闵芳芳, 聂少平, 万宇俊, 等. 青钱柳多糖在体外消化模型中的消化与吸收[J]. 食品科学, 2013, 34(21): 24-29. DOI:10.7506/spkx1002-6630-201321006.
[27] 汪丹, 蔡甜, 吴志军, 等. HPLC-ESI-Q-TOF-MS法分析金钱草颗粒的化学成分[J]. 中国药房, 2016, 27(12): 1651-1654. DOI:10.6039/j.issn.1001-0408.2016.12.23.
[28] 许文, 傅志勤, 林婧, 等. HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J]. 中国中药杂志, 2014, 39(22): 4365-4372. DOI:10.4268/cjcmm20142218.
[29] 张娥珍, 崔素芬, 辛明, 等. 铁皮石斛超微粉与普通粉物理特性的比较[J]. 热带作物学报, 2014, 35(7): 1444-1449. DOI:10.3969/j.issn.1000-2561.2014.07.033.
[30] 张娥珍, 黄梅华, 辛明, 等. 铁皮石斛纳米粉与超微粉的物理特性和体外抗氧化活性比较研究[J]. 热带作物学报, 2015, 16(12): 2184-2191. DOI:10.3969/j.issn.1000-2561.2015.12.013.
[31] 邹晓莉, 江水, 郑波, 等. 高效阴离子色谱法分离测定蜂蜜和保健食品多糖水解产物中的单糖组成[J]. 四川大学学报(医学版), 2008(5):836-838. DOI:10.3969/j.issn.1672-173X.2008.05.035.
[32] SINGH V, KUMAR P, SANGSHI R. Use of microwave irradiation in the grafting modification of the polysaccharides: a review[J].Progress in Polymer Science, 2012, 37(2): 340-364. DOI:10.1016/j.progpolymsci.2011.07.005.
[33] SAURA-CALIXTO F, SERRANO J, GOÑI I. Intake and bioaccessibility of total polyphenols in a whole diet[J]. Food Chemistry,2007, 101(2): 492-501. DOI:10.1016/j.foodchem.2006.02.006.
[34] ARGYRI K, KOMAITIS M, KAPSOKEFALOU M. Iron decreases the antioxidant capacity of red wine under conditions of in vitro digestion[J]. Food Chemistry, 2006, 96(2): 281-289. DOI:10.1016/j.foodchem.2005.02.035.

