蓝莓花色苷降解动力学及稳定性
李恩惠,矫馨瑶,王晨歌,王月华,王维生,刘 刚,李冬男,孟宪军,李 斌,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110161;2.南京师范大学地理科学学院,江苏 南京 210023;3.沈阳市皇冠蓝莓生物科技有限公司,辽宁 沈阳 110159)
蓝莓,杜鹃花科(Ericaeae)越橘属(Vaccimium)多年生木本灌木,是世界粮农组织推荐的5大健康水果之一[1-3]。蓝莓中富含抗氧化活性物质(如花色苷、多酚类、黄酮类物质),具有保健的功效,研究表明蓝莓具有降低癌症患病风险、抗炎、延缓衰老、调节血脂平衡、抑制胆固醇、消除眼睛疲劳等生理功效[4-8]。我国蓝莓资源丰富,随着蓝莓产量和产业的增加,研究者对蓝莓中的营养物质进行了探究,其中蓝莓花色苷由于具有较高的抗氧化活性而受到广泛关注。
花色苷是自然界最重要的水溶性色素之一,广泛存在于植物的花、果实、种子、和叶片中,属黄酮类多酚[9],花色苷是通过糖苷键将花青素与糖苷链接起来的一种生物活性物质,自然界已知20余种花色苷,食品中常见的分为天竺葵素、矢车菊色素、飞燕草色素,以及甲基化的芍药色素、牵牛花色素、锦葵色素,这6 种花色苷颜色随着B环上的羟基位置和数量变化而改变[10-11]。研究表明我国蓝莓主栽品种中锦葵色素-3-半乳糖苷为含量最高的花色苷[12-13]。
长期以来,蓝莓深加工产品的花色苷成分在加工和贮藏过程中,由于易降解、稳定性差,造成大量损失。前人对花色苷降解进行了大量的研究,不同处理条件、来源不同的花色苷降解动力学也不尽相同,Piga等[14]研究发现,黑橄榄盐水无氧条件下的发酵过程中花色苷在15 d内降解迅速,直至消失,其降解符合零级动力学,多数文献中报道花色苷降解满足一级动力学模型[15-16],而Özkan等[17]报道花色苷在H2O2和抗坏血酸共同作用条件下降解满足二级动力学模型。本实验针对不同pH值、温度、光照、不同体积分数的H2O2和不同质量分数Na2SO3条件下蓝莓花色苷的稳定性进行研究,同时建立降解动力学模型,为有效控制蓝莓深加工产品的花色苷降解提供理论依据。
1 材料与方法
1.1 材料与试剂
蓝莓冻果(北陆)采自辽宁沈阳棋盘山宝石皇冠蓝莓产业有限公司,挑选出无病虫害和机械损伤且成熟度一致的蓝莓果,清洗沥干后速冻,并于-80 ℃超低温冰箱中冻藏。
过氧化氢、亚硫酸钠、无水碳酸钠 国药集团化学试剂有限公司;无水乙醇、95%乙醇 天津市富宁精细化工有限公司;盐酸、氢氧化钠 西陇科学股份有限公司。
1.2 仪器与设备
DW-86L386超低温冰箱 青岛Haier集团;PHS-25酸度计 上海理达仪器厂;SB25-12DTN超声波清洗机、SCIENTZ-10N型真空冷冻干燥机 宁波新芝生物科技股份有限公司;DK-S26水浴锅 上海精宏实验设备有限公司;LS-4000UV光照箱 北京天星科仪科技有限公司;AX124ZH/E分析天平 美国OHAUS公司;SIM-F140ADL制冰机 日本Panasonic公司;JYL-Y912榨汁机 九阳股份有限公司;RE-52AA旋转蒸发器、层析柱(1.8 cm×30 cm) 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;V-5800型可见分光光度计 上海元析仪器有限公司;HL-2恒流泵 上海沪西分析仪器厂有限公司;AB-8型大孔树脂 沧州宝恩吸附材料科技有限公司。
1.3 方法
1.3.1 蓝莓花色苷冻干粉的制备
将蓝莓冻果于4 ℃下解冻过夜(12 h),榨汁机打浆破碎后,称取一定量的破碎后的蓝莓,按料液比1∶15(m/V)加入体积分数60%乙醇溶液搅匀,在40 ℃下,超声功率500 W浸提2 h,真空过滤,得到滤液,40 ℃下旋转蒸发至乙醇蒸净,得到蓝莓花色苷提取液;采用AB-8大孔树脂纯化花色苷提取液,以1 mL/min的流速进花色苷提取液,进样完全后,用5 mL/min流速5 倍柱体积的蒸馏水冲洗,后用体积分数95%的乙醇洗脱蓝莓花色苷,收集洗脱液[10],放入-80 ℃冷冻,后转入冷冻干燥机中冻干,得到纯化后的蓝莓花色苷粉末,经测得冻干粉花色苷含量为265.5 mg/g。
1.3.2 不同pH值蓝莓花色苷溶液的热处理
称取一定量的蓝莓花色苷冻干粉,配制成1 g/L的花色苷溶液,用2 mol/L盐酸和2 mol/L氢氧化钠溶液调节pH值,配制成pH值分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0的花色苷溶液,分装于7 支具塞试管中,每支试管中的花色苷溶液体积均为20 mL,分别放置在40、50、60、70、80、90 ℃的恒温水浴锅中,避光加热4 h,每隔1.0 h测定7 组花色苷含量的变化,每个实验重复3 次,取平均值。
1.3.3 蓝莓花色苷溶液的光照处理
用蓝莓花色苷冻干粉末配制质量浓度为1 g/L的花色苷溶液100 mL,调节pH值为2.0,分装于2支透光性良好的具塞试管中,每支试管中花色苷溶液体积均为40 mL。将2 支试管分别放在7 000 lx光照强度的光照箱和暗箱中,23 ℃下处理16 d,每隔2 d取样,测定2 组试管中花色苷含量,平行测定3 次,取平均值。
1.3.4 蓝莓花色苷溶液的氧化剂与还原剂处理
用蓝莓花色苷冻干粉末配制质量浓度为1 g/L的花色苷溶液100 mL,调节pH值为2.0,分装于5支透光性良好的具塞试管中,每支试管中花色苷溶液体积均为20 mL,分别向试管中加入H2O2至其体积分数为0.0%、0.5%、1.0%、1.5%、2.0%,室温避光处理1 h,每隔15 min取样,测定5 组试管中花色苷含量,平行测定3 次,取平均值。
用蓝莓花色苷冻干粉末配制质量浓度为1 g/L的花色苷溶液100 mL,调节pH值为2.0,分装于5支透光性良好的具塞试管中,每支试管中花色苷溶液体积均为20 mL,按分别向试管中加入Na2SO3至其质量分数为0.00%、0.05%、0.10%、0.15%、0.20%,室温避光处理9 h,每隔2 h取样,测定5 组试管中花色苷含量,平行测定3 次,取平均值。
1.3.5 花色苷的测定
花色苷含量采用pH示差法[18]进行测定,方法如下:取2 支20 mL试管各加入1 mL花色苷溶液,分别加入19 mL pH 1.0(准确称取3 g氯化钾用蒸馏水定容至200 mL,与0.2 mol/L盐酸溶液按照质量体积比1∶3混合)缓冲液和19 mL pH 4.5(准确称取8.2 g乙酸钠用蒸馏水定容至100 mL,加热60 mL 1 mol/L盐酸溶液和90 mL蒸馏水)缓冲液,避光静置60 min,分别检测520 nm和700 nm
波长处吸光度A520 nm,pH 1.0、A520 nm,pH 4.5、A700 nm,pH 1.0、A700nm,pH4.5,平行测定3 次。按式(1)计算吸光度A。

式中:DF为稀释因子(20);Mr为样品中主要花色苷相对分子质量(449)。
1.3.6 降解动力学计算
将式(2)带入公式(3)可以得到残留率。

式中:ρt为t时刻蓝莓花色苷的质量浓度/(mg/mL);ρ0为蓝莓花色苷的初始质量浓度/(mg/mL)。
应用零级和一级动力学模拟不同条件下花色苷的降解,根据残留率ρt/ρ0代入式(4)(零级动力学方程)和式(5)(一级动力学方程)中计算降解速率k,并进行线性回归分析,比较决定系数,确定反应级数[16]。

式中:ρ0为蓝莓花色苷的初始质量浓度/(mg/mL);t为加热时间/h;ρt为t时刻蓝莓花色苷的质量浓度/(mg/mL);k为速率常数/min-1。
蓝莓花色苷半衰期t1/2(h)根据式(6)计算[19]。

式中:Ea为活化能/(kJ/mol);R为气体常数(8.314 J/mol·K);T为绝对温度/K;K0为频率因子/min-1。
花色苷的递减时间D值/h、温度系数Q10和Z值/℃分别通过式(8)、(9)和(10)计算[20-22]。
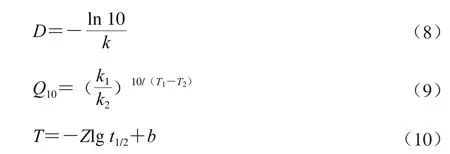
式中:T为温度/℃;k为T ℃下的降解速率/min-1;b为线性方程的截距。
1.3.7 热力学参数计算
通过方程(11)、(12)和(13)计算各温度下的焓变ΔH(kJ/mol),吉布斯自由能ΔG(kJ/mol)和熵ΔS(kJ/(mol·K))[20]。
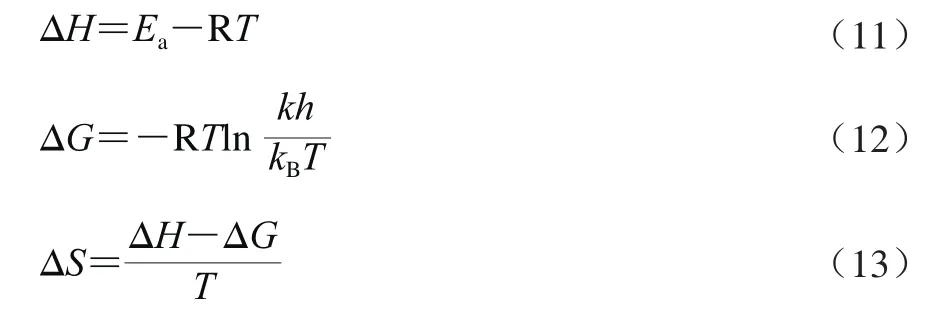
式中:Ea为活化能/(kJ/mol);h为普朗克常数(6.626 2×10-34J/s);kB为玻尔兹曼常数(1.380 6×10-23J/K);T为绝对温度/K;k为降解速率/min-1。
2 结果与分析
2.1 不同pH值、温度对蓝莓花色苷稳定性的影响
2.1.1 不同pH值、温度对蓝莓花色苷残留率的影响
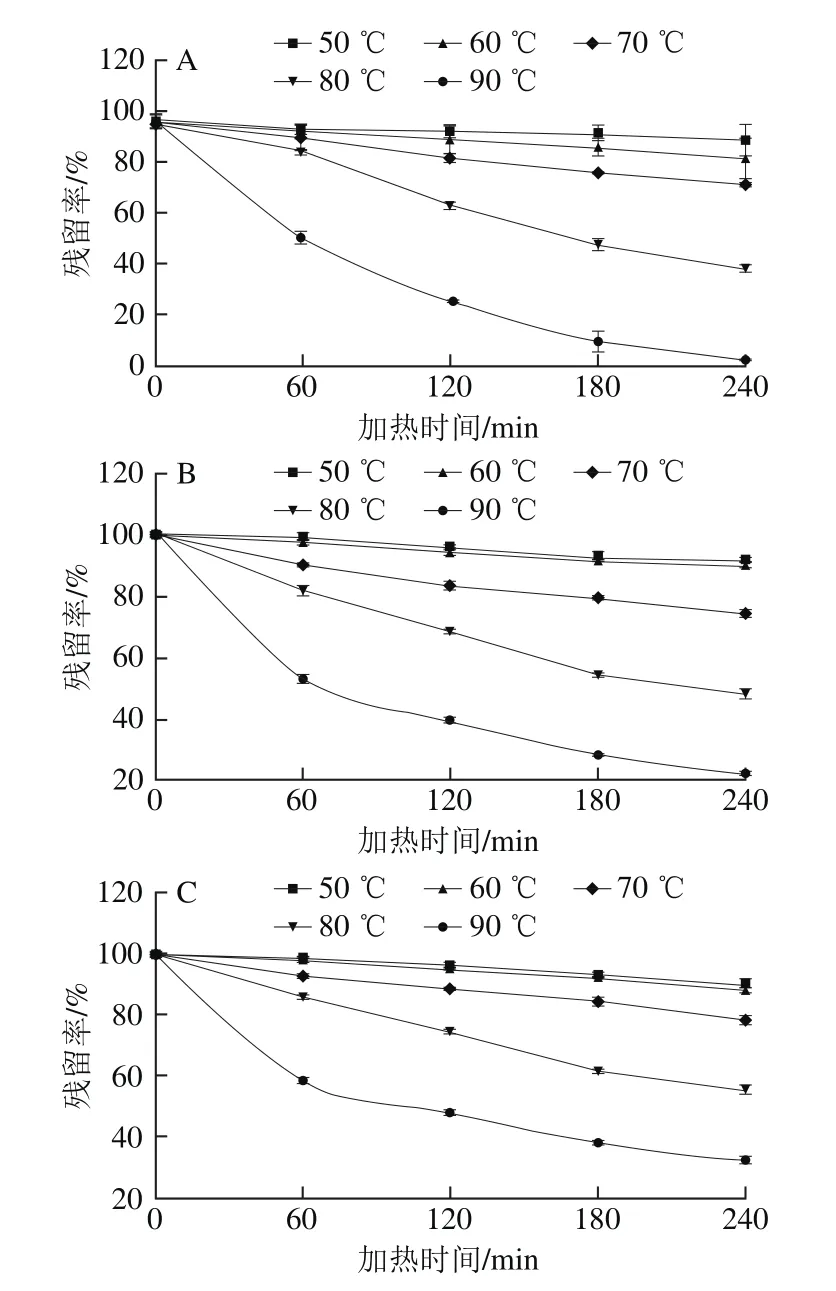

图1 不同pH值蓝莓花色苷在不同温度下加热4 h残留率变化Fig.1 Changes in residual anthocyanins at different pH during 4 h heating treatment at different temperatures
由图1可知,相同pH值的蓝莓花色苷随加热时间和加热强度的变化发生了不同程度降解,花色苷随着随着加热时间的延长不断发生降解反应,温度越高,降解越迅速。90 ℃花色苷降解明显高于其他温度。在低温条件下,随着加热时间的延长,花色苷降解缓慢。50 ℃下加热4 h,pH 1.0~7.0花色苷溶液仍分别有94.6%、91.8%、90.1%、90.5%、86.7%、79.3%、73.0%的残留。随着温度升高,90 ℃加热4 h,pH 1.0~7.0花色苷溶液仅剩有22.9%、22.8%、32.4%、22.7%、25.4%、18.3%、10.3%。结果表明低温条件有利于蓝莓花色苷的稳定。
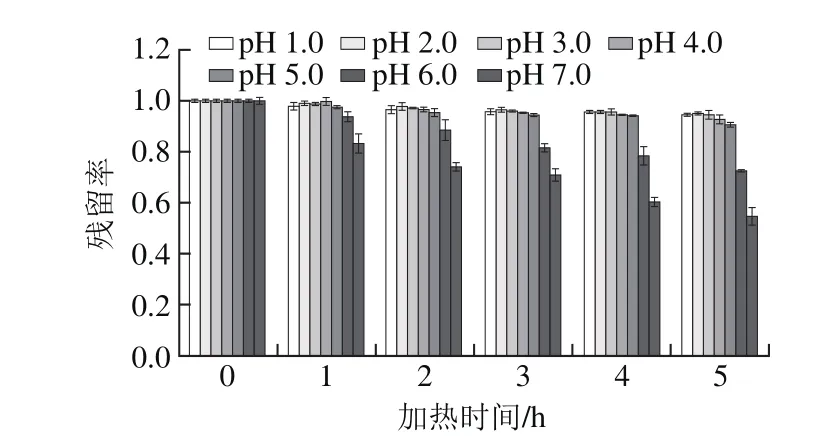
图2 不同pH值蓝莓花色苷在40 ℃下加热5 h残留率变化Fig.2 Changes in residual anthocyanins at different pH during 5 h heating treatment at 40 ℃
由图2可知,40 ℃加热5 h后,pH 1.0~7.0的蓝莓花色苷均发生不同程度的降解,pH 1.0~3.0较比pH 4.0~7.0条件下降解缓慢,其中pH 2.0在40 ℃加热5 h后花色苷降解了(5.07±0.40)%,而pH 7.0在40 ℃加热5 h后花色苷降解了(45.37±0.60)%。原因可能是在较低pH值时(pH值小于3.0),花色苷主要以稳定的花色苷阳离子形式存在,当pH 4.0~7.0时,花色苷主要以不稳定的甲醇假碱和查尔酮形式存在[23]。
2.1.2 不同pH值下蓝莓花色苷热降解动力学研究
假设本实验中花色苷降解符合零级或者一级动力学反应,根据表1中花色苷残留与时间的关系,由式(1)、(2)计算不同pH值和温度下蓝莓花色苷降解在相应反应级数下的降解速率,并进行线性回归分析,确定降解反应级数,结果见表1。

表1 蓝莓花色苷在不同pH值和温度下的零级和一级反应速率及相关系数Table1 Zero- and first-order reaction rates and correlation coefficients for degradation of blueberry anthocyanins at different pH and temperatures
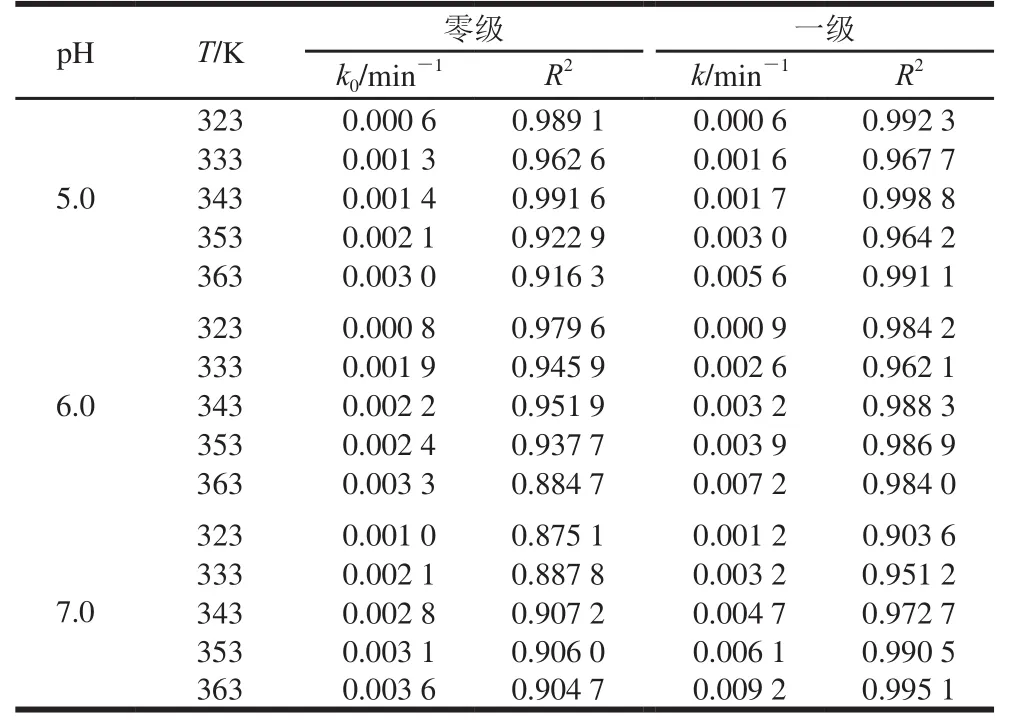
续表1
在一定pH值下,通过对比降解速率k来推断降解的快慢,比较R2判断反应级数。由表1可知,随着温度的升高,蓝莓花色苷的降解速率加大,在各温度下蓝莓花色苷的降解反应明显符合一级动力学反应特征(R2>0.9),这与曹雪丹等[15]在50、70、90 ℃加热5 h的研究结果一致。与不同来源如黑莓[24]、草莓[25]、血橙[16]中的花色苷降解动力学结果相似。
如表2所示,不同pH值条件下,蓝莓花色苷热降解速率k和半衰期t1/2受加热温度的影响。具体表现为:花色苷热降解速率k均随温度的升高而加快,同时伴随着半衰期t1/2和D值相应减小。pH 1.0~5.0时,Q10也随着温度的升高而增大,表明温度高时每升高10 ℃的处理温度会导致花色苷降解速率比温度低条件下增加更大的比例,而pH 6.0、7.0时,Q10随着温度的升高而逐渐降低,可能因为弱酸或中性条件下,花色苷结构发生改变,导致其热稳定性发生变化。pH 1.0~7.0时,反应活化能Ea为44.77~83.79 kJ/mol(符合花色苷降解活化能区间35~125 kJ/mol[26]),花色苷在pH 1.0时Ea最大且Z值最小,表明花色苷在pH 1.0时发生热降解需要能量最高,热稳定性最好。pH 6.0时Ea最小且Z值最大,热稳定性最差,花色苷降解反应对温度变化敏感性比较弱。
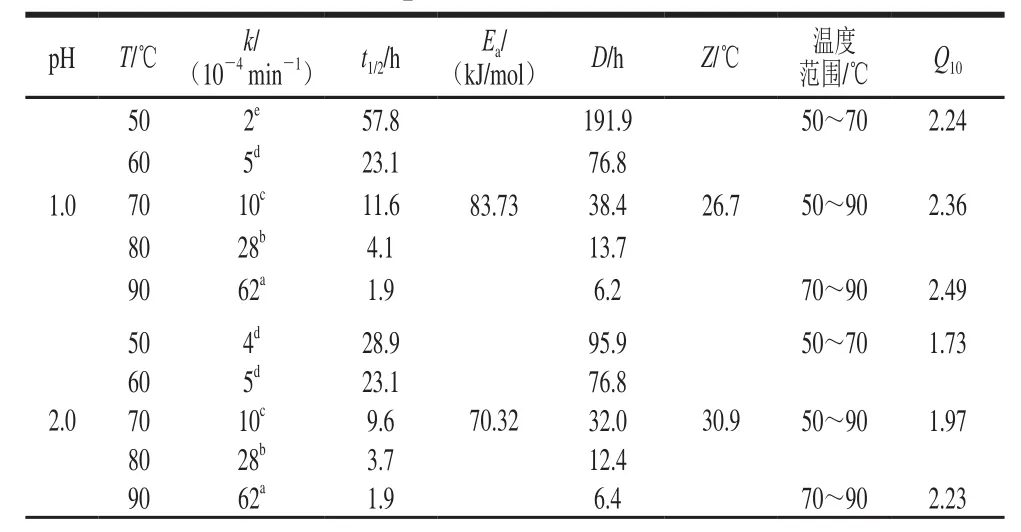
表2 不同pH值花色苷溶液在50~90 ℃加热条件下动力学参数Table2 Kinetic parameters of anthocyanin degradation at different pH and 50–90 ℃
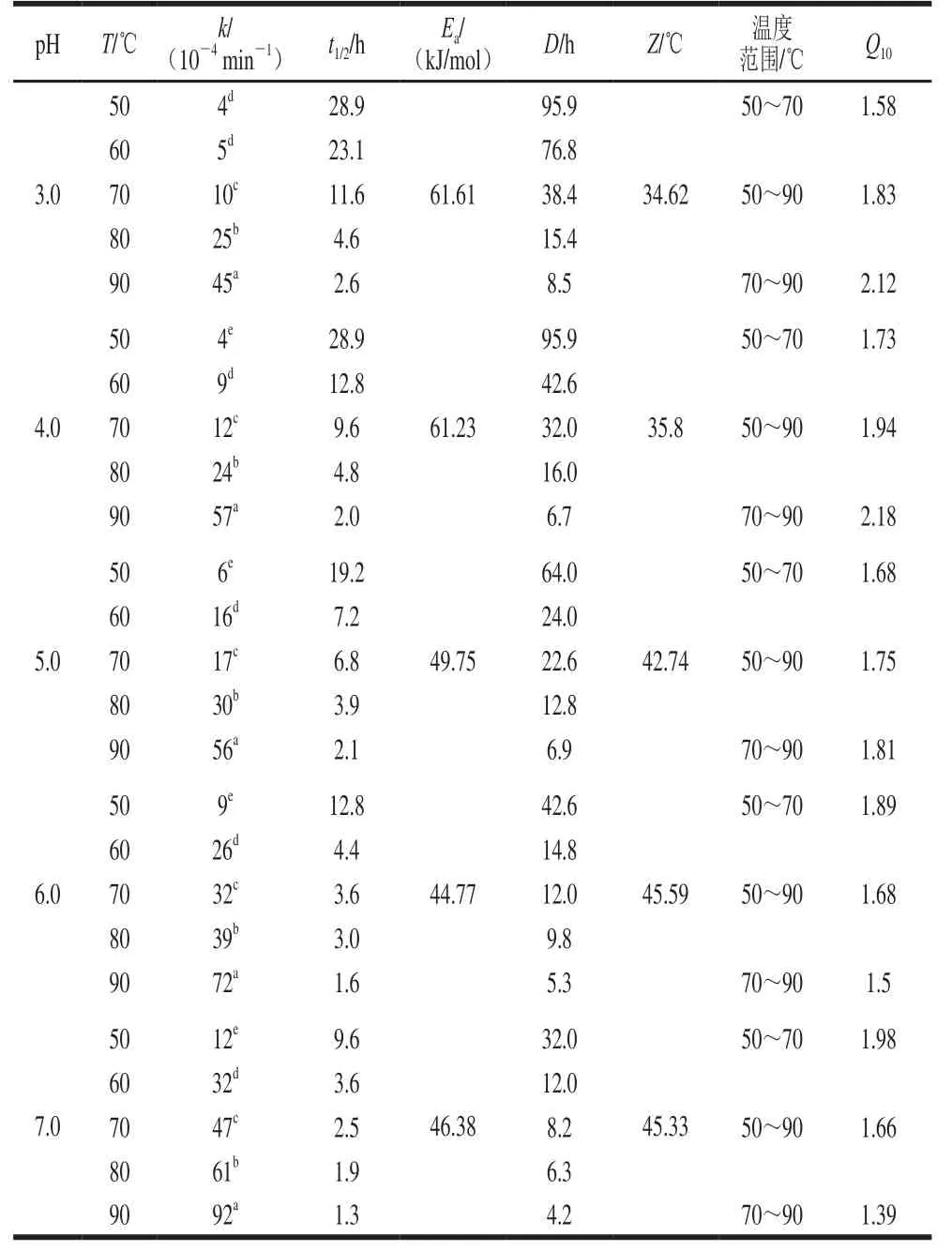
续表2
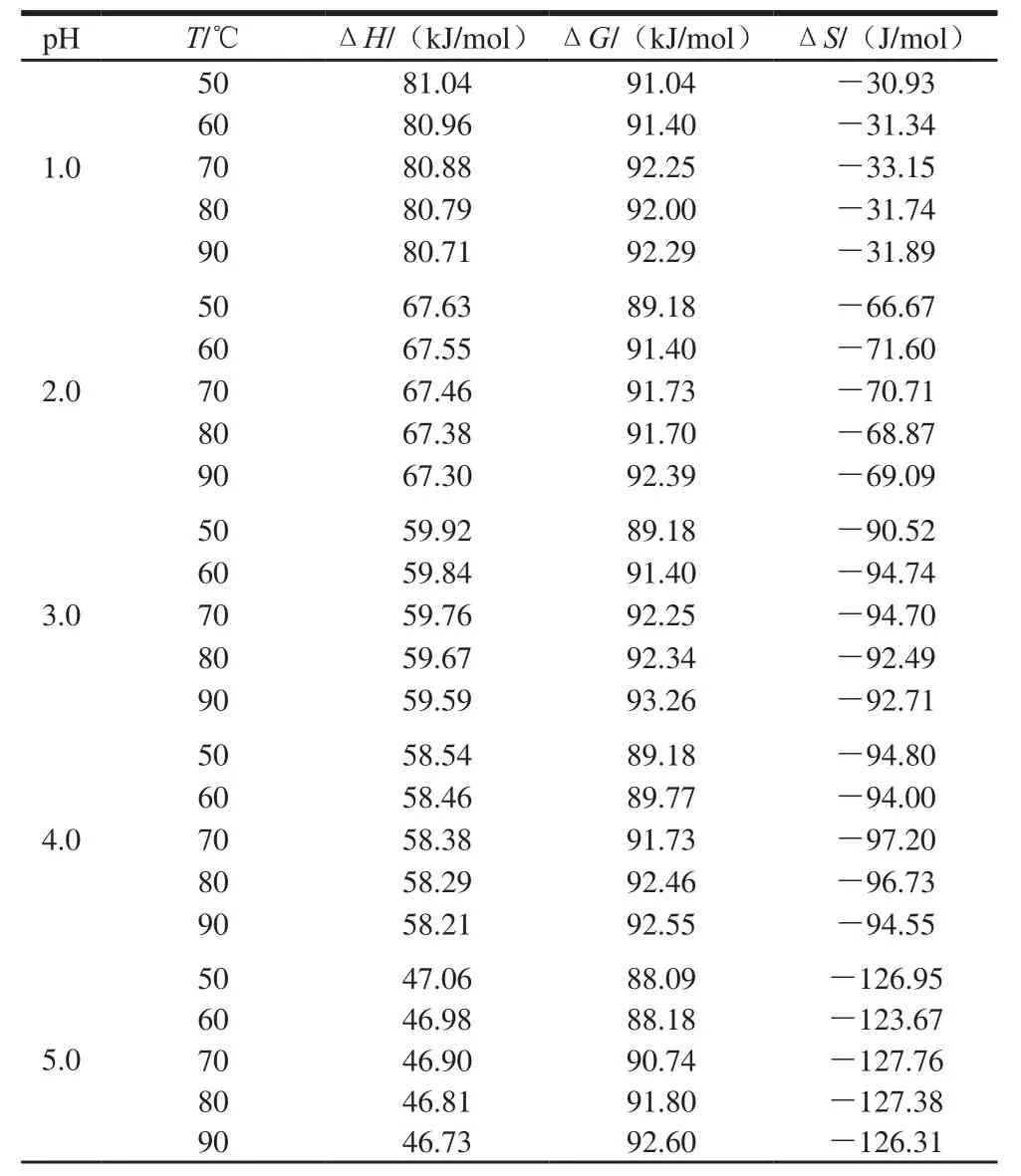
表3 不同pH值花色苷溶液在50~90 ℃加热条件下热力学参数Table3 Thermodynamic parameters of anthocyanin degradation at different pH and 50–90 ℃
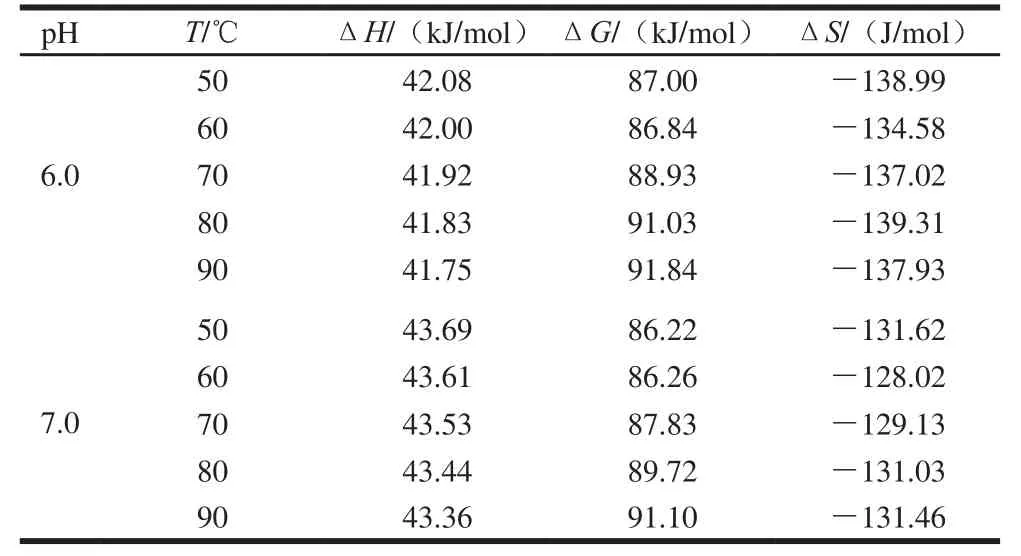
续表3
热力学参数能够深入解释热降解反应中发生的物理和化学现象。表3显示了不同pH值下花色苷的热降解的ΔH、ΔG和ΔS的变化。ΔH表示反应物和活化络合物之间的能量差,它与反应物化学键的强度有关,化学键在反应过程中会发生破裂和结合,ΔH越小势能势垒越低有利于活化复合物的形成[27]。如表3所示,相同pH值下,蓝莓花色苷热降解的ΔH在不同温度下相似,这表明在一定范围内的温度变化不影响蓝莓花色苷的降解的ΔH,也就是说降解的能量势垒的高度与温度无关[22]。表中ΔH都是正的,表明花色苷降解反应为吸热反应[22,28],高温为花色苷降解提供了更多的能量,并加速了活化络合物的形成进程,导致达到能量屏障所需的时间缩短。
ΔG代表反应物的能量和活化状态之间的差异,通常被当作过程自发性的标准[20],蓝莓花色苷热降解的ΔG在相同pH值不同温度下变化不大(86.22~93.26 kJ/mol),这表明花色苷降解是非自发反应。
ΔS代表反应体系中分子的混乱的变化[20],它常与具有可以实际反应的能量的分子的数量有关,在相同pH值条件下,ΔS显示非常接近,表明温度变化对花色苷降解的ΔS影响较小。pH 6.0时ΔS的绝对值从137.93~138.99 J/mol,显著高于pH 1.0时ΔS的绝对值30.93~31.89 J/mol,证明了pH 6.0时对热敏感,pH 1.0时热稳定性高。活化的复合物和试剂之间的状态的ΔS值反映了反应系统到其自身的热力学平衡的距离。较低的活化熵意味着物质刚刚通过了初始结构的某种物理或化学重排,使其达到接近其自身热力学平衡的状态。另一方面,当活化熵值增高时,物质将远离其自身的热力学平衡[29]。因此,表3中ΔS均为负值,表明活化络合物的结构自由度低于反应物。在酸性条件下,初始系统和热力学平衡之间的距离缩短,这导致花色苷降解的发生的可能性降低。
2.2 光照对蓝莓花色苷稳定性的影响
图3显示,pH 2.0、23 ℃下蓝莓花色苷对光照比较敏感,随着光照时间的延长,花色苷的含量均出现一定程度的降低,从第6天开始降低明显。7 000 lx光照处理16 d后,蓝莓花色苷损失了21.25%。而避光条件下贮藏16 d,花色苷损失了15.85%。实验采用7 000 lx光照射,强光使蓝莓花色苷2、4位碳原子活性增强,易受到亲水攻击发生降解。在7 000 lx光照射、避光条件下花色苷的降解均符合一级反应动力学方程,降解速率分别为0.014 8、0.009 6 d-1,半衰期分别为47、72 d。与Ochoa等[30]发现光照对树莓、樱桃中花色苷的降解为一级动力学结论一致。
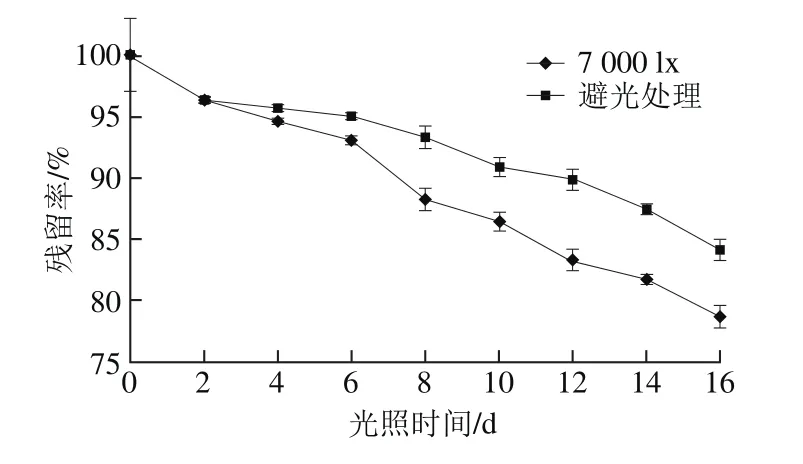
图3 光照对蓝莓花色苷残留率的影响Fig.3 Effect of light on residual rate of anthocyanins
2.3 H2O2对蓝莓花色苷稳定性的影响
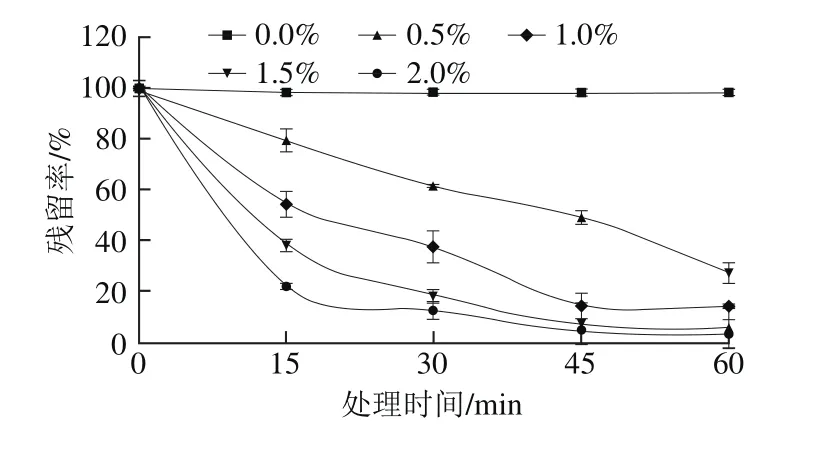
图4 H2O2对蓝莓花色苷残留率的影响Fig.4 Effect of H2O2 on residual rate of anthocyanins
由图4可以看出,不同体积分数的H2O2对蓝莓花色苷的残留率均有较大影响,随着H2O2体积分数增大,花色苷的残留率下降越快,当2.0%的H2O2处理1 h后花色苷仅剩3%,几乎全部降解。在H2O2处理条件下,花色苷降解符合一级动力学方程,0.0%~2.0% H2O2条件下花色苷降解速率k分别为0.000 4、0.020 4、0.034 7、0.050 5、0.057 4 min-1,半衰期t1/2分别为1 732、34、20、14、12 min。不同于Özkan等[31]研究H2O2降解草莓花色苷一级动力学中的降解速率k。
2.4 Na2SO3对蓝莓花色苷稳定性的影响
由图5可以看出,不同质量分数的Na2SO3对蓝莓花色苷残留率影响不同。加热9 h后,0.20% Na2SO3组比对照0.00% Na2SO3组的花色苷残留率升高了0.80%,而加入0.05%、0.10%、0.15%花色苷残留率降低了0.40%、3.60%、1.10%,结果表明不同质量浓度的对花色苷稳定性影响不同,Na2SO3质量分数为0.20%时对花色苷有一定的保护作用,而其他3 个质量分数均促进了花色苷的降解。

图5 Na2SO3对蓝莓花色苷残留率的影响Fig.5 Effect of Na2SO3 on residual rate of anthocyanins
3 结 论
通过研究不同pH值、温度、光照、H2O2和Na2SO3处理条件对蓝莓花色苷含量的变化,模拟动力学模型,分析不同条件下蓝莓花色苷的降解情况,为蓝莓深加工产品的花色苷降解提供理论依据,具体得出以下结论:
不同pH值的蓝莓花色苷热稳定性均较差,其中pH 6.0时花色苷对热最为敏感,pH 1.0时花色苷热稳定性最强,酸性条件下蓝莓花色苷热稳定性强于弱酸和中性;蓝莓花色苷热降解均符合一级动力学模型,相同pH值其降解速率随着温度的升高而升高,半衰期和D值随着温度的升高而降低,不同pH值下的活化能也不相同,pH 6.0时Ea最小为44.77 kJ/mol,pH 1.0时活化能最大为83.73 kJ/mol,通过热力学分析得到花色苷热降解为吸热非自发反应。
光照会加快蓝莓花色苷的降解,花色苷在光照条件下降解符合一级动力学方程,降解速率为0.014 8 d-1,半衰期为47 d。
H2O2会加快花色苷的降解速率,花色苷在H2O2处理条件下符合一级动力学方程,0.5%、1.0%、1.5%、2.0%的降解速率分别为0.020 4、0.034 7、0.050 5、0.057 4 min-1,半衰期分别为34、20、14、12 min。
N a2S O3对花色苷的含量影响不显著,加入0.2% Na2SO3的花色苷残留率升高了0.80%,而加入0.05%、0.10%、0.15% Na2SO3的花色苷残留率降低。
[1] 严红光, 张文华, 丁之恩. 兔眼蓝莓花青素稳定性研究[J]. 食品工业科技, 2013, 34(13): 119-124. DOI:10.13386/j.issn1002-0306.2013.13.042.
[2] 李斌, 雷月, 孟宪军, 等. 蓝莓营养保健功能及其活性成分提取技术研究进展[J]. 食品与机械, 2015, 31(6): 251-254. DOI:10.13652/j.issn.1003-5788.2015.06.059.
[3] NORBERTO S, SILVA S, MEIRELES M, et al. Blueberry anthocyanins in health promotion: a metabolic overview[J].Journal of Functional Foods, 2013, 5(4): 1518-1528. DOI:10.1016/j.jff.2013.08.015.
[4] 赵秀玲. 蓝莓的成分与保健功能的展望研究[J]. 中国野生植物资源,2011, 30(6): 19-23.
[5] TEREFE N T, DELON A, VERSTEEG C. Thermal and high pressure inactivation kinetics of blueberry peroxidase[J]. Food Chemistry,2017, 232: 820-826. DOI:10.1016/j.foodchem.2017.04.081.
[6] TAN Dehong, LIU Yunen, SHI Lin, et al. Blueberry anthocyaninsenriched extracts attenuate thecyclophosphamide-induced lung toxicity[J]. Chemico-Biological Interaction, 2014, 222: 106-111.DOI:10.1016/j.cbi.2014.10.002.
[7] 李颖畅, 李冰心, 孟良玉, 等. 圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J]. 食品科学, 2012, 33(9): 105-109.
[8] 韩斯, 孟宪军, 汪艳群, 等. 不同品种蓝莓品种品质特性及聚类分析[J].食品科学, 2015, 36(6): 140-144. DOI:10.7506/spkx1002-6630-201506026.
[9] DELGADO-VARGAS F, JIMÉNEZ A R, PAREDES-LÓPEZ O. Natural pigments: carotenoids, anthocyanins, and betalains:characteristics, biosynthesis, processing, and stability[J]. Critical Reviews in Food Science & Nutrition, 2000, 40(3): 173-289.DOI:10.1080/10408690091189257.
[10] REIN M. Copigmentation reactions and color stability of berry anthocyanins[D]. Helsinki: University of Helsinki, 2005: 10-14.
[11] 宋会歌, 刘美艳, 董楠, 等. 食品中花色苷降解机制研究进展[J]. 食品科学, 2011, 32(13): 355-359.
[12] LI Dongnan, MENG Xianjun, LI Bin. Profiling of anthocyanins from blueberries produced in China using HPLC-DAD-MS and exploratory analysis by principal component analysis[J]. Journal of Food Composition and Analysis, 2016, 47: 1-7. DOI:10.1016/j.jfca.2015.09.005.
[13] 李颖畅. 蓝莓花色苷的提取纯化及生理功能研究[D]. 沈阳: 沈阳农业大学, 2008: 34-66.
[14] PIGA A, DEL CARO A, PINNA I, et al. Anthocyanin and colour evolution in naturally black table olives during anaerobic processing[J]. LWT-Food Science and Technology, 2005, 38: 425-429. DOI:10.1016/j.lwt.2004.06.011.
[15] 曹雪丹, 方修贵, 赵凯, 等. 蓝莓汁花色苷热降解动力学及抗坏血酸对其热稳定性的影响[J]. 中国食品学报, 2013, 13(3): 47-54.DOI:10.16429/j.1009-7848.2013.03.023.
[16] 曹少谦. 血橙花色苷结构及其在加工过程中的降解机制研究[D]. 武汉: 华中农业大学, 2009: 64-77.
[17] ÖZKAN M, YEMENICIOGLU A, ASEFI N, et al. Degradation kinetics of anthocyanins from sour cherry, pomegranate, and strawberry juices by hydrogen peroxide[J]. Journal of Food Science,2002, 67(2): 525-529. DOI:10.1111/j.1365-2621.2002.tb10631.x.
[18] LEE J, RENNAKER C, WROLSTAD R E. Correlation of two anthocyanin quantification methods: HPLC and spectrophoto-metric methods[J]. Food Chemistry, 2008, 110(3): 782-786. DOI:10.1016/j.foodchem.2008.03.010.
[19] FOGLER H S. Elements of chemical reaction engineering[M]. 4th ed.New Jersey: Prentice Hall, 2005: 79-98.
[20] MERCALI G D, JAESCHKE D P, TESSARO I C, et al. Degradation kinetics of anthocyanins in acerola pulp: comparison between ohmic and conventional heat treatment[J]. Food Chemistry, 2013, 136: 853-857. DOI:10.1016/j.foodchem.2012.08.024.
[21] KECHINSKI C P, GUIMARÃES P V R, NOREÑA C P, et al.Degradation kinetics of anthocyanin in blueberry juice during thermal treatment[J]. Journal of Food Science, 2010, 75(2): 173-176.DOI:10.1111/j.1750-3841.2009.01479.x.
[22] MERCALI G D, GURAK P D, SCHMITZ F, et al. Evaluation of nonthermal effects of electricity on anthocyanin degradation during ohmic heating of jaboticaba (Myrciaria caulif l ora) juice[J]. Food Chemistry,2015, 171: 200-205. DOI:10.1016/j.foodchem.2014.09.006.
[23] 孙建霞, 张燕, 胡小松, 等. 花色苷的结构稳定性与降解机制研究进展[J]. 中国农业科学, 2009, 42(3): 996-1008.
[24] 张丽霞. 黑莓花色苷降解与辅色及抗氧化活性研究[D]. 南京: 南京农业大学, 2012: 65-77.
[25] 王梦泽. 草莓浑浊汁稳定性及品质降解动力学研究[D]. 杨凌: 西北农林科技大学, 2010: 41-45.
[26] YANNIOTIS S, TAOUKIS P, STOFOROS N G, et al. Advances in food process engineering research and applications[M]. New York:Springer, 2011: 489-497.
[27] PERON D V, FRAGA S, ANTELO F. Thermal degradation kinetics of anthocyanins extracted from juçara (Euterpe edulis Martius)and “Italia” grapes (Vitis vinifera L.), and the effect of heating on the antioxidant capacity[J]. Food Chemistry, 2017, 237: 836-840.DOI:10.1016/j.foodchem.2017.04.088.
[28] SILVA N L, CRISPIM J M S, VIEIRAL R P. Kinetic and thermodynamic analysis of anthocyanin thermal degradation in acerola(Malpighia emarginata D.C.) pulp[J]. Journal of Food Processing and Preservation, 2017, 41: e13053.
[29] GEORGIEVA V, ZVEZDOVA D, VLAEV L. Non-isothermal kinetics of thermal degradation of chitosan[J]. Chemistry Central Journal, 2012, 6: 81. DOI:10.1007/s10973-012-2359-6.
[30] OCHOA M R, KESSELER A G, DE MICHELIS A, et al. Kinetics of colour change of raspberry, sweet (Prunus avium) and sour (Prunus cerasus) cherries preserves packed in glass containers: light and room temperature effects[J]. Journal of Food Engineering, 2001, 49: 55-62.DOI:10.1016/S0260-8774(00)00184-9.
[31] ÖZKAN M, YEMENICIOGLU A, CEMEROGLU B. Degradation of variousfruit juice anthocyanins by hydrogen peroxide[J]. Food Research International, 2005, 38: 1015-1021.

