QuEChERS-气相色谱-串联质谱法测定蔬菜中35 种多氯联苯
谢思思,卢俊文,李 蓉*,张宪臣,张朋杰,容裕棠,陈丽斯,谢丽芳
(中山出入境检验检疫局检验检疫技术中心,广东 中山 528400)
多氯联苯(polychlorinated biphenyls,PCBs)又称氯化联苯,是联苯在不同程度上氯原子取代的合成品,是一种广泛存在的环境污染物,在环境中的分解速率缓慢且可以通过食物链富集,是一类典型的持久性有机污染物[1-2]。PCBs由于其化学性质稳定、电导率低、导热性好、不易燃等性质,曾被广泛应用于电力、油漆、塑料、化工等行业,直到1968年日本的“米糠油”事件引起人们对PCBs环境污染问题的关注,PCBs因其高毒性、环境持久性、生物蓄积性及挥发迁移性等特点[3],给人体健康和生态系统造成潜在的威胁,才逐渐禁止生产及应用。PCBs具有致癌、致畸、致突变的“三致”作用[4],由于其难溶于水、易溶于脂肪和有机溶剂,且性质稳定,难分解,会在生物体内富集,可通过食物链放大逐级传递,危害人类及动物的健康。目前在水质、土壤、大气、动植物等介质中均发现PCBs污染[5]。膳食暴露是PCBs进入人体的主要渠道,Xing Guanhua等[6-8]研究表明,由于PCBs的亲脂性,蔬菜中PCBs残留量远低于肉类,但叶类蔬菜的生物可利用度为却远高于肉类(蔬菜可利用度为25%,肉类仅为3%)。目前仅GB 2762—2017《食品中污染物限量》中明确了水产动物及其制品中PCBs限量要求,最大限量为0.5 mg/kg,但没有蔬菜中PCBs的相关限量,且现行的国家标准、地方标准以及行业标准中涉及的多为动物源性食品及环境介质,没有关于蔬菜中PCBs残留量测定的标准。因此,蔬菜类等非动物源性食品的PCBs残留检测也应引起足够的重视。
目前关于PCBs的研究主要集中在环境中的土壤、水体、大气以及食品中的水产品等基质,测定方法主要有气相色谱法[9-14]、气相色谱-质谱法[15-19]、气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)法[20-24]和高效液相色谱法[25]等。而PCBs由于氯原子在联苯上的取代位置不同,同一分子式下具有多种同分异构体,而大多数的同分异构体均具有相似的化学性质,单纯地利用GC法或高效液相色谱法进行分离测定很容易出现假阳性的结果。MS/MS是指质量分离的质谱检测技术,具有组分分离、结构解析同步完成的特点,可以直接分析混合组分,有高度的选择性和可靠性[26]。多级质谱比单级质谱具有更高的灵敏度,MS/MS常用于复杂样品的痕量分析。艾连锋等[27]用快速溶剂萃取-固相萃取柱净化结合GC-MS/MS测定牛奶中的PCBs及多环芳烃,方法定量下限为1.0 ng/g。郑群雄等[28]使用索氏提取,浓硫酸结合Florisil固相萃取柱净化,GC-MS/MS方法测定蔬菜中19 种PCBs,方法检出限为0.04~0.43 μg/kg。崔立迁等[29]使用正己烷-丙酮提取,浓硫酸结合硅胶柱净化后,经GC-MS/MS测定艾叶中19 种有机溶剂和PCBs残留。这些前处理方法繁琐、溶剂使用量大、处理时间长,特别是使用硅胶柱净化,不利于大批量的样品检测。QuEChERS[30](quick, easy,cheap, effective, rugged and safe)具有快速、简单、廉价、有效、可靠及安全等特点,广泛应用于蔬菜、谷物等基质中多种农药残留的样品前处理。目前王彬[31]使用QuEChERS结合GC法测定鱼肉中的PCBs;蔡小虎等[32]使用QuEChERS-GC/电子捕获检测器法分析土壤和沉积物中残留有机氯农药和PCBs,鲜见使用QuEChERS结合GC-MS/MS法进行测定蔬菜中PCBs残留量研究的相关文献报道。因此,采用QuEChERS对样品进行前处理,利用GC-MS/MS法分别得到PCBs的一、二级质谱图以及相对应的母离子、子离子,建立测定蔬菜中PCBs残留量的方法。
1 材料与方法
1.1 材料与试剂
菜心、上海青、生姜、西红柿、生菜等蔬菜样品来自国内市场。
乙腈、乙酸乙酯、正己烷(均为色谱纯)、无水硫酸镁、无水硫酸钠(分析纯,使用前在650 ℃马弗炉内灼烧4 h) 飞世尔实验器材(上海)公司;丙酮(色谱纯) 美国霍尼韦尔公司;二氯甲烷、乙酸(分析纯)广州化学试剂公司;异辛烷(分析纯) 上海凌峰化学试剂有限公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)、十八烷基硅烷键合硅胶(ostadecylsilane,C18)、石墨化炭黑(graphitized carbon black,GCB)、中性氧化铝、QuEChERS提取包(含4 g硫酸镁,1 g氯化钠,0.5 g柠檬酸氢二钠,1 g柠檬酸钠)德国CNW公司;35 种PCBs和PCB101-D3标准品(纯度>95.0%) 德国Dr. Ehrenstorfer公司。
1.2 仪器与设备
TSQ 8000 Evo GC-MS/MS(配Xcalibur数据处理系统)、ST 40R离心机 美国Thermo公司;MS3 basic旋涡混合器 德国IKA公司;Turbo Vap LV型氮吹仪美国Zymark公司;MMV-1000W分液漏斗振动器 上海爱朗公司;Milli-Q超纯水器 美国Millipore公司;GM200捣磨仪 德国Retsch公司。
1.3 方法
1.3.1 标准溶液的配制
PCBs标准储备液:准确称取各PCBs标准品适量,用正己烷配制成200 μg/mL的标准储备液,-18 ℃冰箱保存6 个月。
PCBs标准工作液:准确量取各PCBs标准储备液1 mL,用正己烷配制成2 μg/mL的混合标准工作液,-18 ℃冰箱保存3 个月。
PCB101-D3标准工作液(内标):准确称取各PCB101-D3标准品适量,用正己烷配制成200 μg/mL的标准储备液,-18 ℃冰箱保存6 个月。量取1 mL标准储备液,用正己烷配制成10 μg/mL的标准工作液,作为内标使用,-18 ℃冰箱保存3 个月。
混合标准工作系列溶液:准确量取PCBs混合标准工作液0.005、0.01、0.025、0.05、0.1、0.25、0.5 mL,用正己烷稀释,加入0.01 mL内标,配制成混合标准系列工作溶液。
1.3.2 GC-MS/MS测定
1.3.2.1 GC条件
色谱柱:TR-Pesticide(30 m×0.25 mm,0.25 μm);进样方式:不分流进样,流量:60 mL/min,不分流时间:1 min;流速:1.3 mL/min,进样体积:1 μL;进样口温度:280 ℃;升温程序:初始温度100 ℃,保持2 min,以30 ℃/min升到200 ℃,以3 ℃/min升到265 ℃,以20 ℃/min升到310 ℃。
1.3.2.2 MS条件
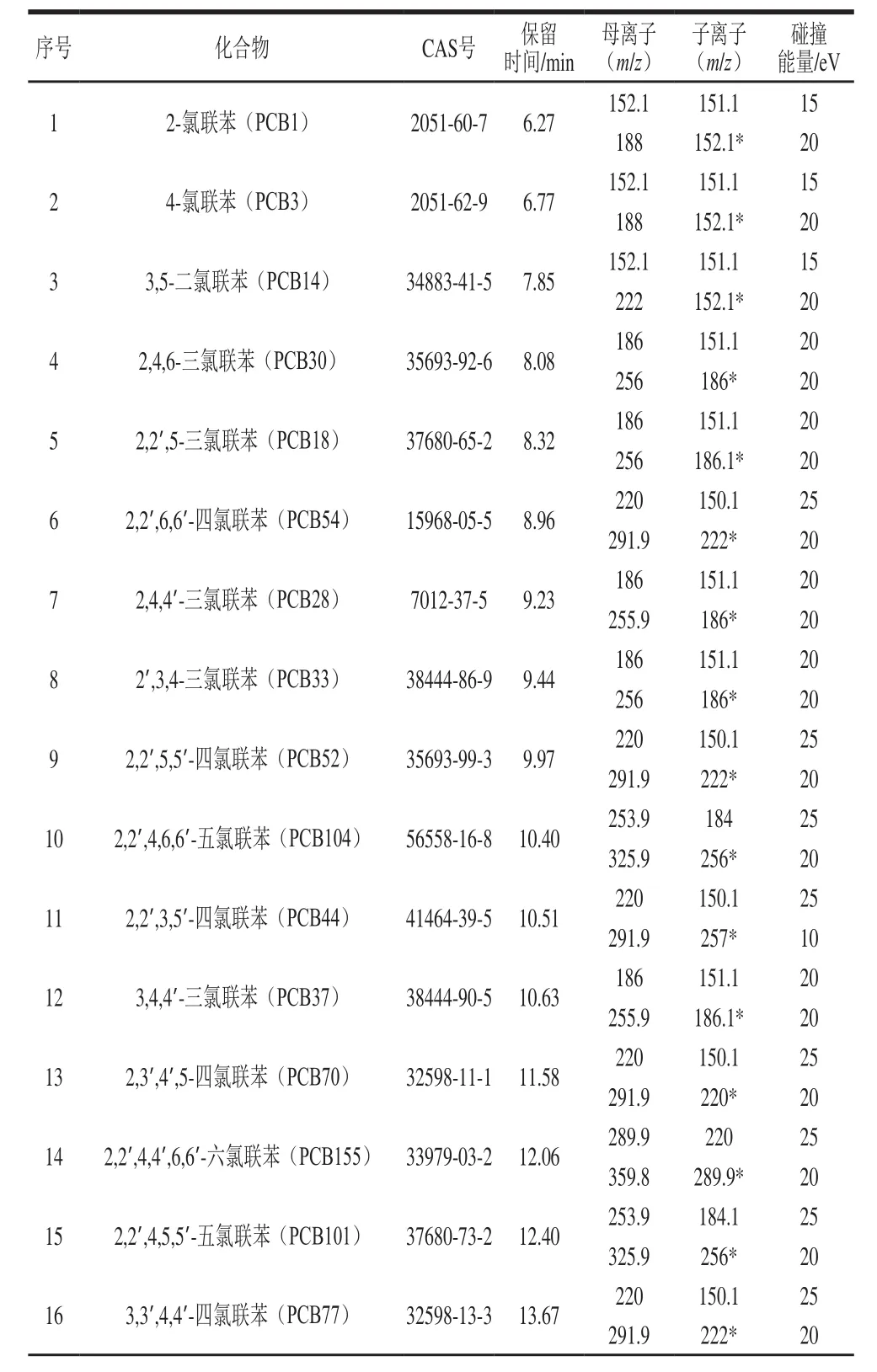
表1 35 种PCBs的选择反应监测模式分析参数Table 1 Parameters in selected reaction monitoring mode for 35 PCBs
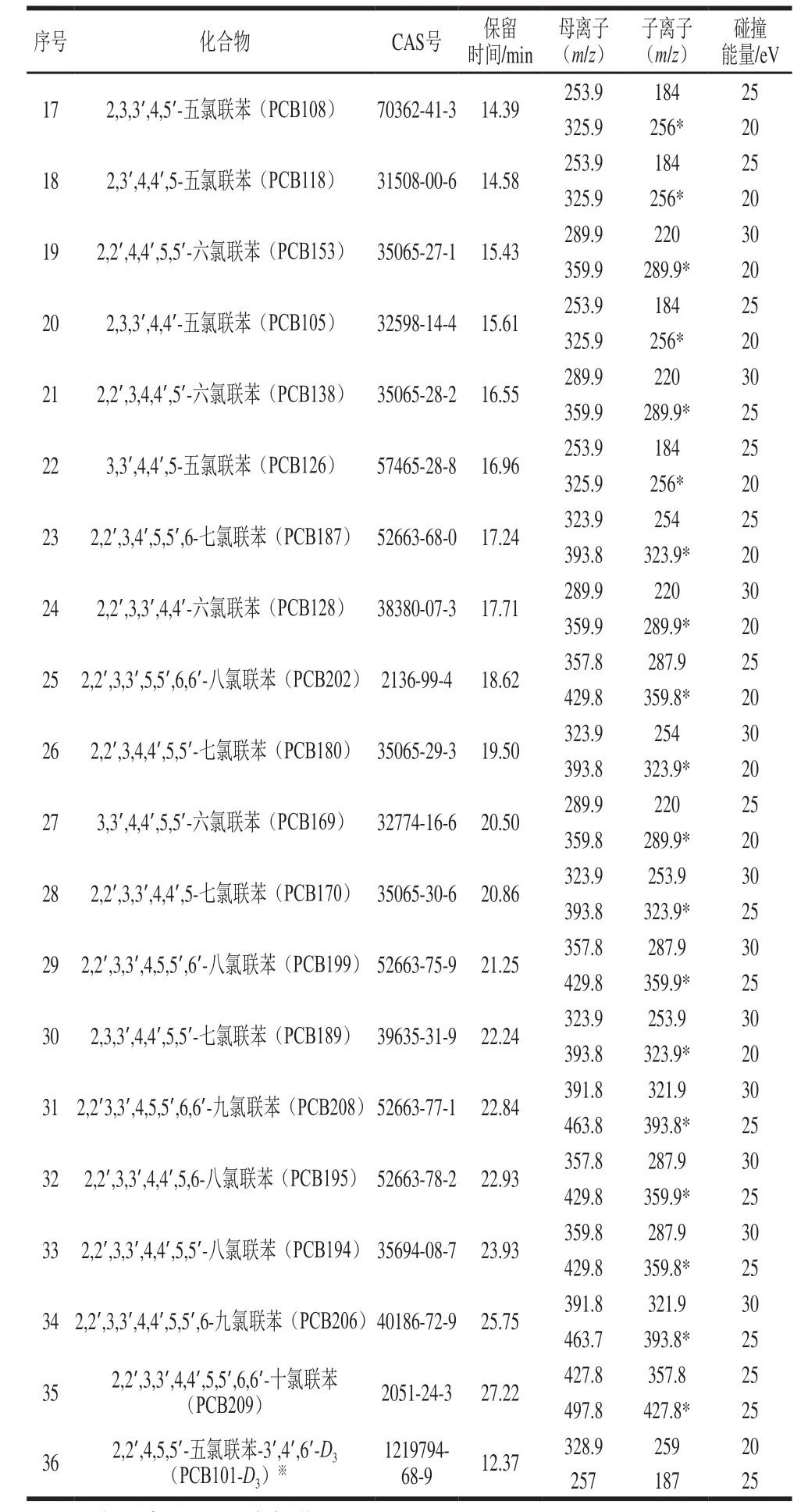
续表1
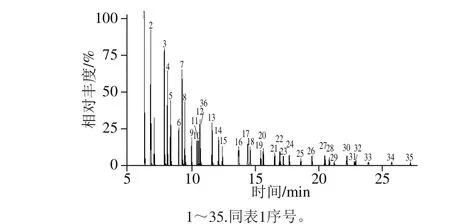
图1 35 种PCBs在选择反应监测模式下的总离子流图Fig. 1 Total ion chromatogram for 35 PCBs in selected reaction monitoring mode
方法类型:Acquistion-Timed;电离源:电子电离源;电离电压:70 eV;离子源温度:300 ℃,传输线温度:300 ℃;溶剂延迟时间:5 min;扫描模式:选择反应监测模式,其具体参数见表1,总离子流图见图1。定量方法:峰面积内标法定量。
1.3.3 样品预处理
1.3.3.1 QuEChERS提取
取适量样品于捣磨仪中粉碎,准确称取10 g样品于50 mL离心管中,加入40 μL内标标准工作液,涡旋,静置;加入20 mL乙酸乙酯,涡旋30 s,再加入QuEChERS提取包,涡旋1 min,振荡提取10 min,然后以4 500 r/min离心5 min,吸取10 mL上清液于45 ℃氮吹浓缩定容至2 mL,加入500 mg无水硫酸镁、100 mg PSA、50 mg GCB,涡旋1 min,4 500 r/min离心5 min,吸取全部上清液,12 000 r/min离心5 min,取上清液供GC-MS/MS分析。
1.3.3.2 固相萃取
取适量样品于捣磨仪中粉碎,准确称取10 g样品,加入40 μL内标标准工作液,涡旋,静置;加入20 mL乙酸乙酯,涡旋30 s,再加入10 g无水硫酸钠,涡旋1 min,振荡提取10 min,然后以4 500 r/min离心5 min,吸取10 mL上清液于已用乙酸乙酯活化好的萃取小柱中净化,净化液于45 ℃氮吹浓缩定容至2 mL,12 000 r/min离心5 min,取上清液供GC-MS/MS分析。
1.3.4 提取方法
1.3.4.1 不同基质对各组分响应值的影响
选择空白样品菜心和生姜,按1.3.3.1节QuEChERS方法进行提取,将所得的定容溶液与乙酸乙酯分别用于稀释1.3.1节标准工作液,并配制成各组分质量浓度为100 ng/mL基质标准溶液和溶剂标准溶液,考察不同基质对各组分响应值的影响。响应值以基质效应表示,考察基质效应与1的关系,基质效应越接近1,则基质对PCBs响应值的影响越小;当基质效应小于1时,基质对PCBs的响应起抑制作用,且基质效应数值越小,抑制作用越大,反之,则起增强作用。基质效应按下式进行计算:
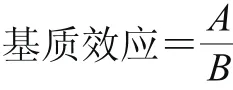
式中:A为基质标准工作液中PCBs峰面积的响应值;B为溶剂标准工作液中PCBs峰面积的响应值。
1.3.4.2 不同溶剂对各组分响应值的影响
由于不同溶剂可提取的目标物及提取效果不同,按1.3.3.1节进行QuEChERS提取,考察正己烷、正己烷-丙酮(1∶1,V/V)、丙酮、二氯甲烷、1%乙酸化乙腈、乙酸乙酯、异辛烷7 种不同提取溶剂对蔬菜中35 种待测物的提取效率。
1.3.4.3 不同净化剂对各组分响应值的影响
蔬菜中的色素、有机酸、碳水化合物等的净化程度会影响样品的回收率。目前QuEChERS方法的净化剂有GCB、C18吸附剂、PSA、中性氧化铝等,GCB主要除去蔬菜中的色素,PSA为正相硅胶键合吸附剂,可以吸附蔬菜中的碳水化合物、有机酸及少量色素,C18是反向硅胶键合吸附剂,可以吸附溶液中弱极性的干扰物如脂肪、多环芳烃等,中性氧化铝表面呈中性,容易保留杂环类(含氮、磷、硫基)、芳香烃和有机胺等富电化合物。选取GCB、C18、PSA、中性氧化铝作为净化剂,按1.3.3.1节进行QuEChERS提取,考察不同吸附剂组合A(100 mg PSA-50 mg GCB)、B(100 mg C18-50 mg GCB)、C(100 mg中性氧化铝-50 mg GCB)、D(100 mg PSA-50 mg中性氧化铝)和E(100 mg PSA-50 mg C18)对蔬菜的净化效果。
1.3.4.4 净化剂不同配比对各组分响应值的影响
同一净化剂组合,不同配比对净化的效果及目标物的回收率有不同影响。在1.3.4.3节的基础上,通过改变单一变量,即固定GCB用量为50 mg,改变PSA用量分别为0、50、100、150、200 mg;固定PSA用量为100 mg,改变GCB用量分别为0、25、50、75、100 mg进行考察,优化净化剂配比。
1.3.4.5 空白样品基质标准曲线的配制
取空白蔬菜样品,按1.3.3.1节进行提取,将所取得的基质溶液配制成内标质量浓度为100 μg/L,各组分质量浓度分别为10、20、50、100、200、500、1 000 μg/L的标准工作曲线,供GC-MS/MS检测。与此同时,取空白生菜、西红柿、生姜3 种空白样品,同时添加35 种PCBs混合标准溶液及内标物PCB101-D3,设定0.01、0.02、0.1 mg/kg三个添加水平,每个水平设置6 个平行样,按1.3.3.1节方法进行实验。
2 结果与分析
2.1 基质效应的影响结果
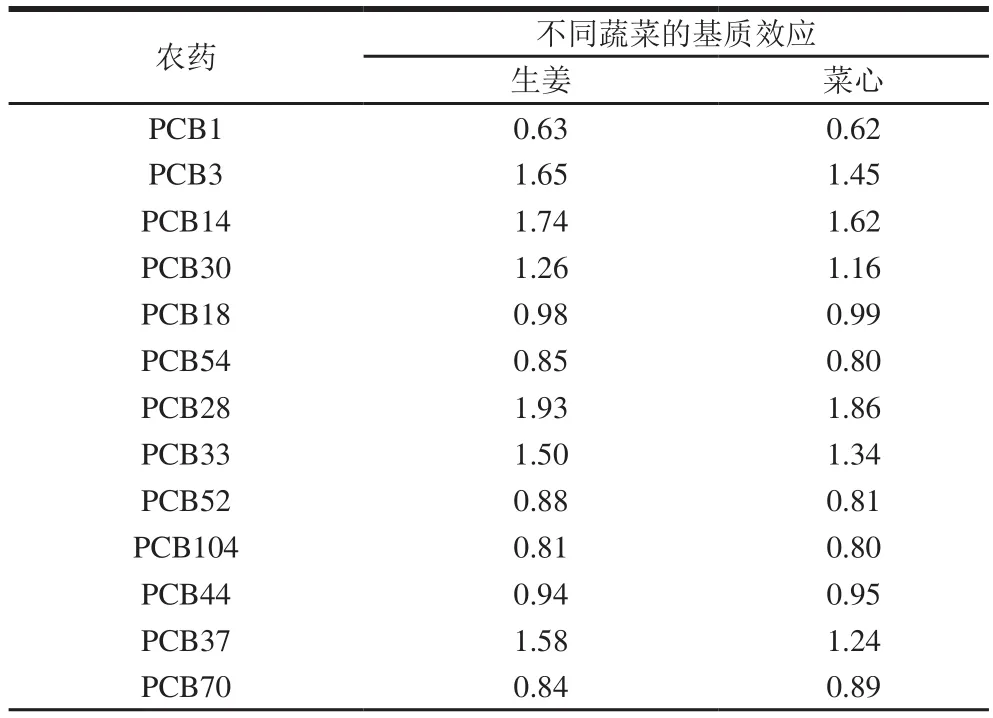
表2 2 种不同基质对PCBs的基质效应Table 2 Matrix effect in determination of PCBs in two vegetable matrices

续表2
由表2可知,基质对35 种PCBs的大多数化合物起抑制作用,小部分起增强作用,不同基质之间的基质效应虽然有差别,但差别不大,且同种化合物间基质效应为同向。因此,为保证实验数据的真实、准确,采用空白基质配制标准工作液进行测定。
2.2 提取结果
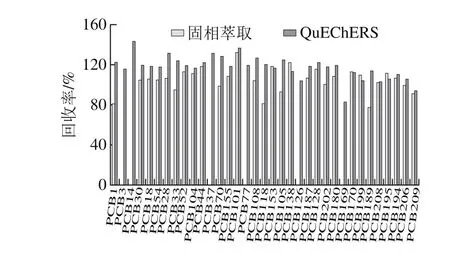
图2 2 种提取方法对回收率的影响Fig. 2 Influence of extraction methods on recovery
由图2可见,QuEChERS方法中各化合物回收率为83.1%~142.7%,而采用固相萃取作为提取方法时,PCB3、PCB14、PCB37、PCB126、PCB169等化合物未检出。因此,选择QuEChERS提取作为本实验的前处理方法。
2.3 提取溶剂的选择结果
实验结果表明,以丙酮、正己烷、异辛烷、1%乙酸化乙腈作为提取溶剂时,除目标物PCB126、PCB169的回收率低于50%外,其余目标物的平均回收率为69%~148%;采用正己烷-丙酮(1∶1,V/V)、二氯甲烷、乙酸乙酯提取时,其平均回收率为85%~130%,提取效果较好。但目前关于PCBs的提取溶剂大多为正己烷-丙酮(1∶1,V/V),鲜见以乙酸乙酯为提取溶剂的文献报道,且考虑到二氯甲烷的毒性较大,因此,本实验选用乙酸乙酯作为提取溶剂。
2.4 净化剂的优化结果
实验结果表明,组合B、C、D、E中各化合物组分的回收率为43%~157%,其中经组合D和E净化后的上机溶液颜色很深,不利于进样针、衬管、色谱柱的使用寿命;组合A各化合物的回收率为66%~122%,相对组合B、C、D、E而言,结果较为理想,因此,选用组合A(100 mg PSA-50 mg GCB)作为实验的净化剂组合。
2.5 样品净化的优化结果

图3 单一变量PSA对回收率的影响Fig. 3 Influence of single variable PSA on recovery
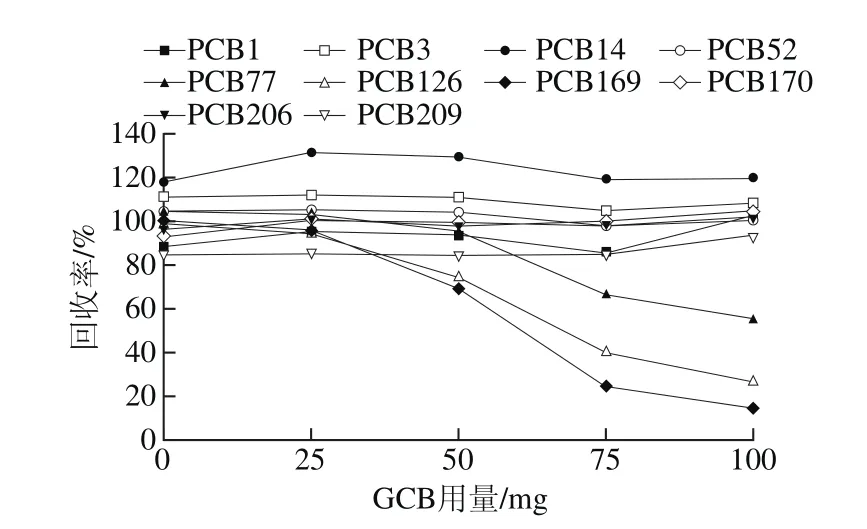
图4 单一变量GCB对回收率的影响Fig. 4 Influence of single variable GCB on recovery
去除有机酸、色素、碳水化合物等的干扰是蔬菜样品检测中的主要环节。按1.3.4.4节方法优化,结果见图3、4(选取部分有代表性化合物进行制图)。结果表明,单独改变PSA的量,大部分化合物回收率随PSA用量的增加而增加,PCB77、PCB126、PCB169随着PSA用量的增加,其回收率先增加后减小,当PSA用量为100 mg时,各组分都能得到较理想的回收;单独改变GCB用量对大部分化合物回收率的影响不大,PCB77、PCB126、PCB169的回收率随着GCB用量的增加而减少,但当GCB用量小于50 mg时,净化后的样品效果差,存在大量的色素杂质,衬管的耗损大,影响色谱柱的使用寿命,GCB用量为50 mg时,各化合物的回收率可达70%以上。通过对PSA、GCB使用量的优化,选择100 mg PSA、50 mg GCB作为蔬菜检测的净化剂。
2.6 方法线性范围及方法检出限
以化合物定量离子峰面积与内标峰面积之比Y为纵坐标,质量浓度X(μg/L)为横坐标绘制标准曲线,以3 倍信噪比确定各目标物的方法检出限,其线性范围、线性方程、相关系数及方法检出限见表3。
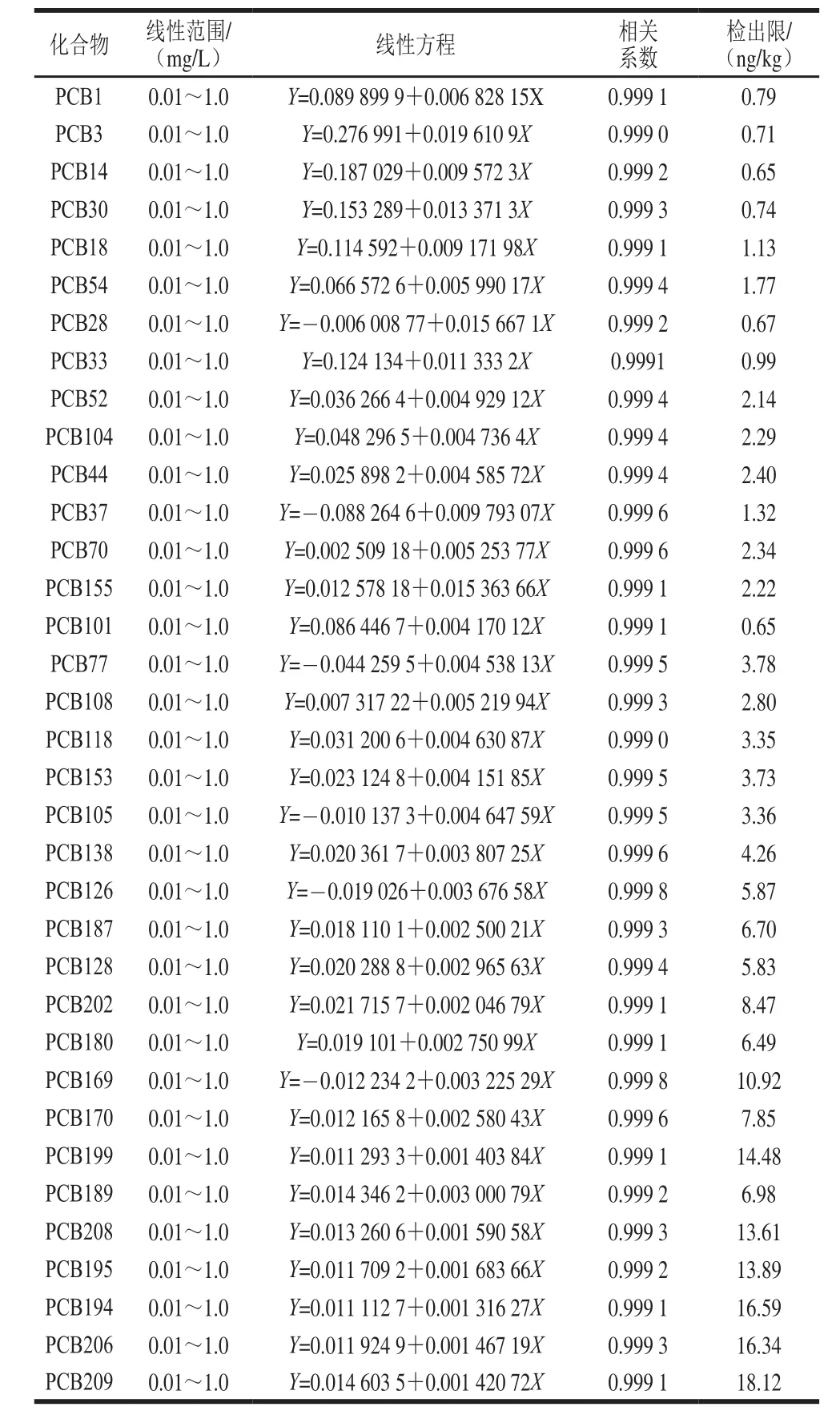
表3 35 种PCBs的线性范围、线性方程、相关系数、方法检出限Table 3 Linear ranges, linear equations, correlation coefficients, and LODs for 35 PCBs
2.7 回收率与精密度实验结果
由表4可知,35 种PCBs的平均回收率为72.3%~119.0%,相对标准偏差为0.4%~9.8%。
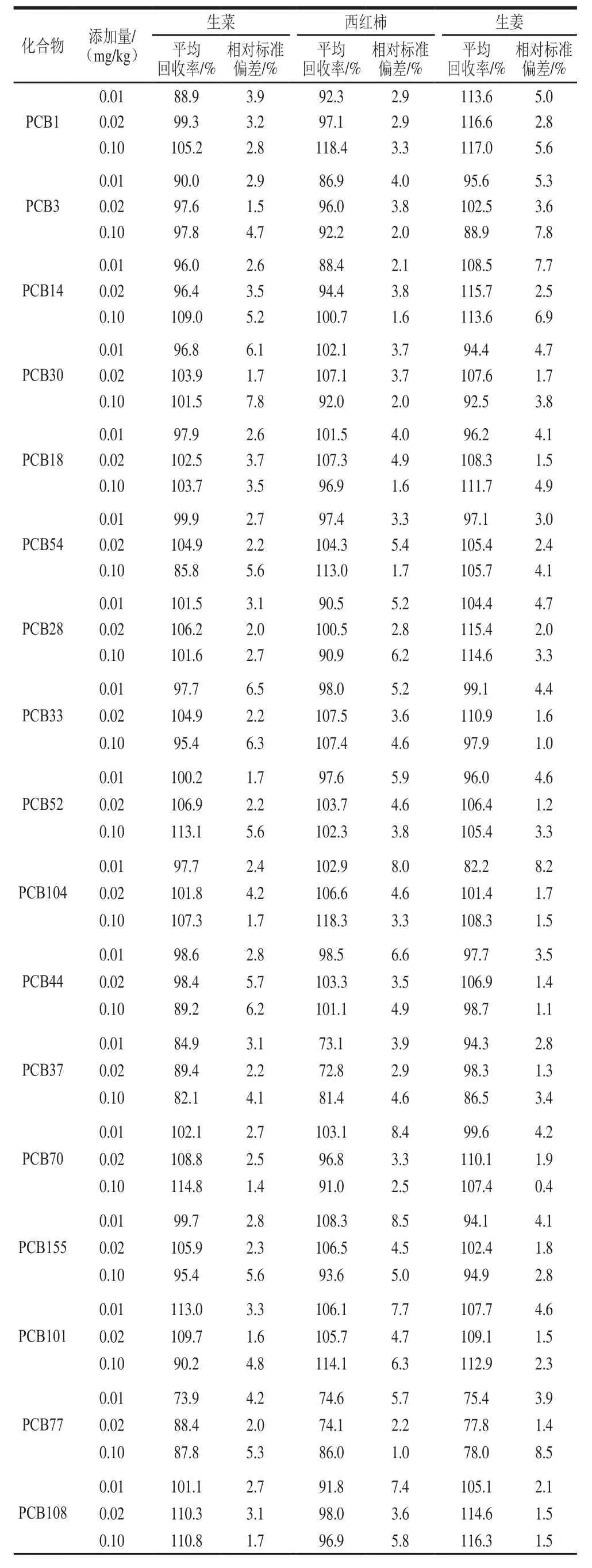
表4 回收率及精密度实验结果(n=6)Table 4 Recovery and precision of the method (n= 6)
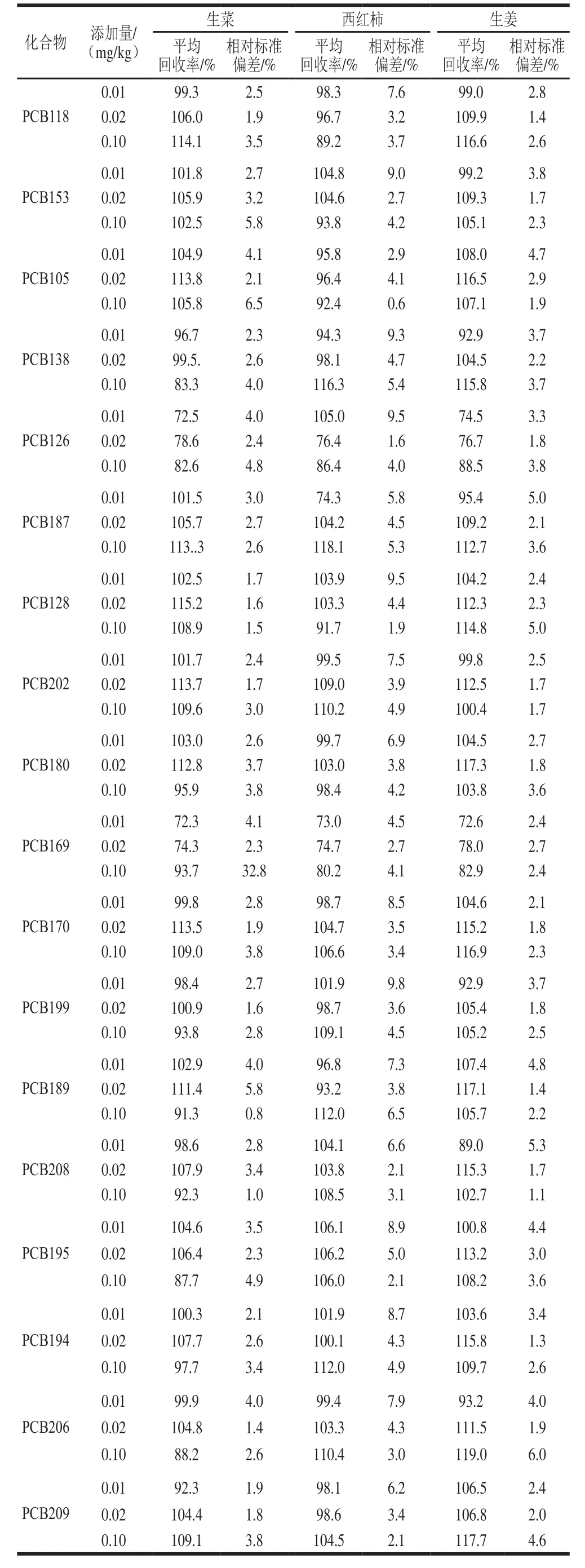
续表4
2.8 实际样品分析结果
为考察本方法的实用性,选取菜心、西红柿、生菜、麦菜、芥蓝和生姜6 类蔬菜各10 批,共60 批样品,采用本方法进行分析。由表5可知,在该60 批样品中,采集于电镀厂附近的菜心、生菜、麦菜和芥蓝的蔬菜样品中均检出PCBs,其余样品均未检出。结果表明,电镀厂附近的土壤已被污染;同时样品中低氯代的PCBs相对含量较大,其原因主要为低氯代的PCBs挥发迁移性和生物积累性。其中,菜心检出样品的总离子流图见图5。
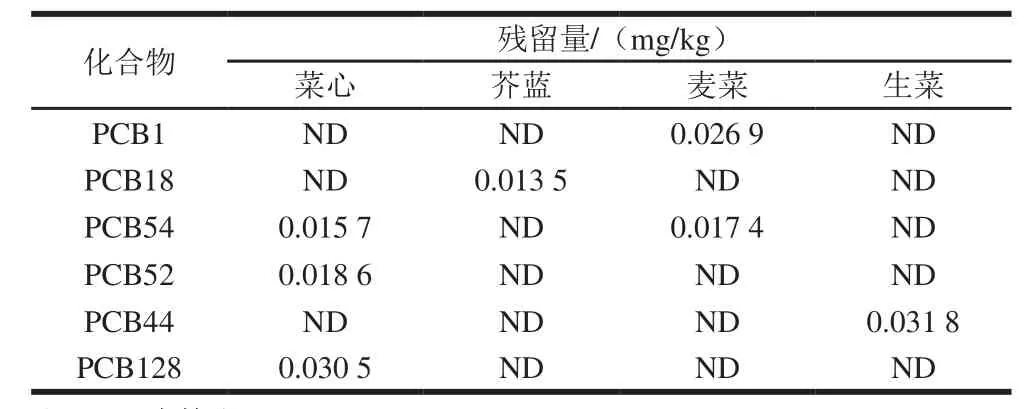
表5 实际样品中PCBs的残留检测结果Table 5 Residues of PCBs in real samples
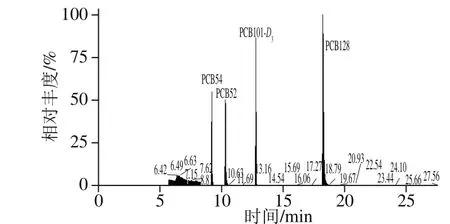
图5 菜心样品检出农药总离子流图Fig. 5 Total ion current chromatogram for PCB residues in flowering cabbage
3 结 论
建立QuEChERS-GC-MS/MS法测定蔬菜中35 种PCBs残留量的分析方法。采用乙酸乙酯为提取溶剂,QuEChERS净化处理,空白基质匹配标准溶液内标法定量,方法简单、快速、灵敏度高,适用于不同种类蔬菜中PCBs确证和定量分析。
[1] 胡华, 王政华. 多氯联苯类污染物对人类健康的影响[J]. 长沙民政职业技术学院学报, 2007, 14(1): 121-126. DOI:10.3969/j.issn.1671-5136.2007.01.041.
[2] YANG Z P, LU W X, LONG Y Q, et al. Assessment of heavy metals contamination in urban topsoil from Changchun city, China[J]. Journal of Geochemical Exploration, 2011, 108(1): 27-38. DOI:10.1016/j.gexplo.2010.09.006.
[3] JIANG Y F, WANG X T, ZHU K, et al. Polychlorinated biphenyls contamination in urban soil of Shanghai: level, compositional profiles and source identification[J]. Chemosphere, 2011, 83(6): 767-773.DOI:10.1016/j.chemosphere.2011.02.077.
[4] 王飞. 持久性有机污染物多氯联苯(PCBs)的研究进展[J]. 科技资讯,2015, 11(20): 139-141; 143. DOI:10.3969/j.issn.1672-3791.2015.20.072.
[5] 郭莉, 汪亚林, 李成, 等. 电子电器废弃物拆解区蔬菜多氯联苯污染及其健康风险[J]. 科学通报, 2017, 62(7): 674-684.
[6] XING G H, YANG Y, CHAN J K Y, et al. Bioaccessibility of PCBs in different foods using an in vitro digestion method[J].Environmental Pollution, 2008, 156(3): 1218-1226. DOI:10.1016/j.envpol.2008.03.020.
[7] JOHN R D, RENLI M. Approaches to assess the oral bioaccessibility of persistent organic pollutants: a article review[J]. Chemosphere,2007, 68(8): 1399-1407. DOI:10.1016/j.chemosphere.2007.03.054.
[8] WANG H S, ZHAO Y G, MAN Y B, et al. Oral bioaccessibility and human risk assessment of organocglorime pesticides (OCPs) via fish consumption, using an in vitro gastrointestinal mode[J]. Food Chemistry,2011, 127(4): 1673-1679. DOI:10.1016/j.foodchem.2011.02.035.
[9] 胡恩宇, 杨丽莉, 王美飞, 等. 气相色谱法同时测定水产品中28种多氯联苯单体[J]. 环境检测管理与技术, 2010, 22(1): 44-48.DOI:10.3969/jissn.1006.2009.2010.01.012.
[10] HERRERA A, PÉREZ-ARQUILLUÉ C, CONCHELLO P, et al.Determination of pesticides and PCBs in honey by solid-phase extraction cleanup followde by gas chromatography with electroncapture and nitrogen-phosphorus detection[J]. Analytical and Bioanalytical Chemistry, 2005, 381(3): 695-701. DOI:10.1007/s00216-004-2924-3.
[11] 胡红美, 郭远明, 郝青, 等. 超声波萃取-PSA净化-GC-ECD法测定鲍鱼不同组织中的多氯联苯[J]. 分析化学, 2016, 44(1): 88-94.DOI:10.11895/j.issn.0253-3820.150544.
[12] 胡红美, 郭远明, 孙秀梅, 等. 超声波萃取-分散固相萃取净化-气相色谱电子捕获法测定土壤或底泥中的多氯联苯[J]. 中国食品学报,2014, 14(4): 198-203. DOI:10.11895/j.issn.0253-3820.150544.
[13] 柯常亮, 刘奇, 王许诺, 等. 气相色谱法同时测定水产品中28 种多氯联苯同系物[J]. 食品发酵与工业, 2015, 41(7): 155-159.DOI:10.13995/j.cnki.11-1802/ts.201507028.
[14] STOKER C, ZAYAS M A, FERREIRA M A, et al. The eggshell features and clutch viability of the broad-snouted caiman (Caiman latirostris) are accociated with the egg burden of organochlorine compounds[J]. Ecotoxicology and Environmental Safety, 2013, 98(3):191-195. DOI:10.1016/j.ecoenv.2013.08.22.
[15] 吉仙枝. 气相色谱-质谱联用法测定食品中的多氯联苯技术研究[D].杨凌: 西北农林科技大学, 2013: 5-11.
[16] 张潜, 余辉菊, 王炼, 等. 饮水中16 种多环芳烃和6 种多氯联苯的固相微萃取-气相色谱-三重四极杆质谱同时测定法[J]. 环境与健康杂志, 2014, 31(2): 173-176.
[17] 姚銘栋, 王余萍, 王冬梅. 饮用水中多氯联苯的全自动固相萃取-气相色谱-三重四极杆质谱测定法[J]. 职业与健康, 2015, 31(19): 2634-2636.
[18] 邓敏军, 罗艳, 邓超冰. 固相萃取-气相色谱-质谱法测定水中的19种多氯联苯[J]. 光谱实验室, 2012, 29(2): 947-950. DOI:10.3969/j.issn.1004-9138.2012.02.070.
[19] 傅胜武, 林麒, 吕华东, 等. 加速溶剂萃取-气相色谱质谱联用法测定食品中指示性多氯联苯的研究[J]. 中国卫生检验杂志, 2006, 16(9):1025-1028. DOI:10.3969/j.issn.1004.8685.2006.09.001.
[20] 佟玲, 杨佳佳, 吴淑琪. 气相色谱-串联质谱法测定植物样品中17 种有机氯农药和8 种多氯联苯[J]. 农药学学报, 2012, 14(2): 185-190.DOI:10.3969/j.issn.1008-7303.2012.02.11.
[21] 田福林, 刘成雁, 王志嘉, 等. 气相色谱-串联质谱法测定土壤中多环芳烃和多氯联苯[J]. 分析科学学报, 2017, 33(2): 212-216.DOI:10.13526/j.issn.1006-6144.2017.02.012.
[22] 周蓓蕾, 赵玲, 沈燕, 等. 气相色谱-串联质谱法测定虾体中18 种多氯联苯[J]. 农药学学报, 2017, 19(2): 223-230. DOI:10.16801/j.issn1008-7303.2017.0030.
[23] 吴岩, 张辛博, 刘永, 等. 凝胶渗透色谱-气相色谱-串联质谱法测定血清中7 种多氯联苯残留量[J]. 中国卫生检验杂志, 2012, 22(3): 478-481.
[24] MOHEBBI-NOZAR S L, ISMAIL W R, ZAKARIA M P. Distribution,sources identification, and ecological risk of PAHs and PCBs in coastal surface sediments from the northern Persian gulf[J]. Human and Ecological Risk Assessment, 2014, 20(6): 1507-1520. DOI:10.1080/10 807039.2014.884410.
[25] 李志英, 杜新贞, 饶红红, 等. 介孔材料固相微萃取-高效液相色谱联用测定黄河底泥中的多氯联苯[C]. 兰州: 西北地区第六届色谱学术报告会甘肃省第十一届色谱年会, 2010.
[26] 史永富, 蔡友琼, 于慧娟, 等. 气相色谱串联质谱法用于水产品中多氯联苯二代污染物鉴别[J]. 分析化学研究报告, 2014, 42(11): 1640-1645. DOI:10.11895/j.issn.0253-3820.140346.
[27] 艾连锋, 李玮, 王敬, 等. 气相色谱-串联质谱法测定牛奶中多氯联苯及多环芳烃[J]. 分析测试学报, 2015, 34(5): 570-575. DOI:10.3969/j.issn.1004-4957.2015.05.012.
[28] 郑群雄, 徐小强, 刘清辉, 等. 气相色谱-质谱法检测蔬菜中19 种多氯联苯[J]. 中国食品学报, 2012, 12(2): 151-158. DOI:10.3969/j.issn.1009-7848.2012.02.023.
[29] 崔立迁, 王欣, 崔进, 等. 气相色谱-质谱联用测定艾叶中持久性有机污染物[J]. 分析科学学报, 2016, 32(1): 111-115. DOI:10.13426/j.issn.1006-6144.2016.01.023.
[30] STEVEN J. Quick, easy, cheap, eあective, rugged, and safe approach for determining pesticide residues[M]//Pestcide Protacols, OAI, 2005:239-261. DOI:10.1385/1-59259-929-X:239.
[31] 王彬. QuEChERS-气相色谱法鱼肉中多氯联苯残留分析方法的研究[J]. 工程与技术, 2016, 40(14): 107-111. DOI:10.16736/j.cnki.cn41-1434/ts.2016.14.040.
[32] 蔡小虎, 蔡述伟, 时磊, 等. QuEChERS-GC/ECD法分析土壤和沉积物中残留有机氯农药和多氯联苯[J]. 环境监控与预警, 2016, 8(3):14-17. DOI:10.3969/j.issn.1674-6732.2016.03.004.

