长白山森林土壤有机碳及其在团聚体密度组分中的分布
孙颖,徐嘉晖,高菲,崔晓阳
0 引言
土壤因其巨大的碳汇作用日益受到关注[1-2],全球约1 500 Pg有机碳储存于土壤中,约为大气碳库的2倍[3-4]。土壤有机碳库轻微的变化将导致大气CO2浓度较大的波动[5]。Birdsey总结大量文献得出森林土壤碳库约占全球土壤碳库的73%[6],因此了解森林土壤有机碳的稳定机制对缓解温室效应和改善全球气候至关重要[7]。Parton将土壤碳库分为活性碳库和惰性碳库[8],活性碳库主要包括轻组有机碳和颗粒有机碳等,其在土壤中稳定性较差,对环境变化极为敏感。惰性碳库主要为重组有机碳,其在土壤中较为稳定,利于有机碳的积累。因此,了解土壤轻、重组有机碳的分布格局对掌握有机碳的周转和固定机制具有重要作用。轻组有机碳(LF-C)是介于新鲜有机质和腐殖质之间的,由未分解或部分分解的有机质所构成的短期土壤养分储存碳库,因此其周转快、有效性高,对土壤养分循环和碳收支变化具有重要意义[9],Golchin[10]根据轻组有机碳在团聚体中的不同位置,将轻组有机碳进一步分为游离在团聚体外的游离态轻组有机碳(FLF-C)和包裹在团聚体内的闭蓄态轻组有机碳(OLF-C);重组有机碳(HF-C)是与土壤矿物紧密结合的,腐殖化程度较高的一类有机质,因此重组有机碳决定了土壤有机碳库的稳定性和质量[11]。用物理方法可将土壤有机质分为游离态轻组(FLF)、闭蓄态轻组(OLF)和重组(HF)[8,10]。团聚体储存了表层土壤近90%的有机碳[12],它对有机碳的物理保护是土壤发挥固碳潜力的基础[13-14]。目前,大多数对密度分组的研究均是以全土为切入点,而相对忽视了团聚体对各密度组分有机碳的分布所产生的影响。
长白山森林生态系统是亚欧大陆东部保存最为完好的温带山地森林生态系统之一,现仍保存着较大面积的原始森林;但20世纪以来,由于强烈的人为干扰,次生林的面积逐步增加[15-17]。本文以长白山地区原始红松林和阔叶次生林的表层土壤为研究对象,采用干筛法分析了有机碳于各粒级团聚体的分布情况,并利用密度分组方法进一步探讨了团聚体有机碳的密度分组情况,以探索有机碳在土壤中的稳定机制。旨在为研究长白山地区土壤固碳潜力和提高土壤碳库的稳定性提供科学依据。
1 研究区概况与研究方法
1.1 研究区概况
研究区位于长白山腹地的吉林省抚松县露水河林业局境内(42° 20' ~ 42° 24' N,127° 29' ~ 128°00' E)。属温带湿润季风气候,年降水量700 ~900 mm,年平均气温0.9 ~ 2.5℃。土壤类型为长白山玄武岩台地上发育的白浆土。属于长白山植物区系,地带性植被为红松针阔混交林,乔木层主要有红松(Pinus koraiensis)、蒙古栎(Quercus mongolica)、水曲柳(Fraxinus mandshurica)等,灌木层有毛榛子(Corylus mundshurica)、刺五加(Acanthopanax senticosus)、暴马丁香(Syringa reticulate)等。由于上世纪50年代至80年代采伐干扰,原始林面积现已锐减,以白桦(Betula platyphylla)、山杨(Populus davidiana)等为主的阔叶次生林面积大幅增加。
1.2 样品采集与处理
2016年8月中旬,选择典型的原始红松针阔混交林样地及毗邻的次生杨桦林样地(成对样地,30 m×30 m),每种林型3次重复。为避免环境差异对结果的影响,样地的海拔、坡度、坡向和坡位等立地因子基本一致。每个样地按S型选取5个采样点,分别按0~5 cm、5~15 cm深度取样。取样时保持土壤原状,用塑料盒带回实验室。剔除石砾及肉眼可见的动植物残体,阴凉处自然风干。利用四分法,部分样品保持原状进行团聚体分组,部分研磨过100目筛,编号备用。
1.3 测定方法
土壤机械稳定性团聚体的分级采用干筛法[18-19]。称取一定量的风干土样,利用孔径为2、1、0.25 mm的土壤筛将样品手动筛分为>2、1~2、1~0.25、<0.25 mm 4个径级的样品,分别称重并取部分研磨过100目筛测定土壤有机碳。
土壤有机碳各组分的分离方法参照[20-22],称取风干土样20.00 g置于100 ml离心管中,加入密度为 1.85 g/cm3的NaI 溶液,轻轻摇动离心管,静置30 min后,以4 000 r/min离心30 min,采用虹吸法收集游离态轻组组分(FLF)于孔径为0.45 μm的微孔滤膜的抽滤器中,重复操作至无可见轻组物质,用去离子水洗涤,转移至已称重器皿中50℃低温烘干、称重。离心管内的沉淀再次加入NaI溶液,摇匀,利用超声波以460 J/ml的能量分散团聚体,团聚体破坏后释放的闭蓄态轻组组分(OLF)同上进行离心、抽滤、重复、洗涤、烘干、称重。离心管内沉淀的重组(HF)用去离子水离心洗涤、收集、烘干、称重。将以上得到的各组分样品研磨过100目筛,用CHN元素分析仪直接测定有机碳浓度并将单位统一换算为g/kg土。
1.4 数据处理
数据采用SPSS19.0软件进行T检验和相关分析,单因素方差分析采用Duncan法进行差异显著性检验。利用Excel2007软件进行绘图。
2 结果与分析
2.1 有机碳在全土及团聚体中的分布特征
两种林型的全土有机碳(SOC)含量差异显著(P<0.05)。在0~5、5~15 cm土层,杨桦次生林SOC含量分别达原始红松林的1.35和1.56倍(表1)。表层土壤总有机碳含量显著高于亚表层,两种林型SOC自表层至亚表层均降低了60%以上。与全土有机碳相似,各级团聚体的有机碳含量自0~5 cm至5~15 cm也显著降低。原始红松林和杨桦次生林不同径级团聚体的有机碳含量均以1~0.25 mm团聚体为主,两林型层间均值分别为26.2 g/kg和30.0 g/kg,占SOC的37.0%和30.8%。其中原始红松林<0.25 mm团聚体的有机碳含量最低层间均值为11.7 g/kg,仅占SOC的15.4%,而杨桦次生林以1~2 mm团聚体的有机碳含量最低层间均值为18.2 g/kg,占SOC的18.1%。综合两种林型团聚体有机碳含量的分布特征,研究区内土壤有机碳在团聚体中的分配比例由高到低依次为1~0.25、>2、1~2、<0.25 mm。
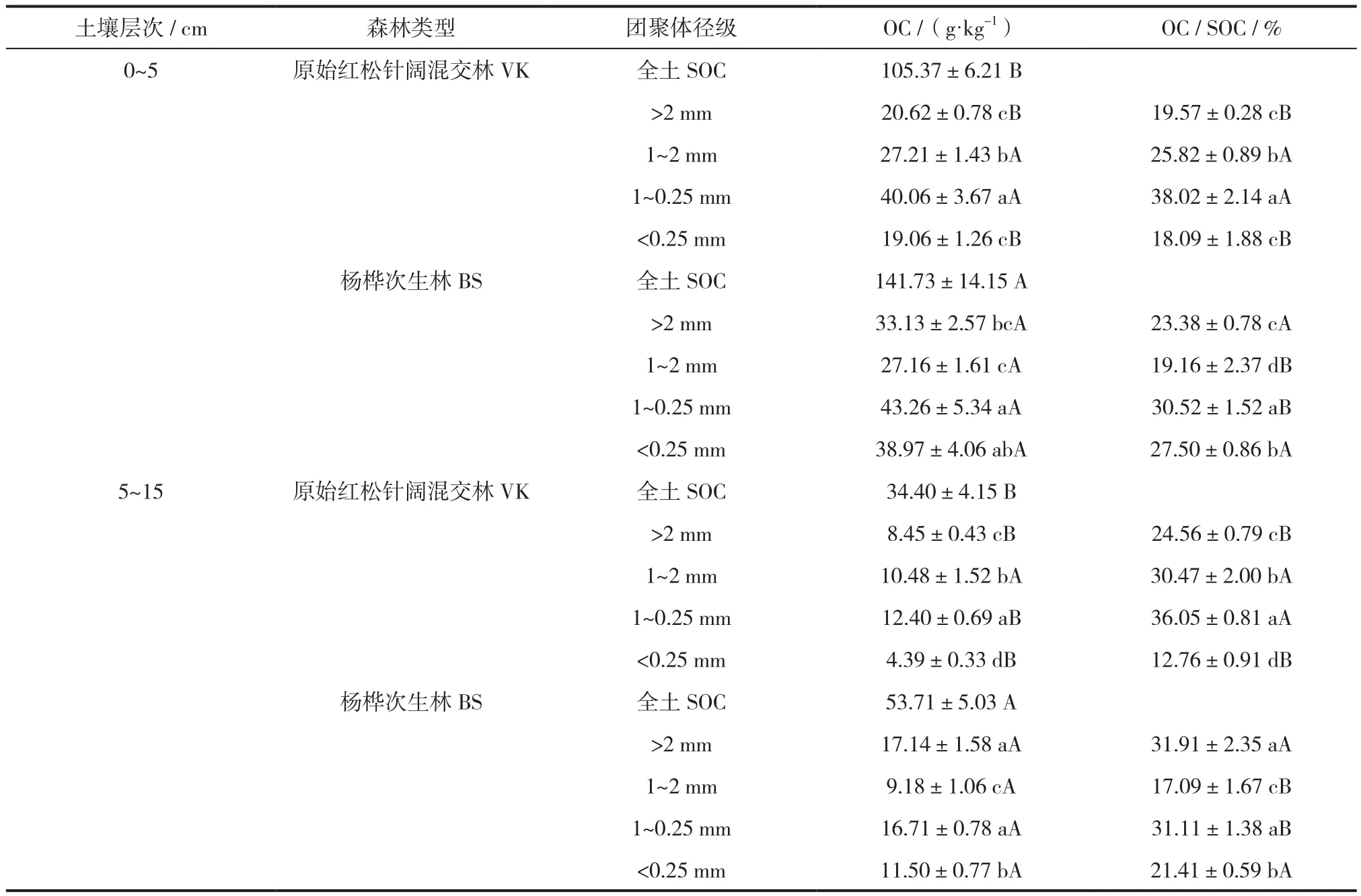
表1 两种森林类型下全土和各级团聚体有机碳含量及比例Tab.1 Organic carbon content and proportion in bulk soil and each size of aggregates under two forest types.
2.2 有机碳在土壤密度组分中的分布特征
两林型下土壤各密度组分的有机碳含量由表层至亚表层显著降低,FLF-C、OLF-C和HF-C原始红松林分别降低了94.3%、83.9%和51.3%;杨桦次生林分别降低了87.9%、76.2%和34.3%。而各密度组分有机碳占全土有机碳的比例,两林型的FLF-C/SOC、OLF-C/SOC均显著下降,降幅在原始红松林可达82.6%和50.5%;杨桦次生林可达67.0%和35.1%,但原始红松林和杨桦次生林的HF-C/SOC随着土层的加深却分别升高了48.6%和79.1%(表2)。这说明,轻组有机碳(LF-C)对表层土壤有机碳的积累影响显著,但随着土层的加深LF-C的影响逐渐减弱,而HF-C则逐渐相对累积。杨桦次生林土壤各组分有机碳含量均高于原始红松林,其中FLF-C和OLF-C均达到显著水平,而表层HF-C则差异并不明显;从各密度组分占SOC的比例来看,次生林的FLF-C/SOC和OLF-C/SOC较原始林高13.5%和1.1%,而HF-C/SOC则低14.6%,且差异显著(表2)。可见,林型差异导致了LF-C的积累差异,而对HF-C的影响较小。
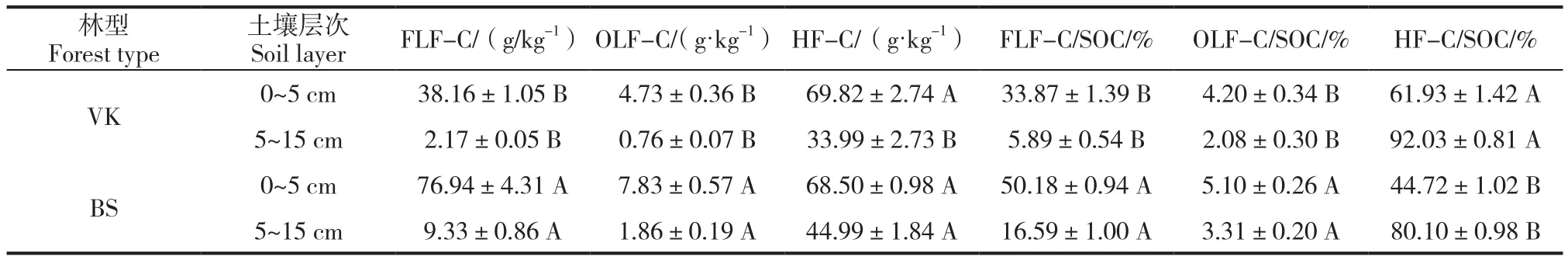
表2 两种森林类型土壤密度组分的有机碳含量及比例Tab.2 Organic carbon content and proportion in density fractions separated from soils under two forest types.
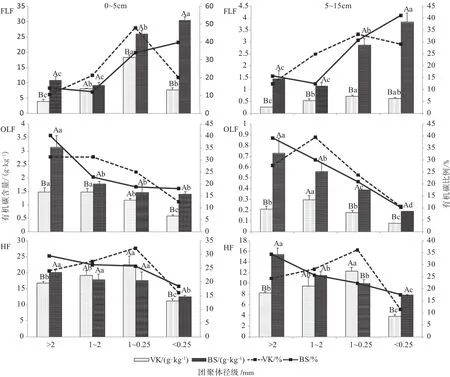
图1 土壤团聚体中不同密度组分的有机碳含量(g·kg-1)和比例(%)Fig.1 Organic carbon content (g·kg-1) and proportion (%) in different density fractions of soil aggregates
2.3 有机碳在土壤团聚体密度组分中的分布特征
如图1所示,随着团聚体径级的减小,0~5 cm和5~15 cm层的各密度组分有机碳含量的分布规律一致,但两林型间却差异显著。原始红松林的FLF-C和HF-C在1~0.25 mm团聚体中含量最高,层间均值分别为9.53、17.46 g/kg,OLF则在1~2 mm团聚体中有机碳含量最高,层间均值为0.89 g/kg;杨桦次生林的FLF-C的峰值出现在<0.25 mm团聚体中,层间均值为17.21 g/kg,OLF和HF则均以>2 mm团聚体的有机碳含量最高,层间均值分别为1.94 g/kg和17.88 g/kg。从各密度组分在不同径级团聚体的分布比例上看,两林型的FLF-C主要分布在<1 mm的小团聚体中,平均占SOC的69.0%,而OLF-C和HF-C则主要分布在大团聚体中(>0.25 mm),平均分别占SOC的87.6%和84.2%。综合两种林型土壤团聚体中各密度组分有机碳分布特征,各密度组分表现出随着团聚体径级的减小,FLF-C逐渐增大,而OLF-C和HF-C则逐渐降低的趋势。
3 结论
(1)杨桦次生林表层和亚表层土壤的有机碳含量均显著高于原始红松林,但重组有机碳(HFC)的比例却显著低于后者。这表明即使次生演替促进了土壤对有机碳的固持,但也降低了土壤有机碳库的整体稳定性。因此,在长白山地区加强原始森林资源的保护并促进次生林生态恢复,对增加稳定性土壤碳库具重要意义。
(2)相比于游离态轻组有机碳(FLF-C)和闭蓄态轻组有机碳(OLF-C),HF-C在两林型不同团聚体中的分配相对稳定,这表明HF-C在稳定性土壤有机碳的固持中起着主导作用。
(3)OLF-C一般不足总有机碳的5%,其分配比例随着团聚体粒级的减小逐渐降低。这部分有机碳在团聚体的保护下相对稳定,增加了土壤稳定性碳库的储量。
[1]Watson R T, Noble I R, Bolin B, et al. Land use, land-use change and forestry: a special report of the intergovernmental panel on climate change[M]. UK: Cambridge University Press, 2000.
[2]Rita J C O, Gama-Rodrigues A C, Polidoro J C, et al. C and N content in density fractions of whole soil and soil size fraction under cacao agroforestry systems and natural forest in Bahia, Brazil[J]. Environmental Management, 2011, 48 (1):134 - 141.
[3]Lal R. Soil carbon sequestration impacts on global climate change and food security[J]. Science, 2004, 304 (5677):1623-1627.
[4]Lal R. Soil carbon sequestration to mitigate climate change[J].Geoderma, 2004, 123(1–2): 1-22.
[5]Sundquist E T. The global carbon dioxide budget[J]. Science,1993, 259 (5097):934-941.
[6]Birdsey R A, Plantinga A J, Heath L S. Past and prospective carbon storage in United States forests[J]. Forest Ecology &Management, 1993, 58 (1-2): 33-40.
[7]Six J, Elliott E T, Paustian K. Aggregate and soil organic matter dynamics under conventional and no-tillage systems[J]. Soil Science Society of America Journal, 1999, 63 (5): 1350-1358.
[8]Parton W J, Schimel D S, Cole C V, et al. Analysis of factors controlling soil organic matter levels in great plains grasslands1[J].Soil Science Society of America Journal, 1987, 51 (5):1173-1179.
[9]Schlesinger W H. Evidence from chronosequence studies for a low carbon-storage potential of soils[J]. Nature, 1990, 348 (6298):232-234.
[10]Golchin A, Oades J M, Skjemstad J O, et al. Study of free and occluded particulate organic matter in soils by solid state 13C Cp/MAS NMR spectroscopy and scanning electron microscopy[J].Soil Research, 1994, 32 (2):285-309.
[11]Christensen B T. Physical fractionation of soil and organic matter in primary particle size and density separates[J]. Advances in Soil Science, 1992, 20:1-90.
[12]Jastrow J D. Soil aggregate formation and the accrual of particulate and mineral-associated organic matter[J]. Soil Biology and Biochemistry, 1996, 28 (4-5): 665-676.
[13]Puget P, Chenu C, Balesdent J. Dynamics of soil organic matter associated with particle-size fractions of water-stable aggregates[J]. European Journal of Soil Science, 2000, 51 (4): 595-605.
[14]Feller C, Beare M H. Physical control of soil organic matter dynamics in the tropics[J]. Geoderma, 1997, 79 (1-4):69-116.[15]Wang A, Pei T. Determination and calculation of evapotranspiration of broad-leaved Korean pine forest on Changbai Mountain[J]. Chinese Journal of Applied Ecology,2002, 13(12):1547.
[16]Wu J, Guan D, Dai L, et al. Summer temperature characteristics of broadleaved Pinus koriaensis forest in Changbai Mountain[J].Chinese Journal of Ecology, 2002, 21(5):14-17.
[17]孙迪, 夏静芳, 关德新,等. 长白山阔叶红松林不同深度土壤水分特征曲线[J]. 应用生态学报, 2010, 21(6): 1405-1409.
[18]章明奎, 郑顺安, 王丽平. 利用方式对砂质土壤有机碳、氮和磷的形态及其在不同大小团聚体中分布的影响 [J]. 中国农业科学, 2007, 40 (8): 1703-1711.
[19]张甜, 朱玉杰, 董希斌. 小兴安岭用材林土壤肥力综合评价及评价方法比较[J]. 东北林业大学学报, 2016, 44(12) :10-14.
[20]Brodowski S, John B, Flessa H, et al. Aggregate-occluded black carbon in soil[J]. European Journal of Soil Science, 2006,57(4): 539-546.
[21]Tan Z, Lal R, Owens L, et al. Distribution of light and heavy fractions of soil organic carbon as related to land use and tillage practice[J]. Soil & Tillage Research, 2007, 92 (1/2): 53-59.
[22]Preger A C, Kösters R, Preez C C D, et al. Carbon sequestration in secondary pasture soils: a chronosequence study in the South African Highveld[J]. European Journal of Soil Science, 2010,61(4):551-562.

