桑叶对绒山羊血脂及脂肪代谢相关基因表达的影响
刘功炜,侯海瑞,王尧悦,贾亚洲,陈玉林,杨雨鑫(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
桑属于桑科桑属落叶乔木,在我国的种植面积约100万hm2[1]。目前桑叶主要用于养蚕业,利用率只能达到50%左右,存在严重的资源浪费问题。对桑叶的营养成分和降解特性进行分析发现,其中动物必需氨基酸含量高达43%[2],且蛋白含量高、纤维含量低、干物质可降解率高、可利用能值高[3]。与苜蓿粉相比,桑叶粗蛋白含量高11%,粗纤维含量低50%,总能值相当[2]。同时,适口性好、可消化率高等[4]也是桑叶饲料的一大特点。因此,桑叶作为饲料资源具有很大的利用空间。
在动物饲料中的应用表明,饲喂桑叶能有效提高日增重、产蛋、产肉等生长和生产性能[1,5-6]。近年来,随着对桑叶功能性有效成分研究的深入,发现桑叶中富含的多羟基生物碱、多糖、黄酮类等生物活性物质具有降血脂、降胆固醇作用,能显著降低动物肝脏中总胆固醇(TC)、甘油三酯(TG)的含量,控制脂肪细胞中甘油三酯分解为游离脂肪酸,并对机体脂肪代谢相关基因的表达有一定调控作用[7-9]。脂蛋白酯酶(lipoprotein lipase,LPL)是一种蛋白水解酶,在脂肪组织和肌肉组织中高度表达,并且能够以脂肪酸的形式为其他组织提供能量,对脂肪代谢过程有重要的调控作用[10]。脂肪酸合成酶(fatty acid synthase,FASN)是脂肪酸合成过程中的关键多功能聚合酶,对平衡机体脂肪生成和分解代谢有重要作用[11]。瘦素(Leptin)是肥胖基因(Obese,OB)的表达产物,主要由白色脂肪组织合成分泌,能够增加能量消耗,减少脂肪沉积,在调节机体脂肪代谢方面有重要作用[12]。
目前对桑叶作为饲料资源的研究多局限于日粮中添加桑叶对动物生长、生产性能的影响,而关于桑叶对动物脂肪沉积规律以及脂肪沉积相关基因表达的影响少有报道。因此,本试验以陕北白绒山羊为研究对象,探讨日粮中桑叶不同添加方式和添加量对绒山羊血脂代谢及脂肪代谢基因LPL、FASN、Leptin表达量的影响,以期为桑叶在畜禽养殖业中的开发利用提供理论基础。
1 材料与方法
1.1 试验动物分组及饲养管理
试验在陕北延安市子长县(地理坐标:N36.6,E109.2;海拔1 200 m)顺天养殖场进行,根据桑叶添加方式不同试验组分为干桑叶组(dry mulberry group,DMG)和青贮桑叶组(silage mulberry group,SMG)。鲜桑叶采收时间为8月初,由陕西省蚕桑丝绸研究所加工,以自然晒干法获得干桑叶;运用塑料袋装简易青贮技术进行桑叶青贮发酵[13],发酵过程持续60 d。
选用体况良好的8~9月龄(平均体质量(28±1.05) kg/只)陕北白绒山羊羯羊共60只,随机均分为对照组和干桑叶组Ⅰ、干桑叶组Ⅱ、青贮桑叶组Ⅰ、青贮桑叶组Ⅱ、青贮桑叶组Ⅲ6组,每组10只。对照组日粮中不添加桑叶,干桑叶组Ⅰ、Ⅱ日粮中分别添加质量分数10%和15%的自然风干桑叶,青贮桑叶组Ⅰ、Ⅱ、Ⅲ组日粮中分别添加质量分数10%,15%和20%的青贮桑叶,每天饲喂2次。日粮配方参照NRC饲养标准(2007)及前期研究成果[14]进行配制,日粮营养成分组成见表1。饲养试验于2015-11-17-2016-01-27进行,持续70 d(其中预饲10 d),期间防疫工作按照羊场标准执行。
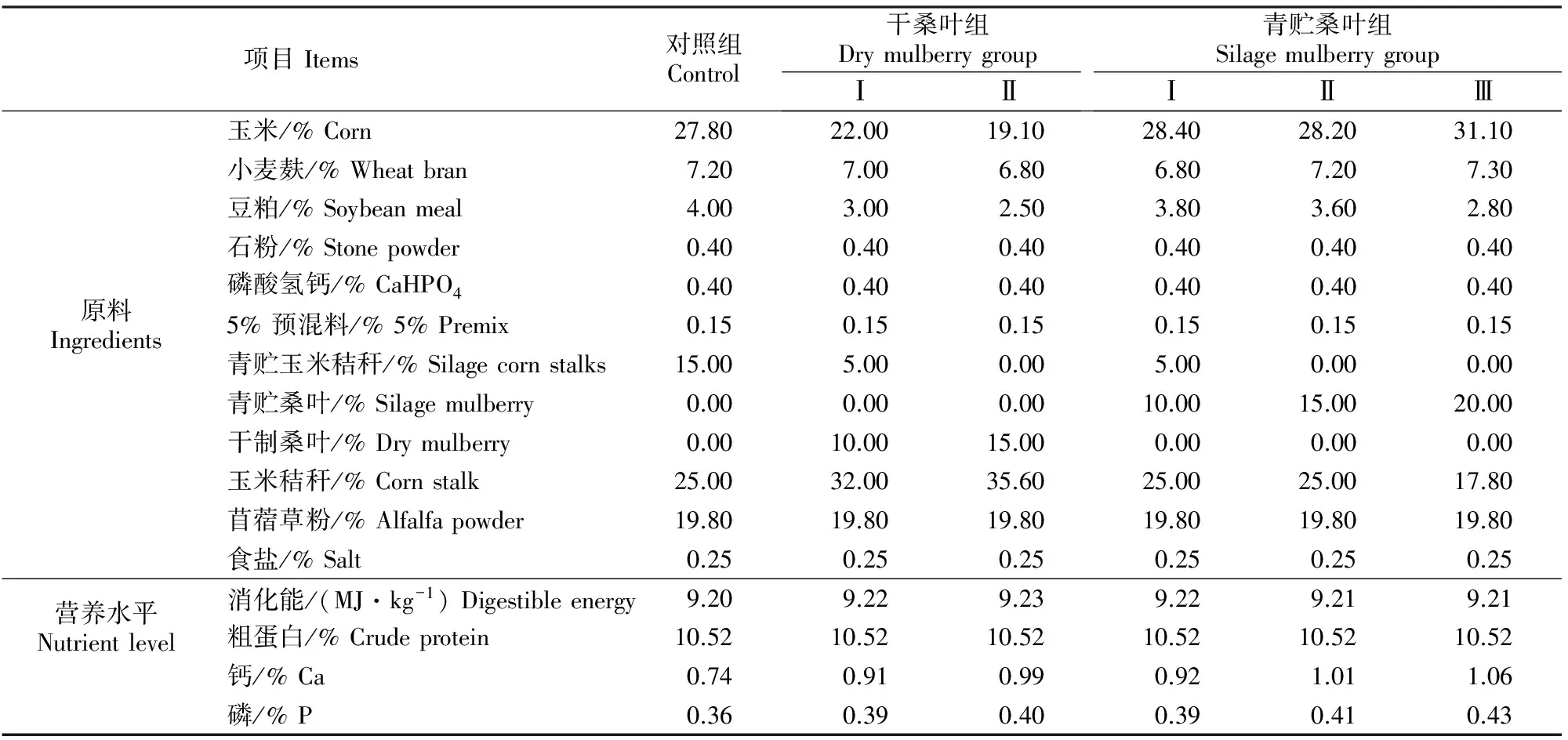
表1 试验日粮营养成分的组成(干物质基础)Table 1 Composition and nutrient levels of experimental diets (dry matter basis)
注:每千克5%预混料含有:VA7 500 IU,VD31 050 IU,VE10 IU,Fe 5 500 mg,Cu 500 mg,Mn 5 000 mg,Zn 4 000 mg,Se 32.5 mg,I 100 mg,Co 32.5 mg。消化能为实测值,其他为计算值。
Notes:Premix contains the following per kg:VA7 500 IU,VD31 050 IU,VE10 IU,Fe 5 500 mg,Cu 500 mg,Mn 5 000 mg,Zn 4 000 mg,Se 32.5 mg,1 100 mg,Co 32.5 mg.The contents of DE were measured values,while the others were calculated values.
1.2 样品采集
饲养试验结束后,每组随机挑选3只羊进行屠宰,宰前禁食、禁水12 h,颈部静脉采血4 mL/只,迅速以4 000 r/min离心10 min取血清,低温保存;宰后分别采集腹部皮下脂肪、肾周脂肪、尾部脂肪、肝脏、背最长肌5个部位的样品,迅速放入液氮中,于-80 ℃保存。
1.3 血清生化指标测定
血清生化指标测定由北京华英生物技术研究所完成。采用全自动生化仪(BS-420,深圳迈瑞)测定血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)浓度;采用半自动生化仪(A6,北京松上)测定血清中脂肪酶(LPS)和LPL活性;采用全自动酶标仪(STAT FAX 2100,Awareness Technology Inc.USA)测定血清中FASN和Leptin质量浓度。
1.4 组织脂肪代谢相关基因表达水平的检测
1.4.1 引物设计与合成 根据GenBank上公布的山羊甘油醛-3-磷酸脱氢酶(GAPDH)、肽酰脯氨基顺反异构酶B(PPIB)、LPL、FASN、Leptin基因序列(GenBank登录号分别为XM_005680968.2、XM_005685667.2、NM_001285607.1、XM_013975079.1、XM_005679433.2),由上海生工生物股份有限公司设计合成实时荧光定量PCR(RT-PCR)引物,引物序列及扩增片段长度见表2。
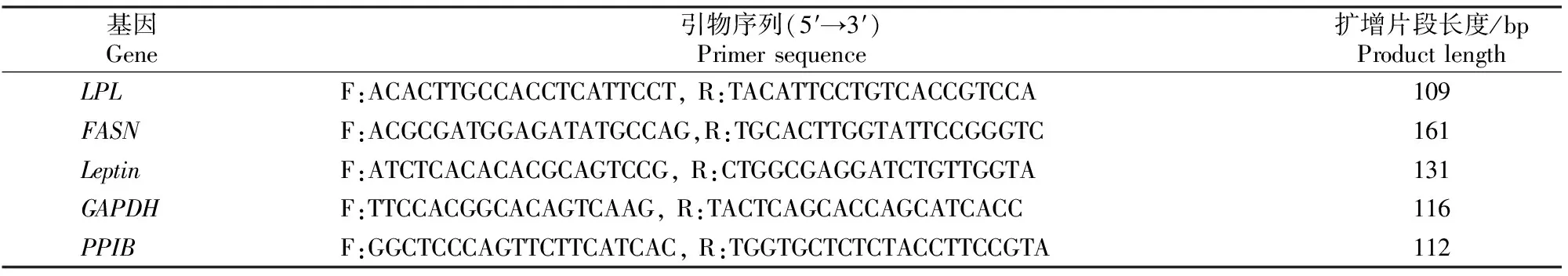
表2 RT-PCR引物序列及扩增片段长度Table 2 Primer sequences designed for RT-PCR and product lengths
1.4.2 组织总RNA的提取及cDNA第一链的合成 参照Eastep®Super总RNA提取试剂盒(Promega,上海)说明书提取腹部皮下脂肪、肾周脂肪、尾部脂肪、肝脏和背最长肌组织的总RNA。用核酸定量仪(Micro-Spectrophotometer,K5800,上海DRAWELL科学仪器有限公司)测定RNA纯度和浓度,以1%琼脂糖凝胶电泳检测RNA完整性。cDNA第一链合成参照Thermo反转录试剂盒(Thermo Scientific,USA)说明书进行。
1.4.3 实时荧光定量PCR 实时荧光定量PCR反应在LightCycle®96(Roche,Switzerland)实时荧光定量仪上进行,反应体系为:SYBR Premix Ex TaqTMⅡ(TaKaRa)12.5 μL,上游引物F(10 μmol/L)1 μL,下游引物R(10 μmol/L)1 μL,模板cDNA 2 μL,ddH2O 8.5 μL,总体积25 μL。PCR反应条件为:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共45个循环。熔解曲线分析程序:95 ℃ 60 s,40 ℃ 60 s,65 ℃ 1 s,97 ℃ 1 s。
1.5 数据处理与统计分析
各组织中基因相对表达量用2-ΔΔCt法计算,其中腹部皮下脂肪、肾周脂肪、尾部脂肪、肝脏4个部位组织以GAPDH为内参基因,背最长肌以PPIB为内参基因。血清生化指标浓度和基因相对表达量结果均以“平均值±标准误(Means±SE)”表示,所得结果用SPSS 20.0进行单因素方差分析(One-Way ANOVE),采用Duncan’s法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 桑叶对绒山羊脂质代谢相关血液生化指标的影响
日粮中添加桑叶对陕北白绒山羊血液生化指标的影响结果如表3所示。
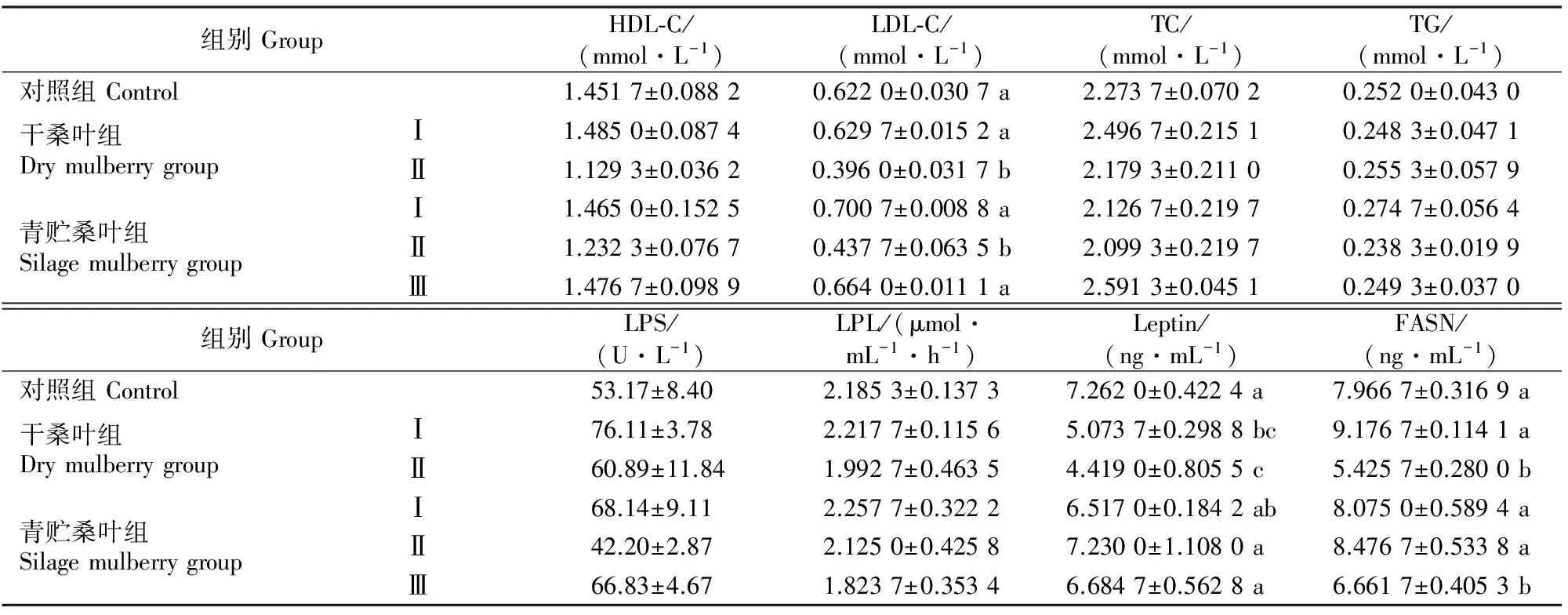
表3 日粮中添加桑叶对绒山羊血液生化指标的影响Table 3 Effects of mulberry on serum biochemical indexes of Cashmere goat
注:同列数据后标不同小写字母表示差异显著(P<0.05),标相同小写字母或未标字母表示差异不显著(P>0.05)。
Notes:In the same column,different small letters mean significant difference (P<0.05),while with same letters or no letter mean insignificant difference (P>0.05).
由表3可知,饲喂桑叶对绒山羊血清中HDL-C、TC、TG、LPS、LPL影响均不显著(P>0.05);青贮桑叶组Ⅱ和干桑叶组Ⅱ的血清LDL-C浓度较对照组分别显著降低30%和36.4%(P<0.05);与对照组血清Leptin质量浓度相比,干桑叶组均显著降低(P<0.05),青贮桑叶组无显著变化(P>0.05),但均显著高于干桑叶组Ⅱ(P<0.05);干桑叶组Ⅱ和青贮桑叶组Ⅲ血清中FASN质量浓度显著降低(P<0.05)。
2.2 LPL、FASN、Leptin在绒山羊不同组织中的基因表达量
利用实时荧光定量PCR法,分别检测LPL、FASN、Leptin在绒山羊腹部皮下脂肪、肾周脂肪、尾部脂肪、肝脏中的基因表达量,结果如图1所示。
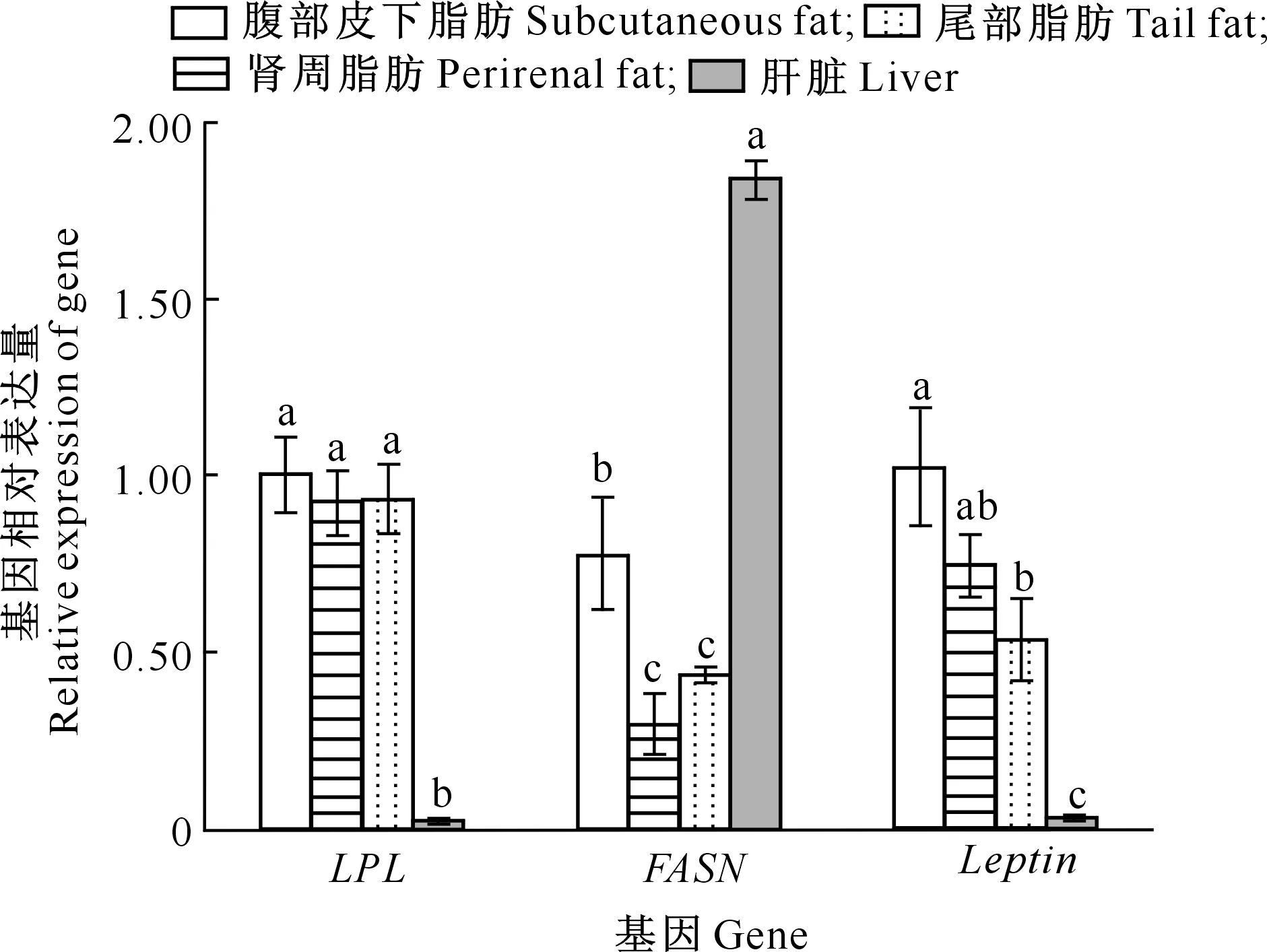
图柱上标不同小写字母表示同一基因不同组织差异显著(P<0.05)Compared with different tissues of same gene,lowercase letters indicate significant difference (P<0.05)图1 LPL、FASN、Leptin基因在绒山羊不同组织中的表达量Fig.1 Expression of LPL,FASN and Leptin in different tissues of Cashmere goat
由图1可知,各组织中LPL基因表达量由高到低依次为腹部皮下脂肪、尾部脂肪、肾周脂肪、肝脏;肝脏中LPL表达量显著低于前3种组织(P<0.05);各脂肪组织LPL基因表达量无显著差异(P>0.05)。FASN基因在肝脏中表达量显著高于其他3个脂肪组织(P<0.05);且腹部皮下脂肪中FASN表达量显著高于尾部脂肪、肾周脂肪(P<0.05)。肝脏中Leptin基因表达量显著低于其他3种脂肪组织(P<0.05);腹部皮下脂肪Leptin基因表达量显著高于尾部脂肪(P<0.05)。LPL、FASN、Leptin在肾周脂肪和尾部分脂肪中的基因表达量差异均不显著(P>0.05)。
2.3 桑叶对绒山羊各组织LPL、FASN、Leptin基因表达量的影响
饲喂干桑叶和青贮桑叶后绒山羊各组织的LPL、FASN、Leptin基因相对表达量分别如图2,3,4所示。由图2可知,在肝脏中LPL基因表达量极低,饲喂桑叶后并未发生显著变化(P>0.05)。腹部皮下脂肪中青贮桑叶组Ⅲ的LPL基因相对表达量约为对照组的4.6倍,且差异显著(P<0.05)。在肾周脂肪中,青贮桑叶组ⅡLPL基因表达量约为对照组的2.4倍,差异显著(P<0.05)。在尾部脂肪中,青贮桑叶组ⅠLPL基因表达量相比对照组显著降低(P<0.05);干桑叶组Ⅱ和青贮桑叶组Ⅱ均显著提高LPL基因表达量(P<0.05),且干桑叶组Ⅱ中LPL表达量更高(P<0.05)。在背最长肌中,青贮桑叶组Ⅱ中LPL表达量显著高于对照组及其他试验组(P<0.05),其他试验组LPL表达量较对照组均有所降低,但差异不显著(P>0.05)。

图柱上标不同小写字母表示同一组织不同处理组差异显著(P<0.05),未标字母表示差异不显著(P>0.05)。下图同Compared with different groups of same tissue,different lowercase letters indicate significant difference (P<0.05),while no letter indicates insignificant difference (P>0.05).The same below图2 日粮中添加桑叶对绒山羊不同组织中LPL基因表达量的影响Fig.2 Effect of supplementation mulberry on LPL expression in different tissues of Cashmere goat
由图3可知,饲喂干桑叶或青贮桑叶对FASN在腹部皮下脂肪、肾周脂肪、尾部脂肪、背最长肌中的表达量均无显著影响(P>0.05);饲喂干桑叶或青贮桑叶对肝脏中FASN基因表达量影响较大,与对照组相比,干桑叶组Ⅱ和青贮桑叶组Ⅱ中FASN基因表达量均显著降低(P<0.05)。

图3 日粮中添加桑叶对绒山羊不同组织中FASN基因表达量的影响Fig.3 Effect of supplementation mulberry on FASN expression in different tissues of Cashmere goat
由图4可知,在腹部皮下脂肪中,青贮桑叶组ⅢLeptin表达量显著高于其他各组(P<0.05);而干桑叶组Ⅰ和青贮桑叶组Ⅰ较对照组Leptin表达量显著降低(P<0.05)。在肾周脂肪中,青贮桑叶组Ⅱ的Leptin表达量显著高于干桑叶组Ⅰ、Ⅱ和青贮桑叶组Ⅰ(P<0.05);且青贮桑叶组ⅠLeptin表达量相比对照组显著降低(P<0.05)。在尾部脂肪中,干桑叶组Ⅱ、青贮桑叶组ⅢLeptin表达量分别约为对照组的2.1和2.4倍,差异显著(P<0.05);与对照组相比,干桑叶组Ⅰ和青贮桑叶组Ⅰ中Leptin表达量均降低,但差异不显著(P>0.05)。与LPL基因表达量变化类似,在肝脏中Leptin基因表达量极低,饲喂桑叶后并未发生显著变化(P>0.05)。在背最长肌中,青贮桑叶组ⅡLeptin表达量约为对照组的2.6倍,差异显著(P<0.05);青贮桑叶组Ⅰ、Ⅲ中Leptin表达量均显著降低(P<0.05)。
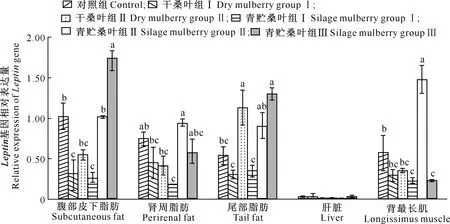
图4 日粮中添加桑叶对绒山羊不同组织中Leptin基因表达量的影响Fig.4 Effect of supplementation mulberry on Leptin expression in different tissues of Cashmere goat
3 讨 论
3.1 饲喂桑叶对绒山羊血脂代谢的影响
TG、TC、LDL-C、HDL-C是反映机体血脂代谢水平的常用指标,对猪[9]、鼠[15]、鸡[16]等动物的研究表明,在日粮中添加桑叶提取物降血脂效果明显,能显著降低血清TC、TG浓度,并抑制血清LPS活性。Kobayashi等[17]研究发现,日粮中添加桑叶提取物能显著降低血清中的LDL-C、TC浓度,而对HDL-C、TG浓度无明显影响。Song等[18]研究发现,给小鼠饲喂桑叶提取物后,高脂肪摄入日粮组血清中TC、TG、LDL-C、HDL-C浓度均显著降低。在本试验中,日粮中添加桑叶后,对绒山羊血清TC、TG、HDL-C、LPS、LPL浓度影响均不显著,但TC、TG浓度有下降趋势。LPL在TG代谢中起关键作用,可促进TG水解为游离脂肪酸以供各组织利用[19]。本试验中,日粮中添加质量分数15%干桑叶和15%青贮桑叶可显著降低绒山羊血清LDL-C浓度。对桑叶提取物中有效成分的研究表明,桑叶中富含的多糖类、黄酮类、多元酚类等生物活性物质均具有良好的降血脂、降血糖功效[8,20]。同时,桑叶中所含脂类以不饱和脂肪酸为主,其中亚麻酸、亚油酸含量可达到36%,亚油酸和亚麻酸能促进胆固醇分泌排出,从而降低血清胆固醇含量[21]。桑叶中含有单宁、纤维素等抗营养因子,可结合饲料中的生物大分子,形成不易消化的复合物[4],从而降低饲料消化率,这也是动物饲粮中不能大量添加桑叶的主要原因。本研究中,添加质量分数20%青贮桑叶组降血脂效果不显著,可能与桑叶中的抗营养因子成分有关。研究表明,桑叶中生物碱类、黄酮类等活性物质积累量具有季节性变化趋势, 9月底至10月初采收的桑叶饲喂效果较好[22]。本试验中,饲喂干桑叶或青贮桑叶均未显著降低血清TC、TG浓度,可能是由于本次试验所用桑叶采收时间较早,生物活性成分积累量未达到最佳状态所致。桑叶在青贮发酵过程中,微生物产生大量的酶类能降解植物纤维素,降低淀粉等高分子对生物碱、多糖、黄酮类等功能性成分的包裹作用,有利于有效成分的溶出[23],导致发酵后桑叶中黄酮类、生物碱类等成分有不同程度的增加[24-25]。但桑叶在晒干过程中黄酮类、生物碱类化合物损失较大[26],因此,青贮桑叶组相比干桑叶组降血脂效果更好,可能是由于青贮桑叶中黄酮类、生物碱类等有效成分含量更高所致。
3.2 绒山羊不同组织LPL、FASN、Leptin基因表达量的差异性分析
绒山羊的体脂沉积及血脂代谢受到基因调控、营养水平、年龄等多因素的影响,基因表达调控是其中的关键因素。LPL是脂肪细胞分化的标志,在脂肪酸的合成和摄取过程中有重要作用;FASN是脂肪酸从头合成的关键酶,直接调控脂肪合成过程;Leptin是肥胖基因的表达产物,主要由白色脂肪细胞分泌,以负反馈方式抑制机体脂肪沉积。本试验分析了LPL、FASN以及Leptin基因在不同组织中的表达规律,3种脂代谢调控基因在腹部皮下脂肪、尾部脂肪、肾周脂肪、肝脏中均有表达,但表现出一定的组织特异性。
本研究中,各组织中LPL基因表达量由高到低依次为腹部皮下脂肪、尾部脂肪、肾周脂肪、肝脏,在肝脏中表达量显著低于3种脂肪组织,而脂肪组织间的表达量并无显著差异。这是由于LPL主要由肝外实质细胞合成,在脂肪组织中可大量合成[10,27]。FASN表达量由高到低依次为肝脏、腹部皮下脂肪、尾部脂肪、肾周脂肪;Leptin表达量由高到低依次为腹部皮下脂肪、肾周脂肪、尾部脂肪、肝脏。肝脏中FASN表达量很高,但Leptin表达量极低,这是由于肝脏是脂肪酸合成的主要场所,脂肪酸合成过程中通过Leptin介导的细胞因子信号转导抑制因子3信号通路,组织中Leptin分泌减少能够使FASN表达量上升,促进脂肪酸合成[28]。FASN、Leptin表达量在腹部皮下脂肪中均较高,前人针对新疆褐牛脂肪代谢调控基因的研究也获得类似结果[28],这可能是由于脂肪沉积最先发生在皮下,腹部皮下也是脂肪沉积量最多的部位[29],从而发生Leptin抵抗现象。同时,本试验结果显示,LPL、FASN、Leptin基因表达量在肾周脂肪和尾部脂肪中比较接近,说明各基因表达有组织特异性,并且在同类组织中的表达也存在一致性。
3.3 日粮中添加桑叶对绒山羊各组织LPL、FASN、Leptin基因表达量的影响
本研究中,日粮中添加桑叶后,绒山羊各组织中LPL、FASN、Leptin基因表达量呈现不同的变化规律,说明桑叶可能通过影响LPL、FASN、Leptin的基因表达量从而调控机体的脂质代谢过程。日粮中添加质量分数15%青贮桑叶,绒山羊尾部脂肪、肾周脂肪和背最长肌中LPL基因表达量均显著升高。研究发现,对LPL有重要转录调控的转录因子包括过氧化物酶体增殖物激活受体(PPARs)、肿瘤坏死因子-α(TNF-α)、cAMP反应元件结合蛋白(CREB)等,PPAR-α能够激活组织中LPL的表达[30]。有研究以小鼠为模型,发现桑叶提取物作用下肝脏和脂肪组织中PPAR-α、PPAR-γ、LPL基因表达量显著上升[31]。同时,本团队在前期研究中发现,桑叶饲喂绒山羊后脂肪组织中PPARs基因表达量有上升趋势,因此笔者推测本研究脂肪组织中LPL基因表达量上升可能是PPARs表达增强引起的。
Sun等[7]在供给大鼠的高脂肪日粮中混合桑叶后,检测到肝脏中FASN基因表达量显著下降。本研究得到相似的结论,饲喂干桑叶和青贮桑叶主要影响绒山羊FASN基因在绒山羊肝脏中的表达量,而对脂肪组织和背最长肌中的基因表达无显著影响。大量研究表明,腺苷酸活化蛋白激酶(AMPK)通路在脂肪代谢中发挥重要调控作用[17,32]。FASN的表达受到固醇调节元件结合蛋白(SREBP)转录因子家族的直接调控作用,SREBP-1是肝脏中脂肪合成的关键转录因子,在AMPK通路中通过对SREBP-1的抑制作用下调FASN的表达[33]。Chang等[32]研究了桑叶提取物抑制肝脏脂肪积累的作用,检测到肝脏中FASN、SREBP-1表达量均显著降低。本试验并未对SREBP-1的表达量进行检测,后续可从AMPK通路进行机制探究。有研究指出,Leptin表达量的增加能抑制FASN的基因表达,从而减少脂肪沉积[34]。因此,本试验中饲喂桑叶组FASN基因表达量降低也可能与Leptin表达量上升有关。
Leptin是由脂肪细胞分泌的与能量代谢有关的激素,能消耗脂肪组织中的油脂而对肌肉组织无明显影响[35]。Leptin通过激活AMPK信号通路,促进TG分解及脂肪酸的氧化,降低细胞中TG和游离脂肪酸的含量[36]。有研究发现,Leptin能够提高肌肉组织中LPL的基因表达量,但抑制脂肪组织中LPL的表达[37]。本研究获得相似的结果,添加质量分数15%青贮桑叶组背最长肌中Leptin基因表达量显著升高,对应的LPL表达量也显著上升;但在脂肪组织中,未观察到Leptin、LPL基因表达量有显著上升,这可能是由于Leptin的抵抗现象引起的[12,38],具体机制应在后续试验中进行探究。
4 结 论
日粮中添加干桑叶和青贮桑叶对绒山羊脂肪代谢均有调控作用,但整体上饲喂青贮桑叶降血脂、抑制脂肪沉积效果更明显;在绒山羊日粮中添加质量分数15%的青贮桑叶有更好的降血脂效果,降低血液中TC、TG、LDL-C浓度,并且能够促进脂肪组织中LPL、Leptin基因表达,抑制肝脏中FASN基因的表达。
[1] 高雨飞,黎力之,欧阳克蕙,等.桑叶在肉牛生产中的开发利用 [J].中国牛业科学,2015,41(1):68-70.
Gao Y F,Li L Z,Ouyang K H,et al.The development and utilization of mulberry leaf in beef cattle production [J].China Cattle Science,2015,41(1):68-70.
[2] 中国饲料数据库.中国饲料成分及营养价值表[DB/OL].[2016-12-30].http://www.chinafeeddata.org.cn/China Feed-Database Information Network Centre.Tables of feed composition and nutritive values in China [DB/OL].[2016-12-30].http://www.chinafeeddata.org.cn/
[3] 王雯熙,杨红建,薄玉琨,等.不同品种桑叶营养成分分析与代谢能值评定研究 [J].中国畜牧杂志,2012,48(3):41-45.
Wang W X,Yang H J,Bo Y K,et al.Study on nutritional composition and energy metabolism of different mulberry leaves [J].Chinese Journal of Animal Science,2012,48(3):41-45.
[4] 杜周和,刘俊凤,左艳春,等.桑叶的营养特性及其饲料开发利用价值 [J].草业学报,2011,20(5):192-200.
Du Z H,Liu J F,Zuo Y C,et al.The nutrient components and utilization of mulberry as animal forage [J].Acta Prataculturae Sinica,2011,20(5):192-200.
[5] 吴 萍,厉宝林,李 龙,等.日粮中添加桑叶粉对黄羽肉鸡生长性能、屠宰性能和肉品质的影响 [J].中国家禽,2007,29(7):13-15.
Wu P,Li B L,Li L,et al.Effect of dietary mulberry powder on growth performance, slaughter performance and meat quality of Yellow-feather broilers [J].China Poultry,2007,29(7):13-15.
[6] 刘爱君,李素侠,吴国明,等.鲜桑叶对育肥猪增重效果的对比 [J].中国牧业通讯,2007(18):76-77.
Liu A J,Li S X,Wu G M,et al.Effect of fresh mulberry leaves to fatten pigs weight [J].China Animal Husbandry Bulletin,2007(18):76-77.
[7] Sun X,Yamasaki M,Katsube T,et al.Effects of quercetin derivatives from mulberry leaves:improved gene expression related hepatic lipid and glucose metabolism in short-term high-fat fed mice [J].Nutr Res Pract,2015,9(2):137-143.
[8] Wu C,Chen S,Ou T,et al.Mulberry leaf polyphenol extracts reduced hepatic lipid accumulation involving regulation of adenosine monophosphate activated protein kinase and lipogenic enzymes [J].Journal of Functional Foods,2013,5(4):1620-1632.
[9] 李有贵,张 雷,钟 石,等.饲粮中添加桑叶对育肥猪生长性能、脂肪代谢和肉品质的影响 [J].动物营养学报,2012,24(9):1805-1811.
Li Y G,Zhang L,Zhong S,et al.Effects of dietary mulberry leaf on growth performance,fat metabolism and meat quality of finishing pigs [J].Chinese Journal of Animal Nutrition,2012,24(9):1805-1811.
[10] Young S G,Davies B S J,Voss C V,et al.GPIHBP1,an endothelial cell transporter for lipoprotein lipase [J].Journal of Lipid Research,2011,52(11):1869-1884.
[11] Smith S.The animal fatty-acid synthase-one gene,one polypeptide,7 enzymes [J].Faseb Journal,1994,8(15):1248-1259.
[12] Heinrich G,Russo L,Castaneda T R,et al.Leptinresistance contributes to obesity in mice with null mutation of carcinoembryonic antigen-related cell adhesion molecule 1 [J].Journal of Biological Chemistry,2016,291(21):11124-11132.
[13] 贾亚洲,付中华,白克明.桑叶塑料袋装简易青贮技术 [J].北方蚕业,2016,37(2):31-33,48.
Jia Y Z,Fu Z H,Bai K M.Simple plastic bag silage technology for mulberry leaf [J].Northern Sericulture,2016,37(2):31-33,48.
[14] 高 晔,李碧波,黄 帅,等.陕北白绒山羊羯羊能量和蛋白质需要量 [J].动物营养学报,2016,28(3):720-730.
Gao Y,Li B B,Huang S,et al.Energy and protein requirements of Shaanbei white Cashmere wether goats [J].Chinese Journal of Animal Nutrition,2016,28(3):720-730.
[15] 李有贵,钟 石,吕志强,等.饲料中添加桑叶粉对单胃哺乳动物小鼠的脂肪代谢影响 [J].蚕业科学,2012,38(3):404-411.
Li Y G,Zhong S,Lü Z Q,et al.Impact of mulberry leaf powder added to diet on fat metabolism of the monogastric mammal mice [J].Science of Sericulture,2012,38(3):404-411.
[16] 章学东,李有贵,张 雷,等.桑叶粉对蛋鸡生产性能、蛋品质和血清生化指标的影响研究 [J].中国家禽,2012,34(16):25-28.
Zhang X D,Li Y G,Zhang L,et al.Effect of dietary mulberry leaves on productive performance,egg quality and serum biochemical indices of laying hens [J].China Poultry,2012,34(16):25-28.
[17] Kobayashi Y,Miyazawa M,Araki M,et al.Effects ofMorusalbaL. (mulberry) leaf extract in hypercholesterolemic mice on suppression of cholesterol synthesis [J].Journal of Pharmacognosy & Natural Products,2016,2(1):1-9.
[18] Song H,Lai J,Tang Q,et al.Mulberry ethanol extract attenuates hepatic steatosis and insulin resistance in high-fat diet-fed mice [J].Nutrition Research,2016,36(7):710-718.
[19] Kawano M,Hozumi Y,Itoh K.Tamoxifen might influence the affinity ofLPLfor heparin-Sepharose [J].Clinica Chimica Acta,2003,337(1/2):141-145.
[20] 陈晓燕.桃仁、桑叶化学成分及生物活性研究 [D].北京:北京协和医学院,2014.
Chen X Y.Studies on the chemical constituents and bioactivities of the seeds of Prunus davidiana and the leaves ofMorusalba[D].Beijing:Beijing Union Medical College,2014.
[21] Dwivedi C,Natarajan K,Matthees D P.Chemopreventive effects of dietary flaxseed oil on colon tumor development [J].Nutr Cancer,2005,51(1):52-58.
[22] 张丽丽,白永亮,宿树兰,等.不同品种不同生长期桑叶中生物碱类与黄酮类化学成分的积累动态分析评价 [J].中国中药杂志,2014,39(24):4822-4828.
Zhang L L,Bai Y L,Su S L,et al.Dynamic analysis of alkaloids and flavonoids inGenusMorusL.in China during different harvesting time [J].China Journal of Chinese Materia Medics,2014,39(24):4822-4828.
[23] Dunière L,Sindou J,Chaucheyras-Durand F,et al.Silage processing and strategies to prevent persistence of undesirable microorganisms [J].Animal Feed Science and Technology,2013,182(1):1-15.
[24] 孙国霞,王 俊,龚 敏,等.不同叶位桑叶及发酵温度对桑红茶中活性成分含量的影响 [J].蚕业科学,2011,37(6):1061-1066.
Sun G X,Wang J,Gong M,et al.Influences of mulberry leaf position and fermentation temperature on contents of active ingredients in mulberry black tea [J].Science of Sericulture,2011,37(6):1061-1066.
[25] 王吉成,刘 轩,唐劲天,等.桑叶发酵前后总黄酮、总酚酸含量变化及抗氧化活性研究 [J].中国民族民间医药杂志,2014,23(23):15-18.
Wang J C,Liu X,Tang J T,et al.Antioxidant activities and determination of total flavonoids and total phenolics in the fermentation and non-fermentation products in mulberry leaf [J].Chinese Journal of Ethnomedicine and Ethnopharmacy,2014, 23(23):15-18.
[26] 白永亮,段金廒,宿树兰,等.桑叶干燥过程中黄酮类和生物碱类成分动态变化分析 [J].中药材,2014,37(7):1158-1163.
Bai Y L,Duan J A,Su S L,et al.Analysis of dynamic changes of flavonoids and alkaloids during different drying process of morus alba leaves [J].Journal of Chinese Medicinal Materials,2014,37(7):1158-1163.
[27] Augustin J G H.The role of lipoprotein lipase-molecular properties and clinical relevance [J].Atherosclerosis Reviews,1979,5:91-124.
[28] Li N,Li H,Yan X,et al.Correlation between four metabolism-related genes in different adipose tissues and adipocyte morphology in Xinjiang brown cattle [J].International Journal of Clinical and Experimental Medicine,2016,9(3):5912-5921.
[29] 张艳芳.CPT1基因对猪脂肪沉积的影响及其调控机制的研究 [D].杭州:浙江大学,2010.
Zhang Y F.Research on intestinal absorption characteristics of iron glycine chelate and its biological effects [D].Hangzhou:Zhejiang University,2010.
[30] Staels B,Dallongeville J,Auwerx J,et al.Mechanism of action of fibrates on lipid and lipoprotein metabolism [J].Circulation,1998,98(19):2088-2093.
[31] Park M,Lee K,Sung M.Effects of dietary mulberry,Korean red ginseng,and banaba on glucose homeostasis in relation toPPAR-α,PPAR-γ,andLPLmRNA expressions [J].Life Sciences,2005,77(26):3344-3354.
[32] Chang J,Hsu M,Huang H,et al.Mulberry anthocyanins inhibit oleic acid induced lipid accumulation by reduction of lipogenesis and promotion of hepatic lipid clearance [J].Journal of Agricultural and Food Chemistry,2013,61(25):6069-6076.
[33] Zhou J,Shi M X,Mitchell T D,et al.Changes in rat adipocyte and liver glucose metabolism following repeated restraint stress [J].Experimental Biology and Medicine,2001,226(4):312-319.
[34] Nogalska A,Swierczynski J.Potential role of high serumLeptinconcentration in age-related decrease of fatty acid synthase gene expression in rat white adipose tissue [J].Experimental Gerontology,2004,39(1):147-150.
[35] Barzilai N,Wang J L,Massilon D,et al.Leptinselectively decreases visceral adiposity and enhances insulin action [J].Journal of Clinical Investigation,1997,100(12):3105-3110.
[36] 黄 英,杨明华,孔令富,等.Leptin介导AMPK信号通路对猪皮下前脂肪细胞脂类代谢调控的研究 [J].生物技术通报,2016,32(2):211-218.
Huang Y,Yang M H,Kong L F,et al.The regulation ofLeptin-mediated AMPK signal pathway on lipid metabolism in porcine subcutaneous preadipocyte [J].Biotechnology Bulletin,2016,32(2):211-218.
[37] Donahoo W T,Stob N R,Ammon S,et al.Leptinincreases skeletal muscle lipoprotein lipase and postprandial lipid metabolism in mice [J].Metabolism,2011,60(3):438-443.
[38] Lin S,Thomas T C,Storlien L H,et al.Development of high fat diet-induced obesity andLeptinresistance in C57BI/6J mice [J].International Journal of Obesity,2000,24(5):639-646.

