斜卧青霉转录调控蛋白Hac1染色质免疫共沉淀分析方法的建立
房艳华,韦小敏,李 肖,来航线,马小娟(西北农林科技大学 资源环境学院,陕西 杨凌 712100)
染色质免疫共沉淀(Chromatin Immunoprecipitation,CHIP)技术是在生理状态下将细胞内的DNA与蛋白质交联在一起,通过超声波或酶处理将染色质切为小片段(100~1 000 bp最佳),用交联蛋白的特异性抗体沉淀交联物,从而将与目的蛋白结合的 DNA 片段沉淀下来的一种技术。人们通过对目的DNA片段的纯化和检测,获得蛋白质与DNA相互作用的信息[1]。因此,染色质免疫共沉淀技术是研究DNA-蛋白质体内瞬时相互作用的常用方法之一[2-3],可以用来研究转录因子和靶基因启动子区域在体内的相互作用,从而确定它们之间相互作用方式的动态变化[4-6],是揭示基因表达调控机制的重要手段。近年来,此技术经过不断的发展和完善,特别是与DNA芯片和分子克隆技术相结合,已经应用于高通量筛选已知蛋白因子的未知DNA靶点和反式作用因子在整个基因组上分布情况[7-10]的研究。
CHIP技术自问世以来,在国内外得到了广泛的应用[11-12],如在酿酒酵母上成功找到了组蛋白H4的结合区域[13],在烟曲霉上成功发现了固醇转录调控蛋白SrbA在真菌缺氧和毒性反应条件下的新调控机制[14],然而在斜卧青霉菌上尚未见相关报道。Hac1是斜卧青霉调控蛋白分泌的重要因子,运用CHIP技术研究斜卧青霉转录调控蛋白Hac1的调控机制,有助于揭示蛋白分泌的深层机理,提高蛋白分泌能力。为此,本研究以斜卧青霉转录调控因子Hac1为研究对象(交联蛋白),对CHIP操作过程中的交联时间、菌丝用量及超声破碎条件(功率、超声时间、间隔时间、超声次数)等进行优化,分析CHIP技术在斜卧青霉上应用的可能性,以期找出Hac1调控的靶基因。
1 材料与方法
1.1 材 料
1.1.1 菌 株 斜卧青霉菌株114-2由山东大学提供。
1.1.2 试剂及仪器 二硫苏糖醇(DTT)、蛋白酶抑制剂苯甲基磺酰氟(PMSF)、4-羟乙基哌嗪乙磺酸(HEPES)和RNA酶,购自上海生工生物工程公司;真菌蛋白酶抑制剂,购自Sigma公司。QIAquick PCR purification kit试剂盒(QIAGEN),超声波破碎仪(新芝,JY92- IIN),核酸测定仪(BioTek Epoch)。
Mandel’s营养盐:KH2PO43 g/L,NaNO32.6 g/L,尿素0.5 g/L,FeSO4·7H2O 7.5 mg/L,MnSO4·H2O 2.5 mg/L,ZnSO4·7H2O 3.6 mg/L,CoCl2·6H2O 3.7 mg/L,MgSO4.7H2O 0.5 g/L,CaCl20.5 g/L,蛋白胨1 g/L,pH约5.5。葡萄糖基础培养基:Mandel’s营养盐+质量分数2%葡萄糖。麸皮-微晶纤维素培养基:Mandel’s营养盐+质量分数1%麸皮+质量分数1%微晶纤维素。
交联Buffer:0.4 mol/L蔗糖,10 mmol/L Tris-HCl,pH 8.0,1 mmol/L EDTA,使用前添加1 mmol/L PMSF和体积分数1%的甲醛。CHIP缓冲液:50 mmol/L HEPES (pH 7.5),150 mmol/L NaCl,1 mmol/L EDTA,体积分数1% TritonX-100,质量分数0.1%脱氧胆酸盐,质量分数0.1% SDS,1 mmol/L PMSF,1×真菌蛋白酶抑制剂。低盐缓冲液:150 mmol/L NaCl,质量分数0.1% SDS,体积分数1% TritonX-100,2 mmol/L EDTA,20 mmol/L Tris-HCl,pH 8.0。高盐缓冲液:500 mmol/L NaCl,质量分数0.1% SDS,体积分数1% TritonX-100,2 mmol/L EDTA,20 mmol/L Tris-HCl,pH 8.0。LiCl缓冲液:0.25 mol/L LiCl,体积分数1% NP40,质量分数1%脱氧胆酸钠,1 mmol/L EDTA,10 mmol/L Tris-HCl,pH 8.0。
1.2 CHIP关键条件的优化
1.2.1 菌丝体制备 用50 mL葡萄糖液体基础培养基摇瓶培养斜卧青霉48 h后,抽滤收集菌丝体,称取约500 mg菌丝体转接到50 mL麸皮-微晶纤维素液体培养基中,摇瓶培养7 h后,加入终浓度为10 mmol/L的DTT诱导Hacl表达,继续培养12 h,真空抽滤收集菌丝体,无菌ddH2O冲洗2次备用。
1.2.2 交联时间的优化 取真空抽滤收集的菌丝放入无菌的250 mL锥形瓶中,加入50 mL交联Buffer,30 ℃、100 r/min轻摇,使DNA和目的蛋白(Hac1)充分交联,交联时间分别设置为5,10,20,30 和40 min,交联结束后加入2.5 mL 2 mol/L的甘氨酸终止反应,然后继续摇动温育10 min。交联菌丝真空过滤器抽干,无菌ddH2O冲洗后,立即用液氮速冻后于-80 ℃储存。
1.2.3 超声波破碎菌丝用量的优化 用液氮将冷冻菌丝快速研磨成粉末,分别取0.25,0.50,1.00和1.50 g菌丝粉末转移到装有10 mL CHIP缓冲液的50 mL离心管中,涡旋混匀,取500 μL样品置于1.5 mL离心管中,以备超声波破碎使用。
1.2.4 DNA超声波破碎条件的优化 取适量经液氮冷冻研磨的菌丝粉末置于装有10 mL CHIP缓冲液的50 mL离心管中,涡旋混匀后分成多份,每份500 μL,置于1.5 mL离心管中进行超声波破碎,对超声功率、超声时间、间隔时间和超声次数进行优化。试验中超声功率设置为15 W(6%),20 W(8%),25 W(10%)和30 W(12%);超声时间设置为1,3和5 s;超声间隔时间设置为10,20,30和40 s;超声次数设置为15,25,30和40次。在对某一条件优化时固定其他3个条件不变,本试验各条件的固定值为超声功率25 W(10%),超声工作时间 5 s,间隔时间40 s,超声30次。
样品经超声破碎仪超声打断后,于4 ℃条件下10 000 r/min离心5 min,取400 μL上清液平均分装到2个新的离心管中,一管用于解交联染色体检验,另一管用于CHIP试验。
1.2.5 解交联染色体的检验 分别取200 μL超声样品和1.2.2节的交联样品,加入8 μL 5 mol/L NaCl,65 ℃温育6 h或过夜后,使交联的DNA和Hac1蛋白质解交联[14],然后用抽提缓冲液(V(苯酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1)抽提1次,再用氯仿抽提。向抽提液中加入20 μg糖原和1 mL无水乙醇沉淀DNA 1 h,4 ℃下13 000 r/min 离心10 min,乙醇挥发后加入30 μL 1×TE溶解DNA,最后加入1 μL RNA酶(10 mg/mL),并在37 ℃下温育30 min。对上述样品进行1%琼脂糖凝胶电泳,检测样品的超声效果,从而确定各条件的优化结果。
1.3 CHIP试验
以优化的条件对菌丝进行处理,获得合格的DNA片段,进行染色质免疫共沉淀试验。
1.3.1 磁珠的清洗 为防止蛋白A/G琼脂糖磁珠受损,每份超声样品用去尖端的枪头吸取120 μL 蛋白A/G琼脂糖磁珠分装于2个1.5 mL的离心管中,用500 μL CHIP缓冲液冲洗2次, 4 ℃下1 000 r/min 离心1 min后收集磁珠。
1.3.2 样品的预处理 将1.2.3节的超声样品加入到蛋白A/G琼脂糖磁珠中,于 4 ℃冷室缓慢摇晃孵育1 h,将样品中可以结合蛋白A/G琼脂糖磁珠的物质去除,防止非特异性结合,提高试验的准确性和可重复性。将样品于4 ℃下10 000 r/min离心2 min,取上清,用于下一步试验。
1.3.3 抗原抗体的结合 将预处理后的样品分为2组,一组加入10 μg亲和纯化抗体(转录因子Hac1特异性抗体),标记为试验组;一组不加抗体,作为阴性对照组。所有处理同时置于4 ℃冷室,缓慢摇晃孵育过夜。在孵育过程中,抗体会特异性地与交联了目的DNA片段的抗原蛋白结合。
1.3.4 抗体磁珠吸附 将75 μL用CHIP缓冲液预处理过的蛋白A/G琼脂糖磁珠分别加入上述2组样品中,4 ℃冷室缓慢摇晃4 h,使蛋白A/G琼脂糖磁珠特异性地与抗体结合。然后于4 ℃下1 000 r/min离心1 min,使蛋白A/G琼脂糖磁珠结合的抗体、抗原蛋白和交联的DNA共同沉淀,小心弃上清,保留沉淀。
1.3.5 沉淀的清洗 为去除非特异性结合,向上述沉淀中依次加入1 mL下述清洗缓冲液,缓慢摇晃5 min,4 ℃下 1 000 r/min离心1 min,弃上清。清洗时所用缓冲液依次为:低盐缓冲液(清洗1次),高盐缓冲液(清洗1次), LiCl缓冲液(清洗1次), TE缓冲液(1 mmol/L EDTA、10 mmol/L Tris-HCl,pH 8.0,清洗2次)。
1.4 解交联
收集1.3节所得清洗后的沉淀,加入100 μL新配制的Elution缓冲液洗脱,摇晃混匀,65 ℃温育10 min,1 000 r/min离心1 min,将上清液小心转移到一支新的1.5 mL离心管中,沉淀继续加入100 μL Elution缓冲液进行第2次洗脱。2次洗脱后所得上清液共200 μL。所有样品加入8 μL 5 mol/L NaCl溶液,65 ℃静置6~8 h,使交联的蛋白和DNA解交联。
1.5 DNA纯化及检测
在解交联溶液中加入1 μL 10 mg/mL的RNA酶于37 ℃温育30 min,以去除溶液中残留的RNA。然后按照QIAquick PCR purification kit试剂盒说明书纯化DNA,纯化后的DNA用30 μL EB缓冲液溶解。用BioTek Epoch核酸测定仪检测纯化的DNA浓度。以纯化后的DNA为模板,以随机引物1(5′-GGTGACGCAG-3′)和2(5′-CTCTCCGCCA-3′)进行PCR检测,试验同时设置不加抗体的处理作为阴性对照,引物由上海生工生物公司合成。PCR扩增反应体系为:模板DNA 1 μL,Taq酶 (5 U/μL) 0.5 μL,10×PCR Buffer 5.0 μL,dNTP (10 mmol/L) 2.0 μL,引物1或2 (10 mmol/L)1.5 μL,ddH2O补足25 μL。PCR扩增程序为:94 ℃ 5 min;94 ℃变性1 min,32~34 ℃退火l min,72 ℃延伸1.5 min,40次循环;72 ℃充分延伸7 min。反应结束后,将扩增产物于1%琼脂糖凝胶中进行电泳检测。
2 结果与分析
2.1 斜卧青霉CHIP试验交联时间的优化
DNA与蛋白质有效交联是染色质免疫共沉淀试验的关键一步,本研究中超声破碎染色质片段和直接解交联所得DNA的电泳结果见图1。
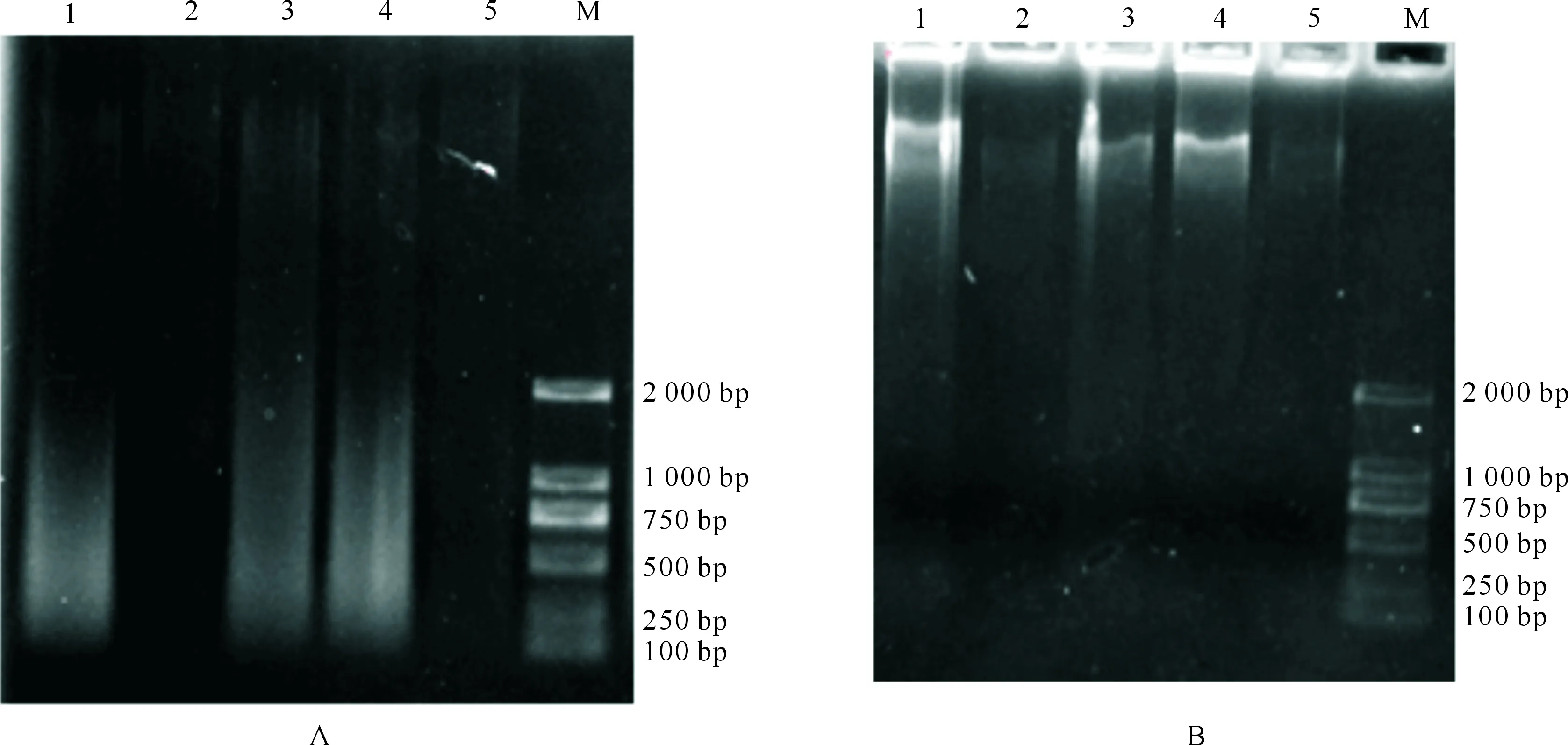
A.交联样品经超声打断后解交联产物的电泳结果;B.交联样品直接解交联产物的电泳结果;1~5.交联时间分别为5,30,10,20,40 min;M.DNA MarkerA.Cross-linked sample by reverse crosslinking after ultrasonic interruption;B.Cross-linked sample by reverse crosslinking directly;1-5.Crosslinking times were 5,30,10,20,and 40 min;M.DNA Marker图1 斜卧青霉Hac1 CHIP试验交联时间的优化Fig.1 Optimization of crosslinking time for ultra-sonication used in CHIP in Penicillium decumbens
图1-A显示,交联时间明显影响超声破碎DNA的效果,交联时间在5~20 min时DNA都能被打断,但交联时间≥30 min时DNA很难被打断。图1-B显示,交联时间在5~20 min时,直接解交联处理的样品总DNA能被提取出来,而交联时间≥30 min时直接解交联的DNA很难被提取。结果表明,随着交联时间的延长,DNA与蛋白结合得越紧密,很难超声打断及解交联,所以交联时间应控制在20 min以内。
2.2 斜卧青霉CHIP试验菌丝用量的优化
试验中,由于10 mL CHIP缓冲液中加入1.50 g菌丝时,菌悬液浓度过高,超声过程中产生泡沫,造成空打,不能充分打断DNA,因此无法进行后续研究;由图2可见,10 mL CHIP缓冲液中加入0.25或0.50 g菌丝时,超声打断后的电泳条带不够亮,DNA含量不高;加入1.00 g菌丝时,超声可正常进行且条带较亮。因此为了保证后续共沉淀中DNA量足够,本试验10 mL CHIP缓冲液中的菌丝用量以1.00 g为宜。
2.3 斜卧青霉CHIP试验超声波破碎条件的优化
2.3.1 超声功率 图3结果表明,当超声功率为15 W(6%)和20 W(8%)时,超声打断的DNA片段比较分散,部分片段长度达1 000 bp以上,不适合进行后续CHIP试验;当超声功率提高到25 W(10%)时,超声打断的DNA片段大部分长度集中在100~800 bp,可满足后续试验要求;超声功率达30 W(12%)时,DNA片段长度也集中在100~800 bp,与功率为25 W(10%)时的效果相差不大,综合考虑选择25 W(10%)的超声功率。
2.3.2 超声工作时间及间隔时间 图4表明,保持超声功率25 W(10%)、超声30次不变的情况下,改变超声工作时间和间隔时间,超声打断DNA的效率不同。由图4-A可知,随着超声工作时间的延长,DNA片段长度变小,当超声工作时间为5 s时,大部分DNA片段长度在1 000 bp以下,已基本符合CHIP试验要求。由图4-B可知,随着间隔时间的延长,DNA片段趋于集中,其中当间隔时间为30 s时,DNA片段长度在100~1 000 bp;当间隔时间为40 s时,DNA片段长度在100~800 bp,符合染色质免疫共沉淀要求。因此为保证后续试验顺利进行,选择超声工作时间为5 s,间隔40 s。

1~3.菌丝添加量分别为0.25,0.50,1.00 g;M.DNA Marker1-3.The dosages of hyphae were 0.25,0.50,1.00 g;M.DNA Marker图2 斜卧青霉Hac1 CHIP试验菌丝用量的优化Fig.2 Optimization of hyphae dosage for ultra-sonication used in CHIP in Penicillium decumbens1~4.超声功率分别为15,20,25和30 W;M.DNA Marker1-4.Ultrasonic power was 15,20,25 and 30 W;M.DNA Marker图3 斜卧青霉Hac1 CHIP试验超声波破碎功率的优化Fig.3 Optimization of ultrasonic power used in CHIP in Penicillium decumbens
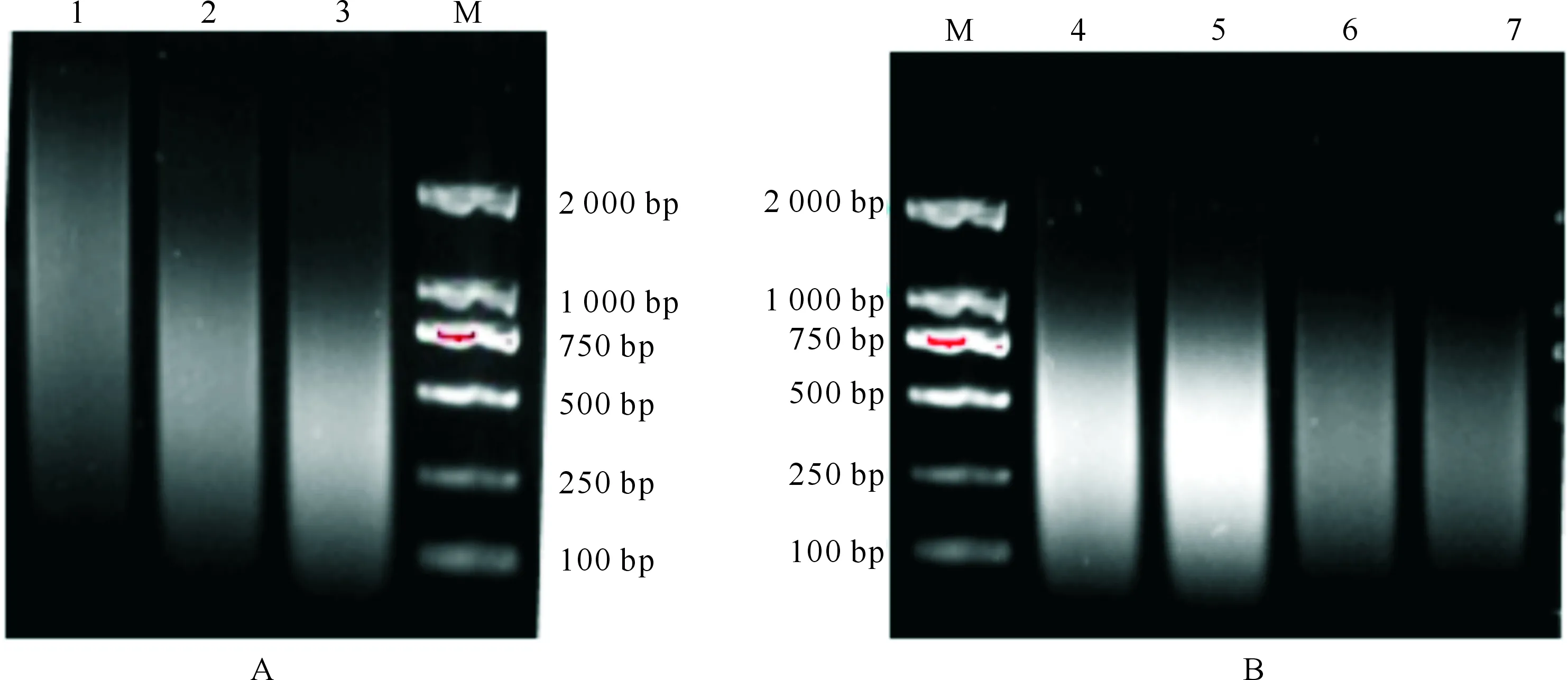
1~3.超声时间分别为1,3,5 s;4~7.间隔时间分别为10,20,30,40 s;M.DNA Marker1-3.Ultrasonic times were 1,3,and 5 s;4-7.Interval times were 10,20,30,and 40 s;M.DNA Marker图4 斜卧青霉Hac1 CHIP试验超声波破碎工作时间(A)及间隔时间(B)的优化Fig.4 Optimization of ultrasonic work time and interval time used in CHIP in Penicillium decumbens
2.3.3 超声次数的确定 图5结果表明,随着超声次数增加,DNA片段逐渐变小,当超声次数为15和25次时,得到的大部分DNA片段长度在500~1 000 bp,片段较大;当超声次数为30次时,DNA片段长度主要集中在100~750 bp,符合后续试验要求;当超声次数达到40次时,大部分DNA片段长度在500 bp以下,片段过小。因此,确定超声次数以30次为宜。
2.4 CHIP试验所得DNA的PCR检测
样品经抗原抗体结合、磁珠吸附、解交联等步骤获得DNA,用QIAquick PCR purification kit试剂盒纯化后,进行DNA浓度测定和随机PCR扩增验证,试验组纯化后测得DNA浓度为10.44 ng/μL。以此DNA为模板进行PCR扩增,结果在500~750 bp间可见明显的扩增条带(图6),说明成功富集到了转录因子Hac1特异性结合的DNA片段。
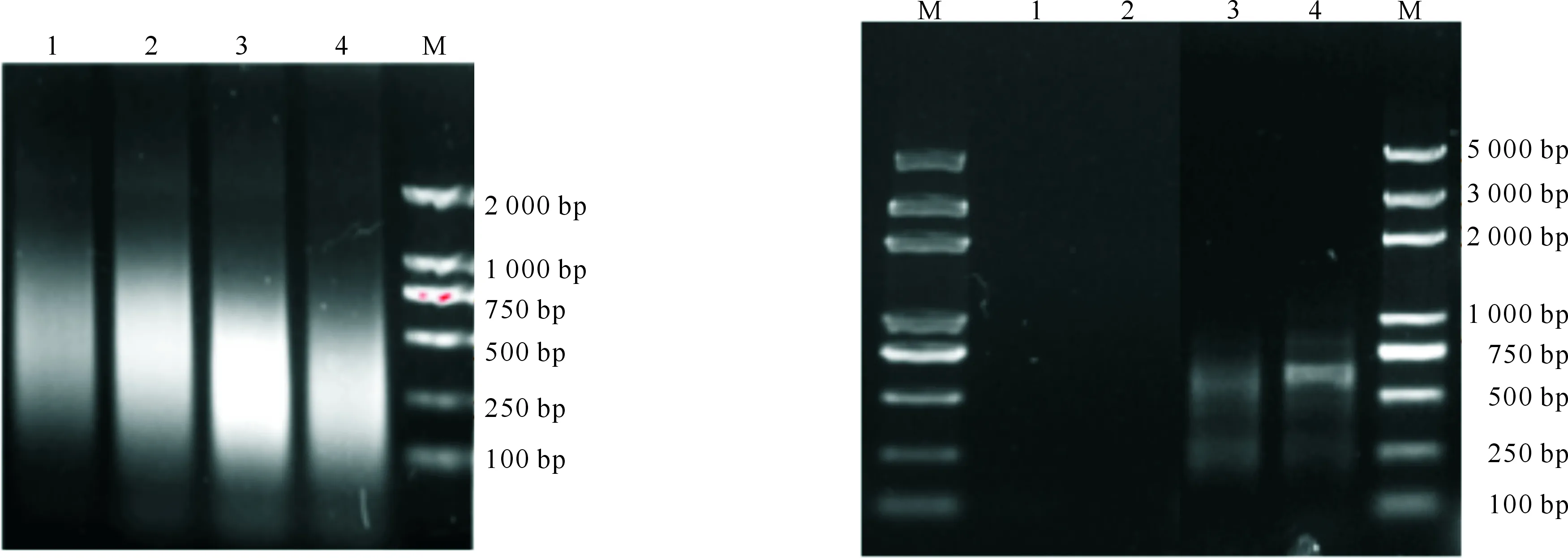
1~4.超声次数分别为15,25,30,40次;M.DNA Marker1-4.Ultrasonic frequencies were 15,25,30,and 40 times;M.DNA Marker图5 斜卧青霉Hac1 CHIP试验超声波破碎次数的优化Fig.5 Optimization of ultrasonic frequency used in CHIP in Penicillium decumbens1~2.分别为阴性对照组随机引物1和2扩增产物;3~4.分别为试验组随机引物1和2扩增产物;M.DNA Marker1-2.The control group results of PCR amplification using random primer 1 and primer 2;3-4.The experimental group results of PCR amplification using random primer 1 and primer 2;M.DNA Marker图6 斜卧青霉Hac1 CHIP试验所获DNA的PCR检验结果Fig.6 PCR amplification of DNA collected by CHIP in Penicillium decumbens
3 讨 论
转录因子(Transcription factor,TF)是一类很重要的蛋白质分子,其可以通过靶定调控一些下游效应分子,引发一系列级联反应,从而发挥强大的生物学作用[15]。近年来,染色质免疫共沉淀技术逐渐发展成熟,利用此项技术找出转录因子的靶基因,从而揭示转录因子的生物学功能和调控机制,受到了研究者的关注。
Grably等[13]以酿酒酵母为材料,首先破碎细胞提取细胞核,然后进行细胞核超声破碎,获得合适的染色质片段;本研究参照Chung等[14]的方法将交联菌丝液氮研磨处理后,直接超声打断,省去了提核的步骤。Baranello等[16]的研究表明,交联时间对染色质免疫共沉淀的后续步骤影响较大,交联时间过长,细胞染色质难以超声破碎,影响结果,而且试验材料也容易在离心过程中丢失;交联时间过短,则交联不完全,容易产生假阴性反应。本研究结果表明,当交联时间≥20 min时,交联的DNA和蛋白质不能被充分解交联,而且不能被超声打断,所以交联时间需控制在20 min以内。在染色质免疫共沉淀过程中,超声破碎染色质的程度对于整个试验的成功至关重要,超声不彻底会引起染色质蛋白复合物过大,抗体不易富集;超声过度则会引起蛋白降解或蛋白抗原表位被破坏,影响富集[17]。一般认为染色质被超声打碎成100~1 000 bp的片段最好[18]。本试验最终确定,超声破碎功率25 W(10%)、超声工作时间5 s、间隔40 s、超声30次为最适合斜卧青霉染色质破碎的条件。影响超声波破碎效率的另外一个重要因素是超声打断染色体的量,染色体量太小,特异性抗原与抗体结合的概率较小,染色质免疫共沉淀效率降低;染色体量太大,超声打断时由于液体中染色体浓度太大,超声过程中容易起沫,泡沫飞溅易造成空打且会造成超声破碎仪的损坏,也会影响破碎效率。本试验发现,超声破碎的最佳菌丝用量为10 mL CHIP缓冲液中加入1.00 g菌丝。本研究通过对交联时间、超声条件、菌丝用量等条件的优化,成功富集到转录因子Hac1结合的特异性DNA序列,为Hac1的生物学功能研究奠定了基础。相较于以往对超声波破碎条件的相关研究,本研究对斜卧青霉超声波破碎的条件进行了系统而全面的研究,避免因超声产物不合格而浪费昂贵的抗体,同时也为研究其他丝状真菌转录因子的生物学功能及调控机制提供了思路。
[1] 李 玲,杨鹏跃,朱本忠,等.染色质免疫共沉淀技术的应用和研究进展 [J].中国食品学报,2012(6):124-132.
Li L,Yang P Y,Zhu B Z,et al.Chromatin immunoprecipitation technology application and research progress [J].Journal of Chinese Institute of Food Science and Technology,2012(6):124-132.
[2] Rusk N.Reverse CHIP [J].Nat Methods,2009,6(3):187.
[3] Déjardin J,Kingston R E.Purification of proteins associated with specific genomic loci [J].Cell,2009,136(1):175-186.
[4] Kuo M H,Allis C D.Invivocross-linking and immunoprecipitation for studying dynamic protein:DNA associations in a chromatin environment [J].Methods,1999,19(3):425-433.
[5] Chien T Y,Lin C K,Lin C W,et al.DBD2BS:connecting a DNA-binding protein with its binding sites [J].Nucleic Acids Research,2012(40):W173-179.
[6] Wade J T,Struhl K,Busby S J W,et al.Genomic analysis of protein-DNA interactions in bacteria:insights into transcription and chromosome organization [J].Molecular Microbiology,2007,65(1):21-26.
[7] 李 玲,傅达奇,朱 毅,等.利用染色质免疫共沉淀技术确定转录因子RIN调控的靶基因 [J].生物技术通报,2011(12):166-170.
Li L, Fu D Q,Zhu Y,et al.Determining the target genes of RIN transcription factor by chromatin immunoprecipition [J].Journal of Biotechnology Bulletin,2011(12):166-170.
[8] Weinmann A S,Bartley S M,Zhang T,et al.Use of chromatin immunoprecipitation to clone novel E2F target promoters [J].Mol Cell Biol,2001,21(20):6820-6832.
[9] Ren B,Robert F,Wyrick J J,et al.Genome-wide location and function of DNA binding proteins [J].Science,2000,290(5500):2306-2309.
[10] Lieb J D,Liu X,Botstein D,et al.Promoter-specific binding of Rap1 revealed by genome-wide maps of protein-DNA association [J].Nat Genet,2001,28(4):327-334.
[11] Robertson G,Hirst M,Bainbridge M,et al.Genome-wide profiles of STZT1 DNA association using chromatin immunoprcipitation and massively parallel sequencing [J].Nature Methods,2007,4(8):651-665.
[12] Oh S W,Mukhopadhyay A,Dixit B L,et al.Idenification of direct DAF-16 targets controlling longevity, metabolism and diapauses by chromatin immunoprecipitation [J].Nature Geneties,2006,38(2):251-257.
[13] Grably M,Engelberg D.A detailed protocol for chromatin immunoprecipitation in the yeastSaccharomycescerevisiae[J].Methods in Molecular Biology,2010,63(8):211-224.
[14] Chung D,Barker B M,Carey C C,et al.CHIP-seq andinvivotranscriptome analyses of theAspergillusfumigatusSREBP SrbA reveals a new regulator of the fungal hypoxia response and virulence [J].Plos Pathogens,2014,10(11):e1004487.
[15] 梁 芳,徐 柯,龚朝建,等.染色质免疫沉淀-测序:全基因组范围研究蛋白质-DNA相互作用的新技术 [J].生物化学与生物物理进展,2013(3):216-227.
Liang F,Xu K,Gong C J,et al.Chromatin immuoprecipitation-sequencing: genome-wide studies of interaction of DNA and protein [J].Progress in Biochemistry and Biophysics,2013(3):216-227.
[16] Baranello L,Kouzine F,Sanford S,et al.CHIP bias as a function of cross-linking time [J].Chromosome Research,2016,24(2):175-181.
[17] 董 浩,彭小薇,王晓英,等.染色质免疫共沉淀技术对羊种布鲁氏菌转录调控因子MucR靶基因的筛选 [J].中国农业大学学报,2016,21(4):102-106.
Dong H,Peng X W,Wang X Y,et al.Indentification of the targets of MucR by chromatin immunoprecipition inBrucellamelitensis[J].Journal of China Agricultural University,2016,21(4):102-106.
[18] 李冬明,宋 渊,安黎哲.植物染色质免疫共沉淀方法 [J].草业科学,2014,31(4):659-667.
Li D M,Song Y,An L Z.Method for plant chromatin immunoprecipitation assay [J].Journal of Pratacultural Science,2014,31(4):659-667.

