具有多靶点抗阿尔茨海默病活性的黄酮类化合物研究进展
袁丽娟,王柯人,桑志培*
(1杭州市余杭区第一人民医院药剂科,杭州 311100;2南阳师范学院化学与制药工程学院,南阳 473061)
阿尔茨海默症(Alzheimer′s disease,AD),又称老年性痴呆症,是一种严重威胁老年人的慢性神经退行性疾病,发病率随着年龄增大而增高。其临床主要表现为记忆功能减退、并伴有语言、记忆、认知、推理、定向力和判断力等多种功能障碍,并逐渐丧失生活自理能力。AD患者脑内主要病理学特征为β淀粉样蛋白(β-amyloid,Aβ)沉积形成的老年斑、异常Tau蛋白磷酸化形成的神经元纤维缠结(neurofibrillary tangle,NFT)以及神经元的丢失等[1]。阿尔茨海默症国际协会(Alzheimer′s disease International,ADI)发布的《2015全球阿尔茨海默症报告》指出,全球目前已有超过4 600万人患上痴呆症,用于痴呆的费用达到8 180亿美元。据预测,到2050年,全球将有1.315亿人口受到AD的困扰[2]。目前FDA批准用于AD的临床药物乙酰胆碱酯酶(AChE)抑制剂和N-甲基-D-天门冬氨酸(NMDA)受体拮抗剂只能在短时期内改善AD症状,并不能有效阻止或逆转病程[3]。因此,临床上迫切需要研发具有新型作用特点的AD治疗药物。
AD病因复杂,其发病机制尚未完全阐明,随着研究的深入,科研工作者提出了多种假说,如胆碱能假说、β-淀粉样蛋白(Aβ)假说、Tau蛋白磷酸化假说和基因突变假说等[4]。基于AD疾病复杂的网络药理学理论,调控疾病网络某一节点的单靶点药物不能从根本上抑制AD的进程。针对诱发疾病的多个靶点、多个节点蛋白同时干预,从而调控整个疾病机制网络的多靶点药物,即所谓的“一药多靶(One-Drug-Multiple-Targets)”有望成为防治AD更优的策略[5-6]。
黄酮类化合物分布广泛,是植物、蔬菜以及水果等自身产生的一类次生代谢产物。由于黄酮类化合物在抗氧化、保护心血管、抗肿瘤、抗神经退行性疾病以及调节免疫力等方面有着重要的治疗和预防功能,其已成为国内外药物研究的热点[7]。尽管黄酮类化合物在治疗AD方面具有潜在的效能,但仍存在生物利用度低、血-脑脊液屏障透过能力较差、缺失对胆碱酯酶的抑制活性等局限,因此有诸多结构修饰领域的研究进展。本文就黄酮类化合物在多靶点抗阿尔茨海默病药物中的研究进展进行综述,为其进一步开发研究提供理论参考依据。
1 黄酮类衍生物
黄酮类广泛分布于芸香科、菊科、玄参科、伞形科及豆科等被子植物中,黄芩素和黄芩苷是黄酮类的代表化合物。
1.1 选择性AChE抑制剂
Sheng等[8]在黄酮的B环进行结构改造合成了一系列黄酮类衍生物,并测试了胆碱酯酶抑制活性。研究结果表明,取代基对AChE抑制活性具有一定的影响,AChE抑制活性由大到小依次为哌啶、吡咯、N-甲基-N-乙基胺、二乙胺,当取代基位于B环的对位比间位显示了更高的抑制活性,其中含有哌啶取代基且位于B环对位的化合物1显示了最强的AChE抑制活性(IC50=0.034 μmol/L)(图1),对丁酰胆碱酯酶的抑制活性较弱(IC50=75.2 μmol/L),分子对接研究进一步阐明了其作用机制,为开发新颖的选择性AChE抑制剂提供了线索。
1.2 兼具抑制Aβ聚集和抗氧化活性的乙酰胆碱酯酶抑制剂
Luo等[9]设计、合成了一系列4-二甲胺黄酮衍生物,并测试潜在的抗AD多靶点活性。研究结果表明大部分化合物具有显著的AChE和BuChE抑制活性,其中化合物2显示了最强的AChE抑制活性,其IC50为1.83 μmol/L,良好的BuChE抑制活性,其IC50为5.01 μmol/L。酶动力学和分子对接研究表明了化合物2对AChE是混合型抑制,能够同时结合AChE的催化位点(CAS)和外周阴离子位点(PAS)。硫磺素T法测试结果表明,在20 μmol/L浓度条件下,化合物抑制了自身诱导的Aβ聚集,其中化合物2显示了显著的抑制活性(45.8%)。氧自由基吸收能力-荧光探针(ORAC-FL)法表明了这些化合物显示了有效的自由基捕捉能力,并且黄酮部分的二甲胺对自由基清除能力起到至关重要的作用。综上所述,化合物2是一个潜在的多靶点抗AD的候选化合物(图1)。
1.3 兼具金属离子螯合和抑制Aβ聚集的AChE抑制剂
Li等[10]设计、合成了一系列黄酮衍生物,并测试了其抗AD多靶点的生物活性。研究结果表明,大部分化合物显示了比母体化合物更好的AChE抑制活性,尤其是二乙胺基通过4个亚甲基碳链连接到黄酮骨架上的化合物3具有最强的AChE抑制活性,其IC50为0.13 μmol/L。构效关系结果表明,烷基链长度对AChE的抑制活性有一定的影响,当取代基为四氢吡咯,2-甲基哌啶和4-羟基哌啶时,含有4或者5个亚甲基碳链的化合物比含有2、3或者6个亚甲基碳链的化合物显示了更好的AChE抑制活性,表明了最佳的碳链长度是4或5个亚甲基(图1)。酶动力学研究和分子对接研究表明表明化合物3是混合型AChE抑制剂,能够同时与AChE的PAS和CAS部位结合。
随后,硫磺素T法测试了黄酮衍生物抑制自身诱导的Aβ聚集的能力。结果表明,侧链的长度对抑制Aβ聚集的活性也有一定的影响,含有5个亚甲基碳链的化合物比含有4个碳链的化合物显示了更好的抑制活性。另外,化合物3还具有金属离子络合作用。上述结果表明了化合物3是一个潜在的多靶点抗AD先导化合物。
Li等[11]设计、合成了一系列他克林-黄酮杂合体,希望能够作为抗AD的多功能胆碱酯酶抑制剂。体外研究表明大部分化合物具有显著的胆碱酯酶抑制活性,化合物4(图1)显示了均衡的药理活性,其抑制AChE和BuChE的IC50分别为133和558 nmol/L。通过硫磺素T法测试了化合物4抑制自身诱导的Aβ1-42聚集的活性,其IC50为6.5 μmol/L。通过紫外可见光谱对金属离子螯合能力进行了研究。随着Cu2+和Fe2+浓度的增加,化合物4的吸收度也相应的增加,说明化合物4能有效地螯合Cu2+和Fe2+,且螯合比例都为1∶1。因此,化合物4是一个潜在的均衡的多靶点抗AD先导化合物,进一步的体内研究还在进行中。

图1黄酮类化合物的化学结构
1.4 兼具抗氧化、金属离子螯合和抑制Aβ聚集的AChE抑制剂
Sang等[12-13]基于“多靶点策略”,将灯盏乙素苷元与卡巴拉汀的药效团——氨基甲酸酯进行拼合,设计并合成了一系列灯盏乙素苷元-O-氨基甲酸酯衍生物。对于胆碱酯酶抑制活性,引入氨基甲酸酯基团后,大部分衍生物显示了不同强度的AChE抑制活性,IC50从几十微摩尔到几微摩尔,其中拥有N,N-二乙胺基氨基甲酸酯片段的化合物5显示了显著的AChE抑制活性,其IC50为0.57 μmol/L。构效关系表明黄酮母核5-位甲氧基取代的衍生物比5-位羟基取代的衍生物显示了更好的AChE抑制活性;氨基甲酸酯部分在黄酮母核4′-位比3′-位显示了更好的AChE抑制活性。更进一步的研究结果表明,代表性化合物5可作为选择性螯合剂与Cu2+和Al3+进行络合,同时显示了显著的神经保护作用,动物实验表明,化合物5对东莨菪碱诱导的小鼠记忆障碍显示了显著的神经保护效应(图2)。
随后Sang等[14]进一步采用多靶点药物设计策略,将灯盏乙素苷元与多奈哌齐的药效团进行结构拼合,设计并合成了一系列灯盏乙素-O-烷基胺类衍生物。生物活性评价结果表明,该类化合物显示了更强的AChE抑制活性,且具有较弱的BuChE抑制活性,表明O-烷基胺片段的引入增强了乙酰胆碱酯酶的抑制活性和选择性。同时母核5-位的取代基和烷基胺侧链在黄酮母核的位置对AChE抑制活性也有不同程度的影响。研究结果表明烷基胺侧链不同的NR1R2基团对AChE抑制活性的顺序由大到小依次为:N-(2-甲氧基苄基)乙基胺、N-(2-甲氧基苄基)甲基胺、N-苄基哌嗪、N-苄基乙基胺、N-苄基甲基胺、N-甲基哌嗪。化合物6(图2)显示了较好的AChE抑制活性(IC50=0.62 μmol/L),且具有较好的选择性(SI=100),酶动力学和分子对接研究表明化合物6是一个混合型AChE抑制剂。同时,化合物6显示了更强的抗氧化活性和金属离子络合作用,化合物6还能够显著的抑制和解聚Aβ聚集,此外,化合物6具有较低的细胞毒性,且对H2O2诱导的PC12细胞损伤具有神经保护作用。体内实验表明,化合物6在最佳剂量6.6 mg/kg时能够改善东莨菪碱诱导小鼠的认知障碍,提高记忆和学习能力。化合物6是一个潜在的多靶点抗AD药物,其进一步的结构优化仍在进行中。

图2灯盏乙素苷元衍生物
近期Sang等[15]在前期的基础上,进一步对灯盏乙素苷元进行了改造,设计并合成了一系列灯盏乙素苷元-O-乙酰胺烷基苄胺衍生物。体外生物活性研究表明,母体化合物的胆碱酯酶抑制活性很弱,其IC50均大于500 μmol/L;所有目标化合物均显示较好AChE抑制活性,大部分衍生物BuChE抑制活性较弱,表明O-乙酰胺烷基苄胺片段的引入可增强化合物对AChE的抑制活性和选择性。化合物7(图2)显示了最强的AChE抑制活性,IC50=(0.051±0.003) μmol/L;较差BuChE抑制活性,IC50>500 μmol/L,是一个高选择性的AChE抑制剂。酶动力学和分子对接研究进一步阐明了化合物7是一个混合型的AChE抑制剂,能够同时作用于AChE的CAS和PAS部位。化合物7还显示了金属离子螯合能力、较强的抗氧化活性、良好的抑制和解聚Aβ聚集能力,以及对H2O2诱导PC12细胞损伤显著的神经保护作用。体内实验表明,化合物7具有较低的急性毒性,且能够通过增强胆碱能的活力来改善东莨菪碱所致的记忆障碍。上述结构表明化合物7是一个潜在的多靶点抗AD活性化合物,其进一步作用机制研究仍在进行中。
2 异黄酮类衍生物
异黄酮类主要分布在豆科植物中,也分布在桑科、鸢尾科被子植物中,大豆素和葛根素是异黄酮类的代表化合物。
2.1 兼具雌激素活性和神经保护作用的AChE抑制剂
Shi等[16]对染料木素的7位引入了二乙胺基丁烷氧基,得到了目标化合物8(图3)。体外生物活性结果表明,化合物8是一个选择性AChE抑制剂(IC50=0.17 μmol/L),酶动力学和分子对接研究表明8是一个混合型AChE抑制剂,能够同时作用于AChE的CAS和PAS部位。实验结果显示8具有雌激素活性,并且对雌激素受体β显示了高的特异性(解离常数Ki为2.86 nmol/L)。另外,化合物8在1 nmol/L时对Aβ诱导的SH-SY5Y细胞损伤具有显著的神经保护作用。因此化合物8是一个潜在的多靶点抗AD候选化合物。
2.2 兼具抗氧化活性的AChE抑制剂
Qiang等[17]设计、合成了一系列染料木素氨基甲酸酯类衍生物,并测试了相应的生物活性。研究结果表明,部分化合物对乙酰胆碱酯酶具有较强的抑制活性,其中化合物9显示了最强的AChE抑制活性(图3),其IC50为1.2 μmol/L。构效关系表明含有4-甲基哌嗪的化合物比含有4-苄基哌嗪的化合物显示了更高的抑制活性;7,4′位含有双吗啉基或者4-甲基哌嗪基的化合物比含单吗啉基或者4-甲基哌嗪基和化合物显示了更好的抑制活性。氧化损伤模型测试结果表明,测试的化合物对H2O2诱导的PC12细胞氧化损伤具有显著的神经保护作用,在10.0 μmol/L浓度下,7或4′-单取代氨基甲酸酯类化合物的细胞存活率高于7,4′-双取代氨基甲酸酯类化合物。化合物9为后期抗AD药物的研发提供了重要依据。
2.3 兼具抗氧化、金属离子螯合性质和抑制Aβ聚集的AChE抑制剂
Qiang等[18]在前期染料木素氨基甲酸酯类化合物的基础上设计、合成了一系列叔胺系列衍生物,期望得到具有多靶点功能的抗AD候选药物。研究结果表明大部分化合物具有较好的AChE抑制活性,并且AChE对BuChE有较高的选择性,其中化合物10显示了最强的AChE抑制活性(图3),其IC50为0.09 μmol/L,表明O-烷基苄胺基团的引入增加了AChE的抑制活性,侧链中烷基的长度对AChE抑制活性也有一定的影响,一般来讲,对于染料木素7位修饰的衍生物,含有6个亚甲基的衍生物比含有3或者4个亚甲基显示了更好的抑制活性;对于染料木素4′修饰的衍生物,含有4个亚甲基的衍生物比含有3或者6个亚甲基显示了更好的抑制活性;对于染料木素7位和4′位修饰的衍生物,两侧都含有4个亚甲基的化合物10显示了最强的AChE抑制活性。酶动力学的研究表明化合物10是一个混合型抑制,分子对接研究进一步证明了这个结论。
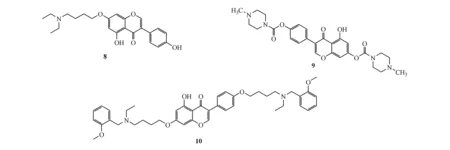
图3染料木素衍生物
通过ORAC-FL法对染料木素叔胺衍生物的抗氧化活性进行了测试,所有的化合物都具有很强的抗氧化活性。另外,通过紫外可见光谱测定法对化合物10的金属离子螯合效应进行了研究,结果表明化合物10可以与Cu2+和Al3+进行络合,而不能与Fe2+和Zn2+进行络合,说明了化合物10对金属离子络合具有一定的选择性,且化合物10与Cu2+的络合比例为1∶1。同时还研究了化合物10抑制Aβ聚集的能力,化合物10在25 μmol/L浓度时,对自身诱导的Aβ聚集的抑制率为35.0%,对Cu2+诱导的Aβ聚集的抑制率为77.8%;化合物10的浓度为100 μmol/L时,对HuAChE诱导的Aβ聚集的抑制率为36.2%。进一步的体内研究表明化合物10能够改善东莨菪碱诱导的记忆障碍。综上这些结果表明,化合物10是一个潜在的多靶点抗AD的候选药物。
3 查耳酮类衍生物
查耳酮类大多分布在菊科、豆科、苦苣苔科等植物,代表化合物是异甘草素和补骨脂乙素。
3.1 兼具抗5-脂氧合酶的Aβ抑制剂
Chen等[19]合成了一系列异甘草素衍生物,并测试了Aβ聚集和5-脂氧合酶的抑制活性作为双靶点抑制剂来治疗AD。硫磺素T法表明所有合成的化合物显示了有效的抑制Aβ1-42聚集的能力,IC50为2.2~23.8 μmol/L。构效关系表明,查耳酮A环上4位取代基的引入增加了化合物的抑制活性,不同取代基的抑制活性趋势如下:六元环胺>芳基胺≈醚类>烷基胺>羟基>甲氧基。其中化合物11显示了较强的Aβ1-42抑制活性,其IC50为3.2 μmol/L。体外的5-脂氧合酶抑制活性表明大部分化合物显示了较好的抑制活性,其中化合物11显示了最强的5-脂氧合酶抑制活性,其IC50为6.1 μmol/L(图4)。
化合物11和5-脂氧合酶的分子对接研究表明化合物11拥有强的抑制活性其中一个原因可能是取代基的长度和灵活性影响了氢键的形成和稳定性,另一个原因是化合物的侧链能够嵌入了活性“口袋”的“深腔”。化合物11和Aβ1-42分子对接研究表明11的B环与亮氨酸17通过σ-π相互作用,组氨酸13和B环上羟基的氧通过氢键相互作用。因此,化合物11是一个潜在的双靶点抗AD先导化合物。
3.2 兼具胆碱酯酶抑制活性的神经保护剂
Rampa等[20]设计并合成了一系列氨基甲酸酯类查耳酮化合物,生物活性测试结果表明目标化合物显示了良好的AChE抑制活性,IC50为0.81~1.80 nmol/L,然而,当碳链长度增加到10时,AChE抑制活性降低了近98%。化合物12(图4)显示了最强的AChE抑制活性(IC50=0.81 nmol/L),良好的BuChE抑制活性(IC50=106 nmol/L)。另外,化合物12对Aβ诱导的神经毒性具有一定的保护作用,同时能够调节神经炎症反应,为AD的研究提供了先导化合物。
3.3 μ-calpain和cathepsin B双靶点抑制剂
Jeon等[21]合成了一系列查耳酮衍生物,并测试了μ-calpain(μ-钙蛋白酶)和cathepsin B(组织蛋白酶B)抑制活性。研究结果表明,化合物13(图4)具有显著的μ-calpain和cathepsin B抑制活性(IC50分别为18.83和6.34 μmol/L),另外在5 μmol/L浓度下,化合物13对H2O2诱导的SH-SY5Y细胞凋亡具有显著的神经保护作用。而且化合物13能够减少p25的形成,tau蛋白磷酸化和不可溶Aβ蛋白的形成。酶动力学和分子对接研究也表明了化合物13能够显著抑制μ-calpain和cathepsin B。因此,化合物13通过抑制μ-calpain和cathepsin B是一个有效的AD治疗候选化合物,其进一步的研究仍在进行中。
3.4 多靶点抑制剂
Wang等[22]合成了一系列新颖的查耳酮氨基甲酸酯类化合物,其结构修饰主要在查耳酮的1′,2′,3′,4′,5和6位,构效关系表明,当同时拥有两个氨基甲酸酯取代(2′和4′)时,几乎没有胆碱酯酶抑制活性,当氨基甲酸酯单独位于3′位时也几乎没有胆碱酯酶抑制活性,而胆碱酯酶位于1′,2′,5′和6′时位时则绝大部分化合物显示了高选择的丁酰胆碱酯酶抑制活性。另外,氨基甲酸酯片段对胆碱酯酶也有一定的影响,整体来说,N-乙基甲基胺和二甲胺显示了较高的胆碱酯酶抑制活性,而二异丙基胺和二乙胺则显示了较弱的抑制活性,其中化合物14(图4)对乙酰胆碱酯酶和丁酰胆碱酯酶都具有显著的抑制活性,其IC50分别为0.87和0.36 μmol/L。研究结果还表明化合物14具有较低的细胞毒性,并且在SH-SY5Y细胞中能够降低氧化应激的产生。化合物14是一个值得进一步发展的小分子化合物,其进一步的体内研究仍在进行中。
Xiao等[23]设计并合成了一系列4′-氨基查耳酮-卡巴拉汀杂合体,研究结果表明,氨基甲酸酯的引入增强了AChE的抑制活性,绝大部分化合物为选择性AChE抑制剂。构效关系显示,母核的4-位拥有环胺取代基比非环胺取代基显示了更高的抑制活性,其中4-位拥有吡咯环的化合物15(图4)显示了最强的AChE抑制活性(IC50=4.91 μmol/L),且对丁酰胆碱酯酶几乎没有抑制活性。AChE抑制动力学和分子对接结果表明化合物15能够同时结合AChE的CAS和PAS部位。另外,化合物15具有显著的抗氧化活性(ORAC=2.83 eq.),金属离子螯合能力以及能够抑制自身诱导和Cu2+诱导的Aβ1-42聚集(抑制率分别为89.5%和79.7%),并且化合物15是一个高选择性的MAO-B抑制剂(IC50=0.29 μmol/L)。综上所述,化合物15是一个潜在的抗AD候选药物。

图4查耳酮衍生物
4 橙酮类衍生物
橙酮类在中药中比较少见,多存在与玄参科、菊科和苦苣苔科植物中,金鱼草素是代表化合物。
4.1 AChE/Aβ双靶点抑制剂
Belluti等[24]合成了一系列噢哢类查耳酮-O-氨基甲酸酯衍生物,研究结果表明含有7个亚甲基的化合物绝大部分显示了nmol/L水平的AChE抑制活性,其中拥有3,4,5-三甲氧基苯基的化合物16(图5)显示了最强的AChE抑制活性(IC50=0.52 nmol/L),且对BuChE也有良好的抑制活性(IC50=136 nmol/L),构效关系表明,当用α或β萘基、蒽基、苯基、二氯苯基取代化合物16中的3,4,5-三甲氧基苯基时,AChE抑制活性则明显的降低,当取代为3,5-二氯苯基片段时,AChE抑制活性进一步减弱;进一步的当化合物16呋喃环结构中的氧原子被环戊酮、吡喃酮和环己酮取代时,AChE抑制活性同样呈现不同形式的降低。另外,化合物16能够抑制AChE诱导的Aβ聚集,上述研究结果为寻找新型的抗AD药物提供了重要支撑。
Li等[25]设计并合成了一系列4-羟基噢哢类衍生物作为潜在的多靶点抗AD药物,生物活性测试表明目标化合物对Aβ聚集显示了良好的抑制活性,研究发现,含有两个羟基的化合物比一个羟基的显示了更好的抑制活性,当6位羟基被二甲胺取代后抑制活性明显降低,表明了羟基在抑制Aβ聚集中起着重要作用。单胺氧化酶抑制活性测试结果表明,化合物17(图5)是最强的MAO-B抑制剂(IC50=0.226 μmol/L)。分子模拟对接进一步阐明了代表性化合物17的高抑制活性,而且化合物17具有抗氧化活性和金属离子螯合性质,并且具有透过血-脑脊液屏障的能力,为新颖多功能抗AD药物的发展提供了良好的基础。
随后,Li等[26]又合成了一系列噢哢曼尼席碱类衍生物,研究结果表明绝大部分化合物为选择性AChE抑制剂,且具有良好的多重药理性质,胆碱酯酶测试构效关系表明脂肪胺取代的衍生物比苄基胺取代的显示了更高的AChE抑制活性。另外所有的曼尼席碱衍生物对BChE几乎没有抑制活性。其中化合物18(图5)显示了最强的AChE抑制活性(ratAChE,IC50=0.008 78 μmol/L;EeAChE,IC50=0.021 2 μmol/L;HuAChE,IC50=0.037 μmol/L),酶动力学和分子对接研究给出了合成的解释。代表性化合物18还具有良好的抗氧化活性、神经保护作用和金属离子螯合能力,并且能够抑制自身诱导和Cu2+诱导的Aβ1-42聚集。化合物18对于开发新型的多靶点抗AD药物是一个有希望的小分子化合物。

图5噢哢类衍生物
5 二氢黄酮类衍生物
二氢黄酮类分布较普遍,多存在与蔷薇科、芸香科、姜科、菊科、杜鹃花科和豆科植物中,陈皮素和甘草苷是代表化合物。
5.1 兼具抗炎活性和抗氧化活性的乙酰胆碱酯酶抑制剂
研究人员对橙皮苷作为治疗AD潜在的先导化合物进行了研究。橙皮苷是柑橘类水果中大量存在的一种黄烷酮糖苷,具有抗氧化,镇痛和抗高血压等活性。Javed等[27]使用不同剂量的橙皮苷(19)(100和200 mg/kg)(图6)处理链脲霉素导致的认知功能障碍的小鼠,结果表明橙皮苷能有效的阻止认知损害,通过有效的调节AChE的水平从而提高了记忆能力。更进一步研究表明,橙皮苷降低了还原型谷胱甘肽的水平,而且能够通过抑制过量的炎症性因子来保护神经元细胞。因此,橙皮苷能有效的改善链脲霉素导致的小鼠记忆障碍,并通过改善神经学行为,抑制炎症性因子和抗氧化应激等,为治疗AD提供了有效的治疗思路。

图6二氢黄酮类衍生物
6 二氢黄酮醇类衍生物
二氢黄酮醇类存在于裸子植物、单子叶植物姜科的少数植物中,双子叶植物中分布较普遍,在豆科、蔷薇科植物中较多,水飞蓟素和异水飞蓟素是代表化合物。
6.1 兼具保肝作用的乙酰胆碱酯酶抑制剂
Chen等[28]设计了一个他克林-水飞蓟宾杂合前药20(图7),并测试了相应的生物活性。研究结果表明化合物20显示了较好的AChE和BuChE抑制活性,其IC50分别为53.9和49.7 nmol/L。通过MTT法测试表明化合物20对谷氨酸诱导的HT-22细胞毒性具有一定的神经保护作用。另外,在肝星状细胞(HSC)的肝毒性模型中,化合物20的肝毒性明显降低。大鼠体内的实验进一步表明,与对照组他克林相比,没有观察到化合物20的肝毒性和对细胞色素P450体系的影响。在东莨菪碱诱导的认知障碍模型中,化合物20能有效改善记忆功能障碍。

图7二氢黄酮醇类衍生物
7 高异黄酮类衍生物
高异黄酮类和异黄酮类相比,其B环和C环之间多了一个-CH2-,主要存在于重要麦冬中,麦冬高异黄酮A是代表化合物。
7.1 兼具MAO-B和Aβ聚集抑制的AChE抑制剂
Li等[29]设计并合成了一系列高异黄酮类衍生物,体外测试结果表明该系列化合物显示了良好的多靶点抗AD活性,胆碱酯酶测试表明所有目标化合物表现了潜在的EeAChE抑制活性。构效关系揭示了胺基取代基及取代基的位置对抑制活性有显著影响,整体来说,曼尼席碱的引入急剧增强了高异黄酮的AChE抑制活性,脂肪胺的取代基比苄基胺显示了更强的AChE抑制活性,其中化合物21具有最强的AChE抑制活性(图8),其IC50分别为2.49 nmol/L,酶动力学和分子对接研究表明,化合物21是一个混合型的AChE抑制剂,能够同时作用于AChE的CAS和PAS部位。单胺氧化酶测试结果显示化合物21具有良好的MAO-B抑制活性(IC50=1.74 μmol/L)。化合物21在25 μmol/L浓度下对自身诱导和Cu2+诱导的Aβ聚集显示了潜在抑制活性,同时还具有抗氧化活性(ORAC=1.65 eq.)和金属离子螯合能力,对PC12细胞毒性小,具有较广的治疗安全范围。因此化合物21对于多靶点抗AD药物的发是一个潜在的候选化合物。

图8高异黄酮类和噻吨酮类衍生物
8 其 他
有些化合物虽然不符合C6-C3-C6的基本骨架,但因具有苯并γ-吡喃酮结构,也将其归为黄酮类化合物。如,呋喃色原酮类、苯色原酮类等。
8.1 AChE/MAO/Aβ抑制剂
Luo等[30]在呫吨酮骨架的基础上设计并合成了一系列新颖的胺烷氧基噻吨酮衍生物。胆碱酯酶测试结果表明,所有目标化合物均比母体化合物显示了更高的AChE抑制活性,且具有较弱的BuChE抑制活性,说明该系列化合物是选择性AChE抑制剂。其中化合物22显示了最强的AChE抑制活性(图8),其IC50为0.59 μmol/L。酶动力学和分子对接研究进一步阐明了化合物22是一个混合型AChE抑制剂,能够同时作用于AChE的CAS和PAS部位。单胺氧化酶测试结果表明目标化合物对MAO-A和MAO-B均有显著的抑制作用,化合物22抑制MAO-A和MAO-B的IC50分别为1.01和0.90 μmol/L。同时化合物22对Aβ聚集也有显著的抑制作用,其在25 μmol/L条件下对自身诱导和Cu2+诱导Aβ1-42聚集的抑制率分别为74.8%和87.7%。另外,化合物22还具有抗氧化活性和金属离子螯合性质,且对SH-SY5Y细胞毒小,具有较广的治疗安全范围。因此,化合物22对于开发新型的多靶点抗AD药物是一个很有希望的候选化合物。
8.2 兼具AChE抑制活性的神经保护剂
Wang等[31]从山竹里面分离得到了一系列呫吨酮衍生物,生物活性测试结果表明绝大部分分离到的天然呫吨酮衍生物能够显著抑制自身诱导的Aβ聚集,并且具有很强的抗氧化活性和金属离子络合能力。其中化合物α-mangostin(23),gartanin (24),garcinone C(25)和γ-mangostin(26)比Trolox显示了更强的清除自由基能力(图9),并且对谷氨酸诱导的HT22细胞死亡有潜在的神经保护作用,另外化合物23,24,25和26能够透过体外的血-脑脊液屏障。上述结果表明天然呫吨酮产物具有多靶点抗AD活性,为AD治疗提供了先导化合物。

图9呫吨酮类衍生物
[1] Alzheimer′s Disease International.Policy brief:the global impact of dementia 2013-2050[EB/OL].http://www.alz.co.uk/research/G8-policy-brief.
[2] Alzheimer′s Disease International.World Alzheimer report 2015:the global impact of dementia[EB/OL].https://www.alz.co.uk/research/world-report-2015.
[3] Guo JJ,Liao H.Development of drug for Alzheimer′s disease [J].JChinaPharmUniv(中国药科大学学报),2010,41(5):395-400.
[4] Citron M.Alzheimer′s disease:strategies for disease modification [J].NatRevDrugDiscov,2010,9(5):387-398.
[5] Cavalli A,Bolognesi ML,Minarini A,etal.Multi-target-directed ligands to combat neurodegenerative diseases [J].JMedChem,2008,51(3):347-372.
[6] De Freitas Silva M,Dias KST,Gontijo VS,etal.Multi-target directed drug as a modern approach for drug design toward Alzheimer′s disease:an update [J].CurrMedChem,2018.doi:10.2174/0929867325666180111101843.
[7] Chen X,Mukwaya E,Wong MS,etal.A systematic review on biological activities of prenylated flavonoids[J].PharmBiol,2014,52(5):655-660.
[8] Sheng R,Lin X,Zhang J,etal.Design,synthesis and evaluation of flavonoid derivatives as potent AChE inhibitors[J].BioorgMedChem,2009,17(18):6692-6698.
[9] Luo W,Su YB,Hong C,etal.Design,synthesis and evaluation of novel 4-dimethylamine flavonoid derivatives as potential multi-functional anti-Alzheimer agents[J].BioorgMedChem,2013,21(23):7275-7282.
[10] Li RS,Wang XB,Hu XJ,etal.Design,synthesis and evaluation of flavonoid derivatives as potential multifunctional acetylcholinesterase inhibitors against Alzheimer′s disease[J].BioorgMedChemLett,2013,23(9):2636-2641.
[11] Li SY,Wang XB,Xie SS,etal.Multifunctional tacrine-flavonoid hybrids with cholinergic,beta-amyloid-reducing,and metal chelating properties for the treatment of Alzheimer′s disease[J].EurJMedChem,2013,69:632-646.
[12] Sang Z,Li Y,Qiang X,etal.Multifunctional scutellarin-rivastigmine hybrids with cholinergic,antioxidant,biometal chelating and neuroprotective properties for the treatment of Alzheimer′s disease[J].BioorgMedChem,2015,23(4):668-680.
[13] Sang ZP,Qiang XM,Li Y,etal.Design,synthesis,and biological evaluation of scutellarein carbamate derivatives as potential multifunctional agents for the treatment of Alzheimer′s disease[J].ChemBiolDrugDes,2015,86(5):1168-1177.
[14] Sang Z,Qiang X,Li Y,etal.Design,synthesis and evaluation of scutellarein-O-alkylamines as multifunctional agents for the treatment of Alzheimer′s disease[J].EurJMedChem,2015,94:348-366.
[15] Sang Z,Qiang X,Li Y,etal.Design,synthesis and evaluation of scutellarein-O-acetamidoalkylbenzylamines as potential multifunctional agents for the treatment of Alzheimer′s disease[J].EurJMedChem,2017,135:307-323.
[16] Shi DH,Yan ZQ,Zhang LN,etal.A novel 7-O-modified derivative with acetylcholinesterase inhibitory effect,estrogenic activity and neuroprotective effect[J].ArchPharmRes,2012,35(9):1645-1654.
[17] Qiang X,Yuan W,Sang Z,etal.Synthesis and biological evaluation of genistein carbamate derivatives[J].ChinJOrgChem(有机化学),2013,33(3):621-629.
[18] Qiang X,Sang Z,Yuan W,etal.Design,synthesis and evaluation of genistein-O-alkylbenzylamines as potential multifunctional agents for the treatment of Alzheimer′s disease[J].EurJMedChem,2014,76:314-331.
[19] Chen YP,Zhang ZY,Li YP,etal.Syntheses and evaluation of novel isoliquiritigenin derivatives as potential dual inhibitors for amyloid-beta aggregation and 5-lipoxygenase[J].EurJMedChem,2013,66:22-31.
[20] Rampa A,Montanari S,Pruccoli L,etal.Chalcone-based carbamates for Alzheimer′s disease treatment [J].FutureMedChem,2017,9(8):749-764.
[21] Jeon KH,Lee E,Jun KY,etal.Neuroprotective effect of synthetic chalcone derivatives as competitive dual inhibitors against μ-calpain and cathepsin B through the downregulation of tau phosphorylation and insoluble Aβ peptide formation [J].EurJMedChem,2016,121:433-444.
[22] Wang L,Wang Y,Tian Y,etal.Design,synthesis,biological evaluation,and molecular modeling studies of chalcone-rivastigmine hybrids as cholinesterase inhibitors [J].BioorgMedChem,2017,25(1):360-371.
[23] Xiao G,Li Y,Qiang X,etal.Design,synthesis and biological evaluation of 4′-aminochalcone-rivastigmine hybrids as multifunctional agents for the treatment of Alzheimer′s disease [J].BioorgMedChem,2017,25(3):1030-1041.
[24] Belluti F,Rampa A,Piazzi L,etal.Cholinesterase inhibitors:xanthostigmine derivatives blocking the acetylcholinesterase-induced beta-amyloid aggregation [J].JMedChem,2005,48(13):4444-4456.
[25] Li Y,Qiang X,Luo L,etal.Synthesis and evaluation of 4-hydroxyl aurone derivatives as multifunctional agents for the treatment of Alzheimer′s disease [J].BioorgMedChem,2016,24(10):2342-2351.
[26] Li Y,Qiang X,Luo L,etal.Aurone Mannich base derivatives as promising multifunctional agents with acetylcholinesterase inhibition,anti-β-amyloid aggragation and neuroprotective properties for the treatment of Alzheimer′s disease [J].EurJMedChem,2017,126:762-755.
[27] Javed H,Vaibhav K,Ahmed ME,etal.Effect of hesperidin on neurobehavioral,neuroinflammation,oxidative stress and lipid alteration in intracerebroventricular streptozotocin induced cognitive impairment in mice[J].JNeurolSci,2015,348(1/2):51-59.
[28] Chen X,Zenger K,Lupp A,etal.Tacrine-silibinin codrug shows neuro- and hepatoprotective effectsinvitroand pro-cognitive and hepatoprotective effectsinvivo[J].JMedChem,2012,55(11):5231-5242.
[29] Li Y,Qiang X,Luo L,etal.Multitarget drug design strategy against Alzheimer′s disease:homoisoflavonoid Mannich base derivatives serve as acetylcholinesterase and monoamine oxidase B dual inhibitors with multifunctional properties[J].BioorgMedChem,2017,25(2):714-726.
[30] Luo L,Li Y,Qiang X,etal.Multifunctional thioxanthone derivatives with acetylcholinesterase,monoamine oxidases and β-amyloid aggregation inhibitory activities as potential agents against Alzheimer′s disease[J].BioorgMedChem,2017,25(6):1997-2009.
[31] Wang SN,Li Q,Jing MH,etal.Natural xanthones fromGarciniamangostanawith multifunctional activities for the therapy of Alzheimer′s disease[J].NeurochemRes,2016,41(7):1806-1817.

