苯胺基嘧啶/偶氮鎓二醇盐杂合物的设计、合成及其抗非小细胞肺癌活性
韩 春,吴林韬,胡晓琴,孙 龙,黄张建,张奕华*
(1长治学院化学系,长治 046000;2中国药科大学新药研究中心,南京 210009;3中国药科大学江苏省代谢性疾病药物重点实验室,南京 210009)
肺癌是一种发病率和死亡率非常高的恶性肿瘤[1],其中非小细胞肺癌(NSCLC)约占肺癌总发病率的85%[2]。由于表皮生长因子受体(EGFR)在NSCLC中过度表达或突变[3],EGFR酪氨酸激酶抑制剂近年来已成为临床治疗NSCLC的有效药物[4]。文献报道,具有母核苯胺基嘧啶的EGFR酪氨酸激酶抑制剂(osimertinib、rociletinib和WZ4002等)能够选择性地抑制EGFR的突变体T790M,克服EGFR激酶抑制剂由于EGFR突变引起的耐受性差和/或因其抑制突变型/野生型(WT)EGFR选择性差的缺点,在NSCLC治疗上颇具特色和优势[5-7]。
一氧化氮(NO)作为一种重要的信使和效应分子,在体内心血管、神经、免疫等系统具有重要功能[8]。近年来研究表明,一些NO供体具有显著的抗肿瘤活性[9]。偶氮鎓二醇盐是一类重要的NO供体,与细胞毒药物联用或与抗肿瘤药物杂合可协同发挥抗肿瘤效应[10]。本文在前期研究基础上[11-13],以苯胺基嘧啶为母核,将其与偶氮鎓二醇盐分别通过硫醚、亚砜、砜等杂合得到新化合物9a~9e、10a~10e、11a~11e,并对其NSCLC细胞增殖抑制活性进行评价,希望获到新型、高效的抗NSCLC药物。
1 合成路线
目标化合物9a~9e、10a~10e、11a~11e的合成见路线1。2-溴-1-三氟甲磺酰氧基乙烷(2)在相转移催化剂15-冠-5的作用下与不同仲胺取代的偶氮鎓二醇盐1a~1e发生反应,生成O2-溴乙基-偶氮鎓二醇盐3a~3e。间羟基苯甲醇4选择性溴代苄位羟基,生成间羟基溴苄5。用KSAc将5的苄位溴取代,生成硫代乙酸酯6。化合物6与2,4,5-三氯嘧啶反应生成芳醚7。化合物7与2-甲氧基-4-(4-甲基哌嗪-1-)苯胺缩合生成苯胺基嘧啶8,然后与化合物3a~3e在碱性条件下发生取代反应得到化合物9a~9e。化合物9a~9e在不同温度下与间氯过氧苯甲酸(m-CPBA)反应,分别得到亚砜类和砜类化合物10a~10e和11a~11e。

Scheme1Synthetic route to the target compounds9a-9e,10a-10eand11a-11e
Reagents and conditions:(a) 15-crown-5,dry THF,25 °C,5 h;(b) PBr3,CHCl3,0 °C-r.t.,2 h;(c) KSAc,dry THF,reflux,1 h;(d) 2,4,5-trichloropyrimidine,K2CO3,DMF,r.t.,2 h;(e) 2-methoxy-4-(4-methylpiperazin-1-yl)aniline,TFA,2-BuOH,reflux,3 h;(f)3a-3e,KOH,MeOH,r.t.,4 h;(g)m-CPBA,anhydrous CH2Cl2,-20 °C,30 min;(h)m-CPBA,anhydrous CH2Cl2,-5 °C,30 min
2 合成实验
2.1 仪器与试剂
采用SGWX-4显微熔点仪(上海仪电物理光学仪器有限公司)测定化合物熔点(温度未经校正);质谱采用HP 1100 LC/MSD质谱仪(美国安捷伦科技公司)测定;核磁共振氢谱采用Bruker ACF-300型磁共振仪(德国布鲁克公司)测定,TMS为内标。实验所用试剂均为市售化学纯或分析纯,必要的情况下,按照标准方法进行纯化和干燥处理。化合物1a~1e、2[14]、3a、3c、3e[15]、5[16]参照文献方法合成。
2.2 化学合成
1-(2-溴乙氧基)-3-甲基-3-苯基三氮-1-烯-2-氧化物(3b) 仲胺取代的偶氮鎓二醇钠盐1b(1.00 g,5.29 mmol)加到无水THF中,滴加15-冠-5,然后在0 ℃下缓慢将2-溴-1-三氟甲磺酰氧基乙烷(2)滴加到反应液中,室温反应5 h。将反应液旋干,加乙酸乙酯溶解,然后用饱和食盐水洗3遍,有机层用无水硫酸钠干燥,浓缩,柱色谱(石油醚-乙酸乙酯,5∶1)。得黄色油状物722 mg,收率50%。ESI-MS:m/z274.1[M+H]+;1H NMR(300 MHz,CDCl3)δ:3.34(3H,s,NCH3),3.58(2H,t,J=6.78 Hz,BrCH2),4.53(2H,t,J=6.81 Hz,OCH2),7.16(2H,d,J=8.1 Hz,ArH),7.23(1H,t,J=7.38 Hz,ArH),7.39(2H,t,J=8.04 Hz,ArH)。
2-(2-溴乙氧基)-1-吗啉二氮烯-1-氧化物(3d) 参照化合物3b的合成方法,由化合物1d(1.00 g,5.92 mmol)制得黄色油状物823 mg,收率55%。ESI-MS:m/z254.0[M+H]+;1H NMR(300 MHz,CDCl3)δ:3.44(4H,t,J=4.32 Hz,2×NCH2),3.59(2H,t,J=6.60 Hz,BrCH2),3.84(4H,t,J=4.56 Hz,2×OCH2),4.49(2H,t,J=6.66 Hz,OCH2)。
S-3-羟基苯甲基硫代乙酸(6) 将化合物5(505 mg,2.7 mmol)溶于THF中,加入KSAC(370 mg,3.24 mmol),回流2 h后将THF旋干,向残余物中加水,用CH2Cl2萃取(3×20 mL),合并有机层,无水硫酸钠干燥,柱色谱(石油醚-乙酸乙酯,10∶1),得棕色油状物390 mg,收率80%。ESI-MS:m/z181.0[M-H]-;1H NMR(300 MHz,CDCl3)δ:2.29(3H,s,SCOCH3),4.06(2H,s,ArCH2),6.77(1H,d,J=7.81 Hz,ArH),6.87(1H,s,ArH),6.96(1H,d,J=7.56 Hz,ArH),7.14(1H,t,J=7.74 Hz,ArH)。
S-3-(2,5-二氯嘧啶-4-氧)苯甲基硫代乙酸(7) 中间体6(364 mg,2.00 mmol)、2,4,5-三氯嘧啶(0.23 mL,2.00 mmol)和K2CO3(552 mg,2.00 mmol)加到DMF 10 mL中,室温搅拌2 h,将反应液倒入冰水中,搅拌至有白色固体析出,过滤,滤饼即为产品,得560 mg,收率85%,无须纯化直接投下一步使用。ESI-MS:m/z329.0[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.29(3H,s,SCOCH3),4.06(2H,s,ArCH2),6.76(1H,d,J=7.83 Hz,ArH),6.87(1H,s,ArH),6.97(1H,d,J=7.65 Hz,ArH),7.16(1H,t,J=7.74 Hz,ArH),8.22(1H,s,ArH)。
S-3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-苯基)氨基)嘧啶-4-氧)苯甲基硫代乙酸(8) 2-甲氧基-4-(4-甲基哌嗪-1-)苯胺(372 mg,1.68 mmol)、7(496 mg,1.68 mmol)、TFA(0.25 mL,3.36 mmol)加到仲丁醇20 mL中,加热到100 ℃反应3 h。反应液直接旋干,浓缩,制砂,柱色谱(二氯甲烷-甲醇,25∶1)。得黄色固体475 mg,收率55%。ESI-MS:m/z514.1[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.30(3H,s,COCH3),2.38(3H,s,NCH3),2.62(4H,t,J=4.57 Hz,2×CH3NCH2CH2N),3.14(4H,t,J=4.75 Hz,2×CH3NCH2CH2N),3.82(3H,s,OCH3),4.14(2H,s,ArCH2S),6.19(1H,d,J=7.2 Hz,ArH),6.46(1H,s,ArH),7.09(1H,d,J=7.95 Hz,ArH),7.16(1H,s,ArH),7.25(2H,d,J=6.57 Hz,ArH),7.39(1H,t,J=7.77 Hz,ArH),7.48(1H,br.s,ArNH),8.22(1H,s,ArH)。
目标化合物9a~9e的合成通法 先将KOH(300 mg,5.26 mmol)溶于甲醇3 mL中,配成KOH的甲醇溶液。将化合物3a~3e(1.30 mmol)、8(450 mg,0.88 mmol)溶于甲醇中,并滴加KOH的甲醇溶液,室温反应过夜。用稀盐酸将反应液调至中性,浓缩,制砂,柱色谱(二氯甲烷-甲醇,30∶1)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)硫乙氧基)-1-(哌啶-1-基)二氮烯-1-氧化物(9a) 由化合物3a和8反应制得黄色固体542 mg,收率65%。mp:86~88 ℃;ESI-MS:m/z643.4[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.48(2H,quint,J=5.64 Hz,NCH2CH2CH2),1.76(4H,quint,J=5.73 Hz,2×NCH2CH2),2.36(3H,s,NCH3),2.59(4H,t,J=4.38 Hz,2×CH3NCH2CH2N),2.72(2H,t,J=6.90 Hz,SCH2),3.11(4H,t,J=4.44 Hz,2×CH3NCH2CH2N),3.30(4H,t,J=5.49 Hz,2×NCH2),3.80(2H,s,ArCH2S),3.81(3H,s,OCH3),4.26(2H,t,J=6.93 Hz,OCH2),6.18(1H,d,J=5.49 Hz,ArH),6.45(1H,s,ArH),7.11(1H,d,J=7.95 Hz,ArH),7.20(1H,s,ArH),7.30(1H,d,J=7.53 Hz,ArH),7.41(2H,t,J=7.68 Hz,ArH),7.55(1H,br.s,ArNH),8.23(1H,s,ArH)。
1-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)硫乙氧基)-3-甲基-3-苯基三氮-1-烯-2-氧化物(9b) 由化合物3b和8反应制得黄色固体587 mg,收率68%。mp:36~38 ℃;ESI-MS:m/z665.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.36(3H,s,NCH3),2.58(4H,t,J=4.29 Hz,2×CH3NCH2CH2N),2.72(2H,t,J=6.81 Hz,SCH2),3.11(4H,t,J=4.5 Hz,2×CH3NCH2CH2N),3.30(3H,s,ArNCH3),3.80(5H,s,ArCH2S,OCH3),4.31(2H,t,J=6.84 Hz,OCH2),6.17(1H,d,J=5.49 Hz,ArH),6.45(1H,s,ArH),7.12(3H,d,J=7.74 Hz,ArH),7.20(2H,t,J=6.54 Hz,ArH),7.29(1H,d,J=6.15 Hz,ArH),7.35(3H,t,J=7.89 Hz,ArH),7.40(1H,t,J=7.62 Hz,ArH),7.55(1H,br.s,ArNH),8.22(1H,s,ArH)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)硫乙氧基)-1-(吡咯烷-1-基)二氮烯-1-氧化物(9c) 由化合物3c和8反应制得黄色固体570 mg,收率70%。mp:51~53 ℃;ESI-MS:629.4m/z[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.92(4H,m,2×NCH2CH2),2.36(3H,s,NCH3),2.58(4H,t,J=4.29 Hz,2×CH3NCH2CH2N),2.71(2H,t,J=6.54 Hz,SCH2),3.11(4H,t,J=4.5 Hz,2×CH3NCH2CH2N),3.47(4H,m,2×NCH2),3.81(5H,s,ArCH2S,OCH3),4.22(2H,t,J=6.66 Hz,OCH2),6.18(1H,d,J=5.49 Hz,ArH),6.45(1H,s,ArH),7.11(1H,d,J=7.62 Hz,ArH),7.20(1H,s,ArH),7.31(1H,d,J=7.56 Hz,ArH),7.41(2H,t,J=7.17 Hz,ArH),7.53(1H,br.s,ArNH),8.23(1H,s,ArH)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)硫乙氧基)-1-吗啉二氮烯-1-氧化物(9d) 由化合物3d和8反应制得黄色固体653 mg,收率78%。mp:34~36 ℃;ESI-MS:m/z645.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.37(3H,s,NCH3),2.59(4H,t,J=4.29 Hz,2×CH3NCH2CH2N),2.71(2H,t,J=6.54 Hz,SCH2),3.11(4H,t,J=4.5 Hz,2×CH3NCH2CH2N),3.37(4H,t,J=4.32 Hz,2×NCH2),3.81(9H,m,2×OCH2,ArCH2S,OCH3),4.26(2H,t,J=6.66 Hz,OCH2),6.18(1H,d,J=5.49 Hz,ArH),6.45(1H,s,ArH),7.11(1H,d,J=7.56 Hz,ArH),7.20(1H,s,ArH),7.31(1H,d,J=7.80 Hz,ArH),7.42(2H,t,J=7.17 Hz,ArH),7.54(1H,br.s,ArNH),8.23(1H,s,ArH)。
1-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)硫乙氧基)-3,3-二乙基三氮-1-烯-2-氧化物(9e) 由化合物3e和8反应制得黄色固体590 mg,收率72%。mp:44~46 ℃;ESI-MS:m/z631.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.06(6H,t,J=6.24 Hz,2×NCH2CH3),2.37(3H,s,NCH3),2.59(4H,t,J=4.29 Hz,2×CH3NCH2CH2N),2.74(2H,t,J=6.66 Hz,SCH2),3.09(8H,q,J=6.84 Hz,2×NCH2CH3,2×CH3NCH2CH2N),3.81(5H,s,ArCH2S,OCH3),4.32(2H,t,J=6.63 Hz,OCH2),6.19(1H,d,J=5.49 Hz,ArH),6.45(1H,s,ArH),7.11(1H,d,J=7.71 Hz,ArH),7.21(1H,s,ArH),7.31(1H,d,J=7.80 Hz,ArH),7.41(2H,t,J=7.62 Hz,ArH),7.56(1H,br.s,ArNH),8.23(1H,s,ArH)。
目标化合物10a~10e的合成通法 将化合物9a~9e(0.32 mmol)溶于无水CH2Cl210 mL中,在-20 ℃下将75%的间氯过氧苯甲酸m-CPBA(74 mg,0.32 mmol)的无水CH2Cl2溶液缓慢滴加到反应液中(约30 min),滴加完毕即停止反应,向反应液中加入饱和碳酸氢钠,分离有机层,用CH2Cl2萃取水层两次,合并有机层。柱色谱(二氯甲烷-甲醇,5∶1)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)亚磺酰乙氧基)-1-(哌啶-1-基)二氮烯-1-氧化物(10a) 由化合物9a制得,黄色固体50 mg,收率24%。mp:104~106 ℃;ESI-MS:m/z659.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.49(2H,quint,J=5.52 Hz,NCH2CH2CH2),1.73(4H,quint,J=5.25 Hz,2×NCH2CH2),2.72(2H,t,J=6.96 Hz,SOCH2),3.30(4H,t,J=5.58 Hz,2×NCH2),3.33(3H,s,NCH3),3.49(4H,t,J=10.68 Hz,2×CH3NCH2CH2N),3.70(4H,t,J=10.17 Hz,2×CH3NCH2CH2N),3.81(2H,s,ArCH2SO),3.82(3H,s,OCH3),4.27(2H,t,J=6.93 Hz,OCH2),6.24(1H,d,J=5.49 Hz,ArH),6.48(1H,s,ArH),7.12(1H,d,J=7.74 Hz,ArH),7.20(1H,s,ArH),7.32(1H,d,J=7.89 Hz,ArH),7.42(2H,t,J=7.83 Hz,ArH),7.48(1H,br.s,ArNH),8.25(1H,s,ArH)。
1-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)亚磺酰乙氧基)-3-甲基-3-苯基三氮-1-烯-2-氧化物(10b) 由化合物9b制得,黄色固体45 mg,收率21%。mp:52~54 ℃;ESI-MS:m/z681.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.72(2H,t,J=6.87 Hz,SOCH2),3.30(8H,m,NCH3,ArNCH3,CH3NCH2CH2N),3.45(2H,t,J=10.83 Hz,CH3NCH2CH2N),3.69(4H,t,J=10.83 Hz,2×CH3NCH2CH2N),3.81(5H,s,ArCH2SO,OCH3),4.32(2H,t,J=6.84 Hz,OCH2),6.22(1H,d,J=6.63 Hz,ArH),6.47(1H,s,ArH),7.12(3H,d,J=7.74 Hz,ArH),7.20(2H,t,J=6.54 Hz,ArH),7.29(1H,d,J=6.15 Hz,ArH),7.35(3H,t,J=7.89 Hz,ArH),7.44(1H,t,J=7.62 Hz,ArH),7.49(1H,br.s,ArNH),8.24(1H,s,ArH)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)亚磺酰乙氧基)-1-(吡咯烷-1-基)二氮烯-1-氧化物(10c) 由化合物9c制得,黄色固体58 mg,收率28%。mp:41~43 ℃;ESI-MS:m/z645.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.92(4H,m,2×NCH2CH2),2.71(2H,t,J=6.54 Hz,SOCH2),3.34(7H,m,2×CH3NCH2CH2N,NCH3),3.49(6H,m,2×NCH2,CH3NCH2CH2N),3.67(2H,t,J=11.01 Hz,CH3NCH2CH2N),3.82(5H,s,ArCH2SO,OCH3),4.23(2H,t,J=6.66 Hz,OCH2),6.21(1H,d,J=5.49 Hz,ArH),6.47(1H,s,ArH),7.11(1H,d,J=7.32 Hz,ArH),7.20(1H,s,ArH),7.32(1H,d,J=7.29 Hz,ArH),7.43(1H,t,J=7.5 Hz,ArH),7.49(1H,s,ArH),7.53(1H,br.s,ArNH),8.24(1H,s,ArH)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)亚磺酰乙氧基)-1-吗啉二氮烯-1-氧化物(10d) 由化合物9d制得,黄色固体62 mg,收率29%。mp:96~98 ℃;ESI-MS:m/z661.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.72(2H,t,J=6.84 Hz,SOCH2),3.30(7H,m,2×CH3NCH2CH2N,NCH3),3.38(4H,t,J=4.77 Hz,2×NCH2CH2O),3.48(2H,t,J=12.75 Hz,CH3NCH2CH2N),3.69(2H,t,J=11.22Hz,CH3NCH2CH2N),3.81(9H,m,2×NCH2CH2O,ArCH2SO,OCH3),4.27(2H,t,J=6.84 Hz,OCH2),6.22(1H,d,J=5.49 Hz,ArH),6.48(1H,s,ArH),7.12(1H,d,J=7.8 Hz,ArH),7.21(1H,s,ArH),7.32(1H,d,J=6.72 Hz,ArH),7.43(2H,t,J=7.8 Hz,ArH),7.54(1H,br.s,ArNH),8.25(1H,s,ArH)。
1-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)亚磺酰乙氧基)-3,3-二乙基三氮-1-烯-2-氧化物(10e) 由化合物9e制得,黄色固体48 mg,收率23%。mp:155~157 ℃;ESI-MS:m/z647.4[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.06(6H,t,J=6.96 Hz,2×NCH2CH3),2.75(2H,t,J=6.75 Hz,SOCH2),3.08(4H,q,J=6.96 Hz,2×NCH2CH3),3.29(4H,t,J=12.75 Hz,2×CH3NCH2CH2N),3.32(3H,s,NCH3),3.50(2H,t,J=10.62 Hz,CH3NCH2CH2N),3.71(2H,t,J=12.03 Hz,CH3NCH2CH2N),3.81(5H,s,ArCH2SO,OCH3),4.32(2H,t,J=6.84 Hz,OCH2),6.23(1H,d,J=5.49 Hz,ArH),6.49(1H,s,ArH),7.11(1H,d,J=7.41 Hz,ArH),7.21(1H,s,ArH),7.31(1H,d,J=7.8 Hz,ArH),7.43(1H,t,J=7.65 Hz,ArH),7.48(1H,s,ArH),7.58(1H,br.s,ArNH),8.24(1H,s,ArH)。
目标化合物11a~11e的合成通法 将化合物9a~9e(0.32 mmol)溶于无水CH2Cl210 mL中,在-5 ℃下将75%的间氯过氧苯甲酸(m-CPBA,148 mg,0.64 mmol)的无水CH2Cl2溶液缓慢滴加到反应液当中(约30 min),滴加完毕即停止反应,向反应液中加入饱和碳酸氢钠,分离有机层,用CH2Cl2萃取水层2次,合并有机层。柱色谱(四氢呋喃-甲醇,1∶2)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)磺酰乙氧基)-1-(哌啶-1-基)二氮烯-1-氧化物(11a) 由化合物9a制得,黄色固体78 mg,收率36%。mp:95~97 ℃;ESI-MS:m/z675.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.47(2H,quint,J=5.52 Hz,NCH2CH2CH2),1.72(4H,quint,J=5.25 Hz,2×NCH2CH2),2.83(1H,m,SO2CH2),3.02(1H,m,SO2CH2),3.30(11H,m,2×NCH2,2×CH3NCH2CH2N,NCH3),3.48(2H,t,J=11.07 Hz,CH3NCH2CH2N),3.71(2H,t,J=12.03 Hz,CH3NCH2CH2N),3.83(3H,s,OCH3),4.04(1H,d,J=12.87 Hz,OCH2),4.20(1H,d,J=13.02 Hz,OCH2),4.52(2H,m,ArCH2SO2),6.26(1H,d,J=7.98 Hz,ArH),6.47(1H,s,ArH),7.21(1H,s,ArH),7.22(1H,d,J=6.99 Hz,ArH),7.34(1H,d,J=7.53 Hz,ArH),7.49(2H,t,J=6.42 Hz,ArH),7.55(1H,br.s,ArNH),8.25(1H,s,ArH)。
1-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)磺酰乙氧基)-3-甲基-3-苯基三氮-1-烯-2-氧化物(11b) 由化合物9b制得,黄色固体86 mg,收率39%。mp:52~54 ℃;ESI-MS:m/z697.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.83(1H,m,SO2CH2),3.02(1H,m,SO2CH2),3.31(8H,m,NCH3,ArNCH3,CH3NCH2CH2N),3.47(2H,t,J=10.83 Hz,CH3NCH2CH2N),3.68(4H,t,J=10.95 Hz,2×CH3NCH2CH2N),3.83(3H,s,OCH3),4.04(1H,d,J=12.87 Hz,OCH2),4.20(1H,d,J=13.02 Hz,OCH2),4.57(2H,m,ArCH2SO2),6.25(1H,d,J=6.63 Hz,ArH),6.46(1H,s,ArH),7.14(3H,d,J=7.74 Hz,ArH),7.20(2H,t,J=6.54 Hz,ArH),7.29(1H,d,J=6.15 Hz,ArH),7.36(3H,t,J=7.89 Hz,ArH),7.44(1H,t,J=7.62 Hz,ArH),7.49(1H,br.s,ArNH),8.32(1H,s,ArH)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)磺酰乙氧基)-1-(吡咯烷-1-基)二氮烯-1-氧化物(11c) 由化合物9c制得,黄色固体95 mg,收率45%。mp:101~103 ℃;ESI-MS:m/z661.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.93(4H,m,2×NCH2CH2),2.83(1H,m,SO2CH2),3.02(1H,m,SO2CH2),3.29(7H,m,2×CH3NCH2CH2N,NCH3),3.48(6H,m,2×NCH2,CH3NCH2CH2N),3.71(2H,t,J=10.59 Hz,CH3NCH2CH2N),3.83(3H,s,OCH3),4.05(1H,d,J=12.84 Hz,OCH2),4.21(1H,d,J=12.99 Hz,OCH2),4.48(2H,m,ArCH2SO2),6.26(1H,d,J=7.92 Hz,ArH),6.48(1H,s,ArH),7.22(2H,d,J=7.32 Hz,ArH),7.35(1H,d,J=7.65 Hz,ArH),7.52(3H,m,2×ArH,ArNH),8.25(1H,s,ArH)。
2-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)亚磺酰乙氧基)-1-吗啉二氮烯-1-氧化物(11d) 由化合物9d制得,黄色固体83 mg,收率38%。mp:107~109 ℃;ESI-MS:m/z677.3[M+H]+;1H NMR(300 MHz,CDCl3)δ:2.83(1H,m,SO2CH2),3.02(1H,m,SO2CH2),3.30(7H,t,J=12.18 Hz,2×CH3NCH2CH2N,NCH3),3.40(4H,t,J=4.86 Hz,2×NCH2CH2O),3.47(2H,t,J=10.95 Hz,CH3NCH2CH2N),3.68(2H,t,J=11.28 Hz,CH3NCH2CH2N),3.81(7H,t,J=4.86 Hz,2×NCH2CH2O,OCH3),4.03(1H,d,J=11.73 Hz,ArCH2SO2),4.20(1H,d,J=12.99 Hz,ArCH2SO2),4.54(2H,m,OCH2),6.26(1H,d,J=7.74 Hz,ArH),6.48(1H,s,ArH),7.21(1H,s,ArH),7.25(1H,d,J=7.44 Hz,ArH),7.34(1H,d,J=7.68 Hz,ArH),7.50(2H,t,J=7.83 Hz,ArH),7.61(1H,br.s,ArNH),8.25(1H,s,ArH)。
1-(2-(3-(5-氯-2-(2-甲氧基-4-(4-甲基哌嗪-1-基)苯胺)嘧啶-4-氧)苄基)磺酰乙氧基)-3,3-二乙基三氮-1-烯-2-氧化物(11e) 由化合物9e制得,黄色固体80 mg,收率38%。mp:49~51 ℃;ESI-MS:m/z663.4[M+H]+;1H NMR(300 MHz,CDCl3)δ:1.05(6H,t,J=6.96 Hz,2×NCH2CH3),2.86(H,m,SO2CH2),3.04(H,m,SO2CH2),3.11(4H,q,J=6.96 Hz,2×NCH2CH3),3.29(4H,t,J=12.75 Hz,2×CH3NCH2CH2N),3.31(3H,s,NCH3),3.49(2H,t,J=10.20 Hz,CH3NCH2CH2N),3.69(2H,t,J=11.22 Hz,CH3NCH2CH2N),3.82(3H,s,OCH3),4.05(1H,d,J=12.81 Hz,ArCH2SO2),4.19(1H,d,J=12.99 Hz,ArCH2SO2),4.58(2H,m,OCH2),6.24(1H,d,ArH,J=5.49 Hz),6.47(1H,s,ArH),7.21(1H,s,ArH),7.23(1H,d,J=7.41 Hz,ArH),7.34(1H,d,J=7.83 Hz,ArH),7.50(3H,t,J=7.35 Hz,2×ArH,ArNH),8.25(1H,s,ArH)。
3 体外抗NSCLC活性测试
3.1 目标化合物对H1975细胞的抑制率测定
以吉非替尼(gefitinib)为对照,采用MTT法测定目标化合物9a~9e、10a~10e、11a~11e对含EGFR L858R/T790M突变体的人肺腺癌细胞H1975的增殖抑制活性。
按每孔1×103个细胞将H1975细胞株接种到96孔板中,在含有体积分数10%胎牛血清的培养基中培养过夜。目标化合物以10 μmol/L的终浓度进行给药,每个化合物设3个复孔,加药后继续培养72 h。向每孔中加入MTT(5 g/L)20 μL 溶液继续孵育4 h。弃上清液后,每孔加入DMSO 100 μL,振荡10 min后选择570 nm为测试波长、630 nm为参比波长于酶标仪上测定吸收度(A)。按公式:抑制率=(1-药物处理孔平均A/细胞对照孔平均A)×100%,计算细胞生长抑制率。结果如表1所示,当药物浓度为10 μmol/L时,硫醚类9a~9e对H1975细胞的增殖抑制率为92.30%~94.90%,均强于吉非替尼(54.84%);亚砜类10a~10e和砜类11a~11e的抑制率分别为36.45%~84.25%和29.00%~50.60%,与吉非替尼相当或弱于吉非替尼。
Table1Inhibition rate of target compounds against H1975 cells at 10 μmol/L
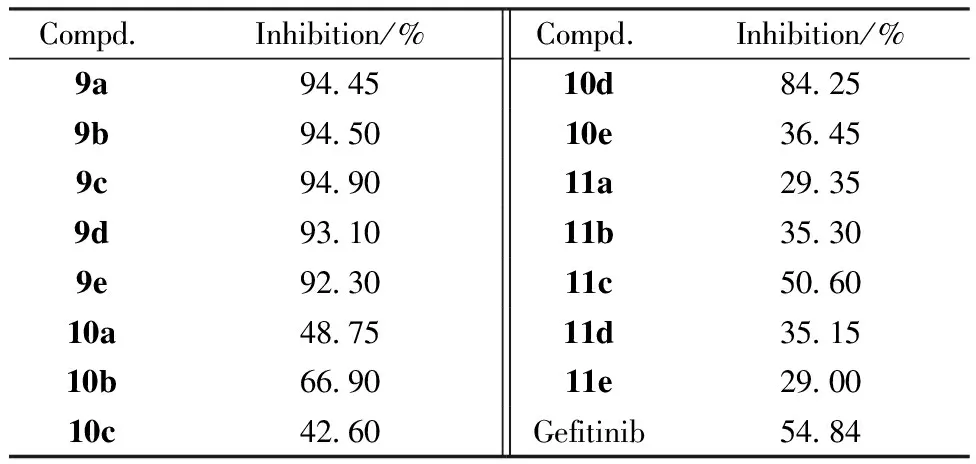
CompdInhibition/%CompdInhibition/%9a944510d84259b945010e36459c949011a29359d931011b35309e923011c506010a487511d351510b669011e290010c4260Gefitinib5484
3.2 目标化合物9a~9e对H1975细胞的IC50测定
以吉非替尼为对照,对化合物8和活性较好的9a~9e分别设置0,0.000 1,0.001,0.01,0.05,0.1,1,10 μmol/L 8个浓度对肿瘤细胞H1975进行增殖抑制实验,方法同上述筛选实验。利用GraphPad Prism 5.0中的Sigmodial Dose Response的非线性回归模型计算化合物的IC50,结果见表2。化合物9a~9e(IC50=0.65~2.05 μmol/L)优于吉非替尼(IC50=9.47 μmol/L),其中化合物9b(IC50=0.65 μmol/L)活性最强。
Table2IC50of compounds9a-9eagainst H1975 cells

CompdIC50/(μmol/L)9a2059b0659c1219d0909e1128254Gefitinib947
3.3 分子对接研究
利用Discovery Studio 2017 R2软件LibDock模块进行分子对接,预测化合物9b与EGFR T790M(PDB code:3IKA)的结合模式。化合物9b与EGFR T790M分别通过“Prepare Ligands”和“Prepare Protein”程序处理,利用3IKA的配体确定结合位点。模拟结果如图1所示,ARG841与苯胺基嘧啶母核形成氢键;CYS797和ASP800分别通过氢键和静电作用力与偶氮鎓二醇盐片段中的O原子和N原子结合。

Figure1Predicted binding mode for compound9band EGFR T790M
4 结果和讨论
构效关系分析可知:(1)随着目标化合物中硫原子氧化程度的增加,抑制活性有所减弱,其顺序为:硫醚类9a~9e>亚砜类10a~10e>砜类11a~11e。可能是随着硫原子氧化程度增加,化合物极性也相应增加,不利于化合物透过细胞膜进入细胞发挥作用;(2)含NO供体偶氮鎓二醇盐的9a~9e其抑制作用整体上强于结构上不含偶氮鎓二醇盐的类似物8,提示NO可能对9a~9e的活性具有重要贡献。
初步药理研究结果表明,苯胺基嘧啶/偶氮鎓二醇盐杂合物9b具有显著抑制NSCLC细胞增殖的活性;此外,分子对接提示,化合物9b主要通过氢键和静电作用力与靶点EGFR T790M结合。因此,有必要对化合物9b进行深入研究。本研究将在后期工作中,研究其对EGFR激酶的抑制作用、体内抗NSCLC活性及其作用机制等,结果将另文报道。
[1] Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CACancerJClin,2015,65(2):87-108.
[2] Herbst RS,Heymach JV,Lippman SM.Lung cancer[J].NEnglJMed,2008,359(13):1367-1380.
[3] Johnson BE,Janne PA.Epidermal growth factor receptor mutations in patients with non-small cell lung cancer[J].CancerRes,2005,65(17):7525-7529.
[4] Govindan R.A review of epidermal growth factor receptor/HER2 inhibitors in the treatment of patients with non-small-cell lung cancer[J].ClinLungCancer,2010,11(1):8-12.
[5] Finlay MR,Anderton M,Ashton S,etal.Discovery of a potent and selective EGFR inhibitor(AZD9291) of both sensitizing and T790M resistance mutations that spares the wild type form of the receptor[J].JMedChem,2014,57(20):8249-8267.
[6] Walter AO,Sjin RT,Haringsma HJ,etal.Discovery of a mutant-selective covalent inhibitor of EGFR that overcomes T790M-mediated resistance in NSCLC[J].CancerDiscov,2013,3(12):1404-1415.
[7] Zhou W,Ercan D,Chen L,etal.Novel mutant-selective EGFR kinase inhibitors against EGFR T790M[J].Nature,2009,462(7276):1070-1074.
[8] Basudhar D,Ridnour LA,Cheng R,etal.Biological signaling by small inorganic molecules[J].CoordChemRev,2016,306(Pt 2):708-723.
[9] Huang Z,Fu J,Zhang Y.Nitric oxide donor-based cancer therapy:advances and prospects[J].JMedChem,2017,60(18):7617-7635.
[10] Cheng H,Wang L,Mollica M,etal.Nitric oxide in cancer metastasis[J].CancerLett,2014,353(1):1-7.
[11] Han C,Huang Z,Zheng C,etal.Novel hybrids of(phenylsulfonyl)furoxan and anilinopyrimidine as potent and selective epidermal growth factor receptor inhibitors for intervention of non-small-cell lung cancer[J].JMedChem,2013,56(11):4738-4748.
[12] Han C,Huang Z,Zheng C,etal.Nitric oxide donating anilinopyrimidines:synthesis and biological evaluation as EGFR inhibitors[J].EurJMedChem,2013,66:82-90.
[13] Han C,Wan L,Ji H,etal.Synthesis and evaluation of 2-anilinopyrimidines bearing 3-aminopropamides as potential epidermal growthfactor receptor inhibitors[J].EurJMedChem,2014,77:75-83.
[14] Huang Z,Kaur J,Bhardwaj A,etal.O2-sulfonylethyl protected isopropylamine diazen-1-ium-1,2-diolates as nitroxyl (HNO) donors:synthesis,beta-elimination fragmentation,HNO release,positive inotropic properties,and blood pressure lowering studies[J].JMedChem,2012,55(22):10262-10271.
[15] Hong SY,Saavedra JE,Keefer LK,etal.Improved synthesis of V-PYRRO/NO,a liverselective nitric oxide prodrug,and analogues[J].TetrahedronLett,2009,50(18):2069-2071.
[16] Hamann JN,Rolff M,Tuczek F.Monooxygenation of an appended phenol in a model system of tyrosinase:implications on the enzymatic reaction mechanism[J].DaltonTrans,2015,44(7):3251-3258.

