黄体酮阴道缓释凝胶在FET周期不同内膜准备方案中黄体支持的效果分析
许科,陈莉,陈洋,黄晓阳
(南京医科大学附属常州市妇幼保健院生殖中心,常州 213000)
采用激素替代周期进行冻融胚胎移植(FET)内膜准备,因其简单方便,子宫内膜容受性好,具有较高的妊娠率,在临床上获得广泛应用[1]。该方法由于缺乏黄体功能,需完全依赖外来激素支持妊娠,因此在实施该技术时应用何种有效且安全的黄体支持方法对妊娠结局极为关键[2]。临床上常用的黄体酮药物在用药剂量、种类、给药途径及用药时间上目前尚无统一标准。受药物种类、地域等因素及传统观念的影响,目前国内FET周期中黄体支持常使用口服黄体酮与针剂相结合,但患者对肌肉注射方案的接受度不高。黄体酮阴道缓释凝胶在欧美国家被广泛应用于IVF-ET后的黄体支持[3],具有简便、安全、有效等优点,患者接受度较好。本研究探讨黄体酮阴道缓释凝胶在FET周期(自然周期和激素替代周期)中黄体支持的效果,以期为本中心寻求更合适的内膜准备和黄体支持方案。
资料和方法
一、研究对象
回顾性分析2015年10月至2017年5月本院生殖中心260例激素替代FET周期患者(A组)及300例自然周期FET患者(B组)的临床资料。
纳入标准:(1)接受FET周期助孕;(2)年龄>18岁、<40岁;(3)有至少1~2个优质第3天(D3)卵裂胚可移植;(4)患者临床资料完整。
排除标准:(1)合并子宫内膜息肉、子宫明显畸形、宫腔粘连、输卵管积水等对胚胎着床有影响的疾病;(2)合并严重内科疾病;(3)对性激素的使用存在明显禁忌者;(4)夫妻双方均有染色体异常;(5)反复进行移植均失败;(6)既往有心理疾病或精神疾病确诊史。
根据不同黄体支持方式将患者分为4个亚组:A组中黄体酮针剂+地屈孕酮组(A1组,186例)、A组中黄体酮阴道缓释凝胶+地屈孕酮组(A2组,74例);B组中黄体酮针剂+地屈孕酮组(B1组,234例)、B组中黄体酮阴道缓释凝胶+地屈孕酮组(B2组,66例)。分析各组的黄体支持效果及妊娠结局。
二、FET方法回顾
1. 内膜准备:A组所有患者在月经第1天开始均给予戊酸雌二醇(拜耳,德国)2~8 mg/d口服,14 d后对患者实施B超检查,测量其内膜厚度,待E2>366 pmol/L、内膜厚度≥8 mm后实施内膜转化;B组自然周期FET患者在其月经第12天开始对其卵泡发育情况及内膜发育情况进行监测,排卵日内膜≥8 mm、E2>366 pmol/L时实施内膜转化。
2. 内膜转化:A1、B1组患者内膜转化方案均给予黄体酮针剂(浙江仙琚制药)+地屈孕酮(雅培,荷兰)口服,患者使用黄体酮针剂肌肉注射60 mg/d,给予地屈孕酮口服10 mg,Bid;A2、B2组患者内膜转化方案均给予黄体酮阴道缓释凝胶(雪诺同8%,默克雪兰诺,德国)+地屈孕酮,黄体酮阴道缓释凝胶使用90 mg/d经阴道给药,口服地屈孕酮10 mg,Bid。
3. FET及黄体支持:各组患者在内膜转化3 d后接受FET手术。利用快速复苏技术对之前行玻璃化冷冻的胚胎进行复苏,在胚胎复苏后第2天观察评级,全部患者均至少移植1枚胚胎以上,但不超过3枚胚胎。全部患者胚胎培养均有至少1枚优质胚胎。A1、B1组患者黄体支持方法为黄体酮针剂肌肉注射60 mg/d+地屈孕酮口服10 mg,Bid;A2、B2黄体支持方法为黄体酮阴道缓释凝胶90 mg/d+地屈孕酮口服10 mg,Bid。持续黄体支持至移植后2周。
4. 妊娠判定:患者移植胚胎2周后静脉采血检测。血HCG水平<3 U/L属于未妊娠,停止黄体支持药物;血HCG水平≥3 U/L属于生化妊娠,继续黄体支持;在FET后1个月为患者实施B超检查发现有妊娠囊或流产物绒毛或见宫外妊娠者属于临床妊娠;患者在停经后13周左右经B超检查发现宫内有存活胎儿属于持续妊娠;妊娠12 周内胚胎停育者为早期流产。
三、观察指标
比较A1与A2、B1与B2组患者的一般资料及接受胚胎移植后的妊娠结局,包括临床妊娠率、流产率及继续妊娠率等。
四、统计学方法
结 果
一、患者一般资料及移植优胚情况比较
A组患者年龄20~40岁,平均(34.52±5.14)岁;不孕年限1~8年,平均(4.31±1.45)年。B组年龄20~39岁,平均(35.14±5.21)年;不孕年限1~7年,平均(4.12±1.37)年。
A1组与A2组患者间年龄、体重指数(BMI)、不孕年限、移植日内膜厚度、移植胚胎数比较,差异均无统计学意义(P>0.05)(表1)。B1组与B2组患者间年龄、BMI、不孕年限、移植日内膜厚度等比较,差异亦无统计学意义(P>0.05)(表2)。A1、A2、B1、B2组移植优胚数分别为(1.86±0.49)枚、(1.91±0.54)枚、(1.85±0.50)枚、(1.89±0.49)枚,4组间移植优胚数比较,差异均无统计学意义(F=0.410,P=0.746)(表1、2)。

表1 A组中不同黄体支持患者一般资料及移植优胚情况比较(-±s)

表2 B组不同黄体支持患者一般资料及移植优胚情况比较(-±s)
二、各组患者的妊娠结局比较
A组不同黄体支持亚组的妊娠结局比较,A1、A2两组间生化妊娠率比较无统计学差异(P>0.05);A2组临床妊娠率、持续妊娠率均显著高于A1组(P<0.05)(表3)。B1、B2两组患者的生化妊娠率、临床妊娠率及持续妊娠率比较,差异均无统计学意义(P>0.05)(表4)。
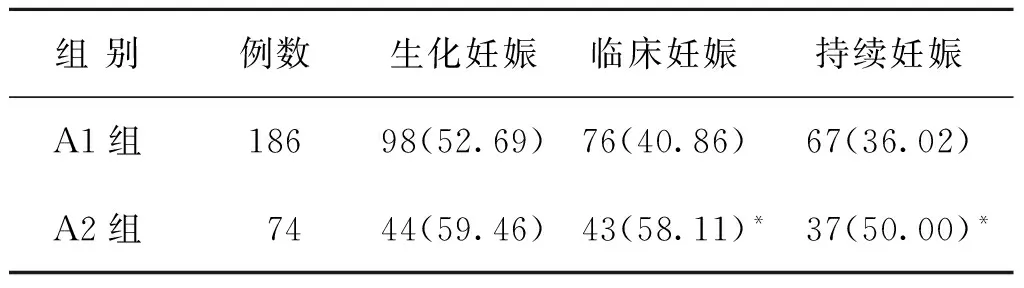
表3 A组中不同黄体支持亚组患者的妊娠结局比较[n(%)]
注:与A1组比较,*P<0.05
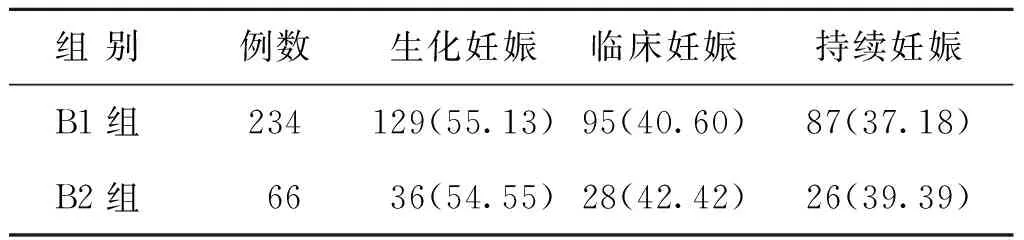
表4 B组不同黄体支持患者妊娠结局比较[n(%)]
讨 论
1983年,世界首例不孕患者接受FET获得临床妊娠成功[4]。随着胚胎冷冻技术的发展,FET周期在提高胚胎利用率、增加妊娠成功率、降低卵巢过度刺激综合征(OHSS)发生等方面,显示出非常明显的优势。因此,目前FET有逐渐取代新鲜胚胎移植周期的趋势[5]。
FET的成功与子宫内膜厚度及种植窗的开放有密切关系,FET周期主要采用3种内膜准备方案:促排卵周期、自然周期及激素替代周期[6]。自然周期需要对患者的卵泡发育情况连续监测,卵泡与内膜发育不同步或卵泡生长发育情况不佳均易导致周期取消;促排卵周期则需要为患者肌肉注射药物并对其卵泡发育情况连续监测,该周期可能因为卵泡发育不佳而取消周期;促排卵周期及自然周期这两种方案均需具有内源性黄体功能。激素替代周期的子宫内膜准备则是通过外源性雌激素进行,个体之间存在的差异并不明显,因此该方案具有较强的操作性及可控制性,适用于既往子宫内膜厚度<8 mm者、存在排卵障碍者及月经不规律者。加之该方案用药方便,无需对患者的卵泡发育情况进行持续监测,周期取消率较低,因此临床应用也较广泛,但接受激素替代周期的患者均需要依靠外源性黄体支持,也存在一定的局限性[7-9]。
黄体期需要充足的孕激素于子宫内膜上皮细胞产生作用,促进其转变为分泌性内膜,同时对子宫内膜的种植窗开放及容受性需有一定诱导。在激素替代周期中,患者自身不会形成内源性黄体,因此内膜的转化需要经外源性孕酮使用进行。有学者认为高雌激素水平将对子宫内膜的正常作用造成直接干扰,导致子宫内膜容受性明显下降,在转化中极易发生胚胎着床失败等情况[10]。一定量的雌激素促进子宫内膜在一定程度内增生后,孕激素刺激子宫内膜种植窗的开放并促进胚胎着床与发育。在激素替代周期中,内膜需要受到大剂量外源性雌激素直接作用,因此需要为患者使用足够的孕酮促进黄体转化,针对部分雌激素用量较多且作用时间较长的患者,可考虑为其适当增加孕酮的使用促进内膜转化[11]。
目前黄体酮制剂主要包括阴道置胶囊、口服片剂、口服胶囊、注射液、阴道置凝胶等,因黄体酮注射液有着更为理想的血药浓度,药物价格低廉,因此目前的FET周期黄体支持手段多为患者使用黄体酮注射液,而黄体酮口服制剂具有使用方便、服用无痛苦等优点,多与黄体酮针剂联合用于FET周期黄体支持[12]。然而黄体酮针剂给药极易导致局部发生红肿,限制药物的吸收;而黄体酮口服后则与其他口服制剂相似,极易导致患者出现肝脏首过效应等情况,黄体酮被肝脏大量代谢后,药物浓度不稳定,降低其生物利用率,部分患者还会出现嗜睡等诸多中枢系统症状。随着研究的深入,有学者提出可采用阴道给药的方式进行黄体支持,阴道给药较口服及肌肉注射有更低的流产率及更高的活产率,同时阴道给药还具有促进宫颈粘液栓增加、镇静子宫、平衡杀伤因子之效,更利于早期保胎[13-14]。在所有阴道制剂中,以阴道缓释凝胶的效果最为确切,且更适合广大患者。
基于上述论证,本研究对我中心接受激素替代周期FET与自然周期FET的患者分别使用黄体酮针剂+地屈孕酮及黄体酮阴道缓释凝胶+地屈孕酮治疗,结果显示对于激素替代周期患者而言使用黄体酮阴道缓释凝胶+地屈孕酮者临床妊娠率及持续妊娠率均高于使用黄体酮针剂+地屈孕酮的患者;而对于自然周期FET患者,不同黄体酮支持手段的妊娠率及持续妊娠率无明显差异。结果提示,对于激素替代周期FET患者,给予黄体酮阴道缓释凝胶的黄体支持效果优于黄体酮针剂,而自然周期FET患者则可根据患者具体情况选择合适的黄体酮制剂。这可能是因为激素替代周期患者没有内源性黄体功能,在持续使用单一的大剂量雌激素作用下,需要为患者提供更多的外源性黄体酮以帮助其内膜转化成功,而使用黄体酮阴道缓释凝胶能够稳定、快速并持续地对子宫内膜及阴道产生直接作用,有利于提高患者的妊娠率[15]。而对于以HCG作为诱导的自然周期FET患者而言,因其有内源性黄体的产生,因此为其补充黄体酮阴道缓释凝胶并没有显著效果[16]。
综上所述,若FET患者有内源性黄体酮功能,可根据患者的接受情况、经济条件等考虑是否使用黄体酮阴道缓释凝胶;而对于缺乏内源性黄体酮功能的FET患者可为其使用黄体酮阴道缓释凝胶,以减少子宫收缩,增加子宫内膜容受性,缩短胚胎着床的时间,减少异位妊娠的发生。
[1] 肖潇,熊芳,张昀,等.黄体酮阴道缓释凝胶在激素替代冻融胚胎移植黄体支持中的应用价值[J].中国妇幼保健,2016,31:5441-5443.
[2] 李小兰,黄睿,方丛,等.基础血清抗苗勒管激素与新鲜/冷冻胚胎移植周期活产率的相关性分析[J].中山大学学报(医学科学版),2017,38:63-71.
[3] Polyzos NP,Messini CI,Papanikolaou EG,et al. Vaginal progesterone gel for luteal phase support in IVF/ICSI cycles:a meta-analysis[J]. Fertil Steril,2010,94:2083-2087.
[4] 方春霞,朱琴,张红霞,等.孕酮测定在决定自然周期冷冻胚胎移植时机中的价值[J].中国妇幼保健,2017,32:2991-2993.
[5] 罗轶群.冷冻胚胎移植周期中黄体支持的研究现状[J].国际生殖健康/计划生育杂志,2015,34:339-343.
[6] 林洪,李蓉,钱卫平. 冷冻胚胎移植周期中不同内膜准备方案对助孕结局的影响[J]. 中华妇幼临床医学杂志(电子版)2014,10:457-460.
[7] Shapiro BS,Daneshmand ST,Garner FC,et al. Evidence of impaired endometrial receptivity following controlled ovarian stimulation:a prospective randomized trial in high responders[J].Fertil Steril,2011,96:344-348.
[8] Aflatoonian A,Oskouian H,Ahmadi S,et al. Can fresh embryo transfers be replaced by cryopreserved-thawed embryo transfers in assisted reproductive cycles? A randomized controlled trial[J]. J Assist Reprod Genet,2010,27:357-363.
[9] LabarIa E,Martinez-Conejero JA,Alamá P,et al. Endometria receptivity is affected in women with high circulating progesterone levels at the end of the foIlicular phase:a functional genomics analysis[J].Hum Reprod,2011,26:1813-1825.
[10] 康艳,匡延平.冻融胚胎移植周期内膜准备方案的进展[J].生殖与避孕,2012,32:479-481.
[11] Shawki O,Peters A,Abraham-Hebert S. Hysteroscopic endometrial destruction,optimum method for preoperative endometrial reparation:a prospective,randomized,multicenter evaluation[J]. JSLS,2002,6:23-27.
[12] 方颖,杨晓葵,王树玉.三种黄体支持方案对激素替代周期冻融胚胎移植妊娠结局的影响[J].生殖医学杂志,2015,24:277-280.
[13] 何健英,邹立波,程兆俊.比较两种黄体支持方案对冷冻胚胎移植周期妊娠结局的影响[J].中国妇幼保健,2015,30:6296-6298.
[14] 许科,陈莉.黄体酮阴道缓释凝胶在体外受精-胚胎移植黄体支持中的应用效果分析[J].中外女性健康研究,2017,18:103-104.
[15] Alsbjerg B,Polyzos NP,Elbaek HO,et al. Increasing vaginal progesterone gel supplementation after frozen-thawed embryo transfer significantly increases the delivery rate[J/OL]. Reprod Biomed Online,2013,26:133-137.
[16] 刘景瑜,王玢,孔娜,等.自然周期使用hCG诱导排卵对冻融胚胎移植临床结局的影响[J].生殖与避孕,2014,34:871-873.

