miR-142在乳腺癌组织和细胞中的表达变化及其对MDA-MB-231细胞侵袭迁移能力的影响
胡潺潺,李青山,刘兰芳,梁云微,朱翠敏,张晶晶,李爱科,王锐
(承德医学院附属医院,河北承德067000)
乳腺癌是全球最常见的女性恶性肿瘤之一[1],肿瘤的侵袭转移是其死亡的主要原因之一。虽然,近十几年来的手术技术及药物治疗取得明显进步,但患者5年总生存率并未得到明显提高[2]。近期研究发现,微小RNA(miRNA)在众多恶性肿瘤的侵袭转移中发挥重要作用[3]。miR-142是miRNA家族成员之一[4],在多种恶性肿瘤中表达异常,推测其在恶性肿瘤的发生发展中发挥重要作用[5]。但是,目前有关miR-142在乳腺癌中表达情况的研究甚少,并且作用机制尚不清楚。2017年12月~2018年4月,我们观察了乳腺癌组织和细胞中miR-142的表达变化,并通过脂质体转染技术上调乳腺癌细胞MDA-MB-231中miR-142的表达,探讨miR-142对乳腺癌细胞侵袭和迁移的影响,为乳腺癌的靶向治疗提供新方向。
1 材料与方法
1.1 主要材料
1.1.1 组织细胞样本 收集2016年5月~2017年5月在承德医学院附属医院手术切除的92例女性乳腺癌患者的乳腺癌组织及相对应的癌旁组织(距肿瘤边缘5 cm以上),组织离体后立即置于液氮中,-80 ℃冰箱保存。患者术前未行放化疗及其他抗肿瘤治疗,术后均经病理检查确诊。本研究获医院伦理委员会批准,患者均签署知情同意书。人乳腺癌细胞系MCF-7、MDA-MB-231、MDA-MB-468及人正常乳腺上皮细胞HBL-100均购自美国典藏细胞库(ATCC),其中MDA-MB-231和MDA-MB-468为高侵袭性乳腺癌细胞,MCF-7为低侵袭性乳腺癌细胞[6]。
1.1.2 主要试剂 RPMI1460培养基及DMEM培养基购自美国Gibco公司;miR-142模拟物及阴性对照序列购自上海吉玛制药公司,miR-142及内参U6 snRNA引物均购自广东锐博生物公司,TRIzol试剂及LipofectamineTM2000脂质体转染试剂均购自美国Invitrogen公司,逆转录试剂盒及qRT-PCR试剂盒购自大连TaKaRa公司;Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。
1.2 实验方法
1.2.1 细胞培养与转染处理 将各类乳腺癌细胞均接种于含10%胎牛血清的RPMI1460培养基,人正常乳腺上皮细胞接种于DMEM培养基中,均置于37 ℃、5% CO2培养箱中培养。取对数生长期的MDA-MB-231细胞并分为观察组和对照组,消化、离心后接种于6孔板(2×105/孔);细胞融合达70%~80%时更换培养液,观察组和对照组采用LipofectamineTM2000脂质体试剂盒转染miR-142模拟物及阴性对照序列,转染后24 h进行后续实验。
1.2.2 组织和细胞中miR-142检测 采用qRT-PCR法。采用TRIzol试剂提取各类组织及细胞总RNA,用超微量分光光度仪测定RNA的浓度及纯度。以100 ng总RNA为模板,按逆转录试剂盒说明书逆转录得到cDNA。取cDNA和引物,根据qRT-PCR试剂盒说明书配制PCR体系进行反应。反应条件:95 ℃ 变性10 min;95 ℃ 15 s,60 ℃ 60 s,共40个循环。miR-142引物序列上游为5′-TGCAGGGCAGCAGAGGAGCTGCTGT-3′,下游为5′-ACTGAGGCTCTGGGCAGTCAGGACC-3′。以U6作为内参,采用2-ΔΔCt法计算miR-142相对表达水平。
1.2.3 转染后MDA-MB-231细胞侵袭及迁移能力观察 采用Transwell侵袭及迁移实验。Transwell小室内膜均匀涂抹Matrigel胶,放置过夜成膜。用无血清DMEM培养基重悬细胞,制作细胞密度为1×105/mL的细胞悬液。细胞饥饿处理后,按200 μL/孔将细胞悬液加入小室上室,在小室下室加入500 μL含10% 胎牛血清的DMEM培养基,置于37 ℃孵育培养24 h。取出小室,PBS冲洗后用棉签擦除上室内膜黏附的细胞;甲醛固定,PBS冲洗后染色;倒置显微镜下随机取5个高倍视野,计数穿透滤膜的细胞,以此表示细胞的侵袭能力。迁移实验除了小室内膜上不给予涂抹Matrigel胶外,余操作同侵袭实验,以穿透滤膜的细胞数表示细胞的迁移能力。
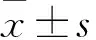
2 结果
2.1 乳腺癌、癌旁组织中miR-142表达比较 乳腺癌组织中miR-142相对表达量为0.35±0.09,低于癌旁组织中的1.02±0.04(P<0.01)。
2.2 乳腺癌和正常乳腺上皮细胞中miR-142表达比较 乳腺癌MCF-7、MDA-MB-231、MDA-MB-468细胞中miR-142相对表达量分别为0.53±0.05、0.17±0.06、0.19±0.08,均低于人正常乳腺上皮细胞HBL-100中的1.01±0.03(P均<0.01),且高侵袭性乳腺癌细胞MDA-MB-231、MDA-MB-468中miR-142相对表达量低于低侵袭性乳腺癌细胞MCF-7(P均<0.01)。
2.3 两组转染后的MDA-MB-231细胞中miR-142表达比较 转染后观察组MDA-MB-231细胞中miR-142相对表达量为32.97±1.89,高于对照组的1.01±0.06(P<0.01)。
2.4 各组转染后的MDA-MB-231细胞侵袭和迁移能力比较 观察组迁移和侵袭实验中穿膜细胞分别为(110±15)、(52±9)个,均低于对照组的(305±27)、(148±16)个(P均<0.01)。
3 讨论
miRNA是一类存在于真核细胞内的小分子非编码单链短RNA,长度为18~23个核苷酸。miRNA通过其种子序列完全或部分与靶基因mRNA的3′非翻译区互补配对,降解靶基因mRNA或抑制其翻译,从而调控靶基因的表达,在细胞的增殖、分化、凋亡、侵袭、迁移等机体生理或病理过程中发挥极其重要的作用[7,8]。适当的miRNA表达水平是维持细胞稳态及机体正常功能的必要条件,异常的miRNA表达在恶性肿瘤中的发生发展中发挥着重要作用,起着类似癌基因或者抑癌基因的作用[9,10]。
miR-142是miRNA家族重要成员之一,2004年由Chen等[11]首先在造血干细胞中发现并报道。研究表明,miR-142在维持干细胞分化及细胞的增殖、凋亡等方面发挥着重要作用[12]。近期研究结果表明,miR-142在恶性肿瘤的发生发展中也起重要作用,但有关miR-142在恶性肿瘤中表达情况的研究结果不同。研究结果表明,miR-142在肝细胞癌[13]、非小细胞肺癌[14]、宫颈癌[15]、急性淋巴细胞白血病[16]、骨肉瘤[17]等恶性肿瘤中表达水平降低,起着抑癌基因的作用;但在鼻咽癌[18]、结肠癌[19]、肾细胞癌[20]等恶性肿瘤中表达升高,起着癌基因的作用。这说明miR-142在恶性肿瘤中的作用机制复杂,通过多种不同的分子通路参与肿瘤的发生发展。目前,有关miR-142在乳腺癌中的研究甚少。本研究结果显示,乳腺癌组织中miR-142表达低于癌旁组织,并且乳腺癌细胞MCF-7、MDA-MB-231、MDA-MB-468中miR-142表达均低于正常乳腺上皮细胞HBL-100。这说明miR-142异常表达与乳腺癌的发生有关,可能在乳腺癌的发生中起着抑癌基因的作用。
乳腺癌的局部浸润和远处转移是目前治疗的难点,是乳腺癌患者死亡的最主要原因之一。miRNA在肿瘤中的功能研究,为恶性肿瘤的进展及侵袭转移机制提供了新思路。研究报道,在高侵袭性的乳腺癌细胞中miR-21高表达、miR-149低表达,可作为乳腺癌高侵袭性的分子标志[21,6]。本研究发现,高侵袭转移乳腺癌细胞MDA-MB-231、MDA-MB-468中miR-142表达低于低侵袭转移乳腺癌细胞MCF-7,提示miR-142异常低表达可能与乳腺癌细胞的高侵袭性有关。
目前,Transwell侵袭及迁移实验是检测肿瘤细胞侵袭与迁移能力的最常用方法。为进一步探讨miR-142对乳腺癌细胞侵袭转移能力的影响,我们在体外应用脂质体转染法将miR-142模拟物转染至MDA-MB-231细胞,提高MDA-MB-231细胞中miR-142的表达水平。Transwell侵袭及迁移实验显示,转染后观察组细胞的侵袭及迁移的穿膜细胞数较对照组明显减少。这说明上调乳腺癌细胞中miR-142的表达,能够明显抑制肿瘤细胞的侵袭转移能力,进一步表明miR-142在乳腺癌中起抑癌基因的作用。
综上所述,miR-142在乳腺癌组织和细胞中表达降低,且高侵袭性低于低侵袭性乳腺癌细胞;提高乳腺癌细胞中miR-142的表达水平,能够抑制细胞的侵袭和迁移能力。但是,乳腺癌的发生发展及侵袭转移是一个多因素相互作用的复杂过程,miR-142在此过程中的具体作用机制尚需进一步的探讨。

