干预基质金属蛋白酶-9对高血压脑出血后期脑水肿治疗的影响
苑 杨,杜 鹏,栾新平
高血压脑出血(hypertensive cerebral hemorrhage, HCH)是临床最为常见的急性脑血管疾病,具有极高的致死、致残率,发病率较高[1]。发生HCH后会出现原发性和继发性的损害。原发性损害为脑出血对脑组织的原发破坏;继发性的主要为脑水肿,且可加重脑部不可逆损害,加重促进神经功能缺损,是病情加重的重要原因[2]。脑水肿具体发生的机制非常复杂,诱发因素很多,目前还没有较为明确有效的治疗方法。基质金属蛋白酶(Matrix Metalloproteinases,MMPs)是一组与锌原子有关的金属蛋白内切酶,其在体内起到降解和再塑造细胞外基质的作用。其中基质金属蛋白酶-9(MMP-9)引起缺血性脑血管病、脑水肿的主要研究方向之一。有研究证明,MMP-9可通过破坏血脑屏障,参与脑出血早期的血管源性水肿形成[3],或与凝血酶协同作用加重脑水肿[4]。MMP-9抑制药能够通过抑制MMP-9的高表达及酶的活性来降低血-脑屏障(简称为BBB)连接蛋白或基底膜发生的降解,使BBB通透性逐渐的恢复正常,以达到减轻脑水肿的目的。本研究通过MMP-9对HCH患者后期脑水肿形成的分析及治疗方案,旨在为临床治疗提供依据。
1 对象与方法
1.1 对象 选取2014-06至2016-05我院神经外科住院治疗的112例患者,纳入标准:(1)符合HCH诊断;(2)血肿位于基底节区且<30 ml;(3)无药物治疗禁忌证;(4)同意入组且依从性好。排除标准:(1)入院时有脑疝形成表现或已经存在脑疝;(2)治疗期间再出血或因其他疾病引起预后不良;(3)资料不全;(4)依从性不良。按治疗方法随机分为两组,常规治疗联合MMP-9抑制药(实验组),常规治疗(对照组),每组56例。两组入院时发病时间、年龄、GCS评分、脑水肿范围、MMP-9值、NIHSS评分等资料差异无统计学意义,具有可比性(表1)。所有患者均签署知情同意书。
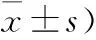
表1 两组高血压脑出血患者一般资料比较 (n;
1.2 治疗方法 对照组给予常规化的治疗,常规治疗包括乌拉地尔泵入控制血压在150/90 mmHg以下、止血药物应用3 d(注射酚磺乙胺注射液0.5 g,3次/d)、适当剂量20%甘露醇脱水控制水肿(甘露醇125 ml,每8 h/次)、(咪达唑仑静脉泵入)适当镇静等;实验组在对照组治疗基础之上加用了MMP-9外源性抑制药,选用丁苯酞氯化钠注射液(石药集团生产药准字 H20100041),规格25 g/100 ml,2次/d,静脉滴注,两次间隔时间>6 h,治疗时间均为2周。
1.3 观测指标及标准 记录并对比入院和2周后MMP-9值、脑水肿体积、NIHSS评分情况。脑水肿体积的变化情况,采用日本多田计算公式计算获得:水肿体积=水肿和血肿总的体积-入院时血肿体积; NIHSS评分(美国国立卫生研究院卒中量表National Institute of Health stroke scale),总分42分,0~1分正常,2~4分小卒中,5~15分中度卒中,16~20分中、重度卒中,>20分重度卒中;有效率(%)=(总例数-因水肿加重改变治疗方式例数)/总例数×100%。1、2项均由两名医师各自计算后取平均数获得。
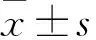
2 结 果
2.1 脑水肿体积、NIHSS评分及MMP-9值比较 入院时,对照组与实验组脑水肿体积、MMP-9值以及NIHSS评分进行比较,差异无统计学意义。经过2周的治疗后,实验组脑水肿的体积、MMP-9数值,以及NIHSS评分明显低于对照组,两者之间的差异具有统计学意义(P<0.01,表2)。
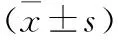
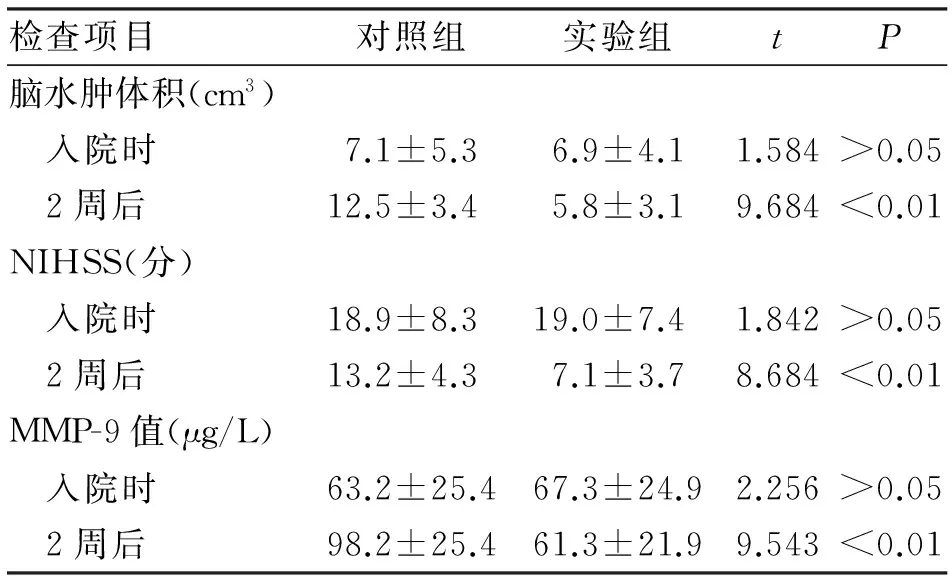
检查项目对照组实验组tP脑水肿体积(cm3) 入院时7.1±5.36.9±4.11.584>0.05 2周后12.5±3.45.8±3.19.684<0.01NIHSS(分) 入院时18.9±8.319.0±7.41.842>0.05 2周后13.2±4.37.1±3.78.684<0.01MMP-9值(μg/L) 入院时63.2±25.467.3±24.92.256>0.05 2周后98.2±25.461.3±21.99.543<0.01
2.2 有效率比较 对照组改变治疗方案的为20例,继续原治疗的36例,对照组有效率为64.29%(36/56),实验组改变治疗方案为8例,继续原治疗的48例,实验组有效率为85.71%(48/56),两组有效率对比,差异有统计学意义(P<0.01)。
3 讨 论
HCH后血液在出血部位迅速形成血肿,压迫周围正常脑组织,导致相邻或者远处的区域出现较为广泛的血液供应不足,继发细胞的缺血、缺氧导致细胞膜的功能受到影响,进一步影响脑组织的水钠代谢,从而引起脑水肿,如果能够改变这种状态就可以减少水肿的形成[5]。符合手术指征的患者在出血后6 h内清除脑部的血肿,可以将其对脑部的损伤程度降至最低,各种后遗症也会显著的较少[6]。但脑水肿属于HCH继发性的损害。它能够使脑部发生不可逆的损害及神经功能出现缺损,对HCH的预后也可产生重要的影响。HCH后期出现脑水肿的原因可能还受各种炎性因子的介质及MMP-9、HIF-1α的影响[7],因此减轻无手术指征患者HCH后期脑水肿至关重要。
目前,MMP-9是一个重要的研究方向,与HCH后期脑水肿的发生有着密切的联系。一方面,HCH后会引起脑组织的缺氧,HIF-1α属于一种转录因子,它能够使机体内的细胞在低氧(或无氧)的条件下生存下来,较大数量的动物实验证明,HIF-1α的激活可以使MMP-9的表达量显著上升[9]。另一方面,HCH后机体会出现氧化应激、炎性反应及细胞毒性等反应,MMP-9在这些反应的刺激下,体内的氧自由基以及凝血纤溶酶被激活,使得MMP-9在机体内表达能力增加。MMP抑制药能够有效抑制MMP-9的高表达,以降低BBB连接蛋白或基底膜发生的降解,此时BBB的通透性就会显著地减小,周围脑组织水肿体积即会缩小[9]。前期已有大量相关的ICH动物模型研究指出[10],当敲除小鼠体内MMP-9基因或采用MMP-9的抑制药,会使MMP-9在小鼠体内的表达量显著减少或其活性被抑制,实验小鼠发生脑水肿的概率随之降低。有基础实验证明,阿托伐他汀、半胱氨酸蛋白酶抑制药、小剂量米诺环素及丁苯肽等外源性抑制药可能有抑制MMP-9分泌和降低其活性的作用[11],我们选取用丁苯酞,以减少体内MMP-9的产生及活性表达,从而减轻脑水肿作用[12]。
研究证实,MMP-9在HCH的病情全程中均有某种相关性。MMP-9在降解纤黏和层黏蛋白,以及胶原蛋白Ⅳ型方面具有其特有的性质,且参与炎性反应,从而增加血脑屏障通透性,加重脑水肿[13]。本研究发现,两组入院时脑水肿体积、MMP-9值,以及NIHSS评分相比无统计学差异,2周后实验组脑水肿体积、MMP-9值都显著低于对照组,差异有统计学意义,且MMP-9值的高低与脑水肿体积大小之间有相关性。血清MMP-9的值经外源性MMP-9抑制药治疗后实验组数值小于对照组,说明外源性抗MMP-9药物可以通过抑制分泌或表达而发挥减轻脑水肿的作用。2周后,实验组脑水肿体积与NIHSS评分明显小于对照组,表明临床症状改善。治疗后,对照组总有效率为64.29%,实验组为85.71%,具有统计学意义,表明应用外源性MMP-9抑制药可以减轻脑水肿,提高小量脑出血患者非手术治疗的有效率。我们认为,常规治疗联合外源性MMP-9抑制药,能够通过抑制MMP-9的表达及其活性从而发挥减轻脑水肿的作用,提高非手术脑出血的治疗效果。由此可见,MMP-9脑水肿形成过程中有一定的治疗作用。
虽然通过本研究发现脑出血后期脑水肿与MMP-9之间具有相关性,且通过外源性MMP-9抑制药可降低MMP-9的值及水肿程度进而验证了这一相关性,但MMP-9是否是脑出血后引起脑水肿的唯一,或最终通路,以及外源性抑制药是否为单一通过抑制MMP-9的产生和表达来而减轻脑水肿,还需通过动物实验来进一步验证。
[1] Aghaei I,Bakhshayesh B,Ramezani H,etal.Therelationship between the serum levels of ferritin and theradiological brain injury indices in patients with spontaneous intracerebral hemorrhage[J].Iran J Basic Med Sci,2014,17(10): 729.
[2] 王艳春.TLR4拮抗剂减轻小鼠脑出血的炎性反应损伤机制[D].重庆:第三军医大学,2013.
[3] Jin R,Yang G,Li G. Molecular insights and therapeutic targets forblood-brain barrier disruption in ischemic stroke:critical role ofmatrix metalloproteinases and tissue-type plasminogen activator[J]. Neurobiol Dis,2010,38(3):376-385.
[4] Xue M,Hollenberg M D,Yong V W,etal. Combination of thrombin and matrix metalloproteinase-9 exacerbates neurotoxicity in cell culture and intracerebral hemorrhage in mice[J]. J Neurosci,2006,26(40):10281-10291.
[5] Skjolding A D, Rowland I J, Søgaard L V,etal. Hydrocephalus induces dynamic spatiotemporal regulation of aquaporin-4 in human and rat hydrocephalic brain[J].Neuropathology, 2013, 39(2):179.
[6] 胡长林, 吕涌涛, 李志超.颅内血肿微创穿刺清除技术规范[M].北京:人民卫生出版社,2014: 105-107.
[7] 靳 娜,张国华.脑出血后脑水肿的形成机制及治疗进展[J].医学综述,2017,23(12):2380-2384.
[8] 董 静,刘 群.人脑出血灶周缺氧诱导因子1α和基质金属蛋白酶9表达与脑水肿的相关性研究[J].中华老年心血管病杂志,2016,18(6):581-585.
[9] Florczak R M,Grond G C,Montaner J,etal. Matrix metalloproteinases in human spontaneous intracerebral hemorrhage:an update[J]. Cerebrovasc Dis,2012,34(4):249-262.
[10] Rosell A,Ortega A,Alvarez J,etal. Increased brain expression of matrix metalloproteinase-9 after ischemic and hemorrhagic human stroke[J]. Stroke,2006,37(6):1399-1406.
[11] Cui J J,Wang D,Gao F,etal.Effects of atorvastatin on pathological changes in brain tissue and plasma MMP-9 in rats with intracerebral hemorrhage[J]. Cell Biochem Biophys,2012,62(1):87-90.
[12] 高 兰.丁苯酞对脑缺血再灌注损伤大鼠MMP-9活性和血脑屏障通透性的影响[D].郑州:郑州大学,2012.
[13] Yang J,Lin S,Zhou J,etal.Genetic variations of MMP-9 gene and intracerebral hemorrhage outcome: a cohort study in Chinese Han population[J]. J Neurol Sci,2014, 343 (1):56-59.

