软骨发育不全1例临床特点及其基因突变分析
张亚妹,万乃君,孙慧慧
软骨发育不全(achondroplasia,ACH)是一种先天性软骨发育异常性疾病,属于常染色体显性遗传疾病,80%为散发病例。其主要临床表现为短肢型侏儒症,表现为不成比例的身材短小、巨颅、前额突出、面中部发育不良、“三叉手”、关节过伸、腰椎过度前突等,智力一般都正常[1],寿命接近正常人。此病于1878年首次报道[2],发病率1/10000-30000活产婴儿[3],全世界大约有25万人罹患此病,男女比例无差别。一般最终的成年身高男性为(131±5.6)cm,女性为(124±5.9)cm[4, 5]。成纤维细胞生长因子受体3(fibroblast growth factor receptor 3, FGFR3)基因是ACH的重要致病基因,外显率100%,绝大多数为杂合突变,1138位核苷酸点突变是为最常见的突变,约90%为1138G>A,余不到10%G>C[6-8],此外1123G>T(G375C)突变也报道过[9]。我院收治一例ACH患者的临床资料,对患儿进行遗传性骨病的Ⅱ代测序,确定本患儿是否存在FGFR3基因突变,结合患儿临床特点及基因突变表型。
1 病例报告
1.1 一般情况 患儿,男,1岁6个月,因“生长迟缓1年6月”于2017在北京积水潭医院儿科门诊就诊,对患儿及父母建立临床资料信息登记表、签署知情同意书,并收集患儿及其父母外周血DNA。患儿男,G1P1,孕41周,因头盆不称剖宫产出生,出生体重3900 g,出生身长50 cm,入院查体:身长71.7 cm(p<3 th),体重10.3 kg(p10-25 th),头围52 cm(p>97 th),上部量占身长的60%,下部量占身长的40%,自小身高较同龄人矮,头大,四肢短粗,鼻梁塌陷,睡眠打鼾伴呼吸困难,“三叉手”,腰椎过度前突,臀部后翘,下肢弯曲畸形,智力正常。患儿父母为非近亲结婚,体型外貌无异常,家族中无特殊疾病。
1.2 辅助检查
1.2.1 X线检查 左手左腕正位骨龄大致相当于1.5岁左右,双手尺桡骨干骺端增宽(图1)。胸腰段部分腰椎改变,胸腰椎椎体不规则变扁,腰骶角增大,代谢性骨病(图2)。
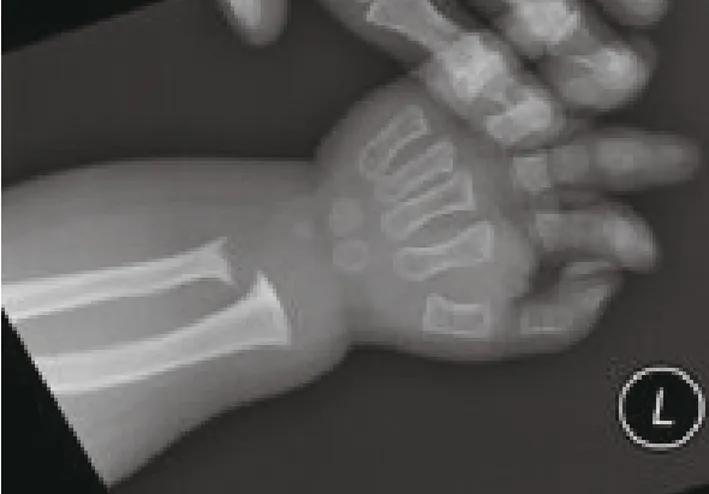
图1 左手左腕正位骨龄片
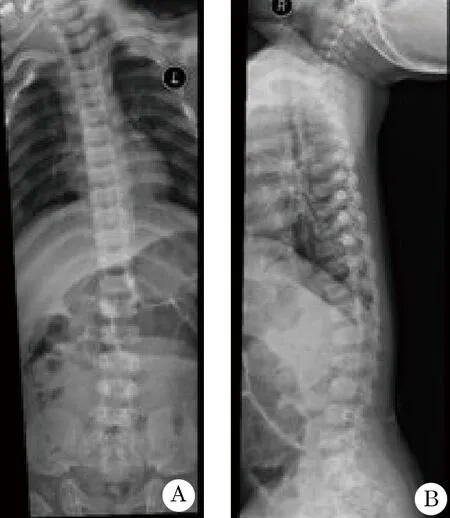
图2 脊柱
1.2.2 血液样本采集和DNA提取 收集患者及其父母的外周血。
1.2.3 二代测序 从受检者外周血中提取基因DNA,构建基因组文库,然后通过探针杂交捕获与遗传性骨病相关基因的外显子及相邻内含子区域(50 bp),并进行富集,富集的目的基因片段通过下代高通量测序仪(Illumina)进行测序。
测序数据运用Next Gene V2.3.4软件与UCSC数据库提供的人类基因组 hg19 参考序列进行比对,并对目标区域的覆盖度和测序质量进行评估。依据严格的筛选标准对变异进行过滤,并添加HGMD数据库、蛋白功能预测软件的相关注释信息,对明确或可能与受检者临床表型相关的基因变异,采用Sanger测序进行验证,上述检测均由北京信诺佰世医学检验所完成。
1.3 结果 对患者及其父母进行基因分析,检测受检者与遗传性骨病相关的473个基因,对测序数据进行深入分析,确定了可能的突变基因,并对受检者及其父母进行一代测序验证。突变位点及其临床意义的详细信息如下:
1.3.1 遗传学意义 本研究在患儿FGFR3基因发现c.1138G>A/(p.G380R)杂合突变,为HGMD报道的已知致病性突变。未发现受检者父母携带上述突变,因此推测该突变为新生突变,但不排除父母存在生殖细胞嵌合体的可能,具体见测序图(图3)。
1.3.2 测序图 一代验证结果 FGFR3基因c.1138G>A(p.G380R)杂合突变,未在受检者父母外周血中检测到。
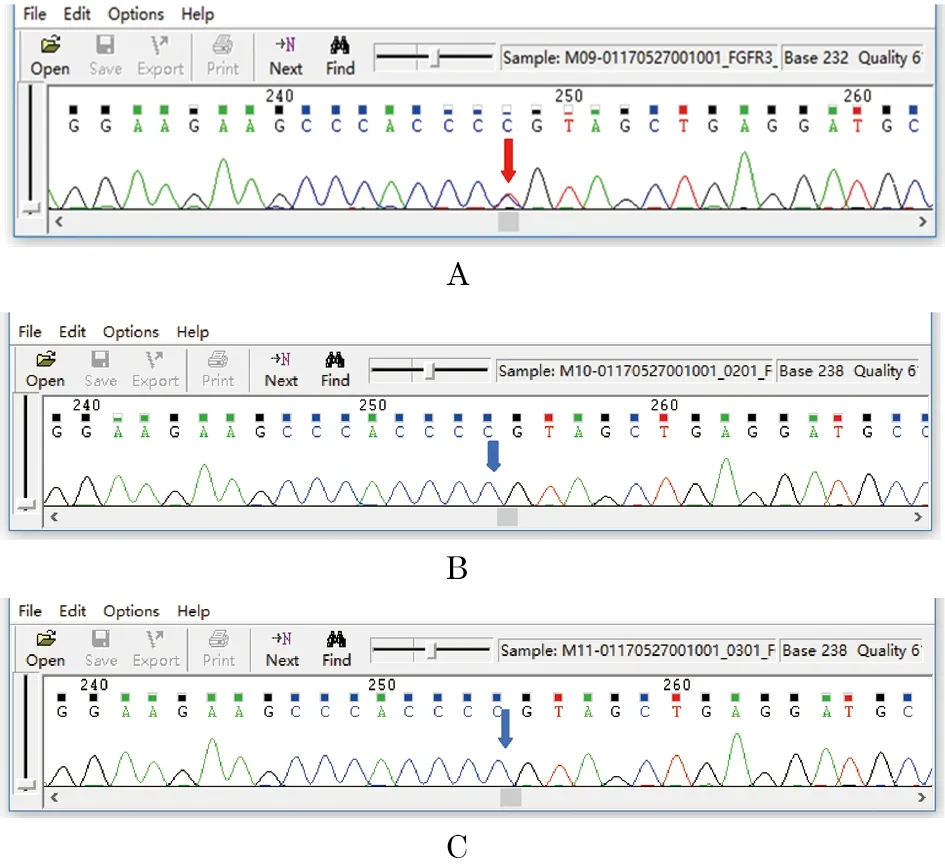
图3 反向测序结果
2 讨 论
ACH是一种常见的软骨发育异常,其发生率在软骨发育异常中最高,且发现较早。ACH的患儿表现为四肢短小,躯干相对细长,伴有巨颅,前额突出,面中部发育不良,“三叉手”,关节过伸,腰椎过度前突等异常。患儿的肢体远端受累会轻于近端,表现为胫腓骨及尺饶受累较股骨及肱骨轻。随着患儿年龄的增长,这种差异会更加显著,形成特殊的畸形,称为侏儒畸形。对ACH患者的研究,发现所有患者均为成纤维细胞生长因子受体3(fibroblast growth factor receptor 3, FGFR3)基因编码的基因FGFR3突变所致。FGFR3属于成纤维细胞生长因子受体家族成员之一,是一种具有调节生长发育等功能的跨膜蛋白。FGFR3基因位于4p16.3上,此基因长度约为16.5 kb,有19个外显子和18个内含子,其中第10外显子编码FGFR3跨膜区[10],含有806个氨基酸残基,由胞外区,疏水跨膜区,胞内酪氨酸激酶活性区3部分组成。FGFR3为无活性单体,与成纤维细胞生长因子(fibroblast growth factor,FGF)2、4、9结合后,聚合为二聚体,激活胞内区酪氨酸激酶活性,使其酪氨酸残基磷酸化,启动下游信号传导通路。现研究FGFR3主要是通过激活信号传导和转录激活因子1(signal transducer and activator of transcription, STAT)和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路发挥作用,STAT1通路抑制软骨细胞增殖,MAPK通路抑制软骨细胞向肥大细胞分化[11],其通过抑制软骨细胞增生分化,抑制软骨细胞外基质合成及促进其降解而发挥骨骼生长调节作用[12]。但生理情况下FGFR3活化后会被迅速泛素化,随后被蛋白酶体降解,信号传导随即终止,从而调节软骨的成骨。但ACH患儿,由于FGFR3基因1138位核苷酸点突变G>A,该突变导致了甘氨酸置换成精氨酸,使跨膜区结构改变,影响蛋白功能,这种改变会增强酪氨酸活性,干扰泛素化反应,延缓蛋白酶体的降解,延长传导时间,从而增强了FGFR3对软骨细胞增殖和分化的负性调节作用,干扰了软骨内成骨[13],而软骨内成骨是长骨线性生长的主要方式[14]。不仅FGFR3基因1138G>A突变会改变跨膜区的结构,1138G>C突变、1123G>T突变均会改变跨膜结构,干扰软骨成骨。本研究我们报道的1例ACH患者,临床表现为身高较同龄人矮,头大,四肢短粗,鼻梁塌陷,睡眠打鼾伴呼吸困难,“三叉手”、腰椎过度前突,臀部后翘,下肢弯曲畸形。外观表现典型,进一步对其骨骼系统的致病基因捕获,患儿携带ACH的常见基因FGFR3突变,基因1138位核苷酸点突变G>A,为ACH最常见突变类型。ACH虽为常染色体显性遗传,外显率100%,但实际却多为散发病例报道。我们报道的病例,其父母表型均正常。Fryns等[15]认为,此种现象可能由新生突变或生殖细胞嵌合突变所致(嵌合突变即一方的生殖细胞存在正常和突变两种细胞)。另一方面散发原因与罹患者因自身疾病终身未婚或婚后未生育,导致致病基因没有了下一代延续有关。因此建议有家族史或生育过ACH患儿的父母如再次生育仍需进行产前监测并完善基因学检测。目前有报道ACH致病基因其实多来自父亲,与父亲年龄呈相关性。因为男性精子形成后持续终身,随着男性年龄的增长,在反复增殖与分化的过程中,携带突变的精原细胞及精子的比例逐渐升高,因此ACH的发生会随着父亲年龄风险成倍增长[16]。此例患儿母亲28岁,父亲32岁,父亲年龄较大,结合我国目前国情,我国刚刚进入二胎全面放开时期,高龄父母将成倍增多,ACH的发病率可能会上升。
ACH的患者智力水平、寿命、性发育和常人基本相同,但他们生活质量却很低。除了短身材带来的身心问题之外,多系统骨骼的异常导致的相关并发症才是影响生活质量的主要原因。例如头颈颌面骨骼发育畸形,造成了解剖学上气道的狭窄,狭窄的气道可导致反复地呼吸道及中耳的感染,反复的中耳炎又会引起听力的下降,甚至耳聋的发生[17],一部分病例甚至发生听力受损后的继发言语延迟。脑积水也是ACH的常见并发症,它是由于颅颈交接区狭窄导致脑室扩大,脑脊液过度分流所致,临床常表现头围增大。脊柱方面的畸形也较多,包括齿突发育不良、枕骨大孔狭窄、椎弓根短小、椎体扁平、椎管狭窄、胸腰段后凸、脊柱侧突等[18],并且脊柱畸形随生长而进展,这样脊髓腔压力可逐渐增高导致神经系统受压病变,临床上就会逐渐出现肢体的麻木疼痛、感觉异常、进行性肌肉张力减退,行走障碍和大小便失禁。婴儿猝死是最严重的并发症。ACH婴儿猝死发生率比普通孩子增加6倍[19],1岁之内婴儿被报道的病例可达到7.5%[20]。它的发生是由于患儿脑干脊髓受压、颌面发育异常、扁桃体肥大及腺样体肥大协同作用。四肢的成角畸形在整个生长发育期会一直存在,因此对于ACH患儿我们需要更关注他并发症的预防和治疗,改善其生活质量。本例患儿头大,鼻梁塌陷,夜间打鼾伴呼吸困难,提示患儿可能存在脑积水及呼吸道梗阻问题,在我们进一步的随访中需要定期监测呼吸功能,及时干预尽量减少并发症对其生活影响。
目前关于ACH尚无有效治疗手段,仍是控制症状和减轻并发症的后果,2014年曾评估了他汀类药物对骨骼生长的作用,其可能通过对软骨细胞的合成代谢作用来刺激骨生长[21-23],但具体机制尚不清楚,可能与他汀类药物会加速FGFR3的降解有关[24, 25]。目前虽有大量关于他汀类药物在人体内使用的数据,但人们对于儿童的用药安全仍不确定,需要进一步临床研究证实。另一方法用于晕动病的非处方抗组胺药物美克洛嗪在动物实验也取得一定效果,治疗的小鼠骨生长有所改善[26],但机制也尚不明确。利钠肽类似物C型钠尿肽类似物(C type-natriuretic peptide, CNP)、FGFR3诱变因子(sFGFR3),一种12氨基酸多肽(P3)及小分子针对酪氨酸激酶等药物也在研究阶段。这些方法均为以后的治疗提出了新的希望,也是目前研究的热点,这些治疗可能可以预防ACH各种并发症的发生。目前通过产前诊断阻止重症患儿出生是首选的预防措施。对于正常的孕妇来说,超声仍是诊断的主要方法,孕晚期超声通过判断股骨、肱骨长度,临床把长度<2SD,或低于相应孕周参考值的第5百分位[27],同时可伴有双顶径与孕周不相符,三叉手,面中塌陷及羊水量增多等异常辅助诊断[28]作为筛检对象;但其局限性是一般确诊都在孕晚期或出生后。因此建议一方或双方ACH患者或曾生育过ACH患儿的家庭,在孕早、中期通过侵入性产前检查FGFR3基因进行早期诊断,FGFR3基因热点的检测仍是目前对胎儿早期确诊的最直接最有效的检测。
综上所述ACH是一种常染色体显性遗传病,是由于FGFR3基因突变所致,绝大多数突变是1138G>A突变,少数是1138G>C突变。它临床导致多系统骨骼异常并伴有多种并发症,目前对于ACH尚无有效治疗方法,因此产前筛查对于预防此病和早期诊断至关重要,建议对高危人群需及时进行FGFR3基因热点检测。
[1] Baujat G, Legeai-Mallet L, Finidori G,etal.Achondroplasia [J].Best Pract Res Cl Rh, 2008,22: 3-18.
[2] Parrot J M.Sur les malformations achondroplasiques et le dieu Ptah[J].Bull Anthropol Paris, 1878,1:196.
[3] Waller D K, Correa A, Vo T M,etal.The population-based prevalence of achondroplasia and thanatophoric dysplasia in selected regions of the US[J].Am J Med Genet A,2008,146A:2385-2389.
[4] Horton W A, Rotter J I, Rimoin D L,etal.Standard growth curves for achondroplasia[J].J Pediatr,1978,93:435-438.
[5] Richette P, Bardin T, Stheneur C.Achondroplasia: from genotype to phenotype[J].Joint Bone Spine,2008,75:125-130.
[6] Wilkin D J, Szabo J K, Cameron R,etal.Mutations in fibroblast growth-factor receptor 3 in sporadic cases of achondroplasia occur exclusively on the paternally derived chromosome[J].Am J Hum Genet,1998,63:711-716.
[7] Bellus G A, Hefferon T W, Ortiz de Luna R I,etal.Achondroplasia is defined by recurrent G380R mutations of FGFR3[J].Am J Hum Genet,1995;56:368-373.
[8] Xue Y, Sun A, Mekikian P B,etal.FGFR3 mutation frequency in 324 cases from the international skeletal dysplasia registry[J].Mol Genet Genomic Med,2014,2:497-503.
[9] Superti-Furga A ,Steinmann B, Gitzelmann R ,etal.Aglycine 375-to-cysteine substitution in the transmembrane domain of the fibroblast growth factor receptor-3 in a newborn with achondroplasia [J].Eur J Pediatr, 1995,154(3):215-219.
[10] 罗春玉,张菁菁,马定远,等软骨发育不全的产前诊断[J].现代妇产科进展,2014;23(1):41-43.
[11] Ornitz DM, Itoh N.The Fibroblast Growth Factor signaling pathway [J].Wiley Interdiscip Rev Dev Biol, 2015;4(3):215-266.
[12] Foldynova-Trantirkova S, Wilcox WR, Krejci P.Sixteen years and counting: the current understanding of fibroblast growth factor receptor 3 (FGFR3) signaling in skeletal dysplasias [J].Hum Muat, 2012;33:29-41.
[13] You M, Li E, Hristova K.The achondroplasia mutation does not alter the dimerization energetics of the fibroblast growth factor receptor 3 transmembrance domain [J].Biochemistry, 2006; 45(17):5552-5556.
[14] Ornitz D M, Marie P J.Fibroblast growth factor signaling in skeletal development and disease [J].Genes Dev, 2015,29(14):1463-1486.
[15] Fryns J P, Kleczkowska A, Verresen H,etal.Germinal mosaicism in achondroplasia: a family with 3 affected siblings of normal parents [J].Clin Genet, 1983,24: 156-158.
[16] Waller D K, Correa A, Vo T M,etal.The population-based prevavalence of achondroplasia and thanatophoric dysplasia in selected regions of the US [J].Am J Med Genet A, 2008, 146A(18):2385-2389.
[17] Hunter A G , Bankier A, Rogers J G,etal.Medical complications of achondroplasia: a multicentre patient review [J].J Med Genet, 1998,35:705-712.
[18] Shirley E D, Ain M C.Achondroplasia: manifestations and treatment [J].J Am Acad Orthop Surg, 2009,17(4):231-241.
[19] Simmons K, Hashmi S S, Scheuerle A,etal.Mortality in babies with achondroplasia: revisited[J].Birth Defects Res AClinMolTeratol,2014,100:247-249.
[20] Hecht J T, Horton W A, Reid C S,etal.Growth of the foramen magnum in achondroplasia[J].Am J Med Gene,1989;32:528-535.
[21] Yudoh K, Karasawa R.Statin prevents chondrocyte aging and degeneration of articular cartilage in osteoarthritis (OA) [J].Aging (Albany NY),2010,2:990-998.
[22] Simopoulou T, Malizos K N, Poultsides L,etal.Protective effect of atorvastatin in cultured osteoarthritic chondrocytes[J].J Orthop Res,2010,28:110-115.
[23] Yamashita A, Morioka M, Kishi H,etal.Statin treatment rescues FGFR3 skeletal dysplasia phenotypes[J].Nature,2014,513:507-511.
[24] Baker J F, Walsh P M, Byrne D P,etal.Pravastatin suppresses matrix metalloproteinase expression and activity in human articular chondrocytes stimulated by interleukin-1beta[J].J OrthopTraumato,2012,13:119-123.
[25] Bush J R, Berube N G, Beier F.A new prescription for growth? Statins, cholesterol and cartilage homeostasis[J].OsteoarthrCartil,2015,23:503-506.
[26] Matsushita M, Hasegawa S, Kitoh H,etal.Meclozine promotes longitudinal skeletal growth in transgenic mice with achondroplasia carrying a gain-of-function mutation in the FGFR3 gene[J].Endocrinology,2015,156:548-554.
[27] 朱毓纯,孙 瑜,杨慧霞.胎儿股骨短的临床意义和处理[J].中华围产医学杂志,2015,18(4):313-314.
[28] Chitty L S, Griffin D R, Meaney C,etal.New aids for the non-invasive prenatal diagnosis of achondroplasia: dysmorphic features, charts of fetal size and molecular confirmation using cell-free fetal DNA in maternal plasma [J].Ultrasound Obstet Gynecol, 2011,37(3):283-289.

