丛枝菌根真菌对不同品种万寿菊幼苗生理特性的影响
赵永平,杨 萍,朱 亚,李念鲁,秦晓洁,郑世伟,杨 攀
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
丛枝菌根真菌(Arbuscularmycorrhizalfungi,AMF)是自然界分布最广泛的一类菌根真菌,因其并无严格的宿主专一性,所以它能够与大部分高等植物的根系共生并形成菌根结构[1-2]。有研究表明:它能与79%的单子叶植物形成共生系统,与83%的双子叶植物和所有的裸子植物形成共生系统[3],其庞大的菌丝系统扩大了寄生植物的吸收面积,大大促进了宿主对土壤中矿质成分的吸收,改善了植株营养状况,对植物的生长发育有诸多的益处,被丛枝菌根真菌寄生的植物不但可以提高抗逆性,而且可改善植物对矿物质的吸收[4-5]。近年来,丛枝菌根真菌在农业发展中取得了良好的应用效果,可以大幅度减少化学药剂和肥料对环境的污染,有助于实现人与自然和谐发展,有着良好的发展前景[6]。
万寿菊(TageteserectaL)又名臭芙蓉,为菊科万寿菊属一年生草本植物,原产于南欧地、中海沿岸一带[7],既可用于化妆品加工,又具有较高的药用价值。从万寿菊中提取的叶黄素是一种抗氧化剂,可用于面霜、面膜等化妆品。万寿菊全株皆可入药,花是其最重要的经济器官,其花瓣中富含天然叶黄素、类胡萝卜素、三萜系皂角苷等物质,这些活性物质对各种皮肤病如冻疮、外伤、皮疹、烧伤、皮肤感染等有明显的疗效,万寿菊的根还可行气补血,除此之外,万寿菊还被用作天然的食品着色剂[8-10]。随着万寿菊市场供求关系的变化,其栽培面积逐年增大,但由于连作所引起的土壤退化,导致其产量和品质降低等,成为制约产业发展的重要因素,鉴于此,通过盆栽试验,研究了接种丛枝菌根真菌对万寿菊幼苗生理功能的影响,旨在筛选对万寿菊幼苗生长和抗性增强具有促进作用的菌株,为改良土壤、缓解连作障碍、改善万寿菊生产效益提供理论依据。
1 材料与方法
1.1 试验材料
供试种子为万寿菊杂交种陇菊1号、LX-2-1、CF-1-4。接种菌种为种摩西球囊霉(Glomusmosseae)、根内球囊霉(Glomusintraradices)和地表球囊霉(Glomusversi-forme)。
1.2 试验设计
接种菌种的处理设为未接种对照、接种摩西球囊霉处理、接种根内球囊霉处理、接种地表球囊霉处理和复合菌种处理(将3个菌种按1∶1∶1混合接种),分别以CK、G1、G2、G3、G4表示,每个处理3次重复。将处理后的培养基质均匀装入塑料盆(上口内径×高=22 cm×30 cm),在每盆的培养基质中分层加入扩繁后的菌剂(以层播的方法接种)。G1、G2、G3处理是加入相应的扩繁菌种接种剂100 g,G4处理是加入3个扩繁菌种混合接种剂100 g,CK是加入已灭过菌的菌剂100 g,以保证其一致性。
每个万寿菊品种选取籽粒饱满、无病虫害、完好无损的种子各120粒,用5%的NaClO消毒15 min,然后用去离子水漂洗3~4次后备用。将消毒后的种子置于铺有一层滤纸的培养皿中,放在25 ℃萌发培养箱中,期间保持滤纸湿润,种子露白后将其播种在装有培养基质的塑料盆中,每盆播种10粒,常规管理。成株后每盆留有长势一致并且茁壮的幼苗5株,培养40 d后测定各项生理指标。
1.3 项目测定
超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定[11];过氧化物酶(POD)活性采用愈创木酚法测定[11];过氧化氢酶(CAT)活性采用分光光度法测定[11];丙二醛(MDA)含量采用硫代巴比妥酸法测定[11];相对电导率采用浸泡法测定[11];可溶性蛋白含量采用考马斯亮蓝法测定[11]。
1.4 数据处理
数据处理采用Excel 2007和DPS 7.05软件进行数据处理和统计分析。
2 结果与分析
2.1 丛枝菌根真菌对万寿菊保护酶活性的影响
在植物体中,植物的保护酶系统是由SOD、POD、CAT等各种酶类构成的,当环境中的不利因素影响到植物生长时,植物主要通过自身保护酶活性的变化来抵御这些影响,因此,植物抗逆性的强弱在一定程度上可以用保护酶活性来反映[12]。SOD是植物体内氧自由基的天然清除剂,而POD、CAT作为存在于植物体内的一种高活性酶类物质,对植物体的光合作用、呼吸作用等都有一定的影响,两者协同作用,可以提高植物清除体内活性氧的能力,保护生物膜的稳定性,因此,这三者是反映植物抗逆性的重要指标[13]。
由表1可以看出,不同丛枝菌根真菌接种处理中万寿菊的SOD活性均高于CK,其中品种LX-2-1接种复合菌种处理的SOD活性最高,较对照提高50.69%。不同品种万寿菊各接种丛枝菌根真菌处理间的POD活性差异达到显著水平,品种CF-1-4复合菌种处理的POD活性最高,达到185.65 U/(g·min)。不同品种万寿菊各接种丛枝菌根真菌处理间CAT活性差异也达到显著水平,品种LX-2-1接种根内球囊霉处理的CAT活性最高,达到79.72 U/(g·min),较对照提高了29.33%,且同一丛枝菌根真菌处理,不同品种间的SOD、POD、CAT活性变化也存在显著差异。
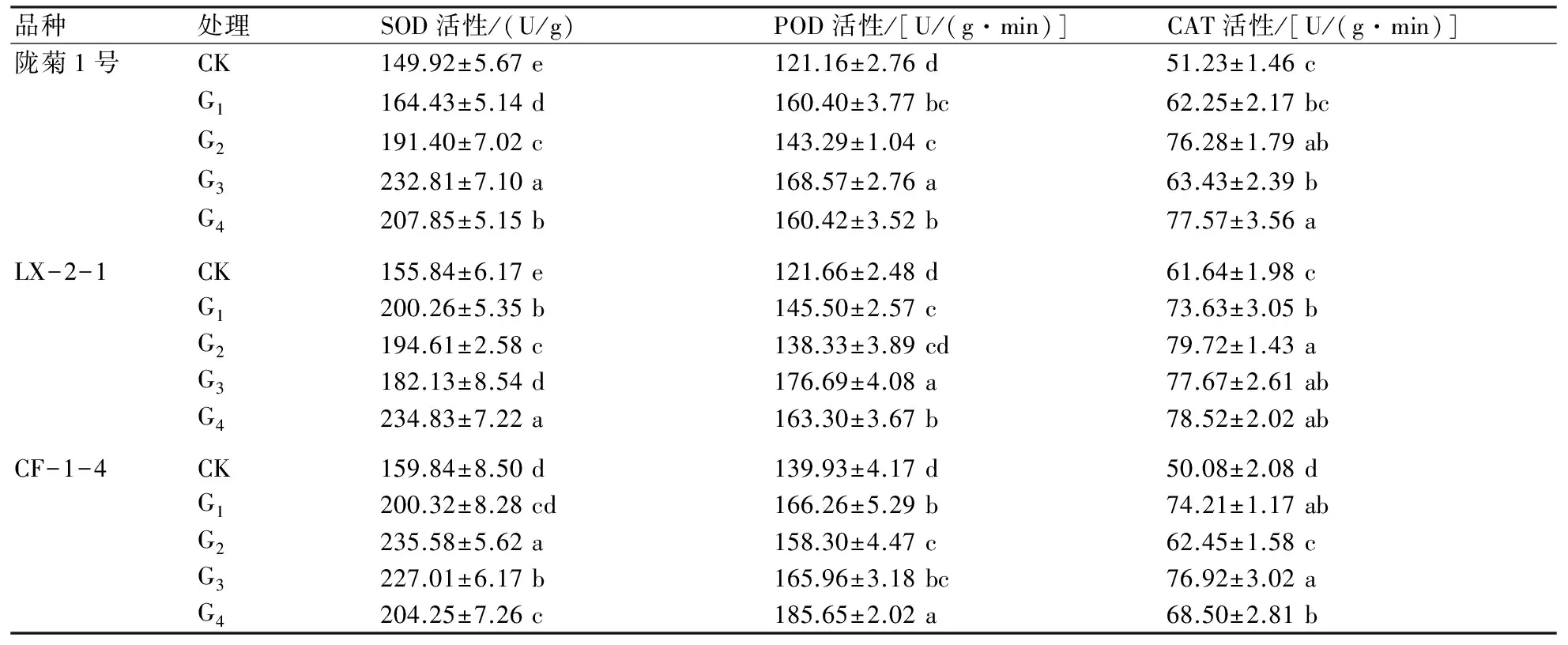
表1 不同丛枝菌根真菌对万寿菊保护酶活性的影响
注:表中数据为平均值±标准差,同列不同小字母代表各处理间在0.05水平上的差异显著性。
2.2 丛枝菌根真菌对万寿菊膜质过氧化程度的影响
植物器官在逆境下遭受伤害时由于体内活性氧和自由基的积累,通常会引发膜质过氧化作用,丙二醛(MDA)是膜脂过氧化的最终分解产物,从膜上产生的位置释放出后,可抑制蛋白质的合成。MDA的积累可能对膜和细胞造成一定的伤害,它在一定程度上也可以反映植物受环境逆境胁迫的情况,在逆境胁迫下植物的抗性与MDA含量呈负相关[14-19]。
由图1可以看出,在不同品种万寿菊中,接种不同的丛枝菌根真菌处理MDA含量均显著低于未接菌种处理,其中陇菊1号各接种丛枝菌根真菌处理间差异不大,而在品种LX-2-1和CF-1-4中,接种摩西球囊霉处理的MDA含量均低于其他接种菌剂处理,分别降低了51.49%和26.07%。

图1 不同丛枝菌根真菌对万寿菊幼苗MDA含量的影响
相对电导率是反映植物膜系统状况的一个重要的生理生化指标,植物在受到逆境或者其他损伤的情况下细胞膜容易破裂,膜蛋白受伤害因而使胞质的胞液外渗而使相对电导率增大,其也是直接反映植物膜质过氧化的一个重要指标。
由图2可知,不同品种间接种丛枝菌根真菌处理相对电导率均与未接菌种处理存在显著差异,各接种丛枝菌根真菌处理间也存在显著差异。其中陇菊1号和LX-2-1品种的接种复合菌种处理相对电导率最低,分别较对照降低48.74%和44.55%,而CF-1-4品种接种摩西球囊霉处理的相对电导率低于其他接种菌剂处理,仅为11.31%。
2.3 丛枝菌根真菌对万寿菊可溶性蛋白含量的影响
可溶性蛋白是植物体内重要的渗透调节物质和营养物质,其对植物体的保水能力也有重要的影响,因此常被作为判断植物代谢能力强弱的主要指标。
从图3可以看出,在不同品种中,各接种丛枝菌根真菌处理间的可溶性蛋白含量存在显著差异,其中LX-2-1品种各接种丛枝菌根真菌处理可溶性蛋白含量均显著高于其他2个品种,且接种根内球囊霉处理和接种地表球囊霉处理可溶性蛋白含量最高,分别达到50.17、50.27 mg/g,分别较对照提高了40.89%、41.17%。
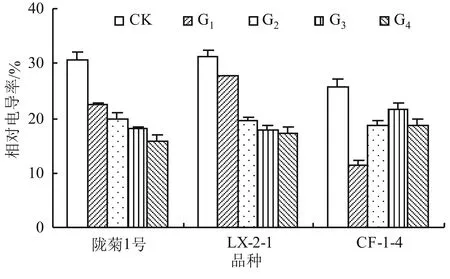
图2 不同丛枝菌根真菌对万寿菊幼苗相对电导率的影响
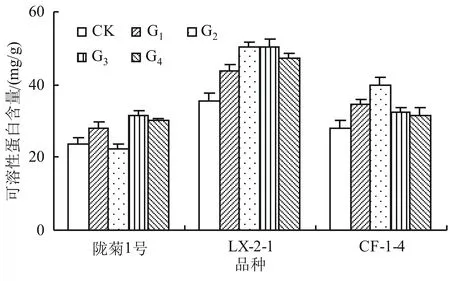
图3 不同丛枝菌根真菌对万寿菊幼苗可溶性蛋白含量的影响
3 讨论与结论
丛植菌根是内生菌根最主要的类型,也是分布最广泛的一类菌根,可以促进宿主植物对土壤养分的吸收,尤其在对磷吸收方面有突出作用[1]。有学者研究表明:逆境胁迫严重影响了植物细胞内的自由基代谢平衡,导致大量活性氧在细胞内积累,引起了细胞膜质的过氧化,破坏了植物细胞结构,接种丛枝菌根真菌可以调节宿主植物体内各组织抗氧化酶活性,激活抗氧化酶清除自由基的能力,SOD、POD和CAT在防御生物体氧化损伤方面起着重要作用,抗氧化酶类之间相互协调,消除细胞内活性氧,从而防止细胞膜质过氧化,提高植物的抗逆性,促进植物生长[12-13]。
本研究通过接种不同的丛枝菌根真菌,研究其对万寿菊幼苗生理特性的影响,结果表明:接种不同丛枝菌根真菌对万寿菊幼苗保护酶SOD、POD、CAT活性变化均有显著的影响,且在同种菌根处理下,不同万寿菊品种间其保护酶活性也存在显著差异,LX-2-1接种复合菌种处理的SOD活性达到234.83 U/g,接种根内球囊霉处理CAT的活性达到79.72 U/(g·min),CF-1-4复合菌种处理POD的活性最高,达到185.65 U/(g·min)。
在逆境条件下,植物内部的结构会发生一定的变化,其细胞质膜因受到胁迫而有一定的损伤,丙二醛(MDA)含量和相对电导率则呈现升高趋势。可溶性蛋白作为植物体内重要的渗透调节物质和营养物质,对植物体抗性的增强也有重要的作用。试验结果表明,接种不同丛枝菌根真菌处理的MDA含量、相对电导率和可溶性蛋白含量均与未接种处理存在显著差异,在各参试品种中,接种不同丛枝菌根真菌处理的MDA含量和相对电导率均低于不接种处理,说明接种丛枝菌根真菌可缓解植物细胞膜脂过氧化程度和质膜受损伤的状况,同时,细胞膜得到保护,膜透性不会发生大的变化,则细胞内电解质外渗现象受到抑制,这与闫妍等在番茄抗冷性的研究中表明接种AMF真菌,可以显著降低番茄幼苗叶片的电解质渗透率,减少MDA积累的结果相一致[19]。接种丛枝菌根真菌处理可溶性蛋白含量均显著高于未接种处理。综上所述,接种丛枝菌根真菌可显著提高万寿菊的SOD、POD、CAT活性和可溶性蛋白含量,降低丙二醛含量和相对电导率,增强植物体的抗逆性,对于改良土壤,提高植物抗性具有重要的指导意义。
[1] 王发园,林先贵.丛枝菌根与土壤修复[M].北京:科学出版社,2016.
[2] 刘静,刘洁,金如海.丛枝菌根真菌剂的生产及应用概述[J].贵州农业科学,2012,40(2):79-83.
[3] 刘先良.接种丛枝菌根真菌对烟草生长及烟草青枯病的影响[D].重庆:西南大学,2014.
[4] 温莉莉,魏玉杰,宋鸽.丛植菌根(AM)真菌扩繁方法的研究进展[J].东北林业大学学报,2009,37(6):92-96.
[5] 刘润进,焦惠,李岩,等.丛枝菌根真菌物种多样性研究进展[J].应用生态学报,2009,20(9):2301-2307.
[6] 王强,王倩,董梅,等.分室培养装置在丛枝菌根真菌研究中的应用及其发展[J].植物生态学报,2014,38(11):1250-1260.
[7] 金敬宏,张卫明,孙晓明,等.金盏花的栽培和经济用途[J].中国野生植物资源,2003,22(4) :40-41.
[8] 邢占芬,成洪达,张平平,等.金盏花HPLC特征指纹图谱研究[J].中药材,2014,37(7):1176-1178.
[9] 赵永平,何庆祥,张肖凌,等.不同基因型金盏花色素含量与生产性能比较研究[J].中国农学通报,2009,25(21):90-92.
[10] 邵友元,杨忠林,陈莹,等.万寿菊中叶黄素的生产技术及应用[J].食品科技,2007(12):155-158.
[11] 张志良,瞿伟菁,李小方,等.植物生理学实验指导[M].第4版.北京:高等教育出版社,2009.
[12] 时振振,李胜,杨柯,等.盐胁迫下豌豆幼苗对内外源NO的生理生化响应[J].草业学报,2014,23(5):193-200.
[13] 秦峰梅,张红香,武祎,等.盐胁迫对黄花苜蓿发芽及幼苗生长的影响[J].草业学报,2010,19(4):71-78.
[14] 荣少英,郭蜀光,张彤.干旱胁迫对甜高粱幼苗渗透调节物质的影响[J].河南农业科学,2011,40(4):56-59.
[15] 刘周莉,何兴元,陈玮.镉胁迫对金银花生理生态特征的影响[J].应用生态学报,2009,20(1):40-44.
[16] 郭智,王涛,奥岩松.镉对龙葵幼苗生长和生理指标的影响[J].农业环境科学学报,2009,28(4):755-760.
[17] 刘艳菊,林以运,曹红星,等.外源ABA对低温胁迫油棕幼苗生理的影响[J].南方农业学报,2016,47(7):1171-1175.
[18] 华智锐,李小玲.盐旱交叉胁迫对小麦种子萌发及幼苗保护酶活性的影响[J].江西农业学报,2017,29(2):18-23.
[19] 闫妍,孙超,于贤昌,等.低温胁迫对接种丛枝菌根真菌番茄幼苗生理特性的影响[J].中国农业大学学报,2011,16(6):64-69.

