敲低CUEDC2基因表达可增强卵巢癌细胞对顺铂的敏感性
李金航,王爱春,周 涛,李 涛,蔡 宏,刘爱军解放军总医院 病理科,北京 00853;军事医学科学院 仪器测试分析中心,北京 00850
卵巢癌是女性生殖系统常见的恶性肿瘤之一,全球每年诊断约23.9万名卵巢癌患者,且每年15.2万名患者死于卵巢癌[1]。大多数卵巢癌患者初次诊断即为晚期,Ⅲ期或Ⅳ期的患者5年生存率分别为28%和16%。化疗结合肿瘤减灭术是治疗卵巢癌的重要方式,顺铂和卡铂是目前卵巢癌一线化疗药物,其通过进入细胞与DNA结合,形成加合物导致链内和链间交联,继而使单链或双链DNA断裂,这种DNA损伤在无法修复的情况下可以导致细胞凋亡。铂类药物还可引起线粒体损伤,降低ATP酶活性导致细胞死亡。虽然卵巢癌被认为是一种化学敏感性肿瘤,80%对早期常规治疗的反应率高,但晚期患者仍会发生肿瘤耐药和复发,导致长期存活率较低[2]。CUEDC2(CUE domaincontaining protein 2)是一种由287个氨基酸残基组成的多功能蛋白质,广泛存在于真核细胞中[3],包含一个由40个氨基酸残基组成的CUE结构域。研究证实CUEDC2与肿瘤细胞增殖相关,可以抑制脑胶质瘤及肺肿瘤的增殖[4-5],但会下调人乳腺癌细胞中孕激素受体(PR)、雌激素受体(ER)的泛素化水平、负调控雌激素和孕激素相关的信号通路[6-8],还能下调p42MAPK、p44MAPK(ERK1/2)的磷酸化水平,即CUEDC2通过抑制MAPK活性抑制孕激素介导的细胞增殖。MAPK信号通路在细胞增殖、分化和存活的调节中发挥主要作用,该通路主要包括p38、ERK1/2和JNK通路[9]。MAPK通路的三级酶促级联反应,即上游激活蛋白经过激酶作用后,引起细胞内级联反应,从而调节细胞周期及对化疗药物的敏感性。研究发现,ERK1/2和JNK可以抑制细胞凋亡[10-11],加快细胞周期进展,上调p38的磷酸化可以逆转卵巢癌细胞系的耐药性[12]。本研究通过检测敲除CUEDC2后SKOV3细胞株对顺铂耐药性的改变以及MAPK通路相关重要蛋白的改变,观察CUEDC2影响顺铂对卵巢癌细胞增殖的抑制作用,从而探讨卵巢癌耐药的作用机制。
材料和方法
1 试剂与仪器 人卵巢浆液性乳头状癌细胞株SKOV3购自ATCC细胞库。鼠抗人CUEDC2抗体受赠于军事医学科学院仪器测试分析中心,鼠抗人Tubulin、兔抗人P-p38 MAPK、兔抗人p38 MAPK、鼠抗人p-ERK、兔抗人ERK抗体购自Cell Signaling Technology(CST)公司。胎牛血清购自宝莱生物有限公司。Opti-MEM、DMEM购于中科迈晨(北京)科技有限公司。MTS检测试剂盒购自Promega公司。iMax试剂盒购自 Invitrogen公司。兔、鼠二抗购自中杉金桥生物技术有限公司。CUEDC2干扰序列由实验室化学合成(5’-CUCAGCGCCAGUUGCCUCAUCUUGG-3’)。顺铂购自齐鲁制药有限公司。
2 细胞培养及siRNA干扰 SKOV3细胞贴壁生长,置于37℃、5% CO2孵箱中培养,常规2 ~ 3 d传代。提前1 h将96孔板中培养基减半至40μl。分别配置相应体积的Opti-MEM与所制备的各干扰序列溶液 (si-CUEDC2 50 nmol/L,si-control 50 nmol/L)混合均匀,按iMax试剂使用说明取4μl,用100μl Opti-MEM稀释,然后将上述100μl干扰序列溶液与该溶液等体积混合,混匀后静置15 min。之后分别加入96孔板中,每孔10μl。37℃、5% CO2孵箱中培养6 h后换液。Western blot鉴定。
3 Western blot检测蛋白表达 取生长状态良好的SKOV3细胞,消化后调整细胞浓度种于24孔板中,3×104/孔,每孔500μl。实验分组:加药组(顺铂 8μmol/L),si-control组 (顺 铂 8μmol/L,sicontrol 50 nmol/L),si-CUEDC2 组 (顺铂 8μmol/L,si-CUEDC2 50 nmol/L),空白组。置于37℃、5%CO2孵箱中培养。72 h后,用M2缓冲液(Tris-HCL、NP-40、NaCl、EDTA、EGTA、PMSF、Cocktail、DTT、β-甘油磷酸、Na3VO4)经裂解液法提取细胞蛋白,加样于上层胶(5% SDS-PAGE)并在1×电泳缓冲液、80V电压下浓缩,在下层胶(10%SDS-PAGE)、120V电压中分离,然后在220 mA电流下经2 h转印到PVDF膜上。5%脱脂牛奶室温封闭1 h,然后一抗(CUEDC2、p-p38 MAPK、p38 MAPK、p-ERK或ERK,1∶1 000)4℃孵育过夜。PBST洗膜3次,每次5 min,HRP连接的二抗(1∶5 000)孵育2 h。分别取出等量ECL试剂A、B液混匀,铺于膜上,室温孵育1 ~ 3 min。在暗室中曝光、显影、定影。每项实验重复3次。
4 MTS检测SKOV3细胞增殖及IC50 取生长状态良好SKOV3细胞,消化后调整细胞浓度于96孔板中,6 000/孔,每孔 100μl。si-control组:转染 si-control(50 nmol/L);si-CUEDC2组:转染si-CUEDC2(50 nmol/L)。将顺铂加入细胞培养基中,终浓度分别为 0μmol/L、8μmol/L、16μmol/L、32μmol/L、64μmol/L,每一浓度分别设3个平行孔,置于37℃、5% CO2孵箱中培养72 h后应用MTS试剂盒检测细胞增殖的变化。实验过程:37℃水浴 10 min溶解 CellTiter 96® AQueous 单溶液试剂。在96孔板中,每孔100μl培养基加20μl CellTiter 96® AQueous单溶液试剂。在37℃,5% CO2的环境下孵育1 h,490 nm读取吸光度值。应用SPSS软件分别计算si-control组及si-CUEDC2组IC50。每项实验重复3次。
5 锥虫蓝染色制作细胞增殖曲线 取生长状态良好SKOV3细胞,消化后细胞种于12孔板中,7×104/孔,每孔1 ml,经加药或干扰处理,置于37℃、5% CO2孵箱中培养,分别于24 h、48 h、72 h消化细胞,在显微镜下计数,用10×物镜观察计数板四角大方格中的细胞数,细胞压中线时,只计左侧和上方,不计右侧和下方。计算细胞密度为(4大格细胞数之和/4)×104×2/原液体积(ml)。
6 统计学处理 采用SPSS19.0统计学软件对数据进行处理,两组间比较采用两独立样本t检验,多组间比较采用方差分析,事后检验采用LSD法及SNK法;Bliss法计算半数致死剂量(IC50)。P<0.05为差异有统计学意义。
结 果
1 Western blot检测敲低SKOV3细胞株中CUEDC2
SKOV3卵巢癌细胞株转染si-control、si-CUEDC2 24 h,72 h后,与si-control组比较,si-CUEDC2组CUEDC2表达水平明显降低(P<0.05),而sicontrol组与未转染组对比,CUEDC2表达水平无明显差异。见图1。

图 2 顺铂对si-control组与si-CUEDC2组 SKOV3细胞增殖的抑制作用(aP<0.05, bP<0.01)Fig. 2 Cisplatin could inhibit the proliferation of SKOV3 cell in sicontrol and si-CUEDC2 group (aP<0.05, bP<0.01)
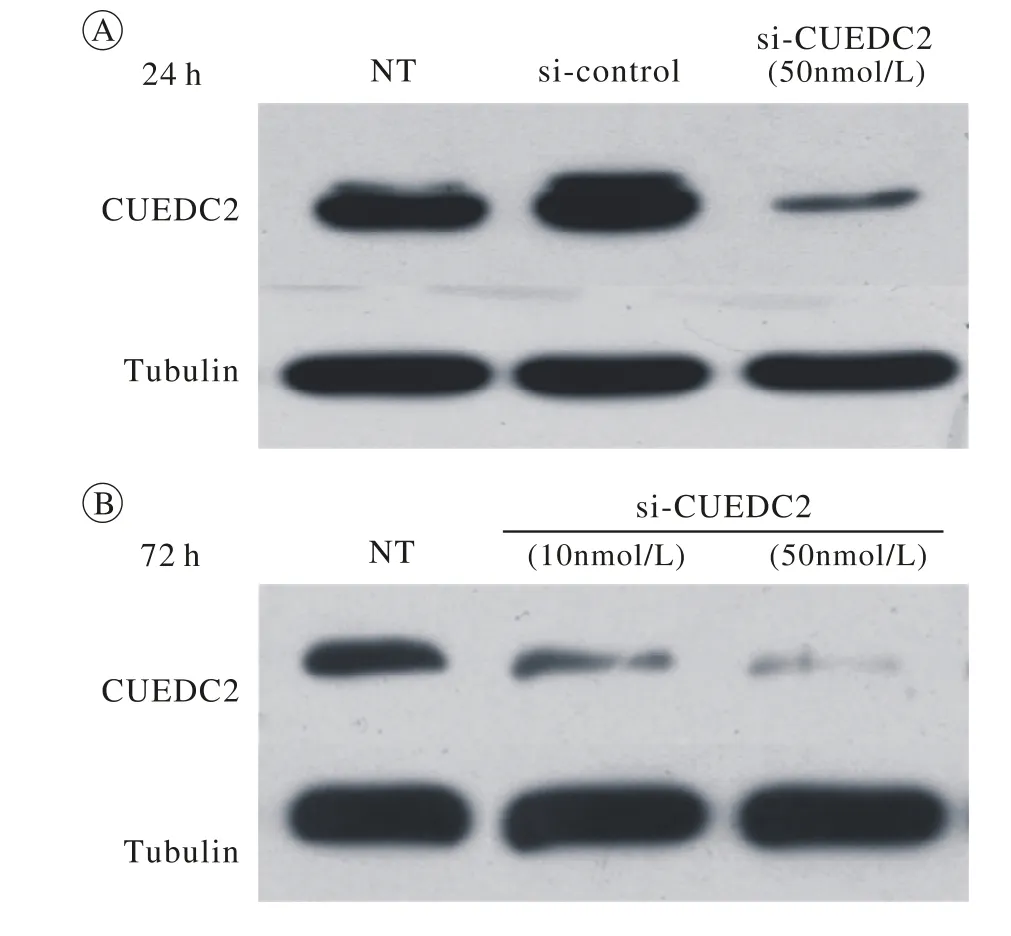
图 1 卵巢癌细胞SKOV3中转染siRNA瞬时敲低CUEDC2水平后24 h CUEDC2蛋白表达情况(A);转染siRNA后72 h CUEDC2蛋白表达情况(B) [NT表示未转染组,si-control表示转染对照siRNA组,si-CUEDC2 (50 nmol/L)表示转染si-CUEDC2 50 nmol/L组]Fig. 1 CUEDC2 was knocked down in SKOV3 cells using siRNA(10 nmol/L or 50 nmol/L) and analyzed by western blot at 24 h(A) and 72 h (B)
2 顺铂显著抑制si-CUEDC2组SKOV3细胞增殖活性 si-control组和si-CUEDC2组中分别加入不同浓度的顺铂,孵育72 h后结果显示,随着药物浓度的增加,顺铂对卵巢癌细胞生长的抑制作用逐渐增强(P<0.05);而与si-control组相比,顺铂对si-CUEDC2组细胞的抑制更显著(P<0.05),见图2。si-CUEDC2及si-control组的IC50分别为3.397μmol/L、10.203μmol/L。
3 SKOV3细胞株经敲低CUEDC2后顺铂作用细胞计数 SKOV3经转染si-control及si-CUEDC2后,加入顺铂8μmol/L分别孵育24 h、48 h、72 h时消化,经锥虫蓝染色发现,随时间延长,经顺铂处理后,24 h及48 h si-control组及si-CUEDC2组细胞数均减少,两组差异无统计学意义(P>0.05);72 h时,si-control组与si-CUEDC2组细胞数有统计学差异(P<0.05)。见图3。
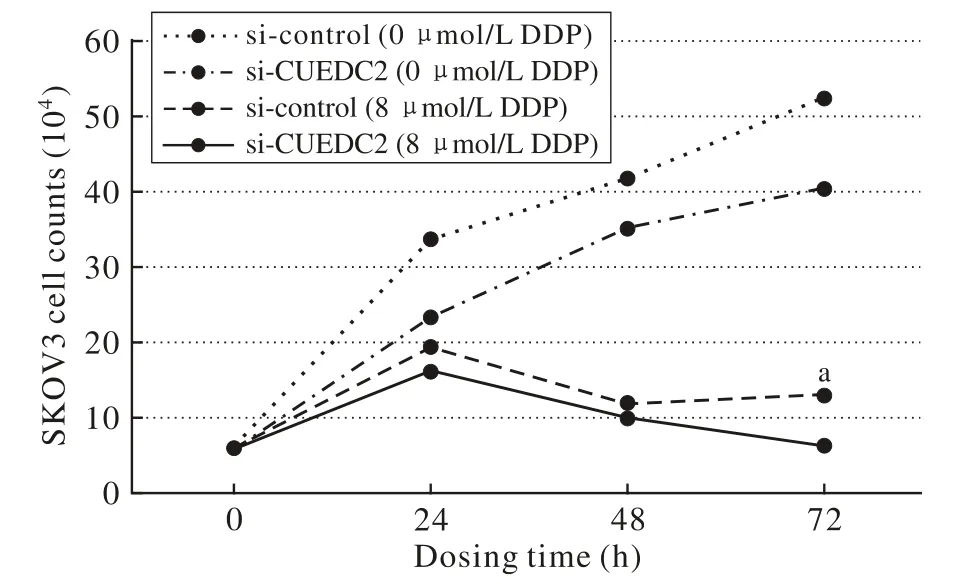
图 3 锥虫蓝染色制作细胞增殖曲线 [aP<0.05, vs si-CUEDC2(8μmol/L DDP)]Fig. 3 Cell proliferation curve by Trypan blue staining [aP<0.05,vs si-CUEDC2 (8μmol/L DDP)]

图 4 卵巢癌细胞SKOV3中磷酸化p38MAPK蛋白水平[DDP(8μmol/L)表示经8μmol/L顺铂处理72 h, —表示只加入顺铂培养72 h, si-control表示转染对照siRNA 50 nmol/L,si-CUEDC2表示转染si-CUEDC2 50 nmol/L, NT表示未加顺铂培养72 h]Fig. 4 Level of Phosphorylatio-p38MAPK in SKOV3 cells Lane—: Cells were treated with 8μmol/L cisplatin (DDP); Lane si-control: Cells were treated with si-control (50 nmol/L) for 6 h, followed by treated with 8μmol/L cisplatin (DDP); Lane si-CUEDC2: Cells were treated with si-CUEDC2 (50 nmol/L)for 6 h, followed by treated with 8μmol/L cisplatin (DDP);Lane NT: Non-treatment
4 敲低CUEDC2对MAPK通路蛋白磷酸化水平的影响 在细胞瞬时干扰并加顺铂8μmol/L培养72 h之后收样,与si-control组相比,si-CUEDC2组卵巢癌细胞p-p38 MAPK有明显升高;而加药组与空白组未见明显差异,见图4。我们同时也检测了MAPK的其他通路,发现敲低CUEDC2后,卵巢癌细胞SKOV3中磷酸化ERK水平降低。见图5。

图 5 卵巢癌细胞SKOV3中磷酸化ERK蛋白水平[DDP(8μmol/L)表示经8μmol/L顺铂处理72 h,—表示只加入顺铂培养72 h,si-control表示转染对照siRNA 50 nmol/L, si-CUEDC2表示转染si-CUEDC2 50 nmol/L, NT表示未加顺铂培养72 h]Fig. 5 Level of Phosphorylatio-ERK MAPK in SKOV3 cells. DDP(8μmol/L):Cells were treated with 8μmol/L cisplatin for 72 h;Lane —: Cells were treated with 8μmol/L cisplatin;Lane si-control: Cells were treated with si-control (50 nmol/L)for 6 h, followed by treated with 8μmol/L cisplatin; Lane si-CUEDC2: Cells were treated with si-CUEDC2 (50 nmol/L)for 6 h, followed by treated with 8μmol/L cisplatin; Lane NT: Nonetreat
讨 论
卵巢癌患者的治疗方式主要是化疗结合肿瘤减灭术,而目前顺铂是一线化疗药物,耐药是导致患者长期生存率较低的主要原因。研究认为卵巢癌顺铂化疗耐药的分子机制主要与以下相关:1)顺铂结合到DNA前分子通路;2)直接涉及DNA-顺铂加合物形成机制;3)顺铂诱导DNA损伤的致死信号通路失活机制;4)影响与顺铂不存在明显联系的分子通路及其他机制[13]。其中MAPK信号通路的激活是导致卵巢癌耐药重要原因,该通路主要包括p38、ERK1/2和JNK通路。
我们在实验中发现CUEDC2可以抑制顺铂对卵巢癌细胞的细胞毒作用,敲低CUEDC2之后卵巢癌细胞对顺铂的敏感性增加。前期有研究发现CUEDC2可以导致乳腺癌细胞中ERK通路异常激活[8,14]。通过对卵巢癌中ERK通路蛋白的表达情况研究,发现经顺铂作用,si-CUEDC2组的p-ERK水平较si-control组明显降低,由此推测ERK通路可能也是CUEDC2引起卵巢癌耐药的分子通路,与之前的研究结果一致[15]。
而MAPK信号通路中的p38MAPK与细胞生长、细胞周期及凋亡也密切相关,焦今文、Zhang等[16-17]的研究发现上调p38的磷酸化可以逆转卵巢癌细胞系的耐药性。本研究发现在卵巢癌细胞经瞬时转染si-CUEDC2、顺铂作用72 h之后,si-CUEDC2组的p38磷酸化水平增高,说明CUEDC2可以降低p-p38的水平,与以往研究结果一致。然而CUEDC2如何与激酶相互作用,并影响信号通路的机制尚不清楚。
CUEDC2经鉴定可以与100多种蛋白质发生作用,其中包括G1期、G2/M期特异结合的蛋白质[18]。但是细胞不经顺铂处理,培养72 h之后,si-CUEDC2组较si-control组细胞数量仅有轻微减少,无统计学差异(P>0.05),因此我们推测CUEDC2可能作用于顺铂药物引起细胞凋亡作用的位点,而不是直接与细胞周期蛋白相互作用,引起耐药。
总之,敲低CUEDC2可以引起卵巢癌细胞系SKOV3细胞对顺铂的敏感性增加,并且si-CUEDC2组p38MAPK的磷酸化水平增加、ERK磷酸化水平降低。因此CUEDC2引起卵巢癌对顺铂的敏感性降低可能是通过抑制p38MAPK通路或者上调ERK通路引起的。我们的研究加深了卵巢癌化疗耐药机制探索,为搜寻靶向治疗药物、逆转肿瘤耐药提供新的思路和希望,而CUEDC2与MAPK通路相关蛋白作用机制有待进一步探讨。
1 Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide : sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386.
2 Yang YI, Kim JH, Lee KT, et al. Costunolide induces apoptosis in platinum-resistant human ovarian cancer cells by generating reactive oxygen species[J]. Gynecol Oncol, 2011, 123(3): 588-596.
3 Man J, Zhang X. CUEDC2 : an emerging key player in inflammation and tumorigenesis[J]. Protein Cell, 2011, 2(9): 699-703.
4 Li F, Tang C, Jin D, et al. CUEDC2 suppresses glioma tumorigenicity by inhibiting the activation of STAT3 and NF-kappaB signaling pathway[J]. Int J Oncol, 2017, 51(1): 115-127.
5 Sun L, Bai L, Lin G, et al. CUEDC2 down-regulation is associated with tumor growth and poor prognosis in lung adenocarcinoma[J].Oncotarget, 2015, 6(24): 20685-20696.
6 Zhang PJ, Zhao J, Li HY, et al. CUE domain containing 2 regulates degradation of progesterone receptor by ubiquitin-proteasome[J].Embo j, 2007, 26(7): 1831-1842.
7 Zhang WN, Wang L, Wang Q, et al. CUEDC2 (CUE domaincontaining 2) and SOCS3 (suppressors of cytokine signaling 3)cooperate to negatively regulate Janus kinase 1/signal transducers and activators of transcription 3 signaling[J]. J Biol Chem, 2012, 287(1): 382-392.
8 Zhang WN, Zhou J, Zhou T, et al. Phosphorylation-triggered CUEDC2 degradation promotes UV-induced G1 arrest through APC/C(Cdh1) regulation[J]. Proc Natl Acad Sci U S A, 2013, 110(27):11017-11022.
9 Lin Y, Xu T, Teng H, et al. Anticancer activity of NOB1-targeted shRNA combination with TRAIL in epithelial ovarian cancer cells[J].Int J Clin Exp Pathol, 2015, 8(9): 10061-10071.
10 Wang W, Zhang Y, Lv M, et al. Anti-IGF-1R monoclonal antibody inhibits the carcinogenicity activity of acquired trastuzumab-resistant SKOV3[J]. J Ovarian Res, 2014, 7 : 103.
11 Zhong ZF, Tan W, Wang SP, et al. Anti-proliferative activity and cell cycle arrest induced by evodiamine on paclitaxel-sensitive and-resistant human ovarian cancer cells[J]. Sci Rep, 2015, 5 :16415.
12 Ayyagari VN, Brard L. Bithionol inhibits ovarian cancer cell growth in vitro - studies on mechanism(s) of action[J]. BMC Cancer,2014, 14 : 61.
13 Galluzzi L, Senovilla L, Vitale I, et al. Molecular mechanisms of cisplatin resistance[J]. Oncogene, 2012, 31(15): 1869-1883.
14 Pan X, Zhou T, Tai YH, et al. Elevated expression of CUEDC2 protein confers endocrine resistance in breast cancer[J]. Nat Med,2011, 17(6): 708-714.
15 Chang MC, Chen CA, Chen PJ, et al. Mesothelin enhances invasion of ovarian cancer by inducing MMP-7 through MAPK/ERK and JNK pathways[J]. Biochem J, 2012, 442(2): 293-302.
16 焦今文. P38MAPK信号通路在卵巢上皮性癌顺铂耐药中的作用机制及逆转策略[D]. 沈阳: 中国医科大学, 2011.
17 Zhang B, Wang X, Cai F, et al. Antitumor properties of salinomycin on cisplatin-resistant human ovarian cancer cells in vitro and in vivo:involvement of p38 MAPK activation[J]. Oncol Rep, 2013, 29(4):1371-1378.
18 常艳. 质谱鉴定在细胞周期中与CUEDC2相互作用的蛋白质[D]. 北京: 中国人民解放军军事医学科学院, 2010.

