冻结速率对鸡汤理化及流变特性的影响
侯佰慧,张维悦,夏杨毅,2*,张艳
1(西南大学 食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆,400715)
汤食在各国饮食文化中不仅代表着营养与饱腹,还带有舒适、宽慰等健康调理色彩[1]。鸡汤富含水溶性风味物质[2],鲜香味美、营养俱佳,还具有改善睡眠、提高情绪和调节生活节律等多种生理功能[3],而丰富的营养物质和高水分含量也为微生物的生长提供了条件。鸡汤常温贮藏极易发生微生物繁殖[4]、脂肪氧化[5]、蛋白变性等,造成营养成分和风味物质的下降,产品腐败变质[6]。产生的变质物质不仅对人体有害,还严重影响鸡汤的品质,对鸡汤工业化生产不利。低温能够降低绝大多数生化反应速度,随着冷链技术的完善,食品冻藏是非常重要的保藏方法[7],而冻结速率对品质特性和保藏性能有较大影响[8-9]。目前国内外学者关于鸡汤冻藏保鲜的研究较少,主要集中在营养成分[10]、工艺研究[11-12]、挥发性风味[13-15]及贮藏等方面。鉴于此,本实验分析了不同冻结速率对鸡汤冻结前后基本理化特性和流变特性的影响,以期为获得高品质鸡汤工业化生产提供试验依据。
1 材料与方法
1.1 材料与试剂
青脚麻鸡,母鸡(12月龄,重量约2.0 kg),由四川省内江金鑫畜禽有限公司提供。MgO、三氯乙酸、硼酸、HCl分析纯,成都市科龙化工试剂厂。
1.2 仪器与设备
DW-86W100 卧式超低温保存箱,BCD-160TB冰箱,青岛海尔股份有限公司;DW-FW110超低温冷冻储存箱,中科美菱低温科技有限公司;YHT309热电偶温度计,台湾泰仕;DDS-608电导率仪, 成都世纪方舟科技有限公司;Avanti J-30I冷冻离心机,美国贝克曼库尔特公司;DHR-1流变仪,美国TA公司;UltraScan PRO测色仪,美国HunterLab公司;722-P可见分光光度计,上海现科仪器有限公司。
1.3 实验方法
1.3.1 样品制备
1.3.1.1 鸡汤熬煮:母鸡宰杀修整,切成3 cm×3 cm×3 cm块状,洗净,沸水预煮3 min,沥干水分,称量,肉、水、盐比为1∶2∶0.015,在电磁炉上于2 000 W煮沸,撇去浮油后转为小火400 W熬煮3 h。冷却至室温,用200目绢布过滤后分装于聚乙烯袋,每袋装量60 g,备用。
1.3.1.2 冻结方法:将上述处理好的鸡汤随机分成4组,4 ℃预冷12 h,至中心温度降至10 ℃,取出放入冰箱冻结,冻结温度分别为-20、-40、-80 ℃,未冻结为对照组。热电偶监测并记录温度达到-18 ℃以下完成冻结,绘制冻结曲线。在4 ℃冰箱解冻10 h后用于指标测定。
1.3.1.3 冻结速率计算:冻结速率V按照国际制冷协会提出的计算方法,计算公式如下:
V=δ0/τ0
(1)
式中:δ0,食品表面与热中心的最短距离,cm;τ0,食品表面达0 ℃至热中心温度达初始冻结点以下10 ℃所需的时间,h。
1.3.2指标测定
1.3.2.1 pH测定
参考GB/T 9695.5—2008《肉与肉制品pH测定》进行,并稍作修改。
1.3.2.2 色差的测定
采用UltraScan PRO测色仪测定鸡汤色差变化。测量模式:TTRN总透射测量模式,测量方法:浊度(Y总),光源:D65/10。测色仪先用标准黑板校正,然后将标准白板紧贴外部镜口,打开内室,将装满纯水的比色皿放入光路中,关闭内室,开始校0,待校正成功,将比色皿中纯水倒掉,换成鸡汤样品进行测定。记录L*(亮度)、a*(红度)、b*(黄度)、Y总(总透过率)
1.3.2.3 电导率测定
取10 mL样品,待样品冷却至室温,将电导率仪採头清洗干净后插入样品中,选取合适的量程,待读数稳定后,读取并记录。
1.3.2.4 硫代巴比妥酸值(thiobarbituric acid reactive substances,TBARS)测定
参考GB 5009.181—2003猪油中丙二醛的测定。
1.3.2.5 可溶性蛋白测定
取鸡汤样0.5 mL于试管中,加入蒸馏水将溶液总体积补充至1 mL,摇匀,每个比色管中加入双缩脲试剂4 mL,充分摇匀,在室温下反应30 min,于540 nm处测定吸光值,根据回归方程,计算样品蛋白浓度。(注:标曲y=0.050 8x+0.004 5,R2=0.999 5,最终单位为mg/mL)。
1.3.2.6 流变特性
采用Discovery DHR-1 TA流变仪,测量平行板夹
具直径为40 mm。参数设置包括:平板夹具间隙为1 050 μm,gap为1 000,转速范围0~1 000 r/s。
1.4 数据统计与分析
采用SPSS 19.0进行方差分析和显著性检验,Origin 8.1进行图像处理与分析。所有试验均做3次重复测定,试验数据采用平均值±标准差形式。
2 结果与讨论
2.1 冻结温度对鸡汤冻结速率和冻结曲线的影响
图1为不同温度下的鸡汤冻结速率曲线。冻结初期和后期温度下降较快,最大冰晶生成带的中期温度下降较为缓慢,符合一般食品的冻结曲线规律。一般认为,食品冻结操作要求快速通过最大冰晶生成带[16],以降低由于冰晶体积较大、分布不均匀而带来的营养物质损失、蛋白变性、脂肪氧化等问题[17]。

图1 不同冻结温度的冻结曲线Fig.1 Freezing curves of different freezing temperature
由表1可知,不同冻结温度下鸡汤冻结点略有差异,冻结点范围在-0.6~-0.9 ℃,与余力[18]研究结果一致。3组冻结温度条件下,鸡汤冻结温度越低,通过最大冰晶生成区的时间越短,冻结速率越快。根据国际制冷学会对速冻(冻结速率大于0.5 cm/h)的划分标准[19],-20 ℃鸡汤冻结组属于慢速冻结,-40、-80 ℃鸡汤冻结组属于快速冻结;而-40、-80 ℃鸡汤冻结组的通过最大冰晶生成区时间和冻结速率均差异显著,是不同冻结速率的2种速冻鸡汤。因此,实验分析时以3组冻结温度来代表冻结鸡汤的3种冻结速率。
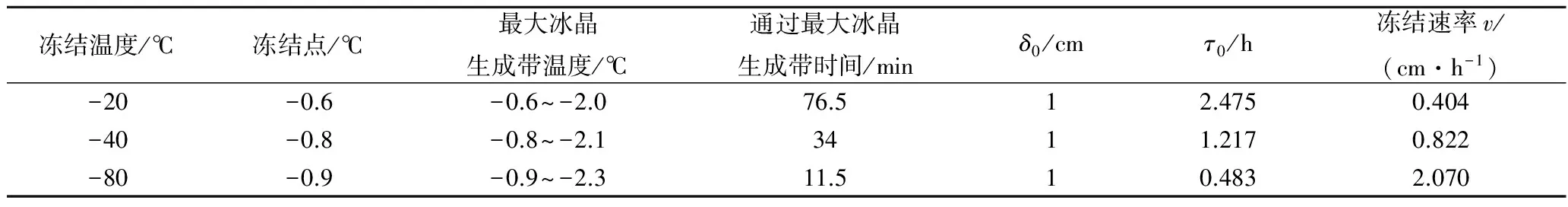
表1 不同冻结温度下的冻结特性Table 1 Freezing features u-er different freezing temperature
2.2 冻结速率对鸡汤理化性能的影响
2.2.1 冻结速率对鸡汤pH的影响

图2 冻结速率对鸡汤pH的影响Fig.2 Effects of different freezing rates on pH of chicken soup注:图中不同小写字母表示差异显著(p<0.05),不同大写字母表示差异极显著(p<0.01)。下图同。
由图2可知,经不同冻结速率处理后的鸡汤,其pH均低于新鲜鸡汤,且随着冻结速率的增大,pH值降低。各冻结组之间无极显著差异(p<0.01),但-40 ℃、-80 ℃冻结与新鲜鸡汤差异显著(p<0.05)。这可能是由于冻结处理抑制了鸡汤内微生物及内源蛋白酶的活性,糖原在缺氧环境下酵解生成乳酸,ATP被消耗分解产生无机磷酸,导致pH值的下降[20]。俞裕明[21]等研究发现经不同冻结速率处理的南方鲇冷冻鱼片,pH值均发生不同程度的降低。刘书来[22]等研究发现鲣鱼经在冷盐水快速和慢速冻结完成后,鱼体的pH值下降,且快速冻结的pH值较低,与本研究的结论一致。
2.2.2 冻结速率对鸡汤色差的影响
鸡汤的色泽与其L*值(亮度值)、Y总值(透过率)、b*(黄度值)、a*(红度值)密切相关,是影响消费者感官及鸡汤品质的一个重要因素。解冻后的鸡汤呈乳白色溶液状,如表2所示a*(红度值)为负值,代表鸡汤红度较弱,同时冻结处理后鸡汤L*值(亮度值)、Y总值(透过率)出现不同程度的提高,与史策结论相似[23]。且冻结速率越大,L*值、Y总值越大。-20 ℃冻结鸡汤与新鲜鸡汤的色泽无显著差异(p>0.05);-40 ℃冻结鸡汤a*、Y总值大于新鲜鸡汤,且差异显著(p<0.05);-80 ℃冻结组鸡汤L*值、a*、Y总值与新鲜鸡汤存在极显著差异(p<0.01),说明较新鲜鸡汤清亮,透过率较高,具体机理有待进一步研究。
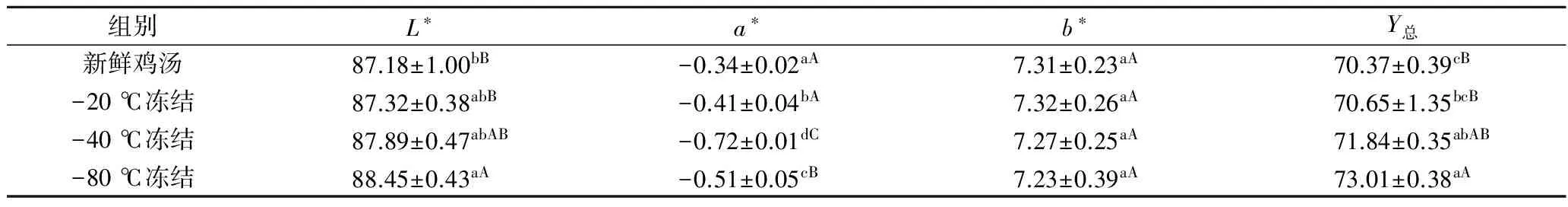
表2 不同冻结速率对鸡汤色泽的影响Table 2 Effects of different freezing temperatures on the color of chicken soup
注:表中同一列不同小写字母表示差异显著(p<0.05),不同大写字母表示差异极显著(p<0.01)。下表同。
2.2.3 冻结速率对鸡汤电导率的影响
电导率可以反应溶液中蛋白、脂肪等大分子物质的降解情况,作为判断新鲜度的指标之一[24]。由图3可以看出,经不同冻结速率处理鸡汤电导率均高于对照组,-20、-40 ℃冻结与新鲜鸡汤差异显著(p<0.05),且-20 ℃和对照组有极显著差异(p<0.01),-80 ℃冻结与新鲜鸡汤差异不显著(p>0.05)。这可能是由于冻结速率较低,形成冰晶颗粒较大,解冻时蛋白结构遭到破坏,组成成分发生分解,引起的电导率差异极显著。

图3 冻结速率对鸡汤电导率的影响Fig.3 Effects of different freezing rates on conductivity of chicken soup
2.2.4 冻结速率对鸡汤TBARS值的影响
由图4可知,鸡汤经不同冻结速率冻结处理后,TBARS值均升高,其中-20 ℃冻结组极显著高于其他组别(p<0.01),-40、-80 ℃的冻结鸡汤与对照组无显著差异(p>0.05)。TBARS是肉及其产品中不饱和脂肪酸的氧化产物丙二醛与硫代巴比妥酸反应后产物的含量,用来衡量食品中脂肪的氧化程度,由于-20 ℃冻结组冻结速率较慢,脂肪氧化加重,所以快速冻结可以降低脂肪氧化程度。牛力[25]在研究不同冻结速率对鸡胸肉品质的影响时也发现,-15 ℃冻结组的TBARS值显著大于-25、-35 ℃下冻结组,与本实验结果相似。
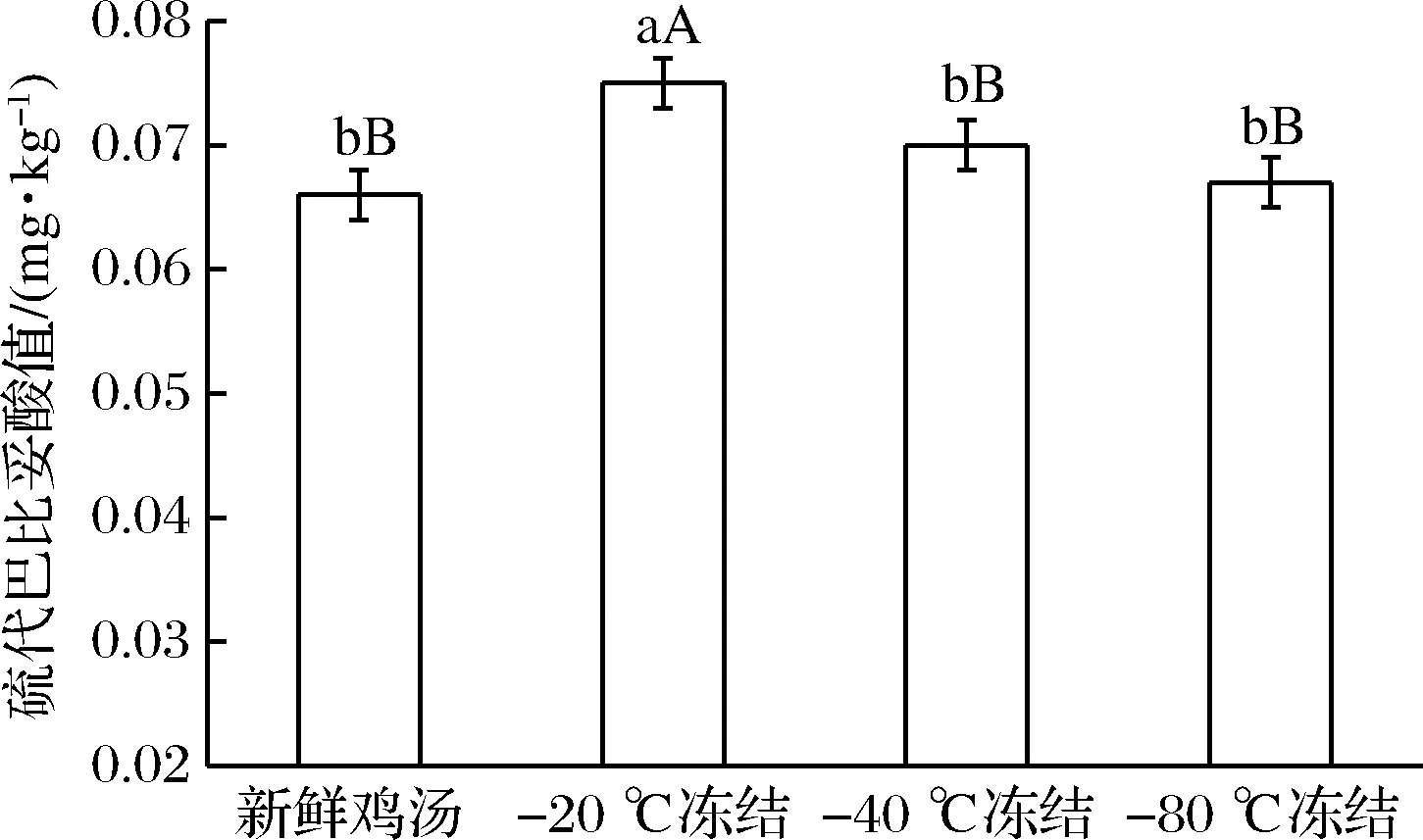
图4 冻结速率对鸡汤硫代巴比妥酸值的影响Fig.4 Effects of different freezing rates on TBARS of chicken soup
2.2.5 冻结速率对鸡汤可溶性蛋白含量的影响
由图5可知,新鲜鸡汤可溶性蛋白含量为8.99 mg/mL,3种冻结速率处理后,鸡汤可溶性蛋白含量均降低,且与新鲜差异显著(p<0.05),3组可溶性蛋白含量分别下降了9.41%、9.18%、3.21%,-80 ℃冻结组下降程度最小,速冻比慢冻更能降低蛋白变性。鸡汤中的可溶性蛋白主要包括水溶性的肌浆蛋白及盐溶性的肌原纤维蛋白[26-27],冻结处理后,蛋白质表面功能基团所结合的水分会被移去,使这些功能基团游离出来而相互作用,从而使蛋白质分子间发生聚集变性[28]。邓敏[29]研究了空气鼓风冻结、酒精溶液浸渍冻结、三元载冷剂浸渍冻结的草鱼块盐溶蛋白含量冻结前后变化,发现冻结速率较快的三元载冷剂浸渍冻结可使草鱼盐溶性蛋白损失最少。由于实验原料、样品处理和实验设计的差异,国内外的研究结果不尽相同[30],后续研究工作将考虑冻结处理对脂肪酸和可溶性蛋白结构特性的影响。

图5 冻结速率对鸡汤可溶性蛋白含量的影响Fig.5 Effect of different freezing rates on soluble protein of chicken soup
2.3 冻结速率对鸡汤流变特性的影响
食品流变学可以利用数学语言对鸡汤加工工艺和过程进行量化来控制鸡汤品质[31],对鸡汤工业化开发具有重要指导作用。从图6可知,在开始剪切速率增加的很小范围内,鸡汤黏度迅速下降,之后随着剪切速率增加,黏度缓慢下降逐渐趋于恒定,整体表现出剪切稀化的假塑性流体特征。与芮闯对花生蛋白流变特性研究结论一致[32]。蛋白分子之间相互作用、脂肪颗粒等其他分子之间相互作用,导致开始时粘度较大。随着剪切速率增加分子间作用力与水合结构遭到破坏,降低了流体阻力,此外触变效应及分子链出现断裂也会引起假塑性现象,黏度呈下降趋势。鸡汤属于多元混合物,流变特性会收到更多因素影响,GOUDOULAS[33]在研究二元混合物的流变特性时指出,混合物的流变动力学与单一物质有明显差异,并构建了可以预测二元混合物弹性性质的动力学模型。鸡汤作为多元混合物,具体流变机理有待进一步研究。在剪切速率相同的条件下,冻结组鸡汤表观黏度均低于对照组,且冻结速率越慢,表观黏度越低,因为冻结速率越快,冰晶体积越小越均匀,疏水基团的暴露越少,即蛋白质分子变性程度小,速冻处理比慢冻处理对鸡汤溶液黏度影响较低。

图6 冻结速率对鸡汤表观黏度的影响Fig.6 Effect of different freezing rates on soluble protein of chicken soup
由图7可知,剪切应力和剪切速率的关系曲线不通过原点,表明鸡汤中有屈服应力的存在,鸡汤的流变曲线属于非宾汉塑性流体。屈服应力的存在意味着鸡汤中大分子物质相互作用和颗粒相互聚集形成了一种弱的三维网状结构,破坏这种结构需要克服屈服应力,相同剪切速率时冻结组的剪切应力均小于对照组,-20 ℃慢速冻结对鸡汤流变影响更显著,而且随着鸡汤冻结速率的增大,物质间的相互作用越强,短时间内破坏网状结构所需克服的屈服应力也就越大,剪切应力逐渐变大。

图7 冻结速率对鸡汤剪切应力的影响Fig.7 Effect of different freezing rates on soluble protein of chicken soup
3 结论
鸡汤在-20、-40、-80 ℃冻结条件下的冻结曲线符合一般食品冻结曲线的特征,冻结速率分别为0.404、0.822、2.070 cm/h,其中-80 ℃冻结鸡汤中心温度下降最快,通过最大冰晶生成带时间最短,不同冻结温度下鸡汤冻结点略有差异。冻结处理会使PH、可溶性蛋白含量、表观粘度逐渐降低,而电导率、TBARS、L*值(亮度值)、Y总值(透过率)会较高于新鲜鸡汤,除了-20 ℃,其他冻结组的TBARS与对照组无显著差异(p>0.05)。慢冻和速冻组的电导率、TBARS有显著差异(p<0.05),可溶性蛋白差异不显著(p>0.05)。速冻组-40 ℃和-80 ℃的鸡汤除了电导率,其他理化指标均无显著差异(p>0.05)随剪切速率增加,鸡汤流变曲线符合剪切稀化的假塑性流体特征,黏度值逐渐减小,剪切应力逐渐变大。当剪切速率相同时,冻结组鸡汤表观黏度和剪切应力均低于对照组,且冻结速率越慢,表观黏度越低,-20 ℃慢速冻结对鸡汤流变影响更显著,速冻处理比慢冻处理对鸡汤溶液黏度影响较小,具体机理有待进一步研究。综合比较,快速冻结更适合鸡汤冷冻处理。
[1] DEMIR M K, KUTLU G, YILMAZ, M T. Steady, dynamic and structural deformation (three interval thixotropy test) char-acteristics of gluten-free Tarhana soup prepared with different concentrations of quinoa flour[J]. Journal of Texture Studies,2017, 48(2): 95-102.
[2] 郑晓杰, 林胜利, 聂小华, 等. 温度对鸡骨酶解液美拉德反应产物光谱特性和挥发性风味成分的影响[J]. 食品与发酵工业, 2015, 41(8): 127-132.
[3] 何蓉蓉, 李怡芳, 李维熙, 等. 鸡汤健康功能的研究现状[J]. 食品与生物技术学报, 2012, 31(1): 17-27.
[4] ATES M B, RODE T M, SKIPNES D, et al. Modeling of Listeria monocytogenes inactivation by combined high-pressure amildtemperature treatments in model soup[J]. European Food Research and Technology, 2016, 242(2): 279-287.
[5] 徐谓, 李洪军, 贺稚非. 甘草提取物对冷藏兔肉糜脂肪酸氧化的影响[J]. 食品与发酵工业, 2017, 43(2): 161-165.
[6] 周涛, 苏燕, 刘玉凌, 等. 反复冻融对鸡汤氨基酸和脂肪酸的影响[J]. 食品工业科技, 2016, 37(1): 53-56+65.
[7] PHINNEY D M, FRELKA J C, ANITA W, et al. Effect of freezing rate and microwave thawing on texture and microstr-uctural properties of potato (solanum tuberosum)[J]. Journal of Food Science, 2017, 82(4): 933-938.
[8] 郝淑贤, 邓建朝, 林婉玲, 等. 冻结速率对凡纳滨对虾虾仁贮藏特性的影响[J]. 现代食品科技, 2013, 29(9): 2 086-2 089,2 299.
[9] 孙圳, 谢小雷, 李侠, 等. 不同冻结温度下牛肉水分的状态变化[J]. 肉类研究, 2016, 30(1): 15-20.
[10] 余力, 贺稚非, 李洪军, 等. 不同贮藏方式对高压鸡汤品质的影响及货架期预测模型的建立[J]. 食品科学, 2016, 37(20): 274-281.
[11] 赵芩, 张立彦, 曾清清, 等. 不同熬煮方法对鸡骨汤风味物质的影响[J]. 食品工业科技, 2015, 36(7): 314-319.
[12] JAYASENA D D, JUNG S, ALAHAKOON A U, et al. Bioactive and taste-related compounds in defatted freeze-dried c-hicken soup made from two different chicken breeds obtained at retail[J]. Journal of Poultry Science, 2015, 52(2): 156-165.
[13] 周涛. 热反应鸡汤呈味物质变化研究[D]. 重庆: 西南大学, 2016.
[14] 张艳, 夏杨毅, 何翠, 等. 基于肉鸡性别的鸡汤挥发性物质主成分分析[J]. 食品与机械, 2016, 32(7): 23-28.
[15] NISHIMURA T, GOTO S, MIURA K, et al. Umami compounds enhance the intensity of retronasal sensation of aromas from model chicken soups[J]. Food Chemistry, 2016, 196: 577-583.
[16] CHENG Li-na, SUN Da-wen, ZHU Zhi-wei, et al. Effects of high pressure freezing (HPF) on denaturation of natural actomyosin extracted from prawn (Metapenaeusensis)[J]. Food Chemistry, 2017, 229: 252-258.
[17] 谢安国. 冷冻冷藏过程中猪肉的光谱特性研究及其品质的快速检测[D]. 广州: 华南理工大学, 2016.
[18] 余力, 贺稚非, 李洪军, 等.不同贮藏方式对高压鸡汤品质的影响及货架期预测模型的建立[J]. 食品科学, 2016, 37(20): 274-281.
[19] 华泽钊, 李云飞, 刘宝林. 食品冷冻冷藏原理与设备[M]. 北京: 机械工业出版社, 1999.
[20] LI Da-peng, ZHANG Long-teng, SONG Si-jia, et al. The role of microorganisms in the degradation of adenosine triphosphate (ATP) in chill-stored common carp (Cyprinuscarpio) fillets[J]. Food Chemistry, 2017, 224: 347-352.
[21] 俞裕明, 李汴生, 朱志伟, 等. 不同冻结速率对南方鲇冷冻鱼片理化和感官品质的影响[J]. 上海水产大学学报, 2008, 17(3):350-356.
[22] 刘书来, 李向阳, 章茜琳, 等. 大洋性围网鲣鱼船上冷盐水快速冻结和慢速冻结的比较[J]. 食品与发酵工业, 2013, 39(12): 73-78.
[23] 史策, 崔建云, 王航, 等. 反复冷冻-解冻对鲢品质的影响[J]. 中国水产科学, 2012, 19(1): 167-173.
[24] 杨秀娟, 张曦, 赵金燕, 等. 应用电导率评价猪肉的新鲜度[J]. 现代食品科技, 2013, 29(5): 1 178-1 180,1 191.
[25] 牛力, 陈景宜, 黄明, 等. 不同冻结速率对鸡胸肉品质的影响[J]. 食品与发酵工业, 2011, 37(10): 204-208.
[26] MOHAMMED S, SHAABAN H, AHMED A. Application of fungal chitosan incorporated with pomegranate peel extract as edible coating for microbiological, chemical and sensorial quality enhancement of Nile tilapia fillets[J].International Journal of Biological Macromolecules, 2017, 99: 499-505.
[27] BEELEN J, R00SN M, GROOTL C P G M. Protein enrichment of familiar foods as an innovative strategy to increase protein intake in institutionalized elderly[J]. Journal of Nutrition Health & Aging, 2017, 21(2): 173-179.
[28] TU Zong-cai, ZHONG Bi-zhen, WANG Hui. Identification of glycated sites in ovalbumin under freeze-drying processing by liquid chromatography high-resolution mass spectrometry[J]. Food Chemistry, 2017, 226: 1-7.
[29] 邓敏, 朱志伟. 不同冻结方式对草鱼块品质特性的影响[J]. 现代食品科技, 2013, 29(1): 55-58,76.
[30] GERARDO R, JESUS E, RAMIREZ W, et al. Management of freezing rate and trehalose concentration to improve frozen dough properties and bread quality[J]. Food Science and Technology, 2017, 37(1): 59-64.
[31] 陈雅韵, 夏杨毅, 李洪军, 等. 酶解鸡汤的流变学特性研究[J]. 食品工业科技, 2014, 35(23): 107-110.
[32] 芮闯, 侯彩云, 苏杨, 等. 不同品种花生蛋白流变特性的研究[J]. 中国粮油学报, 2010, 25(3): 69-72.
[33] GOUDOULAS T B, GERMANN N. Phase transition kinetics and rheology of gelatin-alginate mixtures[J]. Food Hydrocolloids, 2017, 66: 49-60.

