基于PROPELLER的个性化大鼠头部模型构建及其在微波辐射剂量计算中的应用
李春舫,王浩宇,聂彬彬,左真涛,马林,彭瑞云*
1.解放军军事科学院军事医学研究院,北京 100850;2.解放军总医院放射诊断科,北京 100853;3.中国科学院高能物理研究所,中国科学院核分析技术重点实验室,北京 100049;4.中国科学院生物物理研究所,脑与认知科学国家重点实验室,北京100101;*通讯作者 彭瑞云pengry@bmi.ac.cn
脑是微波辐射的敏感靶器官,微波辐射对脑结构和功能均可造成影响[1-6]。探索微波辐射剂量与脑结构和功能损伤之间的关系是研究微波辐射脑部生物效应的基础。大鼠是微波辐射生物效应研究中的重要生物模型。随着现代医学影像技术的不断发展,CT、MRI等已广泛应用于通用大鼠模型的构建中[7-8]。其中,基于 MRI构建的通用大鼠模型可提供良好的软组织对比度,并得到广泛应用[9-11]。然而,基于通用模型的微波辐射剂量计算忽视了受试个体之间的差异,这种个体差异会造成剂量计算的不准确,最终影响量效关系研究的可靠性。基于MRI的个性化大鼠头部模型构建中存在诸多难题,在扫描过程中大鼠的呼吸和心跳等所引起的运动伪影会严重影响MRI成像质量,对模型的构建产生破坏性影响。
周期性旋转重叠平行线增强重建(periodically rotated overlapping parallel lines with enhanced reconstruction,PROPELLER)扫描序列能够有效控制运动引起的伪影[12]。本研究旨在提出一种基于PROPELLER扫描序列获得的T2加权MRI图像构建个性化大鼠头部模型的方法,并验证其应用于计算微波辐射剂量的可行性,为精确的个性化微波辐射剂量计算及微波辐射致脑损伤的评估提供参考。
1 材料与方法
1.1 MRI检查 选取 1只约 450 g雄性 Wistar大鼠,在3.0T MRI扫描仪(GE Discovery 750 MR)上使用四通道小动物专用线圈进行 T2加权像横断位扫描。为尽量避免扫描过程中大鼠呼吸和心跳运动造成伪影对图像质量的影响,本研究选用PROPELLER扫描序列。扫描参数:TR 8083 ms,TE 160 ms,翻转角142°,成像范围为100 mm×100 mm,层内分辨率0.195 mm×0.195 mm,矩阵512×512,层厚1.5 mm,层间距0 mm,层数16,成像时间7 min 33 s。为检验PROPELLER扫描结果对呼吸运动伪影的抑制作用,本研究采用传统T2加权快速自旋回波扫描序列对大鼠头部进行扫描。扫描参数:TR 3500 ms,TE 99.68 ms,成像范围100 mm×100 mm,层内分辨率0.195 mm×0.195 mm,矩阵512×512,层厚1.5 mm,层间距0 mm,层数16,成像时间8 min 4 s。
1.2 个性化大鼠头部结构模型构建方法 参考大鼠断层解剖彩色图谱,根据T2加权PROPELLER图像中各组织之间图像对比度以及相对空间位置关系,使用基于MATLAB编写的程序以及iSEG(Zurich Med Tech AG)对包括脑、皮肤、脂肪、肌肉、骨骼和眼(玻璃体)等在内的各主要组织逐层进行图像分割。最终获得个性化大鼠头部结构模型,该模型整体大小为100 mm×100 mm×24 mm。
1.3 电磁辐射模拟计算方法 ①在个性化大鼠头部结构模型基础上为各组织赋以相应的物理参数,包括相对介电常数ε、电导率σ和组织密度ρ,以构建相应的电磁模型。在L波段(1.5 GHz)、S波段(3 GHz)和X波段(10 GHz)下,大鼠头部各主要组织的物理参数见表1[13]。②分别采用L波段、S波段和X波段平面波,平均功率密度为10 mW/cm2,模拟微波自大鼠头部模型背侧入射,微波的电场(E)方向和磁场(H)方向互相垂直且均垂直于波的传输(k)方向。电场矢量均垂直于大鼠头部模型长轴(E极化),大鼠处于空气中,空间外边界设置为吸收边界。为减小电磁波在网格中传播时发生的畸变,要求网格边长δ满足10δ≤λ,其中λ为入射波波长。对于本研究中的最高频率10 GHz(X波段)微波辐射,其在大鼠头部组织中最短波长λ=3.94 mm(眼玻璃体中),大鼠头部模型网格化边长设为δ=0.2 mm可满足上述要求。计算空间为长方体,空间的网格总数为363×317×241。将个性化大鼠头部电磁模型导入计算空间,运用时域有限差分方法(finite difference time domain,FDTD)模拟微波与模型中各组织的相互作用过程,得到大鼠头部各组织比吸收率(specific absorption rate,SAR)值分布。模拟过程在电磁生物仿真软件Sim4Life(Zurich Med Tech AG)中进行[14]。收敛级别(convergence level,CL)设定为-50 dB。为检验基于个性化大鼠头部模型模拟结果的准确性,在Sim4Life软件提供的通用大鼠模型(Big Male Rat v1.x)基础上同样进行模拟仿真,模拟方式及参数同上[15]。
2 结果
2.1 大鼠头部组织分割及个性化模型构建 使用PROPELLER和传统快速自旋回波 T2加权扫描序列获得的大鼠头部结构像见图1。采用PROPELLER扫描序列可有效地控制大鼠呼吸和心跳引起的运动伪影所致图像模糊,从而为构建个性化的大鼠头部模型提供了保证。使用优化参数后的PROPELLER扫描序列获得的大鼠头部T2加权MRI结构图像见图2A~C。参考大鼠断层解剖彩色图谱,对T2加权MRI图像中脑、眼、皮肤、脂肪、肌肉和骨骼等组织进行分割,见图2D~F。经过参数的优化调整后,T2加权PROPELLER扫描序列能够提供较好的组织对比度,为大鼠脑、眼、皮肤、脂肪、肌肉和骨骼等主要组织的图像分割提供了保证,见图2G。

表1 L波段、S波段和X波段下个性化大鼠头部组织物理参数
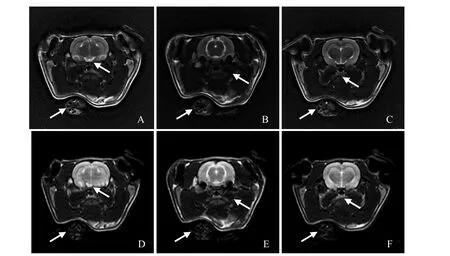
图1 PROPELLER扫描序列与传统快速自旋回波扫描序列获得的T2加权图像比较。A~C分别为PROPELLER扫描序列获得的T2加权像;D~F分别为对应层面用传统快速自旋回波扫描序列获得的T2加权像;箭示呼吸运动伪影

图2 大鼠头部组织分割。A~C分别为PROPELLER扫描序列获得的T2加权像;D~F分别为相应的组织分割后结果;G为个性化大鼠头部模型
2.2 大鼠头部微波辐射SAR值分布 通过FDTD方法进行模拟计算,不同波段(L、S和 X)微波辐射下,大鼠头部SAR值分布情况见图3。当微波辐射从背侧入射时,随着频率的升高(由L到X波段),微波入射深度逐渐变小。L波段时,高SAR值区域位于脑中心部位,见图3A、D;S波段时,高SAR值分布区域向背侧移动,见图3B、E;X波段时,高SAR值区域限于背部表层,见图3C、F。对大鼠脑部的SAR值量化分析结果显示,在不同频率的微波辐射下,全脑平均 SAR值随频率增加而降低,L波段微波辐射从背侧入射时全脑平均SAR值约为S波段微波辐射时的1.44倍,约为X波段微波辐射时的4.77倍。基于个性化大鼠头部模型计算得到的大鼠脑部平均SAR值分布规律与基于Sim4Life软件提供的通用大鼠模型(Big Male Rat v1.x)模拟方针结果所显示的规律一致。见图4。
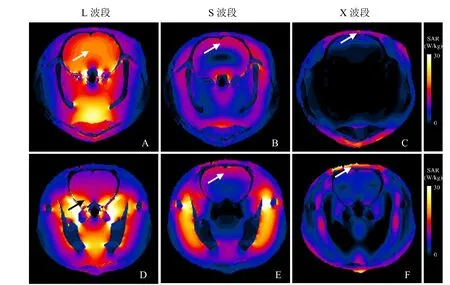
图3 不同波段微波辐射从背侧入射时大鼠头部SAR值分布。色柱示相应伪彩色所表示SAR值,箭示高SAR值区

图4 基于个性化大鼠头部模型与通用大鼠模型计算得到的大鼠脑部平均SAR值分布比较。色柱示相应伪彩色所表示SAR值,箭示高SAR值区
3 讨论
本研究提出了一种基于T2加权PROPELLER扫描序列的个性化大鼠头部模型构建方法,利用该方法构建的模型能够准确显示脑、眼、皮肤、脂肪、肌肉和骨骼等主要组织的形态、分布及相互之间的位置关系。一方面,利用PROPELLER扫描序列对运动伪影的抑制作用,可以获得清晰的大鼠头部 MRI断层图像,为模型的构建提供保证;另一方面,经过扫描参数优化所得到的 T2加权图像能够提供良好的主要组织间对比度,便于组织分割。此外,在个性化大鼠头部模型基础上,本研究还分别模拟了不同波段(L、S和X波段)微波辐射从背侧入射时大鼠头部SAR值分布,并量化分析了全脑的平均SAR值,表明了该个性化模型应用于微波辐射剂量学研究的可行性。由量化分析结果可见,在平均功率密度相同的条件下,随着微波辐射频率增高,全脑平均SAR值降低。当微波辐射频率较低时(如L波段),其入射深度较深,故全脑平均SAR值较高;而当微波辐射频率较高时(如X波段),其入射深度较浅,故全脑平均SAR值较低。这一现象是由高频微波的“趋肤效应”所致。
微波辐射剂量计算是微波辐射生物效应研究的基础。1981年,SAR值正式被美国国家辐射防护委员会采用,成为学术界认可的电磁辐射剂量单位并得到广泛使用。SAR值可以通过实验剂量学和理论剂量学两种方法获得。实验剂量学主要是通过对生物仿真模型中的物理量(如电场强度和温度等)进行实际测量,作为模型中SAR值计算的基础[16-19]。受生物仿真模型复杂度的限制以及实验环境因素的影响,实验剂量学误差较大。理论剂量学方法的优势在于通过建立具有复杂结构的生物体模型更为客观和精确地描述电磁场与生物体之间的相互作用。基于MRI构建的通用大鼠模型能够精确地描述大鼠组织结构,在电磁辐射剂量学研究中得到了广泛应用。Hyun等[9]利用基于MRI构建的通用大鼠模型,研究了不同频率电磁辐射下大鼠脑大小和介电常数对SAR值的影响。Gajsek等[10]研究了实验剂量学和通用大鼠模型理论剂量学计算结果的一致性。苏镇涛等[11]基于 MRI构建的通用大鼠模型,研究了高功率脉冲微波照射时大鼠体内SAR值。
然而在具体的研究中,上述通用大鼠模型均忽视了个体差异带来的影响,会引起SAR值剂量计算的偏差,最终影响微波辐射生物效应研究的可靠性。本研究提出的个性化大鼠头部模型构建方法利用PROPELLER扫描序列的特点,解决了呼吸和运动伪影对大鼠头部 T2加权结构成像及组织分割造成的破坏性影响。与基于通用大鼠模型的剂量计算结果相比,基于该方法构建的个性化大鼠头部模型微波辐射剂量计算在能够准确反映不同波段微波辐射下 SAR值分布规律的基础上,避免了通用模型无法对研究中每只大鼠提供精确剂量分布的问题,为个性化的微波辐射剂量计算、相应的微波辐射脑损伤及有针对性的防治研究提供了条件。
本研究提出的一种基于T2加权PROPELLER扫描序列的个性化大鼠头部模型构建方法可有效抑制呼吸和运动对图像造成的破坏性影响,并可准确计算出不同波段(L、S和X波段)微波辐射下大鼠头部各组织的SAR值分布,从而用于精确的个性化微波辐射剂量计算及微波辐射致脑损伤的评估。本研究提出的基于T2加权PROPELLER扫描序列的模型构建方法尚存在进一步改进的空间。今后可根据研究需求将脑部进一步细分为灰质、白质、脑脊液等部分进行模型构建。此外,本研究中T2加权在3T MRI扫描仪下获得,受信噪比的限制,其空间分辨率有待提高。可使用4.7T或7T等高场小动物MRI扫描仪进行扫描,获得更精确的大鼠头部三维模型,从而进一步提高电磁辐射剂量计算的准确性。
[1]Xiong L, Sun CF, Zhang J, et al. Microwave exposure impairs synaptic plasticity in the rat hippocampus and PC12 cells through over-activation of the NMDA receptor signaling pathway. Biomed Environ Sci, 2015, 28(1): 13-24.
[2]Wang H, Peng R, Zhao L, et al. The relationship between NMDA receptors and microwave-induced learning and memory impairment: a long-term observation on Wistar rats.Int J Radiat Biol, 2015, 91(3): 262-269.
[3]Zhao L, Peng RY, Wang SM, et al. Relationship between cognition function and hippocampus structure after long-term microwave exposure. Biomed Environ Sci, 2012, 25(2): 182-188.
[4]杨瑞, 彭瑞云, 高亚兵, 等. 高功率微波辐射对大鼠海马的损伤效应. 中华劳动卫生职业病杂志, 2004, 22(3): 211-214.
[5]Lai H, Horita A, Guy AW. Microwave irradiation affects radial arm maze performance in the rat. Bioelectromagnetics,1994, 15(2): 95-104.
[6]Wang BM, Lai H. Acute exposure to pulsed 2450-MHz microwaves affects water-maze performance of rats.Bioelectromagnetics, 2000, 21(1): 52-56.
[7]Mason PA, Walters TJ, Fanton JW, et al. Database created from magnetic-resonance images of a Sprague-Dawley rat,rhesus-monkey, and pygmy goat. FASEB J, 1995, 9(5): 434-440.
[8]Chou CK, Chan KW, McDougall JA, et al. Development of a rat head exposure system for simulating human exposure to RF fields from handheld wireless telephones.Bioelectromagnetics, 1999, (Suppl 4):75-92.
[9]Hyun JC, Oh Y. Effects of size and permittivity of rat brain on SAR values at 900 MHz and 1,800 MHz. J Electromagn Eng Sci, 2006, 6(1): 47-52.
[10]Gajsek P, Walters TJ, Hurt WD, et al. Empirical validation of SAR values predicted by FDTD modeling.Bioelectromagnetics, 2002, 23(1): 37-48.
[11]苏镇涛, 杨国山. 高功率脉冲微波照射时大鼠体内 SAR值计算. 中华放射医学与防护杂志, 2004, 24(6): 561-563.
[12]Pipe JG. Motion correction with PROPELLER MRI:application to head motion and free-breathing cardiac imaging. Magn Reson Med, 1999, 42(5): 963-969.
[13]刘谦, 龚辉. 大鼠断层解剖彩色图谱. 武汉: 华中科技大学出版社, 2010: 2-158.
[14]Hasgall PA, Di Gennaro F, Baumgartner C. IT'IS database for thermal and electromagnetic parameters of biological tissues,2015. https://www.itis.ethz.ch/virtual-population/tissueproperties/overview/.
[15]Maiques MM. Sim4Life: a simulation platform for life sciences and medtech applications. European Cells &Materials, 2014, 27(S2): 6.
[16]Person C, Pennec FL, Luc J. Design, modelisation and optimisation of high efficiency miniature E-field probes performed on 3D ceramic prisms for SAR evaluation. Annals of Telecommunications-Annales des Telecommunications, 2008, 63(1-2): 43-53.
[17]Watanabe S, Hamada L, Wake K, et al. Studies on evaluation methods of compliance to radio radiation protection guidelines. J NICT, 2006, 53(1): 125-132.
[18]Stuchly SS, Krassewski A, Stuchly MA, et al. Energy deposition in a model of man in the near field.Bioelectromagnetics, 1985, 6(2): 115-129.
[19]Yu Q, Gandhi OP, Aronsson M, et al. An automated SAR measurement system for compliance testing of personal wireless devices. IEEE Trans EMC, 1999, 41(3): 234-245.

