手性酰氯探针对于盐酸兰地洛尔及其立体异构体识别的质谱研究
戴田行 张才煜 耿 颖 何 兰
(中国食品药品检定研究院, 北京 100050)
1 引 言
盐酸兰地洛尔是用于治疗心律不齐的肾上腺素β1受体抑制剂,2002年由日本小野(Ono)制药株式会社在日本首先上市,目前尚未在国内批准上市[1~3]。盐酸兰地洛尔临床常用剂型是注射制剂,由于它可以快速起效,并且在血浆中代谢半衰期很短,所以常用于治疗手术中及术后快速性心律失常以及心房颤动[4~6]。盐酸兰地洛尔分子中有2个手性中心,共有4个立体异构体分子,临床上应用的盐酸兰地洛尔为S,S-异构体,其化学结构如图1所示。识别盐酸兰地洛尔及其3个立体异构体可以提高药品质量和药效,避免潜在的药物副作用。目前,盐酸兰地洛尔的立体异构体的检测方法报道不多[7],探索并研究盐酸兰地洛尔的立体异构体识别方法对手性药物质量的控制具有重要意义。
手性药物分析的常用方法为旋光度测定、圆二色谱法、核磁共振、X射线衍射以及应用最为广泛的色谱法,这些方法都已经非常成熟,广泛应用在手性分析中,然而也有各自的局限性,如分析周期长、样品处理过程复杂、样品中的微量杂质容易影响测定结果等。目前,在手性药物及其立体异构体识别中尚无法有效避免耗时长、分析方法复杂等问题。质谱法凭借快速、灵敏、准确的特点,已经广泛应用在药物分析领域。由于手性立体异构体具有相同的分子量,所以质谱一度被认为无法鉴别手性异构体。随着软电离源技术以及串联质谱技术的发展,很多文献报道了利用质谱法区分和鉴别手性立体异构体的研究[8~19]。手性物质的质谱分析常依赖手性选择剂形成非对映体复合物,在质谱仪器中进行离子反应或者离子裂解反应,由于非对映异构体之间的空间构型以及分子能量的差异而呈现出不同的二级质谱图, 据此可进行手性识别[20~22]。
质谱法用于识别具有2个手性中心的药物如盐酸兰地洛尔的研究尚未见报道。本研究采用两种具有反应活性的手性酰氯探针试剂N-对甲苯磺酰基-L-苯丙氨酰氯(TSPC)与(-)-莰烷酰氯(其结构如图2所示),与盐酸兰地洛尔及其对映体反应,对盐酸兰地洛尔以及它在与酰氯反应后的质谱裂解行为进行了研究,首次对盐酸兰地洛尔及其3个对映体杂质进行了基于质谱法的手性识别,并采用离子阱-飞行时间质谱(IT-TOF)进行高分辨质谱实验,确证了质谱裂解规律。本方法快速、灵敏,样品用量少,对于盐酸兰地洛尔进行定性研究,为分离识别手性药物对映异构体提供了实验依据。
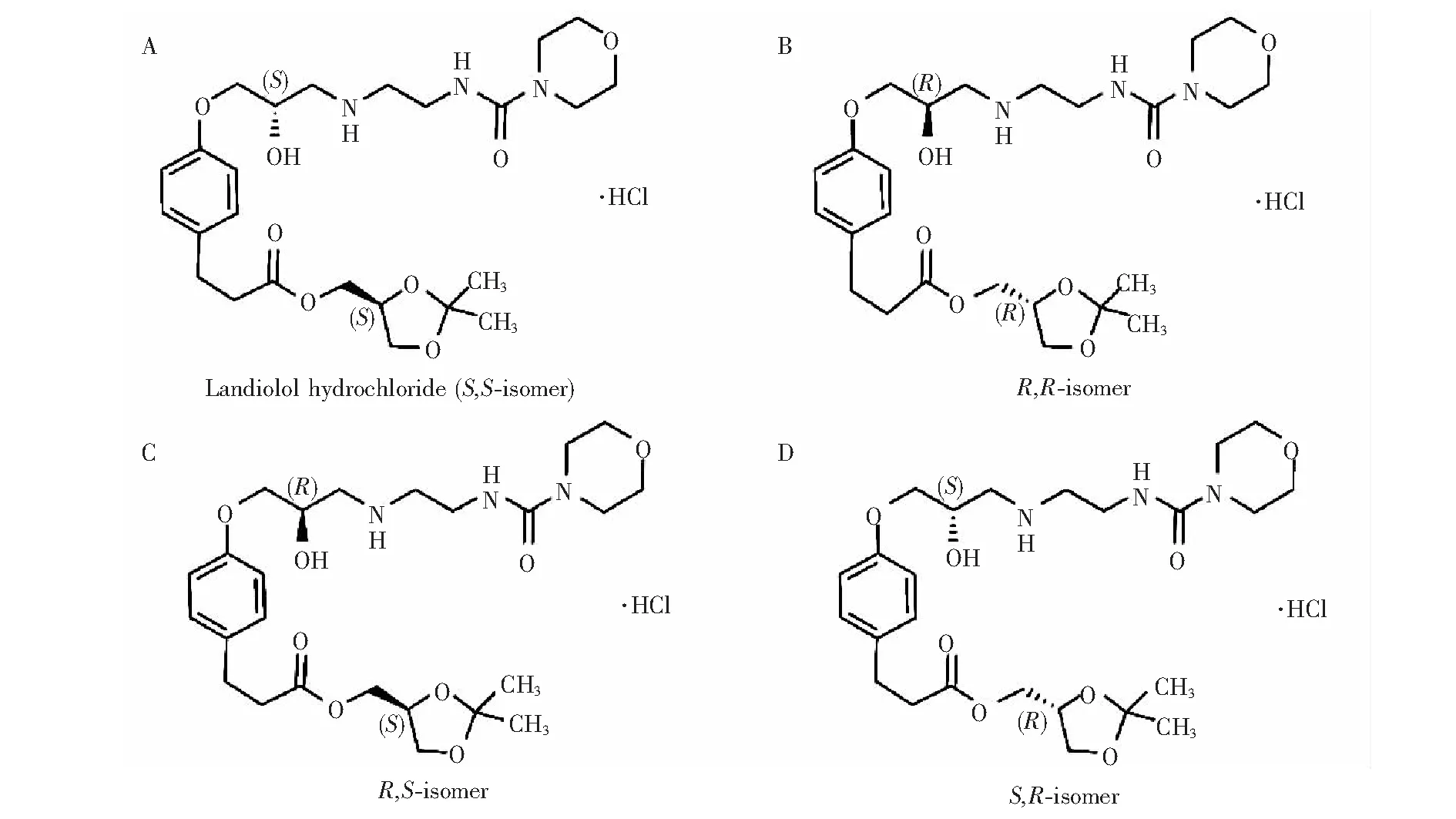
图1 盐酸兰地洛尔(A)及其立体异构体(B, R,R-异构体;C, R,S-异构体;D,R,S-异构体)的结构式 Fig.1 Structure of landiolol hydrochloride (A) and its isomers (B, R,R-isomer; C, R,S-isomer; D, R,S-isomer)
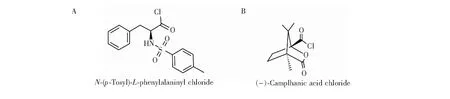
图2 手性酰氯探针的结构式: (A) N-对甲苯磺酰基-L-苯丙氨酰氯(TSPC); (B) (-)-莰烷酰氯Fig.2 Structure of chiral acyl chloride probe. (A) N-(p-Tosyl)-L-phenylalaninyl chloride; (B) (-)-Camphanic acid chloride
2 实验部分
2.1 仪器与试剂
Bruker amaZon离子阱质谱仪(德国Bruker公司); LCMS-IT-TOF离子阱-飞行时间(IT-TOF)质谱仪(日本岛津公司)
盐酸兰地洛尔以及三个立体异构体对照品(100%,中国食品药品检定研究院); 甲醇、乙腈(色谱纯,美国Tedia公司) ;N-对甲苯磺酰基-L-苯丙氨酰氯(TSPC)、(-)-莰烷酰氯(分析纯,上海梯希爱化成工业发展有限公司); 实验用水为超纯水(18.2 MΩ·cm,Million-Q超纯水仪,美国Millipore公司)。
2.2 样品处理
2.2.1样品溶液的配制分别精密称取盐酸兰地洛尔及其3个异构体标准品约10 mg,用乙腈溶解并稀释至10 mL,制成浓度约为0.002 mol/L的样品储备液,在室温下贮存,待用。取样品储备液1 mL,用乙腈稀释至50 mL,经0.22 μm滤膜过滤,作为进样溶液,直接进样分析。
2.2.2手性酰氯探针溶液的配制精密称取TSPC 14 mg、(-)-莰烷酰氯9 mg,分别用乙腈溶解并稀释至10 mL,制成浓度约为0.004 mol/L的溶液,作为探针储备液,室温下密封贮存,待用。
2.2.3手性探针与样品的反应分别取盐酸兰地洛尔及其立体异构体储备液各200 μL,分别与TSPC储备溶液300 μL混合,在室温下超声5 min,用乙腈稀释至10 mL,经0.22 μm滤膜过滤,直接进样分析。再取盐酸兰地洛尔及其立体异构体储备溶液各200 μL,分别与(-)-莰烷酰氯溶液300 μL混合,混合液在室温下超声5 min,反应后用乙腈稀释至10 mL,经0.22 μm滤膜过滤,直接进样分析。
2.3 质谱分析条件
2.3.1BrukeramaZon离子阱质谱仪分析仪器配有电喷雾离子源和离子阱质量分析器,采用正离子模式,样品溶液通过进样泵以170 μL/h的流速注入离子源内。仪器参数:氮气为干燥气,流速5 L/min; 干燥气温度250℃; 氮气为雾化气,压力为10 Psi; 喷雾电压为+4500 V,扫描速度为每秒m/z8000; 碰撞气为氦气。
2.3.2LCMS-IT-TOF离子阱-飞行时间(IT-TOF)质谱仪分析仪器配有电喷雾离子源和离子阱-飞行时间质量分析器,采用正离子模式,干燥气(氮气)温度为150℃,雾化气(氮气)流速为1.5 L/min,雾化气压力为100 kPa,检测电压为1.57 V。氩气为碰撞气,二级质谱碰撞能量设置为30%, 扫描范围为: 一级质谱m/z100~1000,二级质谱m/z240~1000。使用三氟醋酸钠校正准确质量数。
3 结果与讨论
3.1 盐酸兰地洛尔及其立体异构体二级质谱裂解规律研究

图3 盐酸兰地洛尔(A)及其R,R-异构体(B)、R,S异构体(C)、 S,R-异构体(D)的串联质谱图Fig.3 Tandem mass spectra (MS/MS) of landiolol hydrochloride (A) and its R,R-isomer (B)、R,S-isomer (C) and S,R-isomer (D)
采用离子阱质谱仪,在正离子模式下,盐酸兰地洛尔及其立体异构体的二级质谱图如图3所示。盐酸兰地洛尔经ESI电离形成[M+H]+(m/z510),其碰撞能量为0.21 V的二级质谱图如图3A所示。其中m/z423的碎片离子是丢失吗啉环的产物离子,m/z405是它丢失了一分子水的产物离子;m/z365是丢失吗啉环并且在缩酮位置脱去丙酮得到的产物离子,m/z327则为它失去一分子水的产物;m/z309是分子酯键断裂生成的产物,m/z291由它失去一分子水得到。质谱二级可能的裂解途径如图4所示。上述碎裂途径的碎片离子,均通过高分辨质谱得到确证,结果如表1所示。
表1 盐酸兰地洛尔的高分辨质谱数据
Table 1 Accurate mass measurement of landiolol hydrochloride

母离子Precursorions(m/z)碎片离子Productions(m/z)分子式Formula测定值Measuredmass(m/z)理论值Calculatedmass(m/z)相对误差Error(ppm)510[M+H]+-C25H40N3O+8510.2820510.28101.96423C21H31N2O+7423.2134423.21261.89405C21H29N2O+6405.2057405.20209.13365C18H25N2O+6365.1714365.17071.92347C18H23N2O+5347.1615347.16014.03309C15H21N2O+5309.1455309.14453.23291C15H19N2O4+291.1354291.13395.15811[M+H]+-C41H55N4O11S+811.3603811.35832.47793C41H53N4O10S+793.3453793.3477-3.03753C38H49N4O10S+753.3107753.30586.50724C37H46N3O10S+724.2950724.28987.18706C37H44N3O9S+706.2745706.2793-6.80666C34H40N3O9S+666.2481666.24800.15648C34H38N3O8S+648.2385648.23741.70690[M+H]+-C35H52N3O+11690.3587690.3596-1.30672C35H50N3O+10672.3462672.3491-4.31632C32H46N3O+10632.3173632.3178-0.79603C31H43N2O+10603.2920603.29121.33545C28H37N2O+9545.2493545.2494-0.18
由碎裂途径(图4)可知,在盐酸兰地洛尔二级质谱中,羟基位置失去一分子水是比较常见的裂解途径,吗啉环也比较容易丢失,缩酮基团位置丢失丙酮形成的离子强度也比较大。在相同能量下,盐酸兰地洛尔及其立体异构体的碎裂途径,产生的碎片离子基本一致。在二级质谱图中,可以发现兰地洛尔及其立体异构体的二级质谱图的碎片离子种类以及丰度基本一致。
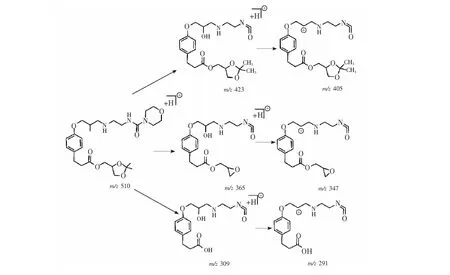
图4 推测的盐酸兰地洛尔裂解途径Fig.4 Proposed fragment pathway of landiolol hydrochloride
3.2 手性酰氯探针识别盐酸兰地洛尔及其立体异构体的质谱区分研究
3.2.1N-对甲苯磺酰基-L-苯丙氨酰氯(TSPC)的质谱识别区分
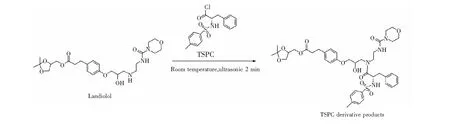
图5 盐酸兰地洛尔与探针N-对甲苯磺酰基-L-苯丙氨酰氯(TSPC)反应的产物结构Fig.5 Structure of N-(p-Tosyl)-L-phenylalaninyl chloride (TSPC) derivative products
在离子阱质谱仪正离子模式下,盐酸兰地洛尔及其立体异构体与手性探针酰氯TSPC反应后(图5),其产物经ESI电离形成[M+H]+(m/z811)准分子离子峰离子峰,对[M+H]+离子进行CID实验,碰撞能量为0.22 V的二级质谱图如图6所示,主要的碎片离子的形成与盐酸兰地洛尔的碎裂途径非常类似,均出现丢失吗啉环和水以及缩酮基团位置丢失丙酮的碎片离子,值得注意的是二级质谱中出现了较强的母离子直接脱水的产物离子峰m/z793,这是盐酸兰地洛尔的二级质谱中没有出现的裂解,根据二级质谱图推测主要碎片离子的结构如图7所示。上述碎裂途径的碎片离子均通过高分辨质谱得到确证,高分辨数据如表1所示。在二级质谱图中,明显可见碎片离子m/z793的丰度在4个异构体中不相同,图6A和图6D中的丰度比明显低于图6B和图6C。
能量分辨质谱(Energy resolution mass spectrometry,ERMS)是研究串联质谱裂解途径的常用方法,原理是通过绘制以二级质谱碎裂能量为横坐标、二级质谱中碎片离子的相对丰度为纵坐标的能量曲线(Breakdown curve),研究二级质谱裂解途径与碎裂能量的关系,此方法也常被用于质谱手性分析中[23~25]。为了进一步研究衍生化产物裂解途径,在碰撞电压为0.16~0.30 V下进行二级质谱实验,将不同碰撞能量下母离子与碎片离子的丰度变化绘制成能量识别曲线(图8),通过能量识别曲线可观察到不同能量下碎片离子丰度的变化。盐酸兰地洛尔与它的立体异构体经过手性探针反应后进入质谱分析后,在同一碰撞能量下的二级质谱图中有一些离子的丰度由于立体构型的原因表现出一定差异,如m/z793和m/z706这两个碎片离子,根据推测的碎片离子结构,m/z793和m/z706这两个碎片离子都是羟基位置丢失水分子的碎片离子,实验结果也表明, 分子中羟基所在的手性中心构型为S的盐酸兰地洛尔和S,R-异构体与R构型的R,S-和R,R-异构体存在明显差异,R构型的手性中心更加利于丢失羟基的碎裂途径,S构型的分子羟基可与手性探针中的羰基形成稳定的分子间相互作用,从而丢失水分子的碎片丰度更低一点,从二级质谱图上可以观察到,羟基所在手性中心构型为S构型时m/z793和m/z706两个碎片离子相对丰度与基峰离子的比值约为0.15(m/z793)和0.10(m/z706),R构型的比值约为0.45(m/z793)和0.25(m/z706)。由于不同构型的母离子立体结构的差异,导致分子内和分子间相互作用不同, 进而导致CID裂解效率有所不同,因此产生的碎片离子丰度也有所差异,利用这种丰度的差异可快速识别盐酸兰地洛尔及其立体异构体。

图6 TSPC结合产物的MS/MS质谱图: (A)盐酸兰地洛尔, (B) R,R-异构体, (C) R,S-异构体, (D) S,R-异构体Fig.6 MS/MS spectra of TSPC derivative products: (A) Landiolol hydrochloride, (B) R,R-isomer, (C) R,S-isomer and (D) S,R-isomer

图7 TSPC结合产物可能的碎片离子Fig.7 Proposed fragment ions of TSPC derivative products

图8 TSPC结合产物碎片离子的能量识别曲线: (A) 盐酸兰地洛尔, (B) R,R-异构体, (C) R,S-异构体, (D) S,R-异构体Fig.8 Breakdown curve of fragment ions of derivative products: (A) Landiolol hydrochloride, (B) R,R-isomer, (C) R,S-isomer, (D) S,R-isomer
3.2.2(-)-莰烷酰氯衍生化的质谱区分离子阱质谱仪正离子模式下,盐酸兰地洛尔及其立体异构体与探针(-)-莰烷酰氯反应之后形成产物如图9所示。产物分子经ESI电离形成准分子离子峰[M+H]+(m/z690), 其碰撞能量为0.20 V的二级质谱如图10所示,因为构型的不同导致碎片离子丰度呈现出差异,主要的碎片离子也都是丢失吗啉环和水以及缩酮位置脱去丙酮形成的,二级质谱出现与手性探针TSPC一致的母离子丢失水分子的碎片离子,可能的碎片离子的结构推测如图11所示。上述碎裂途径的碎片离子,均通过高分辨质谱得到确证,结果如表1所示。在二级质谱图(图10)中,可以观察到4个构型的异构体的二级质谱图都不相同,碎片离子m/z672 与m/z603在4个构型异构体的二级质谱图中的丰度均有差异。与兰地洛尔(图10A)中这两个碎片离子丰度均相比,图10(B~D)中的丰度均与图10A中的碎片离子丰度有差异。

图9 盐酸兰地洛尔与探针(-)-莰烷酰氯反应的产物结构Fig.9 Structure of (-)-Camphanic acid chloride derivative products

图10 (-)-莰烷酰氯结合产物的MS/MS质谱图: (A) 盐酸兰地洛尔, (B) R,R-异构体, (C) R,S-异构体, (D) S,R-异构体Fig.10 MS/MS spectrum of (-)-Camphanic acid chloride derivative products: (A) landiolol hydrochloride, (B) R,R-isomer, (C) R,S-isomer, (D) S,R-isomer
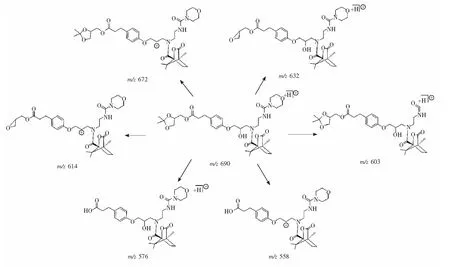
图11 (-)-莰烷酰氯结合产物可能的碎片离子Fig.11 Proposed fragment ions of (-)-Camphanic acid chloride derivative products
在碰撞电压0.17~0.28 V条件下进行二级质谱实验,绘制能量识别曲线(图12),二级质谱图表明,m/z672是由于羟基连接的手性碳构型不同,导致碎片丰度不同,m/z672是母离子直接丢失一分子水的碎片离子,这与TSPC衍生化产物的裂解途径一致,盐酸兰地洛尔(S,S)与S,R-异构体由于羟基所在的手性中心比较稳定不易于丢失羟基,在二级图谱上直观地表现为丢失羟基的碎片丰度比较小。二级质谱图和能量识别曲线表明,羟基所在手性中心构型为S构型时。m/z672碎片离子与基峰离子丰度比值约为0.3,R构型时的比值约为0.5。除此之外,在能量识别曲线中还可以观察到, 在盐酸兰地洛尔(S,S)与R,S-异构体的m/z603碎片离子丰度比R,R-异构体与S,R-异构体高。由于m/z603在质谱图中的相对丰度较低,所以在质谱图中较难观察到,通过能量识别曲线,可以观察到离子丰度的区别。这个区别取决于缩酮基团所在的手性中心的构型,缩酮基团所在的手性中心的空间构型的不同会导致碎片离子相对丰度有所差异。计算可得,当缩酮基团所在手性中心为S构型时,m/z603碎片离子与基峰离子丰度比值约为0.07,R构型时比值约为0.18。由于空间构型的差异导致碎片离子能量的差异,这使得离子丰度也有所差异。结果表明,(-)坎烷酰氯可作为手性探针酰氯,通过计算二级质谱中的特征碎片离子m/z672 与m/z603的相对丰度比值,可以快速区分盐酸兰地洛尔及其立体异构体,并且确定两个手性中心的构型。

图12 (-)-莰烷酰氯结合产物碎片离子的能量识别曲线: (A)盐酸兰地洛尔, (B) R,R-异构体, (C) R,S-异构体, (D) S,R-异构体Fig.12 Breakdown curve fragment ions of (-)-Camphanic acid chloridederivative products: (A) landiolol hydrochloride、(B) R,R-isomer, (C) R,S-isomer, (D) S,R-isomer
4 结 论
通过手性酰氯探针快速衍生化手性药物盐酸兰地洛尔及其立体异构体,采用质谱技术对其进行了研究。研究了质子化盐酸兰地洛尔及其立体异构体在正离子模式下的二级质谱裂解规律,使用两种手性酰氯试剂作为手性探针,对盐酸兰地洛尔及其立体异构体进行了识别研究。结果表明,手性探针识别后,手性中心碳原子构型可以影响二级质谱碎片离子的丰度,由于其立体结构的差异,不同构型特征母离子经过不同效率的裂解途径产生的碎片离子丰度也不同,计算二级质谱中产生碎片离子丰度比值即可快速灵敏地识别盐酸兰地洛尔及其立体异构体,对药物中异构体杂质的分离鉴定提供了借鉴。
1 Saito S, Nishihara F, Akihiro T, Nishikawa K, Obata H, Goto F, Yuki N.Can.J.Anaesth.,2005, 52(10): 1027-1034
2 IdeM, Kadoi Y, Saito S, Takahashi K, Sawano Y, Miyazaki M, Shimada H.J.Anesth.,2010, 24(2): 272-276
3 ZHANG Qian, FEN Ming-Sheng, CAO Yu-Ping, YAO Qi-Zheng.GuideofChinaMedicine,2012, 10(9): 7-9
张 倩, 冯明声, 曹于平, 姚其正. 中国医药指南,2012, 10(9): 7-9
4 Motomura S, Hagihara A, Narumi Y, Hashimoto K J.Cardiovasc.Pharmacol.,1998, 31(3): 431-440
5 Atarashi H.Clin.Pharmacol.Ther.,2000, 68(2): 143-150
6 Sezai A, Minami K, Nakai T, Hata M, Yoshitake I, Wakui S, Shiono M, Hirayama A J.Thorac.Cardiovasc.Surg.,2011, 141(6): 1478-1487
7 YU Li-Ju, HUANG Hai-Wei, LI Xiu-Mei, SHENG Jia, XU Yong-Wei, HE Lan.ChineseJ.Anal.Chem.,2016, 44(9): 1348-1353
庾莉菊, 黄海伟, 李秀梅, 盛 佳, 徐永威, 何 兰. 分析化学,2016, 44(9): 1348-1353
8 Tao W A, Zhang D, Wang F, Thomas P D, Cooks R G.Anal.Chem.,1999, 71(19): 4427-4429
9 Tao W A, Zhang D, NikolaevE N, Cooks R G.J.Am.Chem.Soc.,2000, 122(43): 10598-10609
10 YU Zhan, YAN Cun-Yu, SONG Feng-Rui, LIU Zhi-Qiang, LIU Shu-Ying.ChineseJ.Anal.Chem.,2006, 34(5): 671-674
于 湛, 闫存玉, 宋凤瑞, 刘志强, 刘淑莹. 分析化学,2006, 34(5): 671-674
11 ZHANG Shu-Zhen, WU Bi-Dong, LIU Qin, GUO Ji-Fen, XIE Jian-Wei.ChineseJ.Anal.Chem.,2005, 33(1): 123-128
张淑珍, 吴弼东, 刘 勤, 郭继芬, 谢剑炜. 分析化学,2005, 33(1): 123-128
12 Tao W A, Wu L, Cooks R G, Wang F, Begley J A, Lampert B J.Med.Chem.,2001, 44(22): 3541-3544
13 Tao W A, Gozzo F C, Cooks R G.Anal.Chem.,2001, 73(8): 1692-1698
14 Sun C, Zhu P, Hu N, Wang D, Pan Y.J.MassSpectrom.,2009, 45(1): 89-96
15 Karthikraj R, Prabhakar S, Vairamani M.RapidCommun.MassSpectrom.,2012, 26(11): 1385-1391
16 Wu L, Vogt F G.J.Pharm.Biomed.Anal.,2012, 69: 133-147
17 Wang L, Chai Y, Ni Z, Wang L, Hu R, Pan Y, Sun C.Anal.Chim.Acta,2014, 809: 104-108
18 Nagy G, Pohl N L B.Anal.Chem.,2015, 87(8): 4566-4571
19 Nagy G, Peng T, Pohl N L B.Anal.Chem.,2016, 88(14): 7183-7190
20 Tao W A, Wu L, Cooks R G.Chem.Commun.,2000, No.20: 2023-2024
21 Tao W A, Cooks R G.Angew.Chem.Int.Ed.,2001, 40(4): 757-760
22 Awad H, El-Aneed A.MassSpectrom.Rev.,2013, 47(12): 466-483
23 Hiserodt R D, Pope B M, Cossette M, Dewis M L.J.Am.Chem.Soc.,2004, 15(10): 1462-1470
24 Laprevote O, Ducrot P, Thal C, Serani L, Das B C.J.MassSpectrom.,2015, 31(10): 1149-1155
25 Zhou Y, Pan Y, Cao X, Wu J, Jiang K.J.Am.Soc.Mass.Spectrom.,2007, 18(10): 1813-1820

