选择性肠道去污染对创伤性截瘫家兔小肠组织MDA含量和SOD、GSH-Px的影响
聂 海,刘 鹏,曹德乾,白春宏,周 际,刘齐东,安 洪
选择性肠道去污染(selective decontamination of the digestive tract,SDD)是一种应用前景广阔的预防感染、降低病死率的经济、有效方法,已在ICU、胃肠、烧伤等科室感染治疗中发挥着一定作用[1-4],但目前尚未发现应用于脊髓损伤患者的报道。笔者已经通过动物实验证实短期口服肠道抗生素选择性抑制肠道潜在致病菌,防止细菌过度繁殖,可以有效控制脊髓损伤动物肠道细菌移位,但其具体机制尚不清楚。本研究通过探讨SDD对急性创伤性截瘫家兔小肠组织MDA含量和SOD、GSH-Px活性,明确氧化应激损伤在截瘫家兔肠屏障功能损害中的作用及意义,为进一步研究截瘫后肠道细菌移位和内毒素血症的致伤机制提供实验依据。
材料与方法
1 实验动物与截瘫家兔模型的建立
根据文献报道建立动物模型[5]。根据研究目的和精度要求选择40只体质量为2.0~2.5kg 6月龄清洁级健康家兔(第三军医大学大坪医院实验动物中心提供),雌雄不限,随机分为处理组和对照组,每组20只;另外增加正常对照组家兔10只。速眠新Ⅱ(解放军军需大学兽医研究所研制)按0.2mL/kg体重肌肉注射麻醉后,取背部正中切口打开椎板,显露并完全游离脊髓,从脊髓前方垂直于T6节段脊髓放入夹持力为98g的中号显微血管夹夹持脊髓约1min、大脑皮层诱发电位证实脊髓完全横断,即未引导出大脑皮层诱发电位,仅出现大脑自发脑电活动。彻底止血后逐层关闭切口。术后予以肌注青霉素钠50万U,1次/d抗感染,肌注盐酸哌替啶注射液1mg/kg,1次/d镇痛处理。专人分笼饲养,饲养条件为室温(20±2)℃、光线良好、环境安静,给予普通饲料和清洁饮水,定期导尿预防膀胱尿潴留。
2 SDD处理方案[6-7]
截瘫家兔模型建立后,随机选择20只瘫痪家兔灌饲(每8h灌饲1次,共4d)多粘菌素E(P)(重庆桑禾动物药业有限公司提供,规格:250g/袋)、妥布霉素(T)(太极集团西南药业股份有限公司,规格:80mg/支)和两性霉素B(A)(华北制药集团新药研发有限公司,规格:25mg/支)进行消化道选择性去污染(SDD)处理。SDD方案:在100mL生理盐水中加入多粘菌素E 50mg,妥布霉素40mg,两性霉素B 250mg制成混悬液,每次灌饲5mL。对照组灌饲等量生理盐水。
3 标本的采集和保存
截瘫家兔饲养4d后采集小肠组织标本保存或进行相关检测。采取腹部正中切口,切开腹部皮肤、皮下及深筋膜组织,进入腹腔,切取距回盲部5cm左右适量小肠组织,用生理盐水充分冲洗干净肠内容物,称取重量后,4℃生理盐水制成10%的组织匀浆,4 000r/min 4℃冷冻离心10min,取上清分装,-20℃冷冻保存待检,留取部分上清液检测组织总蛋白含量;同时切取距回盲部约10cm的小肠组织约1cm,生理盐水冲洗干净肠内容物,4%多聚甲醛固定。
4 检测MDA含量和SOD、GSH-Px
将小肠组织制成10%匀浆,考马斯亮蓝法测定组织总蛋白含量,检测步骤严格按照蛋白测定试剂盒(南京建成生物工程研究所)说明书进行。
改良硫代巴比妥酸(thiobarbituric acid,TBA)比色分析法检测血浆和肠道组织丙二醛(malondialdehyde,MDA)含量,检测步骤严格按照MDA试剂盒(南京建成生物工程研究所)说明书进行。
黄嘌呤氧化酶法检测血浆和肠道组织超氧化物歧化酶(superoxide dismutase,SOD)活性,检测步骤严格按照SOD试剂盒(南京建成生物工程研究所)说明书进行。
酶促反应谷胱甘肽消耗法检测血浆和肠道组织谷胱甘肽过氧物酶(glutathione peroxidase,GSH-Px)活性,操作步骤严格按照GSH-Px检测试剂盒(南京建成生物工程研究所)说明书进行。
5 HE染色和图像分析
将肠组织标本包埋、切片、脱蜡入水后进行HE染色。中性树胶封片,显微镜下观察结果。结果判定:细胞核呈蓝色,细胞浆及其他组织呈粉红色。在光镜下观察小肠病理组织学改变并进行图像分析。按Chiu六级评分[8]评价小肠黏膜上皮损伤程度(0~5级),并赋予相应的分值(0~5分)。每个动物观察10个视野进行评分,其评分总和为小肠病理评分。
6 统计学分析

结 果
1 小肠组织MDA含量
正常组小肠组织MDA水平为(2.14±0.67)nmoL/mgprot;对照组为(8.19±1.22)nmoL/mgprot;处理组为(3.58±0.98)nmoL/mgprot,多组均数间比较具有统计学意义(F=150.907,P<0.001)。处理组与对照组均数间比较小肠组织MDA含量明显降低(P<0.001),但仍明显高于正常组小肠组织MDA水平(P<0.001)。见图1。
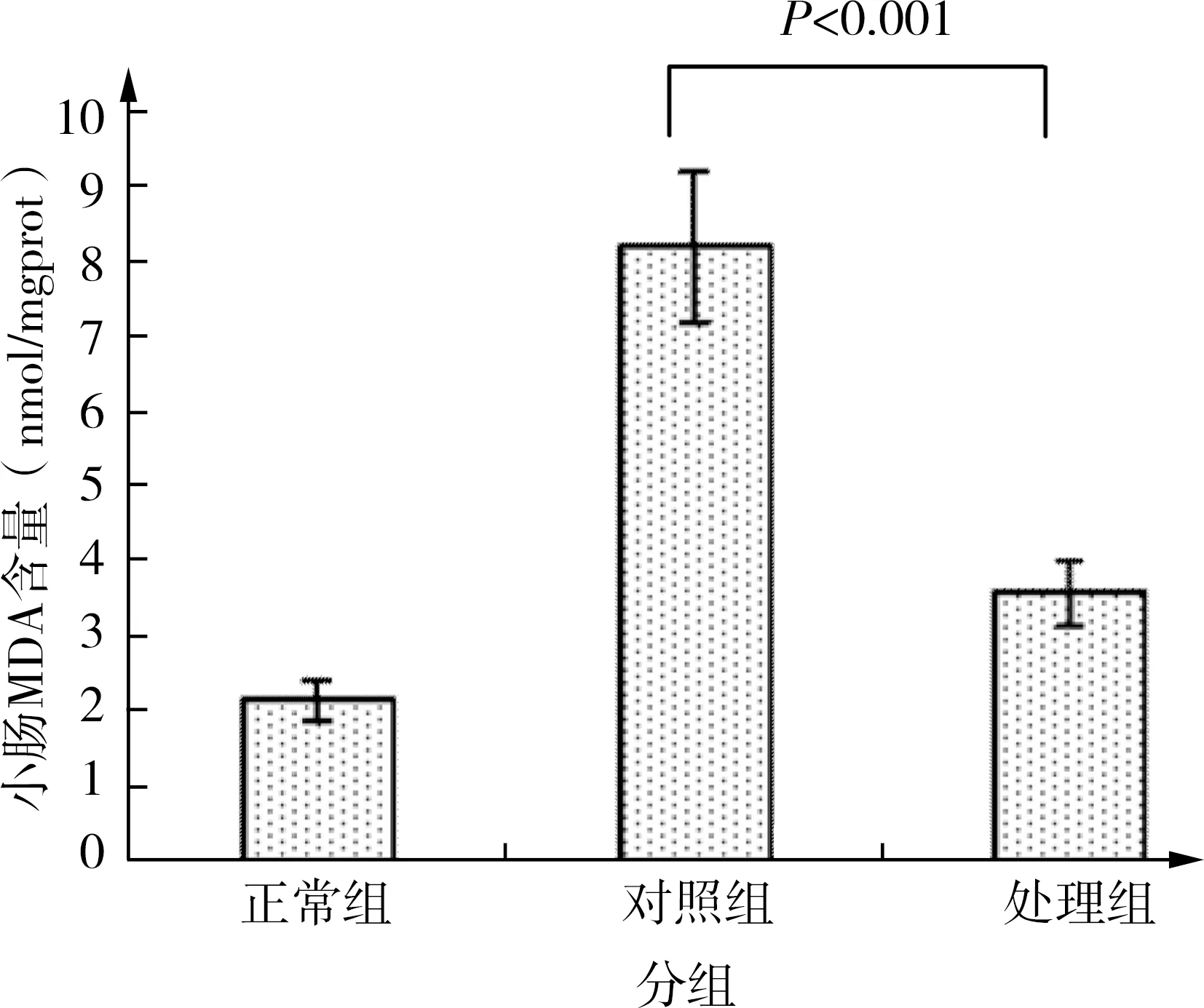
图1 小肠组织MDA含量比较
2 小肠组织SOD活力
正常组小肠组织SOD活性为67.4±5.9U/mgport、对照组为42.7±13.4U/mgport、处理组为57.2±9.4U/mgport,多组均数间比较具有统计学意义(F=19.737,P<0.001)。处理组与对照组比较小肠组织SOD活力明显升高(P<0.001),但仍较正常组小肠组织SOD活力低(P=0.0178)。见图2。

图2 小肠组织SOD活力比较
3 小肠组织GSH-Px活力
正常组小肠组织GSH-Px活性为115.6±9.8U/mgport、对照组为89.7±11.0U/mgport、处理组为111.6±12.0U/mgport,组间均数间比较具有统计学意义(F=26.228,P<0.001)。处理组与对照组比较小肠组织GSH-Px活力明显升高(P<0.001),而与正常组比较无统计意义(P=0.361)。见图3。
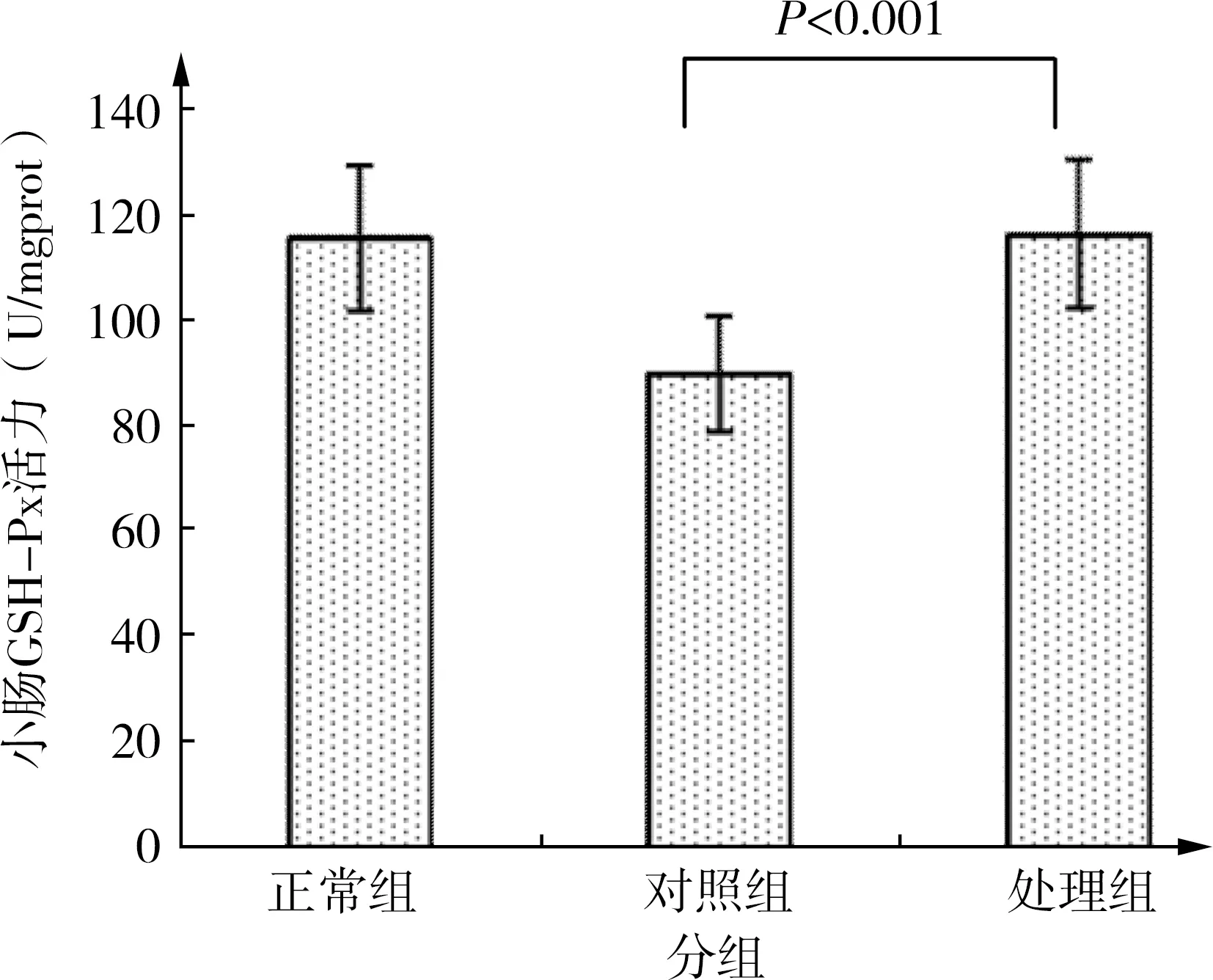
图3 小肠组织GSH-Px活力比较
4 小肠组织氧化应激反应与小肠病理评分之间的关系
从表1中可以看出,小肠HE染色Chiu病理评分与小肠组织MDA呈显著正相关(P<0.01),与SOD、GSH-Px呈显著负相关(P<0.01)。见表1。
讨 论
创伤性瘫痪患者有一半以上出现便秘、大便失禁或阻塞等肠道功能障碍[9],发生发热、全身炎症反应综合征( SIRS)、脓毒血症等感染并发症,成为瘫痪患者死亡的主要原因[10-12],严重影响脊髓损伤患者身心健康。因此脊髓损伤后早期采取有效措施预防控制肠道细菌移位及内毒素血症,对防治肠源性感染(enterogenic infection)、提高患者生存质量、降低病死率具有重要的临床实用价值。SDD已在ICU、烧伤科等危重病患者感染治疗中发挥着一定作用,但目前尚未发现应用于脊髓损伤患者的报道。笔者的前期研究已经证实SDD可以选择性抑制和消灭截瘫家兔肠道潜在致病菌,防止细菌过度繁殖,控制肠道细菌移位。
机体遭受脊髓损伤后产生全身应激对抗损伤,这种状态持续将发生氧化应激反应[13]。这时机体免疫系统激活、炎症介质释放、毒素吸收及缺血-再灌注损伤等一系列病理生理变化均可产生大量氧自由基攻击生物膜磷脂中的多聚不饱和脂肪酸,导致脂质过氧化损伤[14],进一步出现细胞膜结构紊乱,膜结合酶及受体脂质微环境发生改变,酶活性、受体功能下降以及DNA损伤,细胞超微结构特别是肌浆网和线粒体功能受损,进而引起生物体各种病理生理变化[15]。生物体在长期的进化过程中,形成了一套抗氧化系统来清除体内多余的氧自由基,抗氧化酶主要有SOD、GSH-Px等。SOD能将氧自由基歧化为H2O2,H2O2在GSH-Px、过氧化氢酶(CAT)的催化下被清除。GSH-Px在细胞浆中直接参与清除H2O2,减少羟自由基的产生,促使体内的脂质过氧化物分解而减轻其毒性。机体创伤后氧化应激是氧化和抗氧化稳态失衡,表现为自由基的产生增多和(或)机体组织抗氧化能力下降,过度的氧化应激可导致组织损害,机体迅速出现衰竭甚至死亡。因此,氧化应激反应在创伤后机体的病理生理变化过程中起着重要作用。本研究建立截瘫家兔模型并采用SDD处理截瘫家兔,检测不同时相点小肠组织MDA含量和SOD、GSH-Px活性,探讨氧化应激在脊髓损伤后肠黏膜屏障障碍中的作用及意义,为进一步研究脊髓损伤后肠道功能障碍机制及患者救治提供实验依据。
MDA是脂质过氧化反应最终代谢产物,在血清和组织中的含量反映了机体脂质过氧化的速度和强度;而SOD、GSH-Px是体内主要的自由基清除剂,具有保护生物体免受自由基的攻击,催化超氧阴离子自由基发生歧化反应,阻断自由基的毒性作用,保护机体组织和细胞DNA免受氧化损伤。因此,同时检测MDA含量和SOD、GSH-Px活性可了解自由基产生和抗氧化系统的功能状态,是反映体内脂质过氧化水平的敏感指标。本实验结果显示,经SDD处理后的截瘫家兔小肠组织内MDA含量较未处理的截瘫家兔低,而SOD、GSH-Px活性升高,提示家兔截瘫后体内脂质过氧化显著增强,并维持在较高水平,机体抗脂质过氧化系统已不能代偿氧化应激反应,但经SDD可改善脂质过氧化反应,减轻氧化应激损伤,从而保护肠黏膜。小肠HE染色Chiu氏病理评分与小肠组织MDA呈显著正相关,与SOD、GSH-Px呈显著负相关,表明小肠氧化应激反应与小肠病理学改变相关,氧化应激参与了脊髓损伤后肠黏膜的破坏过程。
氧化应激损伤可能与MDA升高或抗氧化酶降低有关。过量MDA与氨基酸反应和蛋白质交联而损伤蛋白并降低细胞膜ATPase活性,其细胞毒性作用损伤生物膜,导致细胞损伤甚至死亡;机体SOD、GSH-Px等抗氧化酶急剧减少,不能有效清除脂质过氧化物产物,而氧自由基等可损伤内皮细胞,增加血管通透性,进一步导致间质细胞广泛损伤,引起脏器功能失常,表明氧化-抗氧化系统失衡不仅是腹腔脏器损伤的结果,而且是促进伤情发展的重要原因之一。
截瘫家兔小肠组织MDA含量增加和SOD、GSH-Px活性降低的可能原因:(1)创伤产生应激反应,机体应激状态下交感-肾上腺髓质系统激活,腹腔内脏血管持续收缩导致胃肠道缺血低氧,氧自由基急剧增多,脂质过氧化反应增强导致组织细胞损伤,并产生大量MDA;(2)各种原因导致机体损伤后,为了抑制过氧化脂质启动了抗脂质过氧化的保护系统。由于氧自由基生成增多,一方面攻击SOD、GSH-Px并使其失活,另一方面氧自由基的不断产生消耗了大量SOD、GSH-Px,从而导致血清和组织中SOD、GSH-Px活性明显降低。
综上所述,截瘫家兔小肠组织MDA含量明显增高,而SOD、GSH-Px活性降低,经SDD处理后小肠组织内MDA含量降低,而SOD、GSH-Px活性升高,提示家兔截瘫后体内脂质过氧化显著增强,但SDD可改善脂质过氧化反应,减轻氧化应激损伤,从而保护肠黏膜。小肠HE染色Chiu氏病理评分与小肠组织MDA呈显著正相关,与SOD、GSH-Px呈显著负相关,表明小肠氧化应激反应与小肠病理学改变密切相关,氧化应激参与了脊髓损伤后肠黏膜的破坏过程。在临床实践中抢救、治疗脊髓损伤患者时,适当应用SDD和抗氧化剂清除氧自由基[16-20],减轻氧化应激损伤,对提高患者对创伤的抵抗力,维持机体免疫调控能力,促进病情好转,具有重要的临床应用价值。
[1] Hurley JC.Impact of selective digestive decontamination on respiratory tract candida among patients with suspected ventilator-associated pneumonia.A meta-analysis[J].Eur J Clin Microbiol Infect Dis,2016,35(7):1121-1135.
[2] Abis GS,Oosterling SJ,Stockmann HB,et al.Perioperative selective decontamination of the digestive tract and standard antibiotic prophylaxis versus standard antibiotic prophylaxis alone in elective colorectal cancer patients[J].Danish Med J,2014,61(4):A4695.
[3] Roos D,Dijksman LM,Tijssen JG,et al.Systematic review of perioperative selective decontamination of the digestive tract in elective gastrointestinal surgery[J].Br J Surg,2013,100(12):1579-1588.
[4] Silvestri L,de la Cal MA,Taylor N,et al.Selective decontamination of the digestive tract in burn patients: an evidence-based maneuver that reduces mortality[J].J Burn Care Res(Am),2010,31(2):372-374.
[5] Bai C,An H,Wang S,et al.Treatment and prevention of bacterial translocation and endotoxemia with stimulation of the sacral nerve root in a rabbit model of spinal cord injury[J].Spine,2011,36(5):363-371.
[6] Roos D,Dijksman LM,Sondermeijer BM,et al.Perioperative selective decontamination of the digestive tract (sdd) in elective colorectal surgery[J].J Gastrointest Surg,2009,13(10):1839-1844.
[7] Speekenbrink AB,Alcock SR,Forrester J,et al.The effect of selective decontamination of the digestive tract with the addition of systemic cefotaxime on the aerobic faecal flora of mice[J].Epidemiol Infect,1987,98(3):385-395.
[8] Chiu CJ,McArdle AH,Brown R,et al. Intestinal mucosal lesion in low-flow states.I.A morphological,hemodynamic,and metabolic reappraisal[J].Arch Surg,1970,101(4):478-483.
[9] Kattail D,Furlan JC,Fehlings MG.Epidemiology and clinical outcomes of acute spine trauma and spinal cord injury:Experience from a specialized spine trauma center in canada in comparison with a large natinal registry[J].J Trauma.2009,67(5):936-943.
[10] Lalwani S,Punia P,Mathur P,et al.Hospital acquired infections: preventable cause of mortality in spinal cord injury patients[J].J Lab Physicians,2014,6(1):36-39.
[11] Eves FJ,Rivera N.Prevention of urinary tract infections in persons with spinal cord injury in home health care[J].Home Healthc Nurse,2010,28(4):230-241.
[12] Liu J,An H,Jiang D,et al.Study of bacterial translocation from gut after paraplegia caused by spinal cord injury in rats[J].Spine,2004,29(2):164-169.
[13] Luo J,Shi R.Diffusive oxidative stress following acute spinal cord injury in guinea pigs and its inhibition by polyethylene glycol[J].Neurosci Lett,2004,359(3):167-170.
[14] Elsayed NM,Gorbunov NV.Pulmonary biochemical and histological alterations after repeated low-level blast overpressure exposures[J].Toxicol Sci,2007,95(1):289-296.
[15] Parihar A,Parihar MS,Milner S,et al.Oxidative stress and anti-oxidative mobilization in burn injury[J].Burns,2008,34(1):6-17.
[16] Hamann K,Shi R.Acrolein scavenging: a potential novel mechanism of attenuating oxidative stress following spinal cord injury[J].J Neurochem,2009,111(6):1348-1356.
[17] Takenaga M,Ohta Y,Tokura Y,et al.Lecithinized superoxide dismutase(pc-sod) improved spinal cord injury-induced motor dysfunction through suppression of oxidative stress and enhancement of neurotrophic factor production[J].J Control Release,2006,110(2):283-289.
[18] Kayali H,Ozdag MF,Kahraman S,et al.The antioxidant effect of beta-glucan on oxidative stress status in experimental spinal cord injury in rats[J].Neurosurg Rev,2005,28(4):298-302.
[19] Torres S,Salgado-Ceballos H,Torres JL,et al.Early metabolic reactivation versus antioxidant therapy after a traumatic spinal cord injury in adult rats[J].Neuropathology,2010,30(1):36-43.
[20] Mishra V.Oxidative stress and role of antioxidant supplementation in critical illness[J].Clin Lab,2007,53(3-4):199-209.

