薄壳山核桃叶不同溶剂浸提物对高丹草的化感效应比较
胡凌峰,孙虎,宋曰钦,韩修文
(黄山学院生命与环境科学学院,安徽 黄山 245041)
植物化感作用是指植物本身通过释放次生代谢物质到环境中,从而对一定范围内的植物(包括自身)产生直接或间接影响,是其自身化学调控和适应环境的一种生态机制[1-3]。主要通过根、叶、花、果等不同器官的淋溶、挥发、腐解和分泌向自然界中释放化感物质,从而影响周围环境中植物群落演替和个体生长发育[4]。农林业中的化感作用普遍存在,是引起森林或耕地地力衰退、生产力下降的主要原因[5-6]。因此,国内外众多学者在筛选强化感潜势新品种,利用不同植物间的正相互作用,进行混作、间作、套作,建立植物间有益组合,改进栽培布局,减少作物化感作用的负面影响等方面进行了深入研究,并取得了重要进展[5,7]。
近年来,我国农林业发展目标逐渐向建设具有长期稳定性、可持续发展的农林业系统转移[8],所以根据不同植物之间化感作用来进行合理的种间配置是发展的重要举措之一。如果间作植物选择不当,可能就会产生植物之间的抑制作用,从而影响产量。李茜[9]等发现核桃叶水浸提液对白术幼苗生长表现出低促高抑的双重质量浓度效应。韩志军[10]等通过研究发现花椒叶浸提液随着浓度的增加对大豆的生长抑制作用也越来越强。因此植物的化感作用也是影响合理布局搭配的重要因素之一[11]。
薄壳山核桃(Carya illinoensis),又名美国山核桃、长山核桃,是胡桃科山核桃属植物,是世界上著名的干果树种之一。其果实个大、壳薄、出仁率高,营养丰富,是理想的保健食品和面包糖果的添加材料[12];同时又因其油脂含量高、材质坚韧、树势挺拔,也成为重要的木本油料植物和用材绿化树种[8]。近年来,我国薄壳山核桃发展逐渐受到政府重视,并进入商业化的栽培模式[13]。以往的研究发现,胡桃科植物体内多含有某些活性物质,能对周围环境中的植物生长起到抑制作用[14],了解薄壳山核桃的化感作用机制对扩大其栽培利用具有十分重要的作用。前人对薄壳山核桃化感作用的研究主要集中于不同器官水提液对植物生长的影响[13,15-17]和其本身的自毒作用[18],在不同溶剂浸提叶片中的化感物质的研究方面较少。高丹草作为一种新型的禾本科饲料植物,具有很强的再生能力和抗逆性,在畜牧业上有很高的应用前景[19]。本文主要采用室内种子发芽及幼苗生长试验,以此探究不同溶剂浸提薄壳山核桃叶片中活性物质的化感作用,以期对薄壳山核桃叶这一丰富的生物资源的开发利用提供新途径,并对其农林复合经营提供科学参考和理论依据。
1 材料与方法
1.1 试验材料
于黄山学院天都园林苗圃地健康薄壳山核桃植株上采集新鲜叶片,洗净,置于实验室内阴干备用。选用健康饱满的高丹草种子,先用1.0%高锰酸钾浸泡15 min,再用蒸馏水冲洗3次备用。
1.2 试验方法
参考朱成磊[20]等的方法并进行修改,取40 g叶片用200 mL80%甲醇浸提24 h,取上层清液保存。再向沉淀物中加入200 mL80%甲醇浸提24 h,取两次获得的上清液于35℃下挥干,加蒸馏水定容至100 mL,得到浓度为0.25 g/mL母液。将母液加入分液漏斗中,先加入200 mL石油醚溶液浸提12 h后收集上清液保存,于35℃条件下挥干,加入去离子水定容至100 mL配成浓度为0.25 g/mL的溶液,即为石油醚态液相(石油醚相);向母液中加入等量三氯甲烷溶液,操作方法同上,得到三氯甲烷态液相(三氯甲烷相);再以此方法得到乙酸乙酯态液相(乙酸乙酯相)以及甲醇态液相(甲醇相)。将各组溶液加入烧杯中封口,置于4℃冰箱保存。
在培养皿(Φ=9 cm)底部铺两层滤纸,向每个培养皿中加入10 mL各组溶液,并以相同体积的纯水作为对照组,每组3个重复,每个重复50粒种子,置于25℃恒温光照培养中培养。6 d后计算各组发芽指标,测量植株根长、茎长、鲜重、可溶性蛋白含量各因素的抑制指数。
可溶性蛋白质含量测定:采用Bradford solution法。利用牛血清蛋白标准溶液进行测量并绘制标准曲线,取 10 μL待测样品加入 100 μL Bradford solution溶液混匀,静置10 min,于紫外线分光光度计595 nm波长下进行测定,每组重复3次,记录数据,求取平均值。
2 数据收集及处理
规定播种后一天为播种起始天数,记录种子发芽情况,以种子生长长度超过种子半径为发芽标准,计算种子发芽率,发芽势。
种子发芽率(%)=正常发芽种子总数/供试种子总数×100
种子发芽势(%)=日平均发芽数达到最高日正常发芽的种子总数/供试种子数×100
发芽指数=∑Gt/Dt
平均发芽速度=∑GtDt/∑Gt
式中:Gt为在第t天的种子发芽数;Dt为相应种子发芽所用的时间。
采用Williamson[21]等提出的敏感指数RI作为衡量化感强度的指标:RI=1-C/T(当 T≥C):RI=T/C-1(当T<C),其中C是对照值,T是处理值,RI则代表化感效应,当RI>0时表现为促进作用,当RI<0时表现为抑制作用,RI的绝对值代表作用强度的大小。
用Excel 2013进行数据记录、数据处理和图表绘制;用SPSS17.0进行t检验,LSD法进行统计检验。
3 结果分析
3.1 薄壳山核桃叶片不同溶剂提取物对高丹草种子发芽的影响
由表1、表2可知,不同提取物处理对种子发芽率、发芽势、发芽指数和平均发芽速度有一定的差异。甲醇相组对种子发芽率影响最大,相比于对照组降低了12.00%,差异极显著,抑制指数达到0.13。石油醚相和乙酸乙酯相的发芽率比对照组低10.00%和9.33%,差异显著,抑制指数分别达到0.11、0.10;甲醇相对种子的发芽势起抑制作用,比对照组降低了6.00%,呈极显著差异,抑制指数达到0.13;乙酸乙酯相和甲醇相种子的发芽指数为37.82、33.58,与对照组之间呈极显著差异,抑制指数分别达到0.13、0.23。各处理组间种子的平均发芽速度并无差异。各相态对高丹草种子发芽影响抑制指数从大到小的排列依次为:甲醇相>乙酸乙酯相>石油醚相>氯仿相。
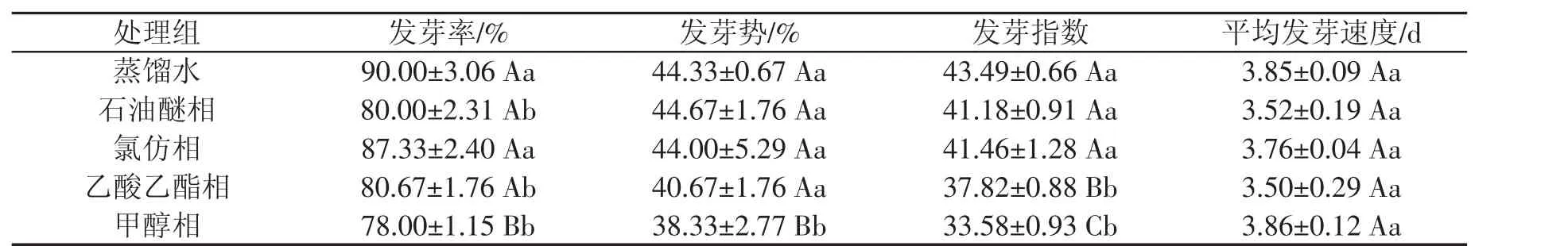
表1 薄壳山核桃叶不同溶剂浸提物对高丹草发芽的影响
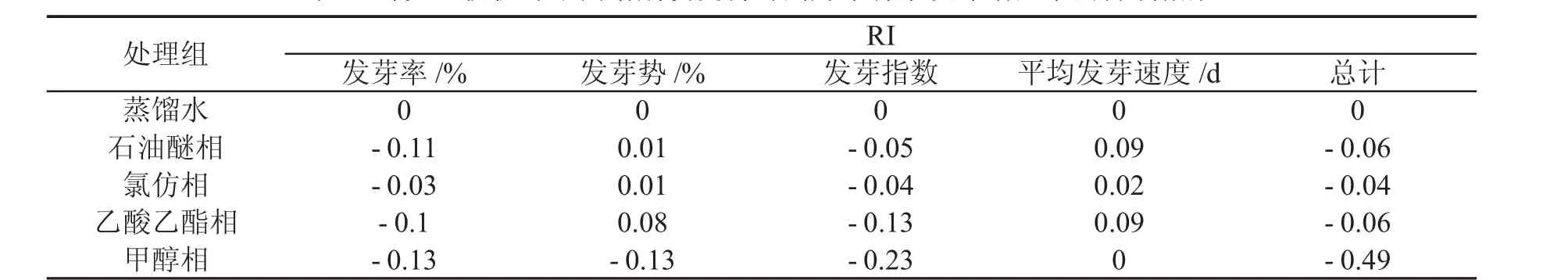
表2 薄壳山核桃叶不同溶剂浸提物对高丹草种子发芽诸因子的抑制指数
3.2 薄壳山核桃叶不同溶剂提取物对高丹草幼苗生长的影响
3.2.1 不同溶剂提取物对高丹草幼苗鲜重的影响
由表3可知,甲醇相组植株鲜重比对照组降低了0.009 g,抑制指数为0.13,与对照组之间差异不显著。石油醚相、氯仿相、乙酸乙酯相的植株鲜重比对照组分别高出 0.022 g、0.011 g、0.010 g,促进指数分别为0.32、0.16、0.15,与对照组相比差异显著。说明石油醚相、氯仿相、乙酸乙酯相3组提取液对高丹草的鲜重物质积累有显著促进作用。各相态对高丹草植株鲜重物质积累抑制指数的影响从大到小排列依次为:甲醇相>乙酸乙酯相>氯仿相>石油醚相。
3.2.2 不同溶剂提取物对高丹草幼苗茎长、根长生长的影响
从表4可知,石油醚相、氯仿相、乙酸乙酯相提取液处理组植株茎长高于对照组,说明这3种溶剂提取物对高丹草的茎生长有促进作用。甲醇相组植株茎生长长度低于对照组,说明甲醇相提取物对高丹草茎的生长有抑制作用。石油醚相、乙酸乙酯相处理组植株茎长比对照组分别高出1.13 cm、0.47 cm,促进指数分别为0.15、0.06,与对照组之间差异不显著。氯仿相组植株茎长比对照组高出1.57 cm,促进指数为0.21,与对照组之间差异显著。甲醇相组植株茎长比对照组低4.55 cm,抑制指数为0.61,与对照组之间差异极显著。说明甲醇相提取液对高丹草茎长生长有极显著的抑制作用;氯仿相提取液对高丹草的茎长生长有显著促进作用;石油醚相、乙酸乙酯相提取液对高丹草的茎生长作用不明显。各相态对高丹草茎长生长的抑制指数的影响从大到小排列依次为:甲醇相>乙酸乙酯相>石油醚相>氯仿相。
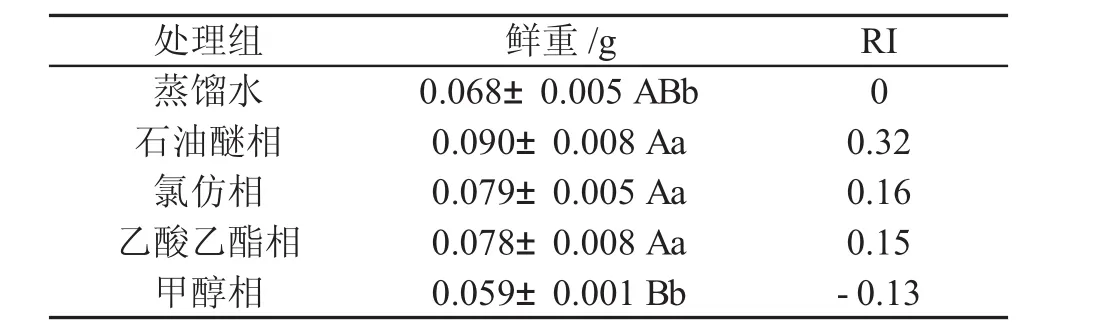
表3 薄壳山核桃叶不同溶剂浸提物对高丹草鲜重的影响
由表4可知,石油醚相、氯仿相、乙酸乙酯相提取液处理组植株根长高于对照组,说明这3种溶剂提取物对高丹草的根长生长有促进作用。甲醇相组植株根生长长度低于对照组,说明甲醇提取物对高丹草根生长有抑制作用。石油醚相、氯仿相、乙酸乙酯相处理组植株根生长量比对照组分别高出1.78 cm、1.26 cm、1.04 cm,促进指数分别为 0.48、0.34、0.28,与对照组之间差异极显著。甲醇相组植株根生长长度比对照组低1.15 cm,抑制指数为0.31,与对照组之间差异显著。说明石油醚相、氯仿相、乙酸乙酯相提取液对高丹草根生长有极显著的促进作用;甲醇相提取液对高丹草根生长有显著的抑制作用。各相态对高丹草根长度生长抑制指数的影响从大到小排列依次为:甲醇相>乙酸乙酯相>氯仿相>石油醚相。
3.2.3 薄壳山核桃叶不同溶剂提取物对高丹草体内可溶性蛋白质合成的影响
可溶性蛋白对植物细胞的生命物质和生物膜起到保护作用,是植物抗逆性指标之一。由表5可知,石油醚相、氯仿相、乙酸乙酯相、甲醇相组高丹草幼苗体内可溶性蛋白合成量比对照组分别下降了 0.269 mg/g、0.253 mg/g、0.299 mg/g、0.283 mg/g,抑制指数分别达到了 0.75、0.71、0.84、0.79,与对照组幼苗中可溶性蛋白质含量成极显著差异。石油醚相、氯仿相、乙酸乙酯相、甲醇相提取液处理组植株幼苗体内可溶性蛋白质合成量远低于对照组,说明这4种溶剂提取物对高丹草体内可溶性蛋白的合成起到一个抑制作用。各相态对高丹草幼苗体内可溶性蛋白质合成量抑制指数的影响从大到小排列依次为:乙酸乙酯相>甲醇相>石油醚相>氯仿相。
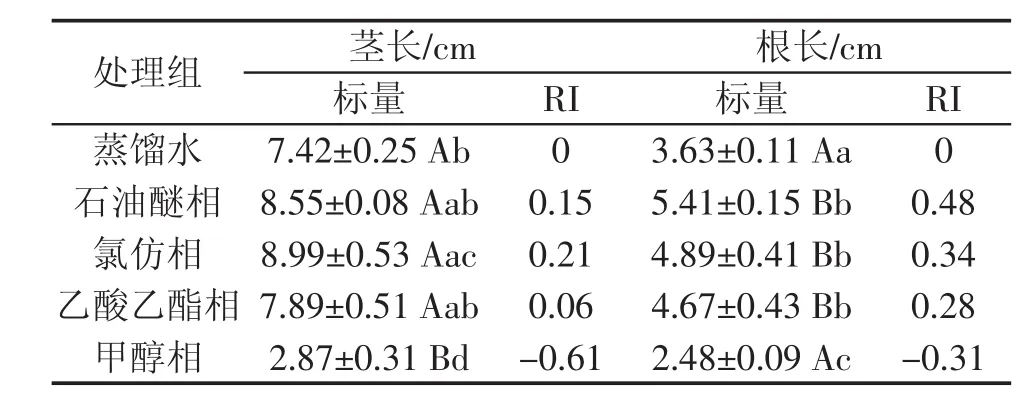
表4 薄壳山核桃叶不同溶剂浸提物对高丹草胚轴的影响
4 结论与讨论
大量研究证明,化感物质随着其种类、浓度、外界环境以及受供体植物的不同作用其机理也存在着多样性[22-23]。单一化感物质的作用机理主要是影响受体植物种子萌发、物质代谢中的关键酶活性、降低光合效率、损伤细胞超微结构和膜系统的稳定性等[22]。Rice按照化学结构把化感物质分为15类[24],但目前认为化感物质主要分为酚类、萜类、糖和糖苷类、生物碱和非蛋白氨基酸,其中酚类和萜类分别具有水溶性和挥发性,是高等植物的主要化感物质[13,22]。本试验使用薄壳山核桃叶片作为供试材料,利用相似相溶原理,使用极性大小不同的有机溶剂(石油醚相<氯仿相<乙酸乙酯相<甲醇相)将叶片中的化感物质进行提取。通过观察比较不同相态组对高丹草种子发芽影响和其幼苗生长,验证了薄壳山核桃叶中含有一定的化感物质。
孔垂华[25]等和张权[15-16]等通过研究发现,化感作用通过对植物种子发芽情况和生长情况来表现,且对于不同受体植物产生的化感作用程度也不一样。本试验表明,不同相态组处理对高丹草种子发芽生长情况影响不同。甲醇相、石油醚相、乙酸乙酯相对种子的发芽率都有显著抑制作用,且抑制指数都高于10%;4种溶剂提取液对种子发芽势和发芽指数都有一定的影响。其中甲醇相对种子发芽率、种子发芽势和发芽指数有极显著抑制作用,乙酸乙酯相对种子发芽指数有极显著抑制作用;试验中甲醇相处理组对高丹草幼苗的茎长、根长以及鲜重有一定程度的抑制作用,其余相态组对这几个指标都有不同程度的促进作用,说明甲醇浸提萃取薄壳山核桃叶片中的化感物质对高丹草的种子萌发和幼苗生长影响较大。其原因可能是因为化感物质普遍具有“低促高抑”的现象,随着溶剂极性的增大,其中溶解的化感物质增多,多种化感物质之间产生加合协同作用[23],从而引起乙酸乙酯相和甲醇相对高丹草生长发育有显著的抑制作用,而石油醚相和氯仿相却起一定的促进作用。这与王大力[27-28]等对豚草的化感作用和朱成磊[20]等对杨梅鲜叶的化感效应方面的研究有相似之处。
通过测定高丹草幼苗中可溶性蛋白含量发现,4种相态的幼苗中的可溶性蛋白含量极显著低于对照组,说明薄壳山核桃中化感物质对高丹草中蛋白质合成有极强的抑制作用,蛋白质含量降低表明植物体内蛋白质合成受阻,影响了植物体内蛋白质合成代谢[29]。孙延杰等[30]通过对不同化感物质对五爪金龙的作用研究发现:由于化感物质的影响,植物体内主要涉及信号传导、能量合成与代谢抗氧化及与基因转录等这些主要功能的蛋白质表达量均发生了改变,但具体的改变途径和表达方式还需要根据不同植物、不同条件进行深入研究,推测不同种类的蛋白质合成与表达变化是不同溶剂薄壳山核桃叶浸提液引起高丹草幼苗生长产生化感效应的生理机制之一。
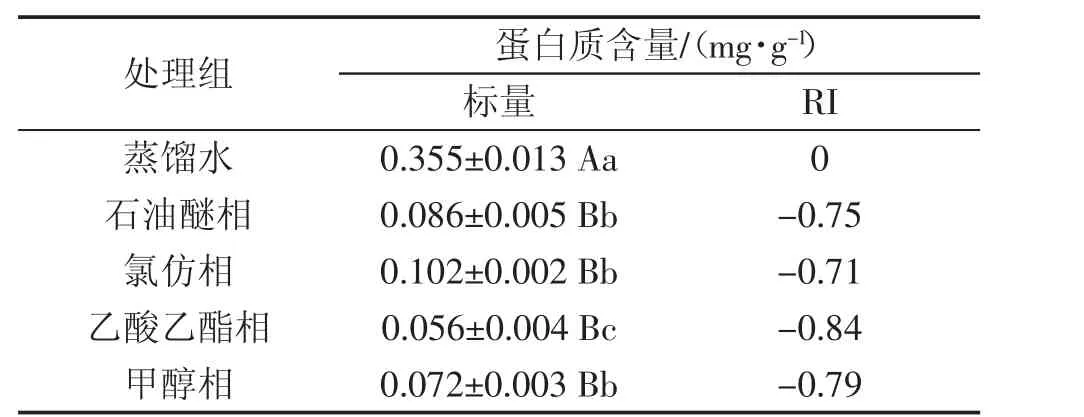
表5 薄壳山核桃叶不同溶剂浸提物对高丹草幼苗内可溶性蛋白质合成的影响
研究薄壳山核桃叶不同溶剂浸提液的化感作用,对薄壳山核桃和不同植物间作的科学耕种有一定现实意义。作为一种多用途树种[8,12],薄壳山核桃有着极大的开发利用潜力,因此合理的对薄壳山核桃进行栽培和管理,减弱或消除彼此作物间的抑制作用,才能更好地提高产量,增加收益。本试验是在室内环境下完成的,对揭示薄壳山核桃叶片的化感作用有一定的理论价值,但应用于生产实践还需要根据栽植地的环境地理条件、间作物种类等实际情况来确定。因此,如何更好地消除薄壳山核桃的化感作用还需要进一步的试验探究。
[1]江贵波,曾任森.艾的挥发性物质化感作用研究 [J].生态科学,2006,25(2):106-108.
[2]黎华寿,黄京华,张修玉,等.香茅天然挥发物的化感作用及其化学成分分析[J].应用生态学报,2005,16(4):763-767.
[3]林武星,洪伟,郑郁善,等.森林植物他感作用研究进展[J].中国生态农业学报,2005,13(2):44-46.
[4]郑维列,田大伦,权红,等.5种植物水浸液对西藏长鞭红景天种子萌发的化感作用 [J].东北林业大学学报,2009,37(1):32-34.
[5]马艳丽.化感作用在林业中的研究现状 [J].林业科技,2012,37(6):48-51.
[6]李建勇,张瑞明.植物化感作用及其在农业生产上的应用[J].上海农业科技,2016(4):21-23.
[7]王建花,陈婷,林文雄.植物化感作用类型及其在农业上的应用[J].中国生态农业学报,2013,21(10):1173-1183.
[8]侯东培,习学良,石卓功.我国薄壳山核桃研究进展[J].山东林业科技,2012,40(1):87-90.
[9]李茜,蔡靖,姜在民.核桃叶水浸提液对白术幼苗生长及光合作用的化感效应 [J].西北农林科技大学学报,2011,39(4):89-94.
[10]韩志军,陈静,郑寒.花椒叶浸提液对大豆种子萌发和幼苗生长的化感作用 [J].应用与环境生物学报,2011,17(4):585-588.
[11]陈欣,唐建军.植物他感作用及其生态学意义 [J].农业现代化研究,1988(1):20-22.
[12]彭方仁,李永荣,郝明灼.我国薄壳山核桃生产现状与产业化发展策略[J].林业科技开发,2012,26(4):1-4.
[13]张博.山核桃属2种植物叶的化感作用研究 [D].南京:南京林业大学,2012.
[14]魏玉君.近十年我国核桃文献浅析 [J].河北林果研究,2005,20(1):91-94.
[15]张权,姚小华,滕建华.薄壳山核桃根系水浸提液对2种作物种子萌发及幼苗生长的影响 [J].植物研究,2016,36(2):204-210.
[16]张权,傅松玲,姚小华.薄壳山核桃叶及青皮水浸液对3种植物的化感作用 [J].林业科学研究,2015,28(5):674-680.
[17]杨巨仙.薄壳山核桃等三种植物叶片水浸液对茶树的化感作用研究[D].南京:南京林业大学,2016.
[18]朱海军,俞卫东,曹仁勇,等.薄壳山核桃种子及种壳化感效应研究[J].江西农业大学学报,2015,37(1):96-100.
[19]刘建宁,石永红,王运琦,等.高丹草生长动态及收割期的研究[J].草业学报,2011,20(1):31-37.
[20]朱成磊,熊静,万志兵.杨梅鲜叶不同溶剂提取液对白菜种子的化感效应[J].凯里学院学报,2016,3(46):51-57.
[21]Williamson G,Richardson D.Bioassay for allelopthy:Measuring treatment response with independent controls[J].Jour-nal ofChemical?Ecology,1988,14:181-188.
[22]拱健婷,张子龙.植物化感作用影响因素研究进展 [J].生物学,2015,32(3):73-77.
[23]柴强,黄高宝.植物化感作用的机理、影响因素及应用潜力[J].西北植物学报,2003,23(3):509-515.
[24]Rice E L.Allelopahy[M].?New York:New York Academic Press,1984:1-50.
[25]孔垂华,胡飞.植物化感(相生相克)作用及其应用[M].北京:中国农业出版社,2001.
[26]宋亮,潘开文,王进闯.化感活性物质影响种子萌发作用机理的研究进展[J].世界科技研究与发展,2006,28(4):52-57.
[27]王大力,祝心如.豚草的化感作用研究 [J].生态学报,1996,16(1):12-19.
[28]王大力,祝心如.三裂叶豚草的化感作用研究 [J].植物生态学报,1996,20(4):330-337.
[29]杨期和,叶万辉,廖富林,等.植物化感物质对种子萌发的影响[J].生态学,2005,24(12):1459-1465.
[30]孙延杰.不同化感物质作用下五爪金龙的生理生化反应及蛋白质组学研究[D].厦门:汕头大学,2011.

