腹腔镜肝部分切除术治疗肝癌患者血清肿瘤标志物的变化
孙启峰,赵志强,周童,张启文
原发性肝癌切除术是治疗肝脏肿瘤最为有效的治疗方法。近年来,腹腔镜肝部分切除术因具有并发症发生率低、创伤小、术后恢复快等优势而逐步取代开腹肝部分切除术,得到广泛的应用[1,2]。血清肿瘤标志物的变化能反映肝癌患者术后病灶清除的效果[3-6]。本研究分析了腹腔镜肝部分切除术后肝癌患者血清肿瘤标志物的变化情况,现报道如下。
1 资料与方法
1.1 一般资料 2014年5月~2016年10月本院收治的原发性肝癌患者77例,男44例,女33例;平均年龄(53.5±9.2)岁。经上腹部CT、MRI检查及实验室检测等诊断,并符合中华人民共和国卫生部颁布的《原发性肝癌诊疗规范》的相关诊断标准[7]。病灶位于半肝范围内,肝功能Child-Pugh A级/B级,肿瘤直径<5 cm,术前无肿瘤转移证据。排除标准:合并严重的肝功能衰竭或自身免疫性疾病者,伴有凝血功能障碍等不宜接受手术治疗者。本研究经我院医学伦理委员会批准,所有纳入患者及家属签署知情同意书。依据患者所选手术方式,将其分为开腹组(n=30)和腹腔镜组(n=47),两组性别、年龄、病灶直径、Child-Pugh分级等方面一般资料比较,均无显著性差异(P>0.05),具有可比性。
1.2 手术方法 开腹组采用传统开腹行肝部分切除术,全身麻醉,于患者右肋缘下作15~20 cm切口,逐层进腹,切开肝周各韧带,于肿瘤组织边缘约2 cm处以电刀标记预切线。常规行第一肝门血流阻断,以CUSA刀逐步切割分离肝实质,于肝脏断面喷凝,并用敷料止血。常规放置腹腔引流管;腹腔镜组采用腹腔镜下肝部分切除术治疗,麻醉,在脐部下缘1 cm处作弧形切口,建立CO2气腹,压力控制在1.6 kPa,放置10 mm Trocar,并置入30°腹腔镜为观察孔。切开肝圆韧带、左右冠状韧带和左右三角韧带。超声刀离断小网膜至静脉韧带根部。镜下以超声刀离断肝实质及管道,以合成夹或腔内切割缝合器夹闭,然后离断。电凝法进行肝脏创面止血,用生物蛋白胶封闭。常规放置引流管,并逐层缝合。
1.3 血清肿瘤标记物及肝功能指标检测 采用ELISA法检测血清甲胎蛋白(α-fetoprotein,AFP)、癌胚抗原(carcino-embryonic antigen,CEA) 和糖类抗原 199(carbohydrate antigen,CA199);使用日立全自动生化分析仪检测血清谷丙转氨酶(ALT)、白蛋白(ALB)和总胆红素(TBIL)等肝功能指标。
1.4 统计学处理 应用SPSS 18.0软件行统计学分析,计量资料以(±s)表示,采用t检验,计数资料以百分比(%)表示,采用x2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组手术情况比较 结果显示,77例患者均顺利完成手术,无围手术期死亡病例,且腹腔镜组无中转开腹手术病例。腹腔镜组手术时间为(89.7±14.6)min,术中出血量为(83.4±14.1)ml,首次进食时间为(2.2±0.5)d,住院时间为(6.3±1.3)d;开腹组手术时间为(114.6±15.8)min,术中出血量为(127.4±16.1)ml,首次进食时间为(4.3±1.1) d,住院时间为(10.2±1.5)d。腹腔镜组首次进食时间和住院时间较开腹组明显缩短(P<0.05),且术后两组患者均无死亡及复发病例。
2.2 两组手术前后肝功能指标变化 术前两组患者血清肝功能指标无显著性差异(P>0.05);术后3个月和6个月时,腹腔镜组血清ALT显著低于开腹组(P<0.01),ALB显著高于开腹组(P<0.01),两组血清TBIL水平无显著性差异(P>0.05,表1)。
表1 两组肝功能指标(±s)变化
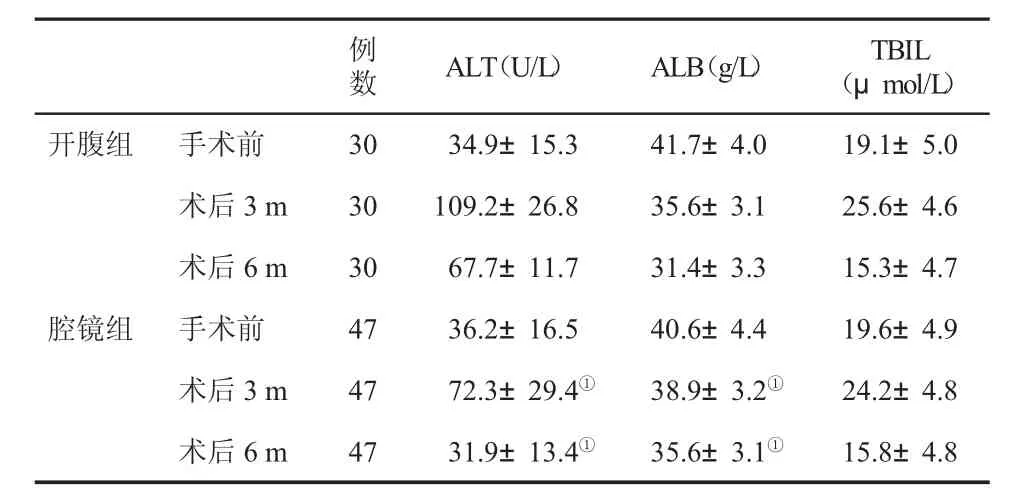
表1 两组肝功能指标(±s)变化
与开腹组比,①P<0.01
例数ALT(U/L)ALB(g/L)TBIL(μmol/L)开腹组 手术前 30 34.9±15.3 41.7±4.0 19.1±5.0术后3 m 30 109.2±26.8 35.6±3.1 25.6±4.6术后6 m 30 67.7±11.7 31.4±3.3 15.3±4.7腔镜组 手术前 47 36.2±16.5 40.6±4.4 19.6±4.9术后3 m 47 72.3±29.4① 38.9±3.2① 24.2±4.8术后6 m 47 31.9±13.4① 35.6±3.1① 15.8±4.8
2.3 两组手术前后血清肿瘤标志物水平变化 术前两组患者血清AFP、CEA和CA199水平均无显著性差异(P>0.05);术后两组血清AFP、CEA和CA199水平均显著降低(P<0.01),但两组间无显著性差异(P>0.05,表2)。
表2 两组血清肿瘤标志物水平(±s)比较
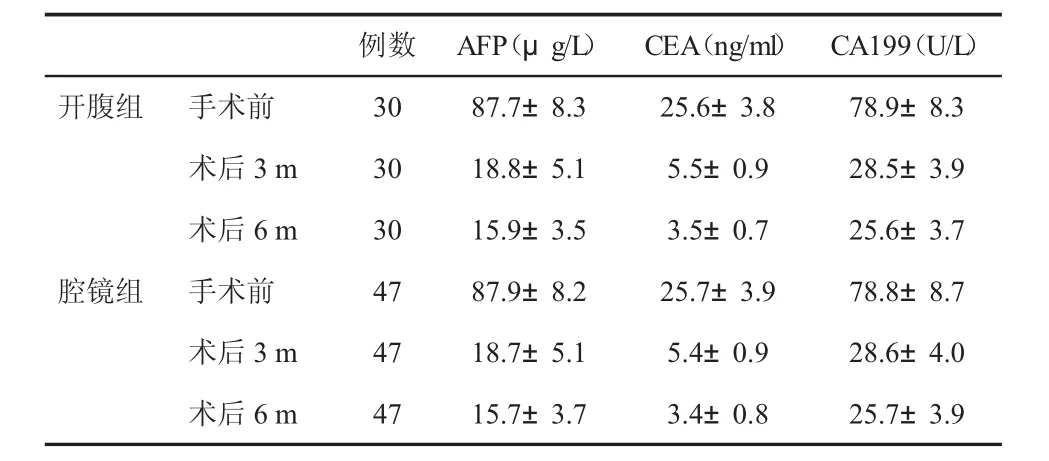
表2 两组血清肿瘤标志物水平(±s)比较
例数 AFP(μg/L) CEA(ng/ml) CA199(U/L)开腹组 手术前 30 87.7±8.3 25.6±3.8 78.9±8.3术后3 m 30 18.8±5.1 5.5±0.9 28.5±3.9术后6 m 30 15.9±3.5 3.5±0.7 25.6±3.7腔镜组 手术前 47 87.9±8.2 25.7±3.9 78.8±8.7术后3 m 47 18.7±5.1 5.4±0.9 28.6±4.0术后6 m 47 15.7±3.7 3.4±0.8 25.7±3.9
3 讨论
研究报道,腹腔镜下手术能精准地进行肝癌切除,与开腹手术比,减少了患者痛苦,缩短了住院时间[8,9]。腹腔镜肝部分切除术可减少损伤,减轻患者术后疼痛程度及组织粘连,对患者术后生活影响较小。
肿瘤标志物是反映肝癌患者术后肿瘤病灶清除效果的直观指标,其中AFP、CEA和CA199是敏感度较高的肿瘤标志物[10,11]。本组术后患者血清AFP、CEA和CA199水平均显著降低,提示腹腔镜肝部分切除术在清除病灶方面与开腹肝部分切除术效果相当[12]。
由于腹腔镜手术或开腹手术均会对患者造成一定程度的创伤,机体免疫系统功能严重降低[13]。为提高肝癌患者术后免疫力,促进术后康复,减少感染,防治并发症以及防止肿瘤转移的风险,需加强肝功能的保护[14,15],尽快恢复肝功能。本组患者术后肝功能恢复较慢,其原因需要观察。保持血清ALB水平稳定,消退黄疸,恢复凝血功能,应根据病因,如乙型肝炎病毒感染者,应接受抗病毒治疗,以确保肝功能的恢复[16]。
[1]陈威,易永祥,张海斌,等.3种评分系统预测肝移植短期预后的效果评价.中华肝胆外科杂志,2014,20(8):557-561.
[2]冯钜涛,陈劲松,岑钧华,等.腹腔镜肝切除术治疗肝癌的疗效观察.中国现代医生,2013,51(17):157-158.
[3]田贵金,刘军红,刘涛,等.白介素2联合胸腺肽α1对肝癌术后患者肝纤维化指标和肝功能的影响.现代医学,2016,44(1):68-71.
[4]高洪元.原发性肝癌患者炎性细胞因子检测的临床诊断价值.实用检验医师杂志,2015,7(2):86-89.
[5]蒋亚琦.腹腔镜下肝切除术患者围术期纤维化及氧代谢指标的变化. 海南医学院学报,2016,22(8):784-786.
[6]Abu HM,Di FF,Abu S M,et al.Oncological efficiency analysis of laparoscopic liver resection for primary and metastatic cancer:a single-center UK experience.Arch Surg,2012,147(1):42-48.
[7]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).中华肝脏病杂志,2012,20(6):929-946.
[8]吴振宇,胡浩,金昌国,等.不同入路腹腔镜肝切除术29例临床应用. 中国内镜杂志,2015,21(6):657-660.
[9]Alkhalili E,Berber E.Laparoscopic liver resection for malignancy:a review of the literature.World J Gastroenterol,2014,20(37):13599-13606.
[10]易永祥,王建,王翔,等.腹腔镜与开腹左外叶切除术对患者临床康复和机体免疫功能的影响.中国老年学杂志,2015,12(35):6844-6846.
[11]葛勇胜,荚卫东,许戈良,等.腹腔镜下肝叶切除术14例报告.实用肝脏病杂志,2015,18(2):128-131.
[12]李社方,陈伟荣,明涛.腹腔镜肝部分切除术对肝癌患者肿瘤标志物及纤维化、炎性指标的影响研究.腹腔镜外科杂志,2015,20(5):324-327.
[13]常啸,李家斌.川芎嗪联合干扰素γ治疗慢性乙肝患者对肝纤维化进程的影响.海南医学院学报,2016,22(24):2999-3002.
[14]詹剑锋,宋茂舟,林镜宏,等.干扰素联合胸腺肽α1序贯治疗耐核苷类药物乙肝肝硬化患者病毒复制及肝纤维化的影响.海南医学院学报,2016,22(17):1950-1953.
[15]Okanoue T,Mizuno M.Liver function tests and liver injuryfocusing on AST/ALT and PLT count.Jap J Mhts,2015,42(2):307-312.
[16]王兆雄,武星君.腹腔镜肝癌切除术患者围术期炎性介质及纤维化指标的变化.实用临床医药杂志,2016,20(15):170-171.

