川芎嗪对人肝癌HepG-2细胞体外侵袭和迁移的影响
孙晓,尹中普,尹红梅
肝癌是一种具有高侵袭和高转移性的恶性肿瘤,患者手术后肿瘤复发率高,预后差[1]。研究表明[2],恶性肿瘤转移和侵袭是导致肿瘤患者术后复发及疾病恶化的主要因素,但其发生机制较为复杂,目前尚未完全明确,阻断肿瘤细胞的侵袭和转移也是目前临床抗肿瘤治疗的重要方法。作为“血中气药”的川芎主要用于瘀血阻滞类疾病的治疗,其有效成分川芎嗪(TMP)具有多种生物学特性,在消化、呼吸、泌尿和心血管系统疾病的治疗中被广泛应用[3,4]。体外研究表明,TMP可诱导多种肿瘤细胞的凋亡,具有良好的抗肿瘤活性[5]。本研究旨在探讨TMP对人肝癌HepG-2细胞体外侵袭和转移的影响,初步分析了其作用机制,现报道如下。
1 材料与方法
1.1 细胞与试剂 人肝癌HepG-2细胞购自中科院上海细胞库。TMP由中国药品生物制品检定所提供,多聚甲醛(Sigma公司),DMEM培养基和胰蛋白酶(Gibco公司),胎牛血清(FBS,BioSHARP公司),Transwell小室(Millipore公司),兔抗基质金属蛋白酶-2(MMP-2,Santacruz公司),兔抗基质金属蛋白酶组织抑制因子-2(TIMP-2,北京中杉金桥生物技术有限公司),羊抗兔IgG-辣根过氧化物酶(HRP,Bioworld公司)。
1.2 TMP对HepG-2细胞粘附的影响 取对数生长期的HepG-2细胞,经0.25%胰蛋白酶消化后接种于6孔板,106个/孔。实验组分别以50 mg/L、100 mg/L、200 mg/L TMP处理细胞24 h,用无血清的DMEM培养液重悬细胞,接种于预先铺好Matrigel基质胶的96孔板,6×105个/孔,各孔设置3个复孔,将培养板置于摇床,缓慢作用30 min,阴性对照组加入同等体积的细胞培养液。以PBS洗掉未粘附的细胞,将粘附细胞以4%多聚甲醛固定15 min,加入0.1%结晶紫染液,清洗,风干,以0.2%TritonX-100溶解,在酶标仪测定各孔吸光度(OD490 nm)。细胞粘附率=(实验组OD490 nm/阴性对照组OD490 nm)×100%
1.3 TMP对HepG-2细胞迁移和侵袭的影响 取HepG-2细胞,经 50 mg/L、100 mg/L、200 mg/L TMP 处理 24 h,用无FBS的 DMEM培养基调整细胞密度为 5×105个 /ml,在Transwell上室加入200 μl细胞悬液,在Transwell下室加入20%FBS的培养基600 μl,培养24 h,PBS洗涤Transwell小室细胞3次,以棉签擦去上室未穿过去的细胞,加入4%多聚甲醛固定15 min,用PBS洗3次,加入0.1%Giemsa染色30 min,于倒置相差显微镜下观察细胞迁移情况,拍照并记录,计算HepG-2细胞迁移抑制率;在Transwell小室外膜均匀涂抹纤维粘连蛋白50 μl,风干后,再于内膜涂抹Matrigel稀释液30 μl,37℃过夜凝胶。取不同浓度川芎嗪处理的HepG-2细胞进行常规洗涤、消化,1 000 r/m离心5 min,收集细胞,用无FBS培养基调整细胞密度为1.5×106个/ml,其他步骤同上。于倒置相差显微镜下观察细胞侵袭情况,拍照并记数,计算HepG-2细胞迁移和侵袭抑制率(抑制率=(阴性对照组-实验组)迁移或侵袭细胞数/阴性对照组迁移或侵袭细胞数×100%
1.4 培养上清液MMP-2和TIMP-2蛋白水平测定 取不同浓度的TMP处理的HepG-2细胞和阴性对照组细胞,分别经0.25%胰蛋白酶消化,调整细胞数至1×106个/ml,取细胞悬液1 ml,分别加入兔抗MMP-2和兔抗TIMP-2 100 μl,室温孵育30 min,以无血清培养基洗涤1次,1 500 r/m离心10 min,弃上清,加入二抗 100 μl,室温孵育 30 min,以无血清培养基洗涤1次,1 500 r/m离心10 min,弃上清。将细胞用PBS 0.1 ml重悬,铜网过滤后,上流式细胞仪测定蛋白水平,激发波长488 nm,应用Expo 32 ADC系统分析免疫荧光数据,蛋白相对水平取均值。
1.5 统计学方法 应用SPSS 17.0统计软件进行数据分析,计量资料以(±s)表示,采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 TMP对HepG-2细胞粘附能力的影响 与阴性对照组比,药物处理组HepG-2细胞粘附率明显降低(P<0.05);与50 mg/L TMP组比,100 mg/L和200 mg/L TMP组HepG-2细胞粘附率明显降低(P<0.05,表1、图1)。

图1 TMP对HepG-2细胞粘附能力的影响(n=3)与阴性对照组比,*P<0.05
2.2 TMP对HepG-2细胞侵袭和迁移能力的影响 随着TMP浓度的加大,HepG-2细胞侵袭和迁移数量逐渐降低;与阴性对照组比,100 mg/L和200 mg/L TMP处理HepG-2细胞迁移和侵袭细胞数明显降低,而迁移和侵袭抑制率显著升高(P<0.05);与50 mg/L TMP组比,100 mg/L和200 mg/L TMP处理组细胞迁移数和侵袭细胞数明显降低(P<0.05,表1、图2)。
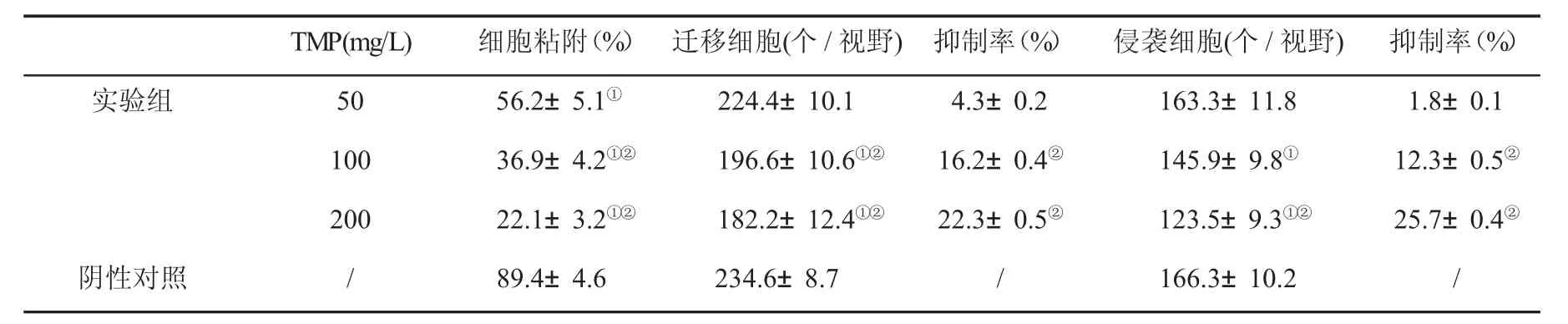
表1 TMP对HepG-2细胞粘附、迁移和侵袭(n=3,)的影响

图2 TMP对HepG-2细胞侵袭能力的影响
2.3 TMP对HepG-2细胞MMP-2和TIMP-2蛋白表达的影响 与阴性对照组比,实验组细胞MMP-2蛋白表达和MMP-2/TIMP-2比值明显降低,TIMP-2蛋白表达明显升高(P<0.05);与 50 mg/L TMP 组比,200 mg/L TMP 处理细胞MMP-2蛋白表达和MMP-2/TIMP-2比值明显降低,TIMP-2蛋白表达明显升高(P<0.05,表2)。
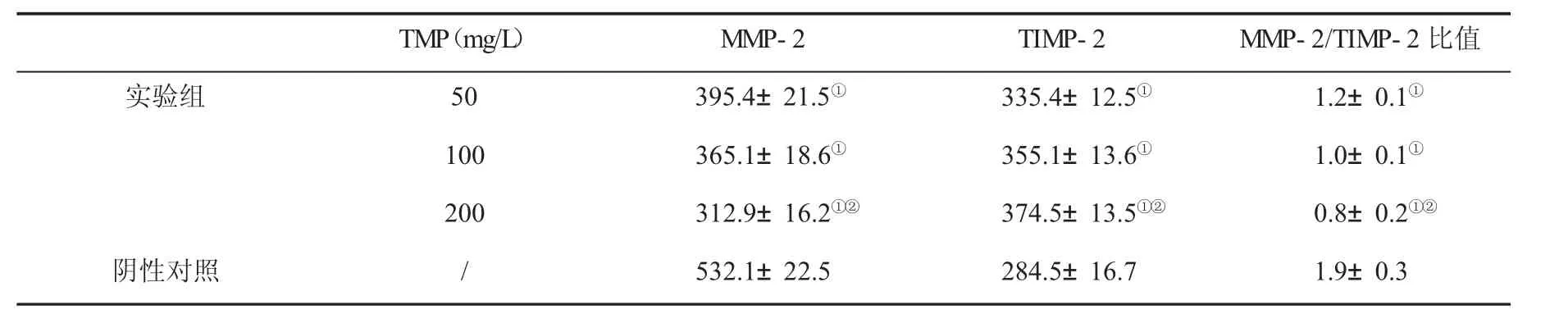
表2 TMP对HepG-2细胞MMP-2和TIMP-2蛋白表达(n=3,)的影响
3 讨论
TMP 具有广谱抗肿瘤作用[6-9]。研究显示[10,11],TMP 可有效抑制乳腺癌MCF-7细胞、肺癌A549细胞的体外增殖,其作用机制主要包括抑制肿瘤新生血管形成、抑制肿瘤细胞增殖、逆转肿瘤细胞多药耐药性等[12]。
本研究实验结果显示,随着TMP浓度的增大,HepG-2细胞的粘附率明显降低,细胞迁移和侵袭细胞数量明显减少,提示TMP能有效降低HepG-2细胞的侵袭和迁移能力,且呈剂量依赖性[13,14]。本研究结果还显示,随着TMP浓度的加大,细胞MMP-2蛋白表达量逐渐降低,而TIMP-2蛋白表达量逐渐升高。
[1]徐教邦,卜庆敖,王希超,等.直径≤5 cm肝癌手术切除与射频消融术后乙型肝炎病毒激活率的比较.中华肝胆外科杂志,2016,22(9):602-606.
[2]吴黎雳,宦宏波,温旭东,等.迷走神经递质P物质对人类肝癌细胞侵袭转移能力的影响及其分子机制.第三军医大学学报,2015,37(7):643-648.
[3]徐丽君,吴南丹,杨颖,等.川芎嗪抑制人视网膜母细胞瘤WERI-Rb1 细胞增殖的机制研究. 广东医学,2016,37(18):2721-2724.
[4]王博,史本康.川芎嗪经超声电导前列腺治疗仪直肠给药治疗Ⅲ型慢性前列腺炎效果观察.山东医药,2017,57(2):85-86.
[5]霍梦琪,张燕玲,郑世超,等.基于共表达蛋白相互作用网络探讨川芎嗪治疗冠心病的机制.北京中医药大学学报,2016,39(12):989-997.
[6]何光志,邓树轩,何前松,等.皂角刺总黄酮对肝癌HepG2细胞增殖、凋亡和侵袭能力影响的实验研究.湖南师范大学自然科学学报,2012,35(1):77-81.
[7]Ito H,TanakaS,AkiyamaY,etal.Dominantexpression of DCLK1 in human pancreatic cancer stem cells accelerates tumor invasion and metastasis.Plos One,2016,11(1):e0146564.
[8]Lee KR,Kozukue N,Han JS,et al.Glycoalkaloids and metabolites inhibit the growth of human colon (HT29) and liver(HepG2) cancer cells.J Agricult Food Chem,2004,52(10):2832-2839.
[9]吴婷婷,丁玉勇.川芎嗪生物活性的研究进展.食品研究与开发,2016,37(6):212-217.
[10]牛媛,王成,张晓燕,等.川芎嗪对人肺腺癌A549细胞增殖、迁移和侵袭的作用与机制. 现代肿瘤医学,2016,24(10):1509-1512.
[11]Fidler I J.Tumor heterogeneity and the biology of cancer invasion and metastasis.Cancer Res,2016,38(9):2651-2660.
[12]毕蕾,颜晓静,杨烨,等.川芎嗪对肝癌HepG2细胞迁移、侵袭和细胞骨架的影响.中国药理学通报,2016,32(2):194-198.
[13]孙宇,单路娟,刘越坚,等.华蟾素注射液对人肝癌HepG-2细胞增殖及凋亡的影响. 中国肿瘤,2010,19(6):410-413.
[14]Kolude B,Adisa A O,Lawal A O,et al.Stoichiometric expression of MMP-2/TIMP-2 in benign and malignant tumours of the salivary gland.Tumor Biol,2015,36(4):1-7.

