甲状腺激素干预H-ras12V转基因肝癌小鼠对肝肿瘤的影响研究
白云,巩方明,田兴松
有研究[1]发现,随着人年龄不断增长,发生肿瘤的几率也增长。甲状腺激素(THs)是具有调节机体发育、细胞增殖与分化、维持内环境稳定等多种作用的一类激素。老年人体内TH水平要明显低于年轻人,TH水平与年龄的增长呈负相关[2]。肿瘤细胞抑制TH的生物学功能有多种分子机制,Ras癌基因可以通过上调Cyclin D1或经过磷酸化维甲酸受体(RXRα)抑制THs/TR信号通路。有学者[3]提出,TH对肝脏、肺和结直肠类肿瘤发生有抑制作用,但尚无定论,TH的作用机制亦不明确。本研究在H-ras12V转基因肝癌小鼠探讨了TH水平对小鼠肿瘤的影响。
1 材料与方法
1.1 动物、药品和设备 3月龄SPF级雄性H-ras12V转基因肝癌小鼠45只【辽宁实验动物中心,生产许可证号为SCXK(辽)2013-0004,饲养于我院第一附属医院动物实验中心】,体质量为24~32 g。宇宙甲状腺素片由上海长城药业有限公司生产(国药准字H31022151),丙硫氧嘧啶片由上海信谊药厂有限公司生产(国药准字H19983194)。北京亚欧德鹏科技有限公司生产的DP-3401型游标卡尺,上海巴玖实业有限公司生产的SAF-680T型酶标仪,美国贝克曼库尔特有限公司生产的Avanti JXN-30/26智能型高效离心机。
1.2 肝癌模型小鼠的制备 取小鼠45只,正常饲养1 w,随机分为甲状腺机能亢进症组、甲状腺机能减退症组和对照组,每组15只,分别给予甲状腺素片28.57 mg.kg-1·d-1、丙硫氧嘧啶片171.4 mg.kg-1·d-1和蒸馏水灌胃。待小鼠达到7 m后,称量体质量。经眼球取血,静置于离心管10~15 min,3000 r/m离心15 min,保留血清。取肝脏,称质量。将肝组织剪切成约1 cm3大小组织块,置于冷冻管中,-80℃保存[4]。
1.3 血清和组织TH检测 采用ELISA法检测血清T3和T4(北京百奥莱博科技有限公司)和游离组织T3和T4(上海钰博生物科技有限公司)[5]。
1.4 小鼠肿瘤生长情况检测 将小鼠肝脏摘取后,使用游标卡尺测量肉眼所见的肿瘤直径,记录不同直径的肿瘤个数。
1.5 统计学方法 应用SPSS 20.0软件进行分析,对符合正态分布的计量资料以(±s)表示,采用独立样本的t检验。以P<0.05为存在统计学差异。
2 结果
2.1 各组小鼠TH水平比较 甲状腺机能亢进症(A)组小鼠血清T3和T4水平显著高于甲状腺机能减退症组(P<0.05);甲状腺机能亢进症(B)组小鼠游离T3和T4水平显著高于其他两组小鼠,甲状腺机能减退症组小鼠游离组织T3水平显著低于对照组(P<0.05,表1)。
表1 各组小鼠血清和游离TH水平(±s)比较
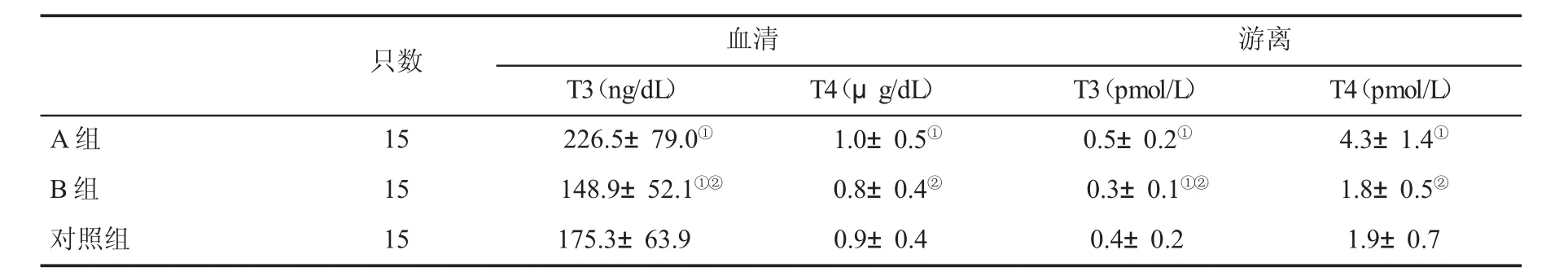
表1 各组小鼠血清和游离TH水平(±s)比较
与对照组比,①P<0.05;与甲状腺机能亢进症组比,②P<0.05
?
2.2 各组小鼠肝肿瘤生长情况比较 见表2。
表2 各组小鼠肝肿瘤生长情况(±s)比较

表2 各组小鼠肝肿瘤生长情况(±s)比较
与对照组比,①P<0.05;与甲状腺机能亢进症组比,②P<0.05
?
3 讨论
有学者发现,在经Ras癌基因诱导的肝肿瘤动物,其肝癌病灶细胞RXRα的磷酸化水平显著增高[6,7],THS/TR通路信号传导被抑制[8-10]。临床上发现,肝癌患者常会有正常甲状腺机能的高甲状腺素血症发生[11-13]。动物实验[14-17]发现,转基因肝癌小鼠血清THs显著升高。因此,推测体内TH水平与肿瘤细胞的繁殖、分化存在关联[18,19]。
本研究发现甲状腺机能亢进症组小鼠血清和游离组织TH水平明显高于对照组或甲状腺机能减退症组,而肝组织肿瘤个数和肝/体质量比亦高于其他两组,说明甲状腺机能亢进症组小鼠甲状腺功能增强,对肿瘤生长起了抑制作用。张敏[20]等也曾在Ras基因诱导的肝肿瘤小鼠研究发现,甲状腺素可有效抑制肝脏肿瘤的生长。
[1]罗翠松,汪珍光,林云,等.年龄对肝癌合并糖尿病患者预后的影响:基于倾向值匹配的分析.第二军医大学学报,2016,37(9):1171-1175.
[2]张秀云.高龄人群血清促甲状腺激素、血脂水平与年龄的相关性分析. 临床心血管病杂志,2016,32(4):421-423.
[3]Memon NS,Kazi TG,Afridi HI,et al.Correlation of manganese with thyroid function in females having hypo-and hyperthyroid disorders.Biol Trace Elem Res,2015,167(2):165-171.
[4]Ajavon A,Killian D,Odom R,et al.Influence of thyroid hormone disruption on the incidence of shingles.Epidemiol Infect,2015,143(16):3557-3571.
[5]杨榕,范晨玲,毕美,等.自身免疫性甲状腺炎小鼠发病中调节性 T细胞、Th17 细胞的变化. 实用药物与临床,2014,17(12):1511-1515.
[6]赵宏,刘海彤,魏冰,等.甲状腺功能亢进合并肝损害30例临床特点及其治疗效果. 中国伤残医学,2015,23(9):117-118.
[7]冼中任,方伟祯,黄坚,等.Graves甲状腺功能亢进性心脏病患者肝功能异常的临床分析. 广东医学,2015,36(21):3342-3344.
[8]潘倩,章建全.甲状腺腺瘤与肝海绵状血管瘤同期联合微波消融治疗的初步尝试.第二军医大学学报,2015,36(5):573-576.
[9]刁海鑫,吴文溪,邓勇.甲状腺全切术治疗原发性甲状腺功能亢进疗效及对患者心脏功能和肝功能的影响.中国现代医学杂志,2014,24(34):94-97.
[10]应爱华.丙硫氧嘧啶与甲巯咪唑对甲状腺功能亢进症肝功能影响情况的对比研究. 中国医药导报,2014,11(4):71-73.
[11]赵荣兰,宋伟,孙艳丽,等.甲状腺激素受体β对大鼠肝癌细胞RH-35凋亡和增殖的影响.中华内分泌代谢杂志,2016,32(8):691-695.
[12]陈强,谢庆吉,岑宏,等.P21激活激酶1在甲状腺乳头状癌中的表达及临床意义的研究.中华普通外科学文献(电子版),2015,9(5):21-24.
[13]谢莲,曾锦章,杨汀,等.TPA诱导肝癌细胞SMMC7721凋亡及与RXRα和TR3的关系.云南大学学报:自然科学版,2006,28(3):271-276.
[14]刘辉,杨波,吴亮亮,等.Th/Tr淋巴细胞比值评估乳腺癌患者抗肿瘤免疫状态. 现代肿瘤医学,2010,18(4):689-691.
[15]熊玮,骆瑜,董少红,等.微小RNA-146a上调cyclin D1表达诱导大鼠血管平滑肌细胞的增殖.中国免疫学杂志,2016,32(7):974-978.
[16]程静屏,傅念,罗艳云,等.甲状腺素对非酒精性脂肪肝大鼠ANGPTL3 表达的影响. 中南医学科学杂志,2016,44(1):25-28.
[17]卢文丽,方肇勤,潘志强,等.甲状腺激素释放相关水解酶基因在H22肝癌小鼠早期不同证候中的表达特征.国际中医中药杂志,2014,36(7):623-627.
[18]段宏.抗甲状腺功能亢进症药物致肝功能损害的临床分析.临床合理用药杂志,2014,7(22):63-64.
[19]何珂,胡蕴.促甲状腺激素受体抗体对人肝癌细胞HepG2凋亡和增殖的影响. 临床荟萃,2014,29(1):45-48.
[20]张敏,聂鑫,董建一,等.甲状腺激素对Ras癌基因诱导的肝肿瘤抑制作用研究. 中华肿瘤防治杂志,2015,22(20):1596-1601.

