非酒精性脂肪性肝病患者粪便钙卫蛋白检测及其意义*
杨钊,魏娟,吴晓辰,王少东,汪芳裕,杨妙芳
钙卫蛋白(FC)是一种主要由中性粒细胞释放的钙-锌结合蛋白,其含量占中性粒细胞胞浆蛋白的60%以上[1-4]。当肠道粘膜发生炎症反应时,中性粒细胞迁移、聚集到肠道炎症部位,并释放更多的钙卫蛋白,后者在肠道蠕动过程中与肠道内容物混合,最
终随粪便排出体外,因而FC水平可反应胃肠道内中性粒细胞的迁移情况[5-7]。FC具有抗细菌降解的能力,在常温下可稳定存在长达7天。因此,FC水平可较为准确地反映肠道的炎症状态[8,9]。FC可用于评价炎症性肠病、肠道憩室病、结直肠癌、乳糜泻等肠道疾病的炎症状态。FC水平还可用于鉴别炎症性肠病与功能性肠病,评价炎症性肠病的疾病活动度,评价药物治疗效果等[10,11]。有研究者甚至认为FC检测可代替内镜检查评估炎症性肠病的炎症状态[12]。近年来,有学者研究发现,在肝硬化患者,FC可作为筛查或评估自发性细菌性腹膜炎和肝性脑病的指标[13,14]。FC还可用于评价系统性硬化病患者是否存在细菌过度生长[15]。另外,研究发现,肥胖与肠道炎症密切相关,通过控制饮食减肥可减轻结肠的炎症程度[16]。肥胖者合并NAFLD的几率可高达94%[17]。目前尚没有关于NAFLD患者FC水平的报道。本研究检测了NAFLD患者FC水平,以评估其肠道的炎症状态,进而阐述肠道炎症在NAFLD发病中的作用。
1 资料与方法
1.1 研究对象 2015年9月~2016年4月在我院脂肪肝联合专病门诊就诊的NAFLD患者,参照2010年修订的非酒精性脂肪性肝病诊疗指南诊断[18],纳入标准为:①18岁~65岁,男女不限;②无饮酒史或饮酒折合乙醇量男性<140 g/周,女性<70 g/周;③肝脏超声表现符合弥漫性脂肪肝的诊断标准。排除标准包括:①患酒精性肝病、病毒性肝炎、药物性肝损伤、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可致脂肪肝的特定疾病或合并有心、肺、脑、肾等严重疾病;②患有可引起FC升高的疾病,如腹泻、炎症性肠病、结肠癌、消化道出血或上、下消化道糜烂/溃疡等;③近1月内服用过非甾体类抗炎药、抗凝药、抗生素和质子泵抑制剂等。选择同期性别和年龄与NAFLD组相匹配的健康体检人员作为正常对照。
1.2 一般资料的获取 记录研究对象的疾病史、饮酒史、药物服用史等,测量血压(mmHg)、腰围(cm)、身高(cm)和体质量(kg),并计算体质指数(BMI,kg/m2)。
1.3 标本收集、处理及检测 所有研究对象空腹留取新鲜静脉血2 ml,并立即送至检验科检测。在此后3天内留取新鲜粪便2 g以上(女性避开月经期),4℃转运至实验室并储存于-80℃待测。使用全自动生化分析仪(日本东京,Hitachi 7600)对血液生化指标进行检测,指标包括 ALT、GGT、碱性磷酸酶(ALP)、AST、空腹血糖、TG、TC、尿酸、HDL、低密 度脂蛋白(LDL,日本第一化学株式会社试剂盒)。采用ELISA法检测粪便钙卫蛋白(瑞士Schnenbuch,Bühlmann)。称取待测粪便50 mg,溶于提取液2450 μl中,混匀后静置;30 min后,取上清液1 ml,2 000g离心5 min;取离心后上清液和标准品各100 μl,采用酶联免疫吸附试验检测[19]。以FC水平大于50 μg/g为肠道存在炎症。
2 结果
2.1 一般情况 本研究纳入NAFLD患者81例和正常人91例。本研究NAFLD患者多为中青年,体质指数和腰围均明显大于健康正常人,NAFLD组肥胖率明显高于正常人(P<0.001),但两组高血压患病率相似。NAFLD组血生化指标均显著高于正常人(P<0.01,表1)。
表1 两组一般资料和血生化指标(±s)比较
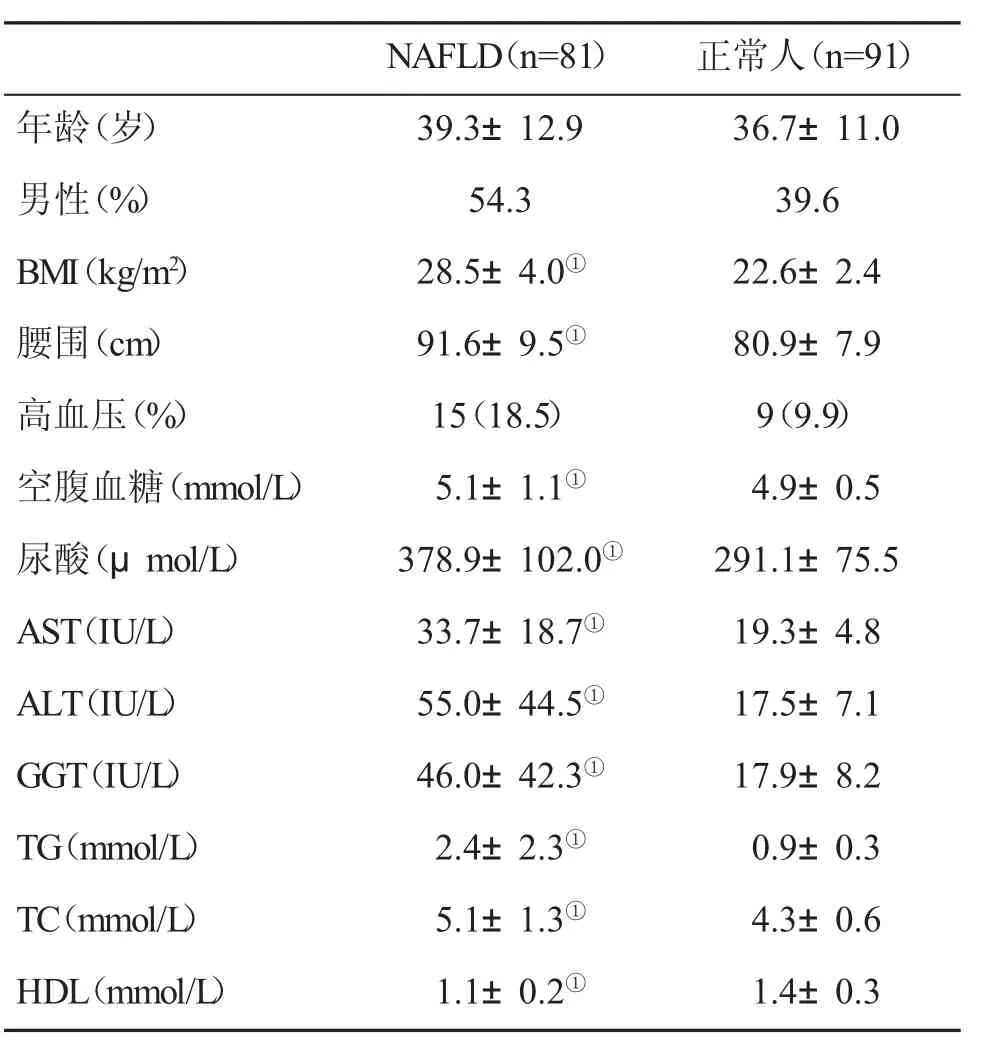
表1 两组一般资料和血生化指标(±s)比较
与正常人比,①P<0.01
?
2.2 FC水平及其相关性分析 NAFLD组FC水平为 43.0(18.8~87.0)μg/g,显著高于正常人的 11.4(4.6~24.4)μg/g,差异有统计学意义(P<0.00,图1);NAFLD组和正常人FC水平大于50 μg/g者分别为48例(59.3%)和6例(6.6%),两者构成比差异具有统计学意义(x2=55.178,P<0.001);相关性分析显示,NAFLD患者FC水平与BMI、腰围、血清GGT、TC 水平呈正相关(r=0.725,r=0.570,r=0.292,r=0.400,P 值均 <0.05,图2A~D)。
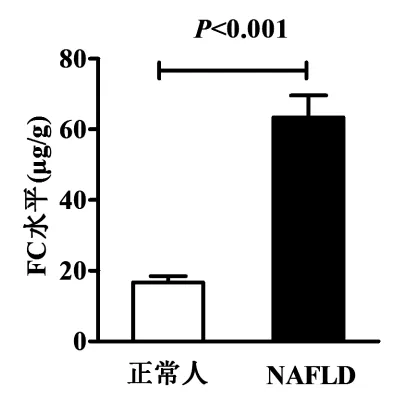
图1 NAFLD患者与正常人FC水平比较

图2 NAFLD患者FC水平的相关性分析 均与FC水平显著相关(P值均<0.05)
2.3 多因素分析 将两组年龄、性别以及在单因素分析中存在组间差异的指标,包括BMI、腰围、空腹血糖、尿酸、ALT、AST、GGT、TC、TG、HDL、LDL 和FC进行Logistic回归分析,结果显示低水平的血清HDL,高水平的血TG、BMI和TC为发生NAFLD的独立危险因素(表2)。
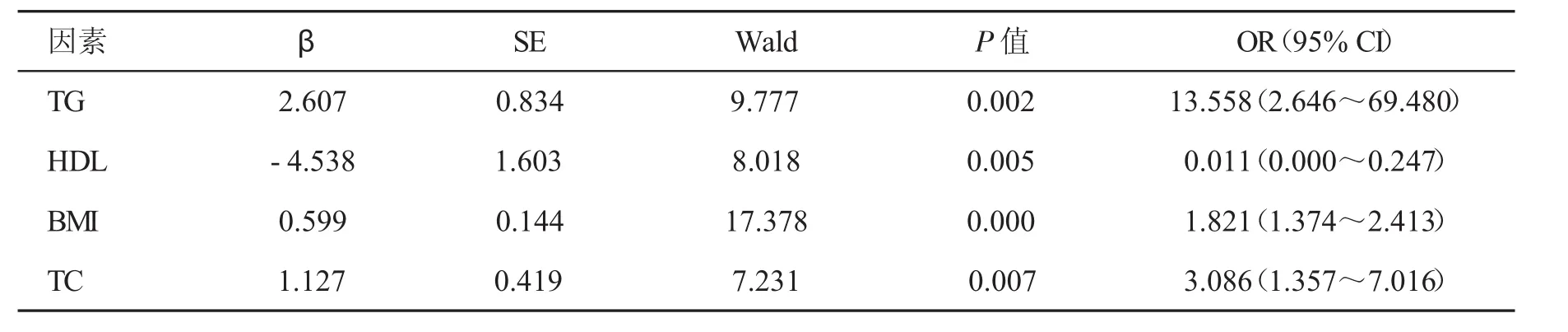
表2 影响NAFLD发生因素的Logistic回归分析
3 讨论
肠-肝的概念于1978年首次被Volta提出[4],后逐渐被认为是肠与肝相互联系相互作用的双向通道[20]。肠道屏障作为肠-肝轴中的重要组成部分,在NAFLD的发生发展中发挥着重要的作用。Miele et al[21]采用免疫组化检测ZO-1蛋白表达量,并检测尿液51Cr-EDTA发现了NAFLD患者的肠道上皮细胞紧密连接被破坏,肠道通透性增加,他们认为肠道屏障障碍在肝脏脂质沉积中发挥了重要作用。最近有研究发现,NAFLD患儿肠道通透性大于正常儿童,并且与NAFLD的炎症程度呈正相关[22]。
肠道炎症可引起肠道通透性增加,进而在NAFLD的发生发展中发挥重要作用。Gabele et al[23]在DSS诱导小鼠肠炎的模型中,在高脂饲料喂养下,肠道炎症促使脂多糖进入门静脉,最终使肝脏炎症及纤维化加重。此外,Jiang在研究肠道微生态与NAFLD关系的临床试验中发现,肠道炎症、肠道粘膜免疫功能障碍是肠道微生态失调作用于NAFLD的重要环节。与Jiang研究发现的结果相似,本研究也发现NAFLD患者多存在肠道炎症。不同的是,Jiang使用透射电子显微镜观察患者十二指肠紧密连接蛋白结构,并用免疫组化检测紧密连接蛋白的表达量,而本研究使用的是更为简便且非侵入性的方法,即检测患者粪便中钙卫蛋白水平,进而评估肠道的炎症状况。
由于粪便与肠道黏膜直接接触,粪便在肠道排出过程中可携带一些蛋白分子(如钙卫蛋白、乳铁蛋白),因而用于反应肠道炎症状态的粪便炎症标志物比血液中炎症标志物更具有优势[24]。目前研究发现,粪便中钙卫蛋白和乳铁蛋白均能较好地评估肠道炎症状态,但有研究表明,使用FC比粪便乳铁蛋白准确性更高[25],因而我们选用了FC来评估NAFLD患者的肠道炎症状态。在本研究中,NAFLD患者FC水平明显高于正常人,虽然在多因素分析中,FC在两组间的差异性不具有统计学意义(可能是样本量不足的原因),但经相关性分析发现,FC与BMI、TC和GGT具有相关性,而肥胖、高脂血症及肝功能异常都是NAFLD的常见临床表现,且肠道炎症与NAFLD的发病进程密切相关。因此,我们认为以FC评估NAFLD患者的肠道炎症状态,进而指导NAFLD的临床检查及用药具有一定的临床应用前景。当然,其应用价值仍需扩大样本量来进一步研究。
本研究不足之处在于样本量不够大,非多中心研究,研究结果不能推及其它中心的NAFLD人群。
本研究发现NAFLD患者肥胖的比率明显高于健康正常人,并且其肝功能普遍有所损害,血脂水平也显著高于正常人。同时,本研究通过一种简便而非侵入性的方法,检测研究队列中FC水平,发现NAFLD患者FC水平显著高于正常人,表明NAFLD患者存在肠道炎症,为肠道炎症在NAFLD发病机制中发挥着重要作用提供了证据。为使本研究结论更可靠及更具有推广性,未来需要加大样本量并在多中心进行研究,甚至可开展NAFLD患者的电子内镜检查以进一步研究证实。
[1]Younossi ZM,Koenig AB,Abdelatif D,et al.Global epidemiology of non-alcoholic fatty liver disease-meta-analytic assessment of prevalence,incidence and outcomes.Hepatology,2016,64(1):73-84.
[2]Loomba R,Sanyal AJ.The global NAFLD epidemic.Nat Rev Gastroenterol Hepatol,2013,10(11):686-690.
[3]曾民德.非酒精性脂肪性肝病:回顾历史,展望未来.实用肝脏病杂志,2016,19(2):129-131.
[4]Volta U,Bonazzi C,Bianchi FB,et al.IgA antibodies to dietary antigens in liver cirrhosis.Ric Clin Lab,1987,17(3):235-242.
[5]Tilg H,Moschen AR.Evolution of inflammation in nonalcoholic fatty liver disease:the multiple parallel hits hypothesis.Hepatology,2010,52(5):1836-1846.
[6]Henao-Mejia J,Elinav E,Jin C,et al.Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity.Nature,2012,482(7384):179-185.
[7]Steinbakk M,Naess-Andresen CF,Lingaas E,et al.Antimicrobial actions of calcium binding leucocyte L1 protein,calprotectin.Lancet,1990,336(8718):763-765.
[8]Vermeire S,Van Assche G,Rutgeerts P.Laboratory markers in IBD:useful,magic,or unnecessary toys.Gut,2006,55(3):426-431.
[9]D'incà R,Dal Pont E,Di Leo V,et al.Can calprotectin predict relapse risk in inflammatory bowel disease&quest.Am J Gastroenterol,2008,103(8):2007-2014.
[10]Kolho KL,Korpela K,Jaakkola T,et al.Fecal microbiota in pediatric inflammatory bowel disease and its relation to inflammation.Am J Gastroenterol,2015,110(6):921-930.
[11]Montalto M,Gallo A,Santoro L,et al.Role of fecal calprotectin in gastrointestinaldisorders.EurRev Med PharmacolSci,2013,17(12):1569-1582.
[12]D'Haens G,Ferrante M,Vermeire S,et al.Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease.Inflamm Bowel Dis,2012,18(12):2218-2224.
[13]Gundling F,Schmidtler F,Hapfelmeier A,et al.Fecal calprotectin is a useful screening parameter for hepatic encephalopathy and spontaneous bacterial peritonitis in cirrhosis.Liver Int,2011,31(9):1406-1415.
[14]Alempijevic T,Stulic M,Popovic D,et al.The role of fecal calprotectin in assessment of hepatic encephalopathy in patients with liver cirrhosis.Acta Gastroenterol Belg,2014,77(3):302-305.
[15]MarieI,LeroiAM,Menard JF,etal.Fecalcalprotectin in systemic sclerosis and review of the literature.Autoimmun Rev,2015,14(6):547-554.
[16]Pendyala S,Neff LM,Suárez-FarinasM,etal.Diet-induced weight loss reduces colorectal inflammation:implications for colorectal carcinogenesis.Am J Clin Nutr,2011,93(2):234-242.
[17]Hardy T,Oakley F,Anstee QM,et al.Nonalcoholic fatty liver disease:Pathogenesis and disease spectrum.Annu Rev Pathol,2016,11(1):451-496.
[18]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南.实用肝脏病杂志,2007,10(1):1-3.
[19]Coorevits L,Baert FJ,Vanpoucke HJ.Faecal calprotectin:comparative study of the Quantum Blue rapid test and an established ELISA method.Clin Chem Lab Med,2013,51(4):825-831.
[20]Mehal WZ.The gut-liver axis:A busy two-way street.Hepatology,2012,55(6):1647-1649.
[21]Miele L,Valenza V,La Torre G,et al.Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease.Hepatology,2009,49(6):1877-1887.
[22]Giorgio V,Miele L,Principessa L,et al.Intestinal permeability is increased in children with non-alcoholic fatty liver disease,and correlateswith liverdisease severity.Dig LiverDis,2014,46(6):556-560.
[23]Gabele E,Dostert K,Hofmann C,et al.DSS induced colitis increases portal LPS levels and enhances hepatic inflammation and fibrogenesis in experimental NASH.J Hepatol,2011,55(6):1391-1399.
[24]Sands BE.Biomarkers of inflammation in inflammatory bowel disease.Gastroenterology,2015,149(5):1275-1285.
[25]Yamamoto T,Shiraki M,Bamba T,et al.Fecal calprotectin and lactoferrin as predictors of relapse in patients with quiescent ulcerative colitis during maintenance therapy.Int J Colorectal Dis,2014,29(4):485-491.

