不同体质量指数糖尿病患者胰岛素分泌及胰岛功能的特点
郭庆妍, 朱翠玲, 卜 乐, 曲 伸, 崔 冉, 尤 慧
(1. 同济大学医学院,上海 200092; 2. 同济大学附属第十人民医院内分泌科-国家标准化代谢性疾病管理中心,上海 200072)
随着人们生活水平提高、生活方式及饮食结构改变,肥胖及2型糖尿病(type 2 diabetes, T2DM)的发病率在全球内呈升高趋势。与其相关的代谢性疾病,如非酒精性脂肪肝、心脑血管疾病、肾脏疾病甚至肿瘤等都迅速增加,给社会造成巨大危害[1-2]。研究[3]表明,肥胖与胰岛素抵抗密切相关。在西方国家,胰岛素敏感性下降或抵抗增强是肥胖的T2DM发病的主要病理机制,而在日本、韩国等国家,胰岛β细胞功能缺陷是非肥胖的T2DM发病的主要病因。然而,在我国的T2DM患者中,不同BMI水平的胰岛素分泌、胰岛素抵抗及胰岛β细胞功能的差异尚不完全清楚。故本研究通过将T2DM患者进行BMI分层并排除了年龄及糖尿病病程的影响,探讨不同BMI水平T2DM患者的胰岛素分泌、胰岛素抵抗及胰岛β细胞功能的差异,为临床达到个体化诊治提供理论依据。
1 资料与方法
1.1 一般资料
本研究共纳入2012年12月至2017年1月在同济大学附属第十人民医院内分泌科住院的T2DM患者377例,其中,男133例,女244例。根据糖尿病病程长短将患者分为3组: A组(<5年,n=157)、B组(5~10年,n=90)、C组(≥10年,n=110)。此外,根据中国成人超重及肥胖症预防控制指南[4],将研究对象分为: 正常组(18.5≤BMI<24,n=132),超重组(24≤BMI<28,n=142),轻度肥胖组(28≤BMI<30,n=38),重度肥胖组(BMI≥30,n=65)。入选标准: (1) 年龄18~65岁;(2) 符合1999年WHO糖尿病诊断标准[5];排除标准: (1) 恶性肿瘤病史;(2) 全身状况较差(严重肝肾功能不全);(3) 严重内分泌疾病及遗传性疾病;(4) 既往曾服用过糖皮质激素或烟酸类药物;(5) 精神疾病不能提供知情同意书者。本研究经同济大学附属第十人民医院伦理委员会批准,所有临床资料及体检资料的收集均征得患者及家属同意(注册号: ChiCTR-OCS-12002381)。
1.2 方法
1.2.1 临床资料收集 询问病史,记录患者的年龄、性别、糖尿病确诊时间、糖尿病病程、既往史及家族史等。测量所有研究对象的身高、体质量、腰围、血压及心率并计算得出BMI。
1.2.2 实验室生化检查 住院次日晨起空腹抽取所有受试者静脉血,用葡萄糖氧化酶法测定FPG,用放射免疫法测定FINS,用全自动生化分析仪测定TC、TG、HDL-C及LDL-C。
1.2.3 口服葡萄糖耐量试验(OGTT)检查 所有受试者清晨抽取空腹血,后行OGTT检查(嘱患者于试验前1日晚餐后禁食,20∶00后开始禁水),分别在进食后0、30、60、120、180min测定患者血糖及胰岛素水平。整个试验过程中,受试者保持安静或休息状态且禁止饮酒、抽烟。
1.2.4 相关参数计算 胰岛素敏感指数(IS)=1/[FPG(mmol/L)×FINS(IU/L)][6],稳态模型评估的胰岛素抵抗指数(HOMA-IR)=FPG(mmol/L)×FINS(IU/L)/22.5[7]。AUCGlu、AUCINS、ΔG30、ΔI30分别代表葡萄糖浓度曲线下面积、胰岛素浓度曲线下面积、OGTT第30min葡萄糖浓度增值和OGTT第30分钟胰岛素浓度增值。采用不规则梯形法计算AUCGlu=0.25×0min时的血糖值+0.75×60min时的血糖值+0.5×120min时的血糖值,AUCINS=0.25×0min时的胰岛素值+0.75×60min时的胰岛素值+0.5×120min时的胰岛素值。评估胰岛β细胞早期分泌功能的早期相胰岛素分泌指数(ΔI30/ΔG30)=(INS30-INS0)/(PG30-PG0)[8]。β细胞功能的评估采用简易葡萄糖处置指数(DI)=ΔI30/ΔG30(AUCINS/AUCGlu)×1/HOMA-IR。
1.3 统计学处理

2 结 果
2.1 研究人群的一般临床资料
本研究共纳入377例符合条件的T2DM患者。其中男性133例,女性244例,平均年龄及BMI差异均无统计学意义(P>0.05)。与女患者相比,男患者的TC、HDL-C、LDL-C、FINS、HOMA-IR及AUCINS显著增加,而IS显著减少(P<0.05),但FPG、TG、DI、AUCGlu、ΔI30/ΔG30及HbA1c差异无统计学意义(P>0.05),见表1。
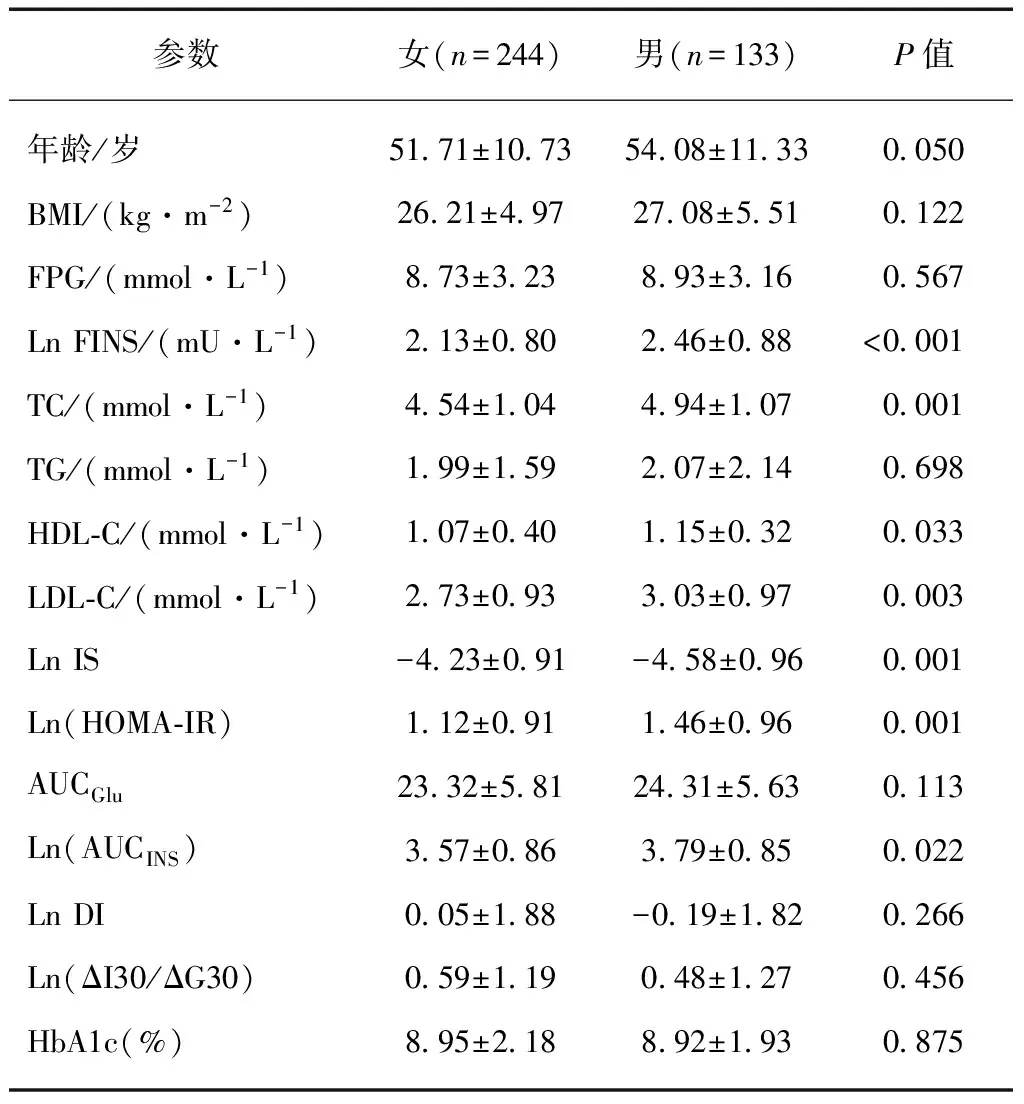
表1 研究人群的一般情况Tab.1 General characteristics of study population
Ln: 经过自然对数转化
2.2 不同糖尿病病程患者血脂及各胰岛参数比较
随糖尿病病程的增加,患者的年龄显著升高,BMI水平显著下降(P<0.001),A、B、C组间FPG、FINS、IS、HOMA-IR、AUCGlu及HbA1c差异无统计学意义(P>0.05);仅C组患者的AUCINS、DI和ΔI30/ΔG30较A、B两组显著减少(P<0.05),而A、B组间差异无统计学意义(P>0.05),见表2。

表2 不同糖尿病病程的糖尿病患者的临床特点Tab.2 Clinical characteristics of diabetic patients with different duration of diabetes
Ln: 经过自然对数转化;与A组相比:aP<0.05,与B组相比:bP<0.05
2.3 不同BMIT2DM患者血脂及各胰岛参数比较
未校正时,患者的年龄随BMI增加显著减少(P<0.001)。与正常组相比,轻、重度肥胖组的TG显著增加(P<0.05),而这两组之间差异不显著;轻度肥胖组HDL-C水平显著低于正常组(P=0.044);TC及LDL-C水平在不同BMI亚组之间差异不显著(P>0.05);重度肥胖组的FINS、HOMA-IR、AUCINS、DI和ΔI30/ΔG30与其余3组相比显著增加,而IS显著降低(均P<0.001);轻度肥胖组的上述指标显著高于正常BMI组和超重组(P<0.05)而IS显著降低;超重组的FINS、HOMA-IR与AUCINS显著高于正常组,而两组的DI和ΔI30/ΔG30差异无统计学意义(P>0.05);4组间FPG、AUCGlu差异无统计学意义(P>0.05),见表3。校正性别、年龄、糖尿病病程及HbA1c后,重度肥胖组的FINS、HOMA-IR、AUCINS仍显著高于其余3组(P<0.05),IS水平仍显著低于其余3组(P<0.001);重度肥胖组的DI高于正常组和超重组,与轻度肥胖组间差异无统计学意义(P>0.05);轻、重度肥胖组ΔI30/ΔG30显著高于正常组和超重组,而轻、重度肥胖组间差异无统计学意义(P>0.05);FPG及AUCGlu在各组间差异无统计学意义(P>0.05),见表4。
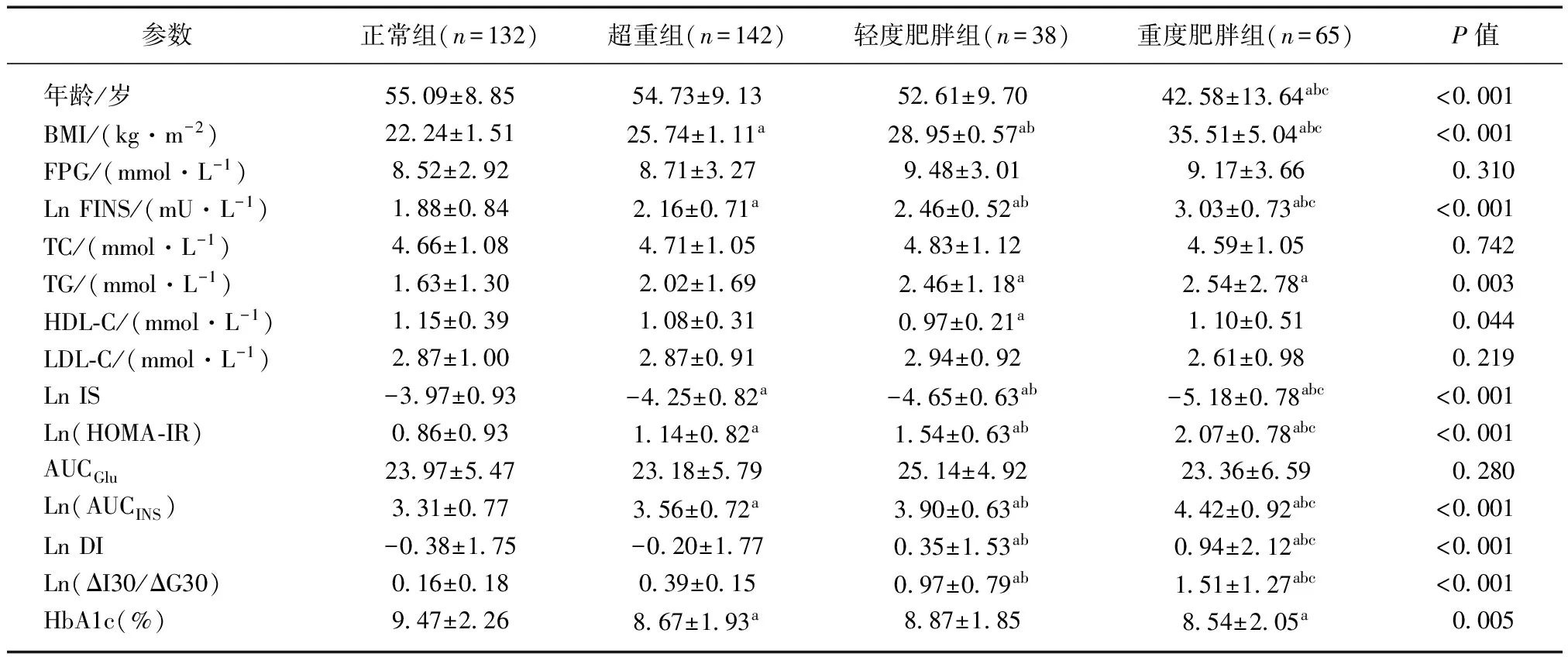
表3 不同BMI亚组的糖尿病患者的临床特点(未校正)Tab.3 Clinical characteristics of diabetic patients in different BMI subgroups(unadjusted)
Ln: 经过自然对数转化;与正常组相比,aP<0.05;与超重组相比,bP<0.05;与轻度肥胖组相比,cP<0.05
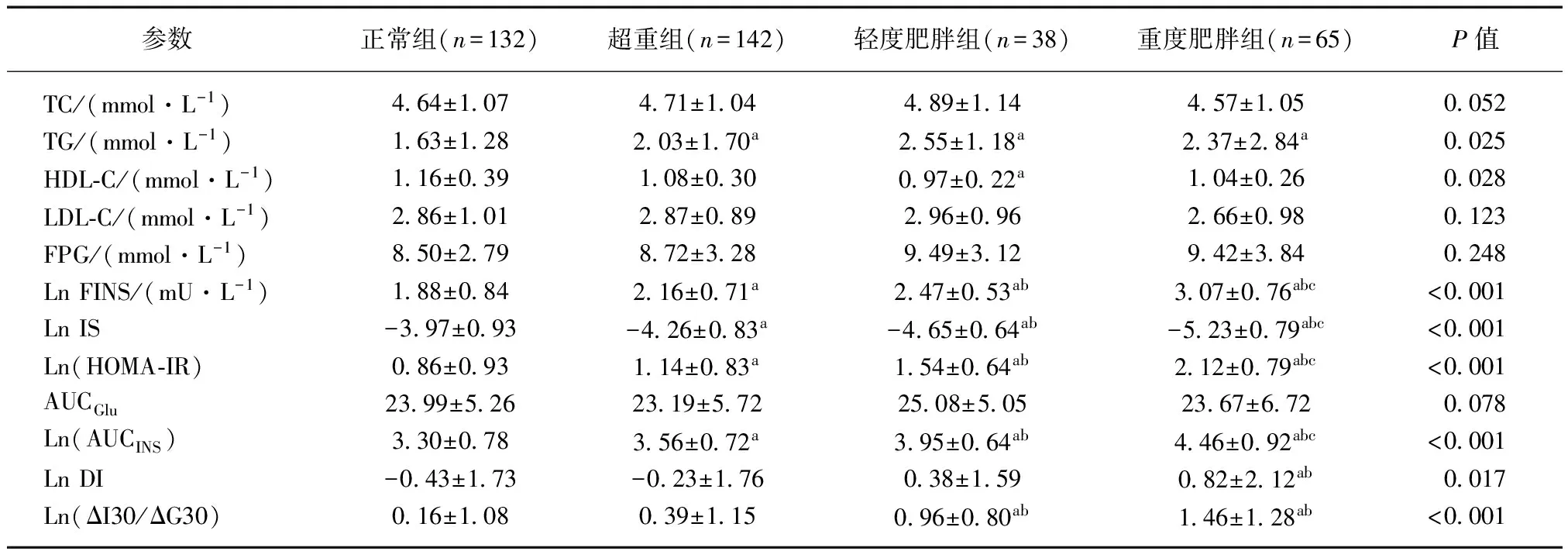
表4 不同BMI亚组的糖尿病患者的临床特点(校正性別、年龄、HbA1c和糖尿病病程)Tab.4 Clinical characteristics of diabetic patients in different BMI subgroups (adjusted for sex, age,HbA1c, and duration)
Ln: 经过自然对数转化;与正常组相比,aP<0.05;与超重组相比,bP<0.05;与轻度肥胖组相比,cP<0.05
2.4 BMI与相关指标的相关性
BMI水平与TG(r=0.178,P=0.001)、FINS(r=0.511,P<0.001)、HOMA-IR(r=0.482,P<0.001)、AUCINS(r=0.503,P<0.001)、ΔI30/ΔG30(r=0.354,P<0.001)、DI(r=0.229,P<0.001)均呈正相关,而与IS及HbA1c呈负相关(r=-0.369,P<0.001;r=-0.143,P=0.006)。BMI与TC、HDL-C、LDL-C、FPG及AUCGlu无相关性,见表5。
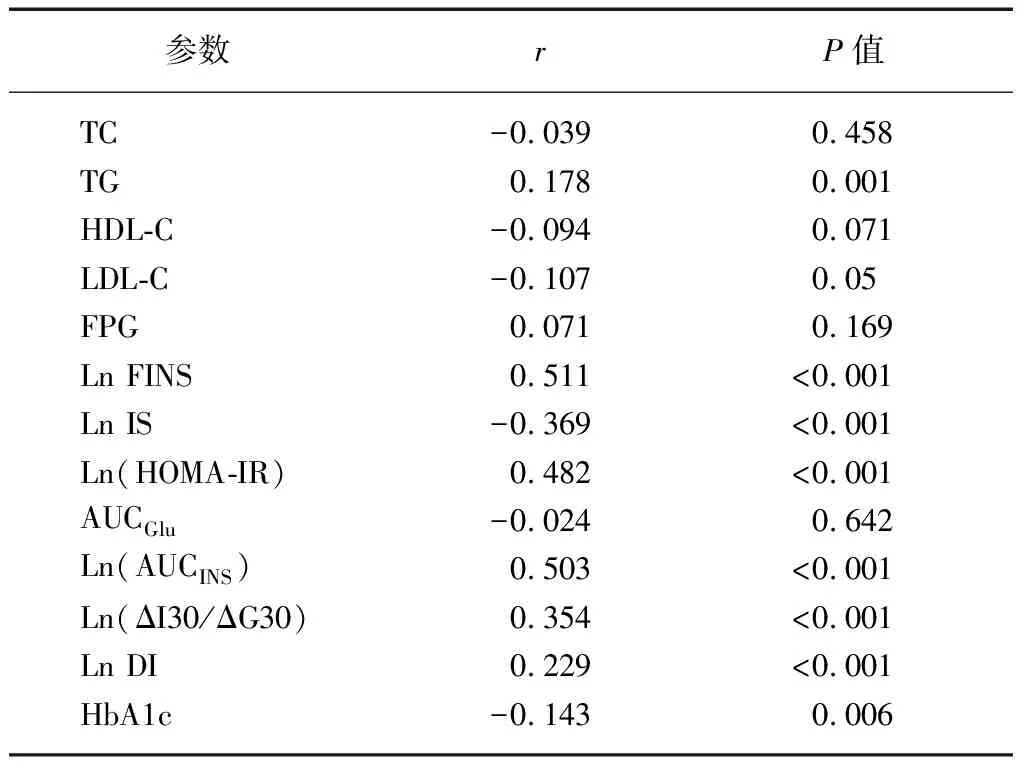
表5 糖尿病患者BMI与相关代谢参数之间的相关性Tab.5 Correlation of BMI with related metabolic parameters in diabetic patients
Ln: 经过自然对数转化
3 讨 论
近年来,肥胖与T2DM的发病率逐年增加,其伴发的并发症更是给人类的健康造成严重威胁。肥胖作为T2DM的独立危险因素,体内有过多的脂肪蓄积,导致过多的游离脂肪酸释放及多种脂肪细胞因子及炎性因子的产生,从而引起胰岛素抵抗[9],而肥胖作为胰岛素抵抗的独立危险因素也已被广泛接受[10]。当胰岛素抵抗程度逐渐加重时,机体为了维持血糖水平的稳定,胰岛β细胞代偿分泌胰岛素的作用,使得胰岛β细胞的负担加重,当β细胞“劳累过度”时,将无法维持血糖在正常水平,最终导致T2DM的发生。胰岛素抵抗和胰岛β细胞功能相对不足是T2DM发病的两大基本因素。在西方国家,肥胖的T2DM患者占90%以上,其中,胰岛素抵抗是其主要发病因素。研究[11]发现,亚洲人群中非肥胖的T2DM患者约占40%,其胰岛β细胞分泌胰岛素的作用缺陷较肥胖的T2DM患者显著。有关我国不同BMI水平的T2DM患者所表现的胰岛素抵抗及胰岛β细胞分泌功能的临床特点方面研究较少,故本研究比较T2DM患者在不同BMI等级下的胰岛素敏感性及胰岛β细胞功能的差异。
本研究结果显示,随着糖尿病病程的增加,只有病程≥10年的患者其负荷后的AUCINS、DI及ΔI30/ΔG30显著减少,而IS无明显变化,说明T2DM患者随病程的延长,其胰岛素水平逐渐减少,胰岛β细胞的分泌功能逐渐减弱而胰岛素敏感性并未随着糖尿病病程的进展而发生显著性改变。这与既往的研究[12]结论一致。此外,本研究对不同BMI的T2DM患者进行了胰岛素敏感性及胰岛β细胞功能的分析比较,结果发现,未校正年龄和糖尿病病程时,重度肥胖组(BMI≥35kg/m2)的TG及HOMA-IR指数较BMI正常组、超重组及轻度肥胖组显著增加,IS显著减少,而反映胰岛分泌功能的FINS、DI、AUCINS及ΔI30/ΔG30显著增加(P<0.001)。由于性别、年龄、糖尿病病程及HbA1c对胰岛素分泌及胰岛β细胞功能评估的影响较大,故本研究将其作为混杂因素进行校正。结果发现,校正后的重度肥胖组的TG、FINS、HOMA-IR、DI、AUCINS及ΔI30/ΔG30仍显著增加,HDL-C及IS显著降低,而FPG及AUCGlu在各组之间差异不显著。此外,本研究中的相关分析结果显示,BMI与FINS、HOMA-IR、DI、AUCINS及ΔI30/ΔG30正相关,与IS及HbA1c负相关。以上结果说明,不同BMI T2DM的胰岛素敏感性及胰岛功能差异,主要表现为肥胖组伴有明显的高胰岛素血症及胰岛素抵抗,且随着BMI增加,胰岛素抵抗程度的加重,胰岛β细胞代偿分泌胰岛素的能力逐渐增强,另一方面也说明了非肥胖的T2DM的胰岛β细胞的分泌功能减弱甚至缺陷,这与研究[10-11]结果相一致。Roy等[13]发现,BMI与胰岛β细胞功能正相关,与胰岛素敏感性负相关。
本研究主要探讨不同BMI水平的T2DM的胰岛素敏感性及胰岛功能的差异,但不同BMI患者尚存在多种激素如脂联素及肠促胰岛素分泌缺陷程度等的不同。此外,Saxena等[14]从基因表达方面深入探讨了BMI对T2DM患者胰岛功能的影响,结果发现非肥胖T2DM患者的胰岛功能缺陷可能与胰岛细胞TCF7L-2及KCNJ11基因多态性有关。故本研究结果尚需进一步的深入研究和探讨。
本研究发现不同BMI的T2DM患者有如下特点: (1) 随着糖尿病病程的增加,患者的胰岛β细胞分泌胰岛素的功能逐渐减弱,而胰岛素敏感性变化不明显;(2) 不论糖尿病病程及年龄,随BMI增加,T2DM患者的胰岛素敏感性显著减弱,但胰岛β细胞分泌胰岛素的能力显著增强,提示胰岛β细胞在肥胖患者有很大的恢复潜能。
[1] JIN M J, CHEN B B, MAO Y Y, et al. Prevalence of Overweight and Obesity and Their Associations with Socioeconomic Status in a Rural Han Chinese Adult Population[J]. PLoS One, 2013,8(11): e79946.
[2] 李惠芝,唐兆生,王华,等.新诊断糖尿病患者肾损害的相关因素分析[J].同济大学学报(医学版),2017,38(1): 80-84.
[3] THOTA P, PEREZ-LOPEZ F R, BENITES-ZAPATA V A, et al. Obesity-related insulin resistance in adolescents: a systematic review and meta-analysis of observational studies[J]. Gynecol Endocrinol, 2017,33(3): 179-184.
[4] 中国肥胖问题工作组数据汇总分析协作组.我国成人体重指数和腰围对相关疾病危险因素异常的预测价值: 适宜体重指数和腰围切点的研究[J].中华流行病学杂志,2002,23(1): 5-10.
[5] ALBERTI K G, ZIMMET P Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus. Provisional report of a WHO Consultation[J]. Diabet Med, 1998,15(7): 539-553.
[6] 周健,贾伟平.应用口服葡萄糖耐量试验评估胰岛B细胞功能及胰岛素敏感性的研究进展[J].上海医学,2008,31(12): 897-900.
[7] ALLARD P, DELVIN E E, PARADIS G, et al. Distribution of fasting plasma insulin, free fatty acids, and glucose concentrations and of homeostasis model assessment of insulin resistance in a representative sample of Quebec children and adolescents[J]. Clin Chem, 2003,49(4): 644-649.
[8] HAFFNER S M, MIETTINEN H, GASKILL S P, et al. Decreased insulin secretion and increased insulin resistance are independently related to the 7-year risk of NIDDM in Mexican-Americans[J]. Diabetes, 1995,44(12): 1386-1391.
[9] MARTINS L M, OLIVEIRA A R S, CRUZ K J C, et al. Obesity, inflammation, and insulin resistance[J]. Gastroenterology, 2014,132(6): 2169-2180.
[10] CZECH M P. Insulin action and resistance in obesity and type 2 diabetes[J]. Nat Med, 2017,23(7): 804-814.
[11] FUNAKOSHI S, FUJIMOTO S, HAMASAKI A, et al. Analysis of factors influencing pancreatic β-cell function in Japanese patients with type 2 diabetes: Association with body mass index and duration of diabetic exposure[J]. Diabetes Res Clin Pract, 2008,82(3): 353-358.
[12] 周迎生,阚瑛,李铭,等.2型糖尿病病程与胰岛β细胞功能的演变[C]//中华医学会第六次全国内分泌学术会议论文汇编.2001: 6-8.
[13] ROY M N, BISWAS K B, SIDDIQUA N, et al. Determinants of insulin secretion and sensitivity in bangladeshi type 2 diabetic subjects[J]. Metab Syndr Relat Disord, 2007,5(3): 275-281.
[14] SAXENA R, GIANNINY L, BURTT N P, et al. Common single nucleotide polymorphisms in TCF7L2 are reproducibly associated with type 2 diabetes and reduce the insulin response to glucose in nondiabetic individuals[J]. Diabetes, 2006,55(10): 2890-2895.

