乙烯利和SNP对花楸树胚胎休眠解除的影响
, ,,
(东北林业大学林学院,林木遗传育种重点实验室,黑龙江 哈尔滨 150040)
花楸树(Sorbuspohuashanensis),为蔷薇科(Rosaceae) 苹果亚科(Maloideae) 花楸属(Sorbus)落叶小乔木,具有很高的观赏价值、经济价值和药用价值[1]。但由于野生花楸树数量较少,种子具有深休眠特性,存在采种困难,种子发芽率低等问题,进而影响苗木的大量快速繁殖[2]。为了解决苗木供应问题,一些学者试图利用嫁接[3]、扦插[4]和组培[5]的方法解决该问题。虽然取得一些进展,但远远不能满足生产的需要。因此实践中花楸树的繁殖仍然以有性繁殖为主[6]。杨玲等研究发现,花楸树种子经过低温2~5 ℃层积才能萌发,新种子解除休眠最短层积时间是120 d,陈种子是105 d[7]。吴超研究发现,花楸树种子胚休眠的主要原因是胚内存在萌发抑制物质,其中之一是ABA;用1 500 mg/L GA3预处理种子结合催芽处理可以促进种子萌发[8]。杨玲等[9]利用200 mg/L 6-BA浸种花楸树种子并且在25 ℃/5 ℃变温下萌发,可以缩短萌发起始时间,提高萌发率和发芽势。
目前国内外关于NO和乙烯对于种子萌发的影响已有报道。最常用到的NO供体是硝普钠(SNP Sodium Nitroprusside)。Bethke[10]利用SNP处理拟南芥(Arabidopsisthaliana)种子能够促进种子解除休眠和萌发。宋要强等研究发现,用10 mmol/L SNP能够有效地打破杜梨(Pyrusbetulifolia)种子的休眠,促进种子萌发,萌发率达到56.7%[11]。说明NO作为一种信号物质参与了种子萌发过程。但是对于NO如何通过信号转导调节胚胎内NO的代谢,促进种子萌发还不清楚。
乙烯是植物五大激素之一,在植物生长发育过程中起调节作用[12]。有研究发现,乙烯对花生(Arachishypogaea)、苹果(Maluspumila)和向日葵(Helianthusannuus)种子的萌发有促进作用[13]。徐小玉等[13]用150 mg/L乙烯利处理美女樱(Verbenahybrid)种子,促进了种子的萌发和幼苗的生长。关于乙烯作用机理,有人认为,乙烯通过抑制脱落酸(ABA)对组织的作用,进而降低ABA的信号在种子休眠中的作用[15];也有人认为,乙烯通过与其受体结合进而促进了赤霉素(GA)的活性[16]。植物种子的萌发是一个复杂的生理过程,受到多种因素的限制。关于NO和乙烯在更多植物种子休眠解除中的作用尚不明确,需要进一步深入研究。
本研究以花楸树成熟合子胚胎为试验材料,利用外源一氧化氮供体硝普钠(SNP)、乙烯利以及SNP与乙烯抑制剂(NBD)组合处理花楸树胚胎,观察并记录胚胎萌发情况,分析各处理对花楸树胚胎萌发的影响,期望找到快速解除花楸胚胎休眠的有效方法,为进一步解释NO和乙烯在解除花楸树种子相互作用机制奠定基础。
1 材料与方法
1.1 萌发试验
1.1.1 试验材料
试验所用材料取自黑龙江省五常市山河屯林业局凤凰山林场(44°15′N,127°54′E)。采种时间2011年9月18日,共采集10株野生成熟花楸母树的种子,将采集后的花楸树果实分别进行人工调制(水选法),将调制后获得的种子置于4 ℃冰箱中留存、备用。
裸胚获得方法:参照杨玲等[17]的研究方法。
1.1.2 萌发试验方法
1) 乙烯利处理试验。将胚胎放在经3 mL(浓度为20 mmol/L)乙烯利溶液浸湿的滤纸上吸胀。对照不经过任何处理,直接在蒸馏水浸湿的滤纸上吸胀。胚胎在培养室内25 ℃、光照(每天16 h光照,光照强度50μmol/(m2·s)下萌发,对照和处理各设3个重复。
2) SNP处理试验。NO熏蒸胚胎方法参照杨玲等[17]的研究方法,将剥离好的胚胎放在一个500 mL的大烧杯里,然后在大烧杯内放置另外一个内含5 mL浓度为2 mmol/L的SNP溶液(现用现配)的小烧杯,最后用保鲜膜将大烧杯的口封好,自然光、室温下熏蒸3 h。处理后,用蒸馏水冲洗胚胎并放置在用蒸馏水浸湿的滤纸上。对照同上,萌发条件同上。
3) SNP与NBD的组合处理试验。将胚胎在2 mmol/L SNP溶液的蒸汽中处理(预处理同上) 3 h后,在含有3 mL(1 mmol/L)NBD溶液浸湿的滤纸上吸胀。对照同上,萌发条件同上。
1.1.3 计算公式
1) 胚胎萌发率(%)=胚胎萌发粒数/供试胚胎总数×100%;
2) 平均发芽速度、发芽指数和发芽势的计算参照《林木种苗学实验教程》[18]。
1.2 数据处理与统计分析
应用Excel 2003软件对文中数据进行处理,数据的方差分析和多重比较应用SPSS 21.0 软件进行,使用Sigma Plot 12.0软件对数据作图。文中的所有表格数据和图中数据均为各重复处理的平均数±标准差。标准差是由每个处理的3次重复测量值计算出来的。采用方差分析评价试验中各影响因素的作用,并在p=0.05水平上进行了显著性检验。平均数间统计学差异用邓肯多重比较法在p=0.05显著性水平上检验。
2 结果与分析
2.1 乙烯利和SNP对花楸树胚胎萌发的影响
不同处理对花楸树胚胎萌发率的影响如图1所示。由图1可知,不同处理的花楸树胚胎萌发率呈逐渐增加趋势,至培养第7天和第8天保持不变,且各处理与对照均有显著性差异(p<0.05)。乙烯利处理后的胚胎在培养的第2天即可萌发,早于其他处理(第3天开始萌发),且萌发率显著高于其他处理。在第7天时,乙烯利处理的胚胎萌发率达到最大值(75.56%),比对照高出41.67%;而SNP与NBD的处理组合萌发百分率(31.11%)最低。
2.2 乙烯利和SNP对花楸树胚胎平均发芽速度的影响
平均发芽速是反应种子发芽快慢的指标。由图2可知,各处理的平均发芽速度是呈先增加后降低的趋势,且各处理与对照均有显著性差异(p<0.05)。乙烯利处理花楸树胚胎平均发芽速度在第1天以后就显著高于其他处理,且在第4天时,平均发芽速度达到最大值(0.128),比对照高出155.56%。SNP与NBD处理组合的平均发芽速度在第6天达到最大值(0.052),比对照低46.43%。

图1 乙烯利和SNP对花楸树胚胎萌发率的影响
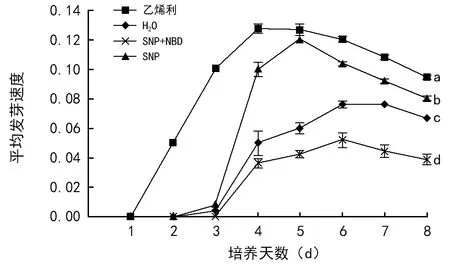
图2 乙烯利和SNP对花楸树胚胎平均发芽速度的影响
2.3 乙烯利和SNP对花楸树胚胎发芽指数的影响
由图3可知,各处理的发芽指数呈逐渐增加趋势,至培养第7天和第8天保持不变,且各处理与对照均有显著性差异(p<0.05)。乙烯利处理花楸树胚胎发芽指数从第1天开始迅速上升,在第7天时达最大(6.40),比对照高97.72%。而SNP与NBD处理组合的发芽指数在第6天时达最大(1.98),比对照低63.31%。

图3 乙烯利和SNP对花楸树胚胎发芽指数的影响
2.4 乙烯利和SNP对花楸树胚胎发芽势的影响
各处理对花楸树胚胎发芽势的影响如图4。由图4可知,与对照均有显著性差异。SNP处理的胚胎发芽势最大(25.56%),显著高于其他处理。SNP与NBD处理组合的发芽势最低(14.44%),比对照低30.77%。

图4 乙烯利和SNP对花楸树胚胎发芽势的影响
3 结论与讨论
3.1 外源乙烯对花楸树胚胎萌发的影响
种子萌发是生物体内一系列化学反应和激素含量变化等复杂生理变化产生的结果。乙烯利是农业生产中常用的植物生长调节剂,乙烯在植物生长发育过程中具有重要作用。研究结果发现,乙烯利处理后的花楸树胚胎的萌发率、平均发芽速度、发芽指数、发芽势显著高于对照。乙烯利处理花楸树胚胎2 d后即可萌发,早于其他处理(第3天开始萌发),并且在第7天时,萌发百分率达到最高(75.56%),比对照高出41.67%。结果表明乙烯对于种子萌发具有促进作用。这与莫云荣等[19]研究结果一致。有研究发现,乙烯和ABA在种子萌发和休眠过程中存在相互拮抗作用,ABA促进和维持种子休眠,抑制种子萌发[20-21]。乙烯利处理促进种子萌发的原因可能是外源添加乙烯增加了乙烯的含量,抵消了种子内源激素ABA的作用,进而促进了种子的萌发。但Leubner-Metzger G等研究发现,乙烯并不能解除烟草(Nicotianatabacum)种子休眠,促进其萌发[22]。这点与本试验结果不一致,原因是烟草种子休眠方式与花楸树胚胎不同。另外,莫云荣等研究发现,乙烯对辣椒(Capsicumannuum)种子萌发的效果具有浓度效应,高质量浓度的乙烯对种子的萌发有抑制作用,低质量浓度的乙烯对种子萌发有促进作用[19]。乙烯虽然在种子萌发过程中具有重要的作用,但是乙烯的信号转导途径和作用机制还不清楚。
3.2 外源NO对花楸树胚胎萌发的影响
NO是一种水溶性和脂溶性的气体小分子。NO作为一种关键的信号分子在植物生命活动和新陈代谢过程中发挥作用[23]。本研究发现,SNP处理后的花楸树胚胎的萌发率、平均发芽速度、发芽指数和发芽势显著高于对照。SNP处理增加了花楸树胚胎的萌发百分率,比对照高出20.83%。说明NO对花楸树胚胎萌发具有促进作用。这与SNP处理拟南芥(Arabidopsisthaliana)种子[24]、苹果(Maluspumila)种子[25],打破休眠促进萌发的结果相一致。杨玲等研究发现,SNP预处理花楸树胚胎可以削弱ABA对胚胎萌发的抑制作用[17]。推测SNP通过产生细胞内NO作为重要的信号分子参与了ABA的代谢活动。SNP与NBD处理组合萌发百分率(31.11%)最低,NBD作为一种乙烯受体抑制剂,抑制内源乙烯与其受体的结合,进而抑制乙烯对胚胎萌发的作用。SNP与NBD的处理组合对花楸树胚胎的萌发效果显著低于对照,这说明SNP产生的NO 不能缓解NBD对花楸萌发的抑制作用,推测NO的作用位点在NBD作用位点的上游。Gniazdowska 等研究发现,NO通过产生乙烯来打破苹果种子胚的休眠,NO清除剂可以逆转这种作用,乙烯合成抑制剂(AOA)可使NO处理过的胚不萌发,NO在乙烯的上游起作用[26]。这与本研究结果一致。杨玲等研究发现,SNP短期预处理可以促进花楸树胚胎的萌发,但是NO对于花楸树胚胎的萌发具有浓度效应,过多的NO 会抑制胚胎萌发,NO对花楸树胚胎萌发具有浓度效应[17]。这与乙烯的作用效果相似。可能是NO通过产生乙烯,乙烯与其受体结合抑制ABA作用,进而调控种子的萌发,并且NO位于乙烯与ABA的上游。关于NO的作用机制还需进一步的研究。
乙烯和NO作为植物体内重要的激素和信号分子在植物生长发育过程中起重要的调节作用。通过本研究可知: 1) 适宜浓度的乙烯和NO对花楸树胚胎萌发具有促进作用;2) SNP处理不能缓解NBD对花楸树胚胎萌发的抑制作用。证明NO的作用位点在NBD作用位点的上游。本研究对NO和乙烯促进花楸树胚胎萌发机理问题进行了初步探索,为进一步解释NO和乙烯在解除花楸树种子相互作用机制奠定了基础。
[1]周以良,董世林,聂绍荃.黑龙江树木志[M].哈尔滨:黑龙江科学技术出版社,1986:334-335.
[2]沈海龙,杨玲,张建瑛,等.花楸树种子休眠影响因素与萌发特性研究[J].林业科学,2006,42(10):133-138.
[3]肖乾坤.花楸树种子变异、苗期生长变异及无性繁殖[D].中国林业科学研究院,2010:43-46.
[4]庄凤君,王继丰,王臣.国产及引进花楸属植物研究与应用进展[J].国土与自然资源研究,2008,30(1):94-96.
[5]杨玲,沈海龙,刘春苹,等.花楸合子胚诱导体细胞胚胎发生研究[J].植物研究,2010,30(2):174-179.
[6]张秋菊,肖智,汪英侠.花楸种子生物学特性研究进展[J].江苏农业科学,2013,41(4):177-179.
[7]杨玲,刘春苹,沈海龙.低温层积时间和发芽温度对花楸种子萌发的影响[J].种子,2008,27(10):20-22.
[8]吴超.花楸树群体遗传结构及种子催芽技术研究[D].中国林业科学研究院,2007:58-60.
[9]杨玲,崔晓涛,沈海龙.外源激素与温度对花楸树种子萌发的影响[J].植物生理学报,2009,45(6):555-560.
[10]Libourel I G,Bethke P C,De M R,et al.Nitric oxide gas stimulates germination of dormant Arabidopsis seeds:use of a flow-through apparatus for delivery of nitric oxide.[J].Planta,2006,223(4):813-20.
[11]宋要强,屠荫华,惠伟.一氧化氮在打破杜梨种子休眠中的作用[J].四川林业科技,2015,36(5):94-97.
[12]李振国,倪君蒂,余叔文.乙烯消减盐渍胁迫对苜蓿种子萌发的抑制作用[J].植物生理学报,1995,31(1):50-56.
[13]徐小玉,张凤银,曹阳.赤霉素和乙烯利对美女樱种子萌发及幼苗生长的影响[J].种子,2014,33(6):72-74.
[14]Jan K,Ewa K.Ethylene in seed dormancy and germination[J].Physiologia Plantarum,1997,101(101):720-726.
[15]Kucera B,Cohn M A,Leubnermetzger G.Plant hormone interactions during seed dormancy release and germination[J].Seed Science Research,2005,15(4):281-307.
[16]Kępczyński J,Bihun M,Kępczyńska E.Implication of Ethylene in the Release of Secondary Dormancy inAmaranthuscaudatusL.Seeds by Gibberellins or Cytokinin[J].Plant Growth Regulation,2006,48(2):119-126.
[17]杨玲,王佳男,边磊,等.外源NO对花楸树胚胎萌发和幼苗发育初期活性氧积累的影响[J].林业科学,2013,49(6):60-67.
[18]杨玲,张鹏.林木种苗学实验教程[M].哈尔滨:东北林业大学出版社,2011:85-87.
[19]莫云容,张培欣,朱海山,等.外源乙烯对不同品种辣椒种子萌发的影响[J].云南农业大学学报,2016,31(2):268-273.
[20]Hwm H.A critical update on seed dormancy.I.Primary dormancy.[J].Seed Science Research,1995,5(2):61-73.
[21]Kermode A R.Role ofAbscisicAcidin Seed Dormancy[J].Journal of Plant Growth Regulation,2005,24(4):319-344.
[22]Leubner-Metzger G,Petruzzelli L,Waldvogel R.Ethylene-responsive element binding protein (EREBP) expression and the transcriptional regulation of class I β-1,3-glucanase during tobacco seed germination[J].Plant Molecular Biology,1998,38(5):785-95.
[23]邵瑞鑫,李蕾蕾,郑会芳,等.外源一氧化氮对干旱胁迫下玉米幼苗光合作用的影响[J].中国农业科学,2016,49(2):251-259.
[24]Liu Y,Shi L,Ye N,et al.Nitric oxide-induced rapid decrease ofAbscisicAcidconcentration is required in breaking seed dormancy in Arabidopsis.[J].New Phytologist,2009,183(4):1 030-1 042.
[25]Gniazdowska A,Krasuska U,Bogatek R.Dormancy removal in apple embryos by nitric oxide or cyanide involves modifications in ethylene biosynthetic pathway.[J].Planta,2010,232(6):1 397-1 407.
[26]Gniazdowska A,Dobrzyńska U,Babańczyk T,et al.Breaking the apple embryo dormancy by nitric oxide involves the stimulation of ethylene production[J].Planta,2007,225(4):1 051-1 058.
——致秋天的花楸树

