具有抑制糖苷酶和胰蛋白酶双重活性的亚麻多肽的大肠杆菌重组表达及其活性分析
吴莎莎,王蕾,石亚伟
(山西大学 生物技术研究所,教育部化学生物学与分子工程重点实验室,山西 太原 030006)
亚麻 (LinumusitatissimumL.) 是一种亚麻科亚麻属的一年生草本植物,在我国西北及华北地区种植广泛,其种子主要用于榨油。亚麻种子含有很多生物活性物质,如α-亚麻酸、亚麻胶、木脂素及亚麻蛋白等。亚麻种子中木脂素及α-亚麻酸具有降血糖作用[1-2],而其中的蛋白主要为球蛋白和白蛋白,具有很高的食用、医用价值[3]。
胰蛋白酶抑制剂(Trypsin inhibitor,TI) 是一类可以抑制胰蛋白酶水解活性的小分子多肽,属于丝氨酸蛋白酶抑制剂,它的传统来源为豆科植物和动物肝脏[4],Bowman-Birk于1944年首次从大豆中提取出大豆胰蛋白酶抑制剂(BBI)[5]。胰蛋白酶抑制剂具有广泛生物学活性和作用,在疾病的诊断、治疗和预防方面显示出了广阔的应用前景。在临床上用于治疗急性胰腺炎、防止脑水肿、脑缺血、脑血管痉挛等,目前还发现具有抗病毒、抗肿瘤、抗真菌和降糖等重要功效[6]。
α-葡萄糖苷酶抑制剂能够有效抑制α-葡萄糖苷酶的活性,使得糖类难以水解为单糖,从而控制血糖水平[7]。自然界内广泛存在的天然α-葡萄糖苷酶抑制剂以黄酮类、酸类物质居多,此外还有皂苷类、多糖类及多肽类等[8],目前有关天然多肽类α-葡萄糖苷酶抑制剂的报道甚少。
本课题组前期在以酵母α-葡萄糖苷酶作为分子靶标,从亚麻油渣蛋白中筛选抑制该分子靶标的活性多肽,结果分离到兼具α-葡萄糖苷酶抑制活性与胰蛋白酶抑制活性的多肽[9],经质谱鉴定,其属于已经报道的亚麻胰蛋白酶抑制剂(LinumusitatissimumTypsin Inhibitor,LUTI)[10]。目前已经报道过的能够同时抑制两种不同类型酶的抑制剂很少,Khanna等从苦瓜和苦瓜籽中分离纯化得到一种具有显著降糖活性多肽P2[11],Gadge等于2015年从鹰嘴豆中提出一种可以同时抑制α-淀粉酶和胰蛋白酶活性的抑制剂[12],闫永飞等从莜麦中分离得到了一种可以抑制α-淀粉酶和胰蛋白酶活性的抑制剂[13]。
本文将化学合成的亚麻双功能多肽基因在大肠杆菌中进行重组表达,并分析重组LUTI(rLUTI)对双酶抑制活性。利用基因定点突变获得rLUTI的C4/A,C49/A,C4、49/A突变体,通过对突变体的抑制活性测定,结合CD谱变化的方法探究C4和C49位点与其双酶抑制活性的关系。
1 材料与方法
1.1 实验材料
BamHⅠ、EcoRⅠ限制性内切酶、T4 DNA ligase、DNA Marker、Protein Maker均购自北京全氏金公司;TaqDNA Ploymerase为Fermentas公司产品;氨苄青霉素(Amp)、异丙基硫代半乳糖苷(IPTG)、胰蛋白胨、酵母提取物均为上海生工生物工程股份有限公司产品;蛋白分离纯化材料:GST亲和柱、Sephacryl S-200购自GE公司;N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(BAPNA)、对硝基苯胺(pNA)、pNPG均购自Sigma公司;牛胰蛋白酶(Trpysin)为 索莱宝公司产品;二硫苏糖醇(DTT) 购自上海励瑞生物科技有限公司。其他试剂均为化学分析纯。质粒pGEX-6p-1,克隆菌株E.coliDH5a,表达菌株E.coliBL21(DE3),均为本实验室保存;电泳纯的天然亚麻双功能多肽,由本实验室制备;SPF级雄性SD大鼠,体重220 g,由山西大学生命科学院所提供。
1.2 重组质粒的构建
以化学合成的亚麻双功能多肽基因为模板,利用正向引物5’-ATGGATCCAGCCGTCGTTGCCCG-3’和反向引物5’-ATGAATTCGGTAATATGCGGCAC-3’,进行PCR扩增。PCR反应条件:95℃ 5 min,95℃ 30 s,53℃ 30 s,72℃ 40 s,72℃ 10 min,30个循环;PCR产物经以BamHⅠ和EcoRⅠ酶切位点克隆于pGEX-6p-1原核表达载体中,构建重组质粒pGEX-6p-1-LUTI,然后将重组载体转入E.ColiDH5a感受态细胞中,进行菌落PCR筛选,阳性克隆经测序分析确定。
根据rLUTI的基因序列,分别设计pGEX-6p-1-LUTIC4/A、pGEX-6p-1-LUTIC49/A、pGEX-6p-1-LUTIC4、49/A的突变引物,以pGEX-6p-1-LUTI质粒为模板,分别利用以下突变引物C4/A:5’-ATGGATCCAGCCGTCGTGCCCCGGGCAAA-3’和5’-ATGAATTCGGTAATATGCGGCAC-3’以及C49A:5’-ACCAAAGATTTTCGTGCCGATCGTGTGTGGGTGATT-3’和5’-GCACGAAAATCTTTGGTCATCGCG-CTGCCTTC-3’。根据FastMutagenesis System说明书进行操作,构建重组质粒pGEX-6p-1-C4/A、pGEX-6p-1-C49/A和pGEX-6p-1-C4,49/A。
1.3 重组及突变型 LUTI融合蛋白的表达与纯化
将含有pGEX-6p-1-LUTI或pGEX-6p-1-C4/A或pGEX-6p-1-C49/A或pGEX-6p-1-C4,49/A的E.coliBL21(DE3)在含有抗生素(25 mg/L 氨苄青霉素)的LB培养基中37℃培养,180 r/min震荡培养OD600=0.6~0.7时,加入IPTG使其终浓度达到0.5 mmol,16℃诱导表达14 h,8 000 rpm离心收集菌体。用30 mL pH 7.3 PBS缓冲液重悬菌体,冰上超声裂解菌体,13 000 r/min离心30 min,收集上清并上样至经pH 7.3 PBS溶液平衡好的GST-Sepharose4B亲和层析,收集Elution样品浓缩至2 mL后,再次上样至相同缓冲液平衡的Sephacryl S-200凝胶柱进一步纯化,收集目的蛋白,过滤除菌后保存于-80℃,12%(质量体积百分比,g/mL) SDS-PAGE分析,检测目的蛋白(见图1)。
纯化的GST-LUTI及其他GST-LUTI的突变体,经本实验室纯化的Prescission Protease,以1/50质量比在室温条件下切割4 h,然后将蛋白混合液再次上样于GST-Sepharose4B亲和层析,去除GST标签,收集穿透即重组LUTI样品,15% SDS-PAGE电泳鉴定重组LUTI蛋白。
1.4 亚麻双功能多肽对α-葡萄糖苷酶的抑制活性测定
α-葡萄糖苷酶抑制活性测定以Johji Yamahara的方法为基础稍加改进后进行测定[14],以4-硝基苯-β-D-吡喃半乳糖苷(pNPG)为底物,取一定量的亚麻双功能多肽与37.5 μLpNPG溶液(2×10-3mol/L)混合后,用0.2 mol/L磷酸缓冲液中(pH 6.8)补足体积至450 μL,于37℃水浴10 min后,加入50 μL来源于酵母的α-葡萄糖苷酶(0.5 U/mL),37℃反应10 min,加入2.5 mL 0.1 mol/L的Na2CO3溶液(pH 10.95)终止反应,在410 nm处测定数值,以pH 6.8磷酸钾缓冲液为空白对照[9]。并计算亚麻双功能肽对α-葡萄糖苷酶抑制率。
将雄性SD大鼠禁食24 h,脱臼处死后,取其小肠轻挤排除内容物后,于冰板上剪开后刮取肠黏膜,加入五倍量4℃的pH 6.8磷酸盐缓冲液匀浆后于4℃,5 000 r/min离心20 min,取上清(上清液中含有α-葡萄糖苷酶),浓度为10.63 mg/mL,-20℃保存备用[15]。
抑制率(%)=(Δ空白组410-Δ实验组410)/Δ空白组410×100%
1.5 亚麻双功能多肽对胰蛋白酶的抑制活性测定
测定方法参照Erlanger[16]的方法,通过底物 BAPNA(N-Benzoyl-L-Arginine P-Nitroanilide)的水解速率测定。在3.5 mL活性测定体系中(50 mmol/L Tris-HCl缓冲液,pH 8.0,含10 mmol/L CaCl2),抑制剂样品和0.4 mL牛胰蛋白酶(76.79 μmol/L,用0.001 mol/LHCl溶液配制)于37℃恒温水浴保温10 min,再加入2 mL BAPNA溶液(1 149.74 μmol/L,用少量DMSO溶液溶解后,加入0.05 mol/LTris-HCl,0.02 mol/L CaCl2·2H2O,pH 8.0的缓冲液补足2 mL),在37℃反应10 min后,加入0.5 mL 33%的醋酸溶液终止反应,在410 nm的波长下测定反应体系中底物的水解产物p-Nitroanilide(pNA)所产生的吸收值。对照反应体系以相同体积的测活缓冲液代替抑制剂样品溶液,并计算LUTI对胰蛋白酶抑制率,公式同1.4。
1.6 rLUTI及其突变体对两种酶抑制的IC50值测定
以pNPG为底物,将rLUTI及各突变型rLUTI设置终浓度为2、4、6、8、12、20 μmol/L,根据1.4的测活方法,检测在测活体系中不同浓度抑制剂作用下α-葡萄糖苷酶反应的吸光值,利用SPSS软件计算rLUTI及其突变体对α-葡萄糖苷酶的IC50值大小。
以BAPNA为底物,将rLUTI及各突变型rLUTI设置终浓度为0.2、0.4、0.8、1.2、1.6、2 μmol/L,根据1.5的测活方法,检测在测活体系中不同浓度抑制剂作用下胰蛋白酶反应的吸光值,利用SPSS软件计算rLUTI及其突变体对胰蛋白酶的IC50值大小。
1.7 圆二色谱分析
取100 μL各种多肽样品,浓度均为0.25 mg/ml,缓冲液为0.01 mol/LPBS(pH 7.3),0.5 mm的石英样品池在Chirascan CD Spectrometer室温下,光谱值范围为190~260 nm,将光谱扫描模式设置为Spectrum Mode,测量时带宽为1.0 nm,单点扫描时间为0.5 s,每个样品重复扫描3次。同样实验条件下测定相同浓度的缓冲溶液的圆二色谱,取信号平均值并基线校正。通过CDNN软件对圆二色谱进行二级结构分析。
2 结果与讨论
2.1 GST-LUTI及其突变型GST-LUTI融合蛋白的表达与纯化
分别将重组质粒pGEX-6p-1-LUTI、pGEX-6p-1-C4/A、pGEX-6p-1-C49/A、pGEX-6p-1-C4,49/A在工程菌E.coli BL21菌株经IPTG诱导,获得LUTI及其突变体的可溶性表达。将分离纯化过程的每一步骤样品进行15% SDS-PAGE分析。结果表明:重组型及突变型GST-LUTI蛋白的分子量约为36 kDa,与计算结果相符。GST-LUTI及突变型GST-LUTI融合蛋白溶液中经GST-Prescission Protease切割后经GST-Spharose4B 亲和柱和Sephacryl S-200凝胶柱纯化获得电泳纯的8 kDa的LUTI及其突变体蛋白(图1)。

1.Protein Maker,2.Expression products,3.Supernatant,4.Preciptation,5.Flow-through,6.Elution fraction,7.GST-LUTI with Prescission Protease,8.rLUTIFig.1 15% SDS-PAGE analysis of rLUTI1.蛋白Maker,2.全菌样品,3.上清液样品,4.沉淀样品,5.GST-Sepharose4B柱穿透样品,6.GST-Sepharose4B柱洗脱样品,7.GST-LUTI被Prescission Protease切割后样品,8.rLUTI图1 15% SDS-PAGE分析rLUTI的纯化
2.2 天然LUTI、GST-LUTI以及rLUTI对两种酶的抑制活性测定
利用1.4和1.5的方法,比较天然LUTI、GST-LUTI以及rLUTI对胰蛋白酶和酵母以及大鼠小肠的α-葡萄糖苷酶都有抑制作用,结果显示,rLUTI对两种酶的抑制活性明显高于天然LUTI和GST-LUTI(图2)。利用新鲜提取的大鼠小肠表面α-葡萄糖苷酶抑制活性检测发现rLUTI对大鼠小肠α-葡萄糖苷酶的抑制活性高于天然LUTI和GST-LUTI(图3)。

Fig.2 Inhibition of trypsin and α-glucosidase by LUTI、GST-LUTI and rLUTI图2 LUTI、GST-LUTI以及rLUTI对胰蛋白酶和酵母α-葡萄糖苷酶的抑制活性

Fig.3 Inhibition of α-glucosidase derived from mammalian(rat intestine) by LUTI、GST-LUTI and rLUTI图3 亚麻双功能多肽对大鼠小肠表面α-葡萄糖苷酶抑制活性
2.3 二硫苏糖醇及过氧化氢对rLUTI抑制活性变化
rLUTI的二级结构以α螺旋、β折叠为主,当在rLUTI蛋白溶液中加入终浓度为1 mmol/LDTT后,与未加入DTT的样品相比较,发现rLUTI对α-葡萄糖苷酶的抑制活性明显下降,由88.9%降为53.7%,而在还原型的rLUTI中加入终浓度为0.5 mmol/LH2O2后,发现其对于α-葡萄糖苷酶的抑制活性明显上升(图4)。
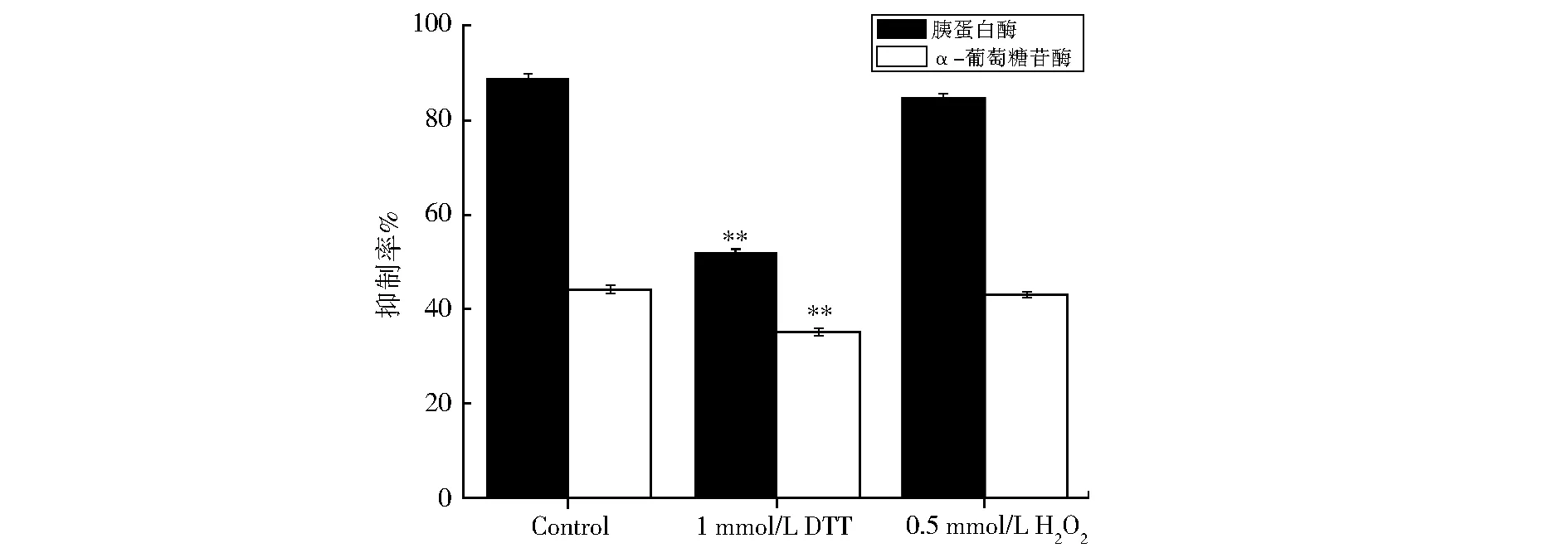
Fig.4 Effect of DTT and H2O2 on trypsin inhibitory activity and α-glucosidase inhibitory activity of rLUTI图4 DTT和H2O2对rLUTI两种酶抑制活性的影响
2.4 天然LUTI、GST-LUTI、rLUTI及其突变体IC50值比较和圆二色谱分析
如表1所示,天然LUTI、GST-LUTI、rLUTI及其突变体C4/A对α-葡萄糖苷酶和胰蛋白酶均有一定的抑制活性,rLUTI对胰蛋白酶的抑制活性明显强于天然LUTI,C49残基在保持LUTI的胰蛋白酶抑制活性中发挥关键作用,一旦突变其胰蛋白酶抑制活性基本丧失。rLUTI的α-葡萄糖苷酶的抑制活性明显强于天然LUTI及融合表达的GST-LUTI,C4和C49对rLUTI的糖苷酶抑制活性的贡献较小。
2.5 圆二色谱分析
对rLUTI及其突变体进行圆二色谱测定,结果显示在208 nm附近均有负峰,以rLUTI作为对照,rLUTIC4/A以及rLUTIC4、49/A曲线上升,同时α-螺旋的比例分别下降5.9%、6.2%,β-折叠比例分别上升16.2%、7.8%,而rLUTIC49/A的α-螺旋和β-折叠的比例基本没有变化(图5,表2)。可见,rLUTI第4位半胱氨酸对于维持其二级结构的稳定性发挥着重要作用。
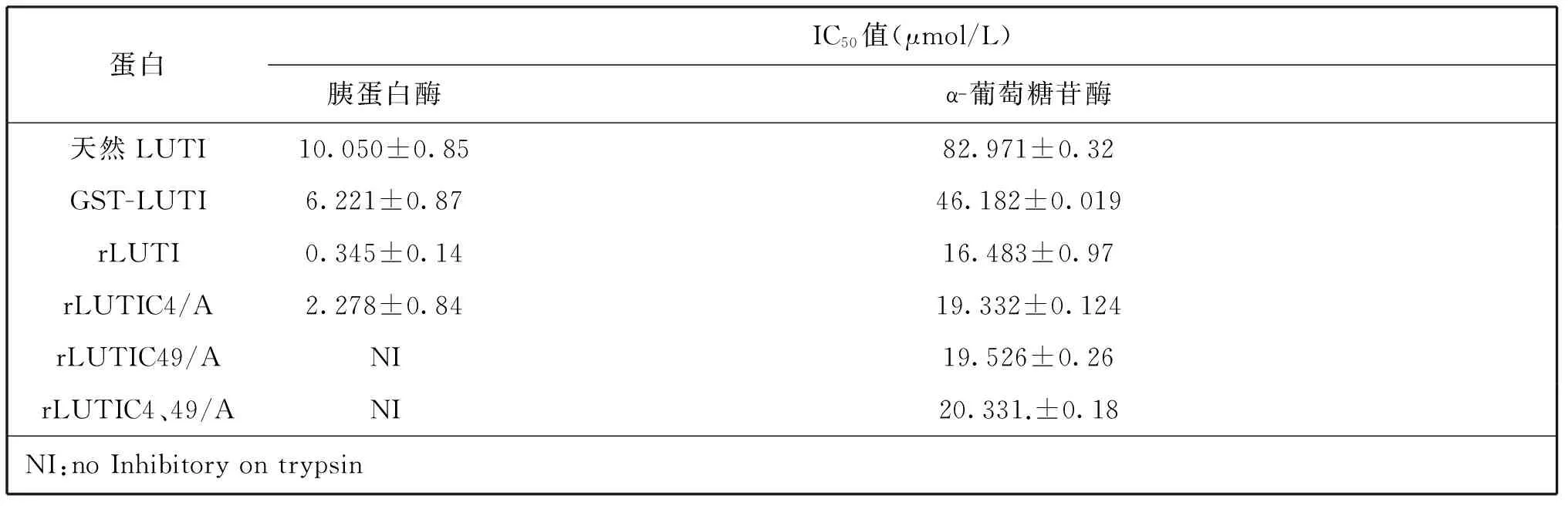
表1 天然LUTI、GST-LUTI及rLUTI及其突变体对α-葡萄糖苷酶和胰蛋白酶的IC50值比较
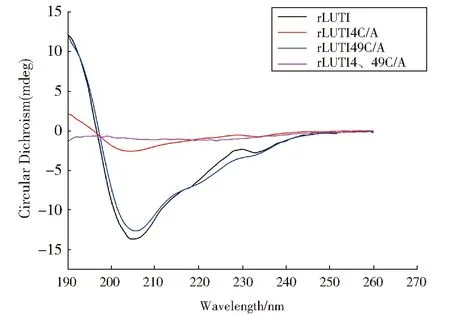
Fig.5 Analysis the secondary structure of rLUTI and its mutants by circular dichroism图5 圆二色谱对rLUTI及突变型rLUTI进行二级结构分析

蛋白二级结构中各组分α-Helix%β-sheet%β-turn%Randomcoil%rLUTI14.028.523.733.0rLUTIC4/A8.144.719.432.7rLUTIC49/A14.927.923.133.3rLUTIC4、49/A7.836.319.835.0
3 结论
本实验室首次从亚麻籽中获得具有α-葡萄糖苷酶有抑制活性的Potato Ⅰ型胰蛋白酶抑制剂[9]。亚麻双功能多肽与苦荞中胰蛋白酶抑制剂(rBTI)以及苦瓜中胰蛋白酶抑制剂(BGTI)空间结构较为相似。但均未报道苦荞或苦瓜中的胰蛋白酶抑制具有降糖活性[17-18],苦瓜的胰蛋白酶抑制剂可以提升苦瓜降糖肽对糖尿病小鼠的降糖功效[19]。α-葡萄糖苷酶和胰蛋白酶属于两种完全不同的酶,抑制两种不同类型酶的抑制剂在自然界中并不常见,其具体的抑制机制有待进一步深入研究。为此我们化学合成了这一段编码亚麻降糖多肽的基因序列,克隆到不同的原核表达载体上进行重组表达。由于天然LUTI含有一对二硫键,原核表达极易形成包涵体。最终我们将LUTI基因构建到pGEX-6p-1原核表达载体上,利用GST标签蛋白实现了LUTI的可溶性表达,为LUTI的进一步研究奠定基础。
比较rLUTI与天然LUTI对α-葡萄糖苷酶抑制活性的IC50值,揭示天然LUTI的IC50值为 82.971 μmol/L,rLUTI的IC50值为16.483 μmol/L;天然LUTI对胰蛋白酶的IC50值为10.050 μmol/L,rLUTI为IC50值为0.345 μmol/L,说明rLUTI的两种酶的抑制活性明显高于天然LUTI。rLUTI相比于天然LUTI而言,其N端存在GST-LUTI经GST-Prescission Protease切割后残留的Gly-Pro-Leu-Gly-Ser五个氨基酸的肽段,这五个氨基酸对于rLUTI双酶抑制活性的升高是否有影响有待进一步研究。
从LUTI的一级结构来看,第4位和第49位各有一个半胱氨酸,并且在LUTI蛋白中形成一对二硫键,对维持蛋白分子的二级结构至关重要[9-10]。我们对LUTI的这两个半胱氨酸残基的定点突变结果,揭示它们在抑制α-葡萄糖苷酶以及胰蛋白酶活性中各自发挥的作用存在明显的差异,二硫键的存在是维持胰蛋白酶抑制活性的一个因素。但二硫键的缺失,诸如Cys4突变为丙氨酸,尽管二级结构变化明显,但并不会引起两种抑制活性的太大变化,但在维持胰蛋白酶抑制活性方面Cys49却发挥至关重要的作用。在维持抑制α-葡萄糖苷酶活性方面,二硫键存在与否,以及两个位点突变均显得不那么重要。由此揭示LUTI在发挥抑制α-葡萄糖苷酶以及抑制胰蛋白酶活性的这两个功能中,所参与结合的氨基酸残基或活性中心存在明显的不同。
[1] Basch E,Bent S,Collins J,etal.Flax and Flaxseed Oil (Linum Usitatissimum):A Review by the Natural Standard Research Collaboration[J].JournaloftheSocietyforIntegrativeOncology,2007,5(3):92-105.DOI:10.2310/7200.2007.005.
[2] Schmidt T J,Klaes M,Sendker J.Lignans in Seeds of Linum Species[J].Phytochemistry,2012,82(1):89.DOI:10.1016/j.phytochem.2012.07.004.
[3] 孙中义.亚麻籽饲用研究进展[J].中国麻业科学,2010,32(1):37-41.DOI:10.3969/j.issn.1671-3532.2010.01.010.
[4] 张宁,王凤山.胰蛋白酶抑制剂研究概况[J].中国生化药物杂志,2004,25(2):115-117.DOI:10.3969/j.issn.1005-1678.2004.02.021.
[5] Kunitz M.Kinetics and Thermodynmics of Reversible Denaturation of Crystalline Soybean Trypsin Inhibitor[J].JournalofGeneralPhysiology,1948,32(32):241-263.DOI:10.1085/jgp.32.2.241.
[6] 蔡祖花,王凤山,张天民.胰蛋白酶抑制剂的临床研究概况[J].中国生化药物杂志,2000,21(3):157-159.DOI:10.3969/j.issn.1005-1678.2000.03.026.
[7] 范莉,王业玲,唐丽.天然来源α-葡萄糖苷酶抑制剂筛选方法的研究进展[J].天然产物研究与开发,2016(2):313-321.DOI:10.16333/j.1001-6880.2016.2.026.
[8] 贾光锋,邸幼军.天然α-葡萄糖苷酶抑制剂的分离与生理活性研究进展[J].中国食物与营养,2012,18(7):65-68.DOI:10.3969/j.issn.1006-9577.2012.07.017.
[9] 陈颖璐.亚麻种子降糖多肽的分离纯化及性质研究[D].太原:山西大学生物技术研究所,2017:17-50.
[10] 陈颖璐,石亚伟.亚麻种子中胰蛋白酶抑制剂的分离纯化及性质研究[J]. 食品工业科技,2016,37(22):234-239.DOI:10.13386/j.issn1002-0306.2016.22.037.
[11] Khanna P,Jain S C,Panagariya A,etal.Hypoglycemic Activity of Polypeptide from a Plant Source[J].JNatProd,1981,44(6):648-655.DOI:10.3321/j.issn:1673-1689.2005.01.012.
[12] Gadge P P,Wagh S K,Shaikh F K,etal. A Bifunctional α-amylase/Trypsin Inhibitor from Pigeonpea Seeds:Purification,Biochemical Characterization and Its Bio-efficacy Against Helicoverpa Armigera[J].PesticideBiochemistry&Physiology,2015,125:17.DOI:10.1016/j.pestbp.2015.06.007.
[13] 闫永飞.莜麦中α-淀粉酶抑制剂的分离纯化与性质研究[D].太原:山西大学,2011.
[14] Li Y,Wen S,Kota B P,etal.Punica Granatum,Flower Extract,a Potent α-glucosidase Inhibitor,Improves Postprandial Hyperglycemia in Zucker Diabetic Fatty Rats[J].JournalofEthnopharmacology,2005,99(2):239-244.DOI:10.1016/j.jep.2005.02.030.
[15] 邢磊,焦颖华,耿丽华,等.生脉六味地黄汤加减方对大鼠小肠内表面黏膜α-糖苷酶的抑制作用[J].中国老年学,2012,32(18):3963-3965.DOI:10.3969/j.issn.1005-9202.2012.18.045.
[16] Erlanger B F,Kokowsky N,Cohen W.The Preparation and Properties of Two New Chromogenic Substrates of Trypsin?[J].ArchivesofBiochemistry&Biophysics,1961,95(2):271.DOI: 10.1016/0003-9861(61)90145-X.
[17] Ikeda K,Kusano T.Purification and Properties of the Trypsin Inhibitors from Buckwheat Seed[J].BioscienceBiotechnology&Biochemistry,1983,47(7):1481-1486.DOI: 10.1271/bbb1961.47.1481.
[18] Miura S,Funatsu G.Isolation and Amino Acid Sequences of Two Trypsin Inhibitors from the Seeds of Bitter Gourd[J].BioscienceBiotechnology&Biochemistry,1995,59(3):469.DOI: 10.1271/bbb.59.469.
[19] 付中平,刘红雨,鲁岚,等.苦瓜蛋白酶抑制剂对苦瓜降糖多肽活性的保护作用[J].中草药,2009,40(8):1259-1262.DOI:10.3321/j.issn:0253-2670.2009.08.028.

