多孔淀粉对石榴多酚的吸附性能及其复合物抗氧化能力的研究
蒋新龙 蒋益花 王纯洁 朱志友 金文浩 沈佳琦
(浙江树人大学生物与环境工程学院,杭州 310015)
石榴在我国大部分地区都有种植,石榴皮富含石榴多酚,但大部分都被丢弃。石榴多酚含有多个酚羟基,有较高的还原性,是一种天然无毒的抗氧化剂,具有抗氧化、抗衰老等多种生理和药理活性[1-2],但在光照、高温等条件下容易被破坏,从而降低药效且浪费资源。如何最大程度地保持石榴多酚的抗氧化能力、防止其自氧化,成为石榴多酚在食品、医药和日用化学品等领域广泛应用的关键难题。
多孔淀粉是由淀粉经人工方法处理而使颗粒呈现多孔状,具较大的比表面积和吸附性能,可作为微胶囊芯材、吸附载体和包埋剂[3-4]。多孔淀粉对吸附质起到类似于“包埋”的作用,可有效防止石榴多酚自氧化。本文选择玉米多孔淀粉作为石榴多酚的吸附载体,研究多孔淀粉对石榴多酚的吸附工艺、吸附热力学规律和吸附机理,并测定复合物的抗氧化活性,为多孔淀粉对石榴多酚抗氧化能力的保护作用提供参考。
1 材料与方法
1.1 材料与仪器
石榴皮:亳州典世堂药业销售有限公司;玉米淀粉:山东济南市历城区顺鑫化工经营部;α-淀粉酶(根据GB 8275—2009[5]方法测定α-淀粉酶酶活,测得α-淀粉酶酶活为1 698 IU/mL)、糖化酶(根据GB 8276—2006[6]方法测定糖化酶酶活,测得糖化酶酶活为1.19×104IU/g):江苏省奥谷生物科技有限公司;DPPH(1,1-二苯基-2-苦基肼):上海源叶生物科技有限公司;其他试剂皆为分析纯;所用水为蒸馏水。
UV-9100紫外可见光谱仪:北京瑞利公司;pHS-3B型精密pH计:上海精密科学仪器有限公司;ZHWY-110X往复式水浴恒温培养振荡器:江苏盛蓝仪器制造有限公司;电热恒温鼓风干燥箱:上海跃进医疗机械厂;300 kV高分辨透射电子显微镜(Tecnai G2 F30 S-Twin):荷兰Philips-FEI公司。
1.2 方法
1.2.1 多孔淀粉的制备
实验利用复合酶-间歇超声制备多孔淀粉。具体方法:1)将玉米淀粉原料分散到pH为5.0的柠檬酸和磷酸氢二钠缓冲溶液,调制成质量浓度为33.3%的淀粉乳A;2)预热处理:将淀粉乳A移入到带搅拌器和冷凝器收集装置的密闭反应器内,搅拌并加热到55 ℃,保持15 min,淀粉颗粒受热发生膨胀制得淀粉乳B;3)酶解处理:在淀粉乳B中加入0.4%的葡萄糖淀粉酶复合酶(糖化酶:α-淀粉酶9:1),酶解10 h;其中,在酶解过程中进行间歇超声处理30 min,每30 min处理1次;4)酶解终止处理:酶解结束后立即加入占缓冲液体积10%的NaOH溶液(4%)终止反应;5)酶解终止后处理:将物料用蒸馏水洗至中性并抽滤,然后60 ℃常压干燥、粉碎过筛,控制含水量<12%,制得多孔淀粉产品。
1.2.2 石榴多酚的制备
采用微波法提取石榴皮多酚(简称石榴多酚)。精密称取干燥、粉碎过80目筛的石榴皮粉末→微波醇提(微波功率288 W,乙醇体积浓度40%,料液比1:30 g/mL,提取时间40 s)→过滤→多酚样品液。
1.2.3 多孔淀粉对石榴多酚吸附实验
准确移取25 mL一定浓度的石榴多酚溶液于250 mL的三角烧瓶中,用0.1 mol/L HC1或NaOH调至预定pH值,加入一定量的多孔淀粉作为吸附剂,置于水浴振荡培养器恒温振荡吸附一定时间后,过滤分离。采用Folin-Ciocalteu比色法(FC法)测定石榴多酚含量[7]。以多孔淀粉对石榴多酚的吸附量为衡量指标。
吸附量qe=(C0-Ce)V/M
式中:qe为平衡时在吸附剂上的吸附量/mg/g;V为溶液的体积/L;M为吸附剂的质量/g;C0为初始质量浓度/mg/L;Ce为吸附平衡时溶液中质量浓度/mg/L。
1.2.4 多孔淀粉对石榴多酚吸附条件优化实验
单因素实验:固定初始条件其他量不变,采用控制变量法,考量pH、吸附时间、吸附剂用量、石榴多酚初始质量浓度、吸附温度几个因素,分别设置pH梯度1.0、2.0、30、4.0、5.0、6.0、7.0;吸附剂用量梯度10.0、15.0、20.0、25.0、30.0 mg/L;石榴多酚质量浓度梯度为3.0、4.0、5.0、6.0、7.0 mg·mL-1;时间梯度为15、30、45、60、90、120 min;温度梯度为30、35、40、45、50 ℃。测定多孔淀粉对石榴多酚的吸附量。
正交实验优化:参照单因素实验以吸附剂用量、石榴多酚浓度、时间、pH为影响因素,进行四因素三水平正交实验。吸附条件优化的最终衡量标准是石榴多酚的吸附量,以石榴多酚吸附量最大时的条件为最优吸附条件。分别选取pH为2、3、4;时间60、90、120 min;吸附剂用量10、20、30 mg/L;石榴多酚质量分数5.0、6.0、7.0 mg/g。
1.2.5 吸附性能测定
在最优吸附条件下进行实验,将实验数据分别用模型进行模拟,求得动力学参数、热力学参数(ΔG0、ΔH0和ΔS0)及最大吸附量等吸附性能参数[8]。每个实验重复3次。
1.2.6 多孔淀粉与石榴多酚复合物制备及抗氧化活性实验
取一定量多孔淀粉在最佳吸附条件下吸附石榴多酚,冷冻干燥后制得复合物,采用Folin-Ciocalteu比色法[7]测得石榴多酚含量为3.808 mg/g。
DPPH·法是用以评价天然抗氧化剂抗氧化活性的一种快速、简便、灵敏可行的方法[9-10]。根据文献[11]方法采用DPPH体系下清除自由基的方法,将石榴多酚和复合物分别置于24 ℃恒温室内自然光(平均光强3 000 lx)、强日光(平均光强85 000 lx)条件下进行光降解对照实验。每隔1 d测定对DPPH·自由基的清除率,以对DPPH·自由基的清除率的保存率P(%)为衡量指标,监测其抗氧化能力的变化。每个实验处理均重复3次。清除率的保存率P=(Y0-Y)/Y0×100%,式中:Y0和Y分别为处理前后样品对DPPH·自由基的清除率。
2 结果与分析
2.1 多孔淀粉的制备
从原玉米淀粉和多孔淀粉的扫描电镜(SEM)成像分析结果(图1)可以看出,原淀粉采用多孔化制备工艺后,在淀粉颗粒表面形成了大量的多孔结构,且多孔的形成不仅仅是在淀粉表面,在淀粉的内部也有孔隙形成,这样的疏松多孔结构,使比表面积明显增大,从而显著增大了对石榴多酚的吸附效果。


图1 原玉米淀粉和多孔淀粉的扫描电镜图
2.2 多孔淀粉对石榴多酚吸附条件优化
2.2.1 单因素实验
由于石榴多酚在结构上存在酚性羟基,在酸性条件下比较稳定。图2可知,当pH<7时,随着pH值的增大,多孔淀粉对石榴多酚的吸附量逐渐减小;随着多孔淀粉用量的不断增加,加大了吸附表面积,同时也增加了参与吸附的位点,但单位多孔淀粉的吸附量在不断减小;随着吸附时间和石榴多酚浓度的不断增加,多孔淀粉对石榴多酚的吸附量也逐渐增大直至达到吸附饱和。由图2可知,当吸附温度为40 ℃时吸附量最大,但与30 ℃水平差异不显著,所以吸附温度固定为30 ℃。
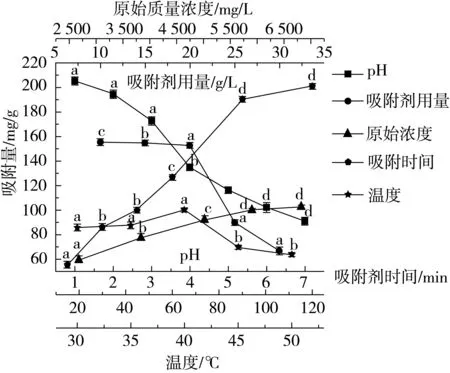
图2 多孔淀粉对石榴多酚吸附单因子实验
2.2.2 正交实验
根据单因子实验结果,采用L9(34)正交实验设计表头,对其中主要因子pH值(A)、吸附时间(B)、吸附剂用量(C)、石榴多酚初始质量浓度(D)4因子在3个不同水平进行优选。实验结果见表1。

表1 正交实验结果
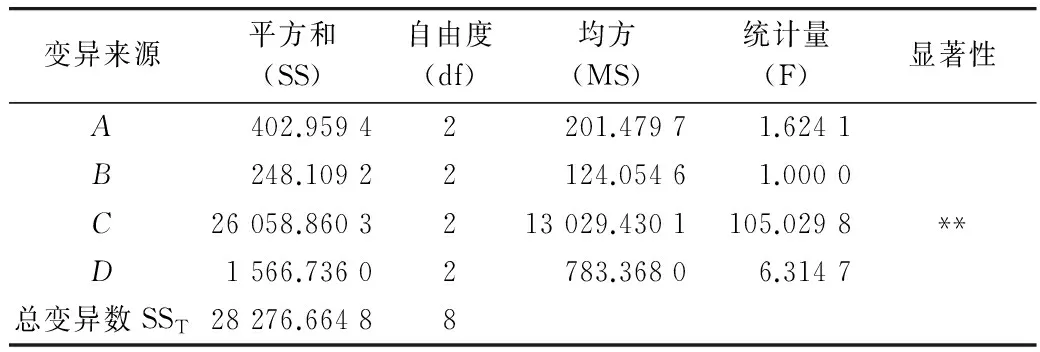
表2 方差分析表
注:F0.01(2、2)=99.00,“**”表示因素影响极显著。
结果采用直观分析和方差分析,以得出多孔淀粉对石榴多酚的最佳吸附条件。表1中K1、K2、K3为每个因素3次实验所得的吸附量的平均值。R为平均数的极差,R越大表明变化幅度大,说明该因素的水平变化对吸附量的影响越大,该因素即是最大影响因素。由表1可知,影响吸附量的因素主次依次排列为:吸附剂用量>初始质量浓度>pH值>吸附时间。由表2可知吸附剂用量对吸附量的影响极显著,其他因素对吸附量的影响则不显著。直观分析,实验的最优水平组合为A1B1C1D1;根据每个因素K1、K2、K3,实验的最优水平组合为A1B2C1D1。吸附时间对吸附量的影响不显著且最小,综合正交实验分析结果,确定最佳工艺条件为A1B1C1D1,即吸附温度30 ℃,pH值2,吸附时间1h,吸附剂用量10 g/L,初始质量浓度5 000 mg/L。
2.3 吸附性能测定结果
2.3.1 吸附动力学性能

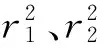

表3 动力学参数
2.3.2 吸附热力学性能
吸附热力学实验目的在于通过研究吸附等温线,确定多孔淀粉体对石榴多酚的最大吸附量及对石榴多酚的吸附热力学特性。通常采用Langmuir吸附等温吸附模型(Ce/q=1/KLqmax+Ce/qmax)和Freundlich吸附等温吸附模型(lgqe=lgKF+lgCe/n)进行分析[8]。
根据优化条件,将不同浓度石榴多酚溶液分别在30、40、50 ℃进行吸附实验,模拟分析结果见表4。表中qmax为吸附剂最大吸附量,K、1/n为经验常数。由2个方程的线性相关系数r值可以判定2个方程都拟合良好,但更符合Freundlich吸附等温吸附模型。多孔淀粉吸附石榴多酚的Langmuir方程拟合相关系数rL达到0.971 3~0.996 0,由此可推测多孔淀粉对石榴多酚的吸附为单层吸附。多孔淀粉吸附石榴多酚的Freundlich方程拟合相关系数rF为0.995 4~0.998 8,K为0.142 5~0.210 9,n为1.296 8~1.314 3,表明多孔淀粉对石榴多酚的吸附是自发吸附[12]。30、40、50 ℃时的最大吸附量分别可达到341.102 4、363.048 0、326.106 2 mg/g,优于明胶微球等吸附材料[13-14]。
在以上等温吸附模型中,可根据吸附等温式常数K,计算吸附热力学参数标准自由能变ΔG0、焓变ΔH0、熵变ΔS0及平衡平衡常数KC[8]。从表5可知,ΔG0、ΔH0均为负值,说明多孔淀粉吸附石榴多酚过程是自发的,而且是放热的。ΔG0介于-29.73~-31.09 kJ/mol,而一般化学吸附的ΔG0介于-80~-400 kJ/mol,说明该过程主要是物理吸附作用。ΔH0为-9.17 kJ/mol,表明多孔淀粉对石榴多酚的吸附是弱放热过程,而|ΔH0|<25 kJ/mol也说明了该吸附主要是物理过程。ΔS0值则说明吸附反应的进行增加了系统的混乱程度。
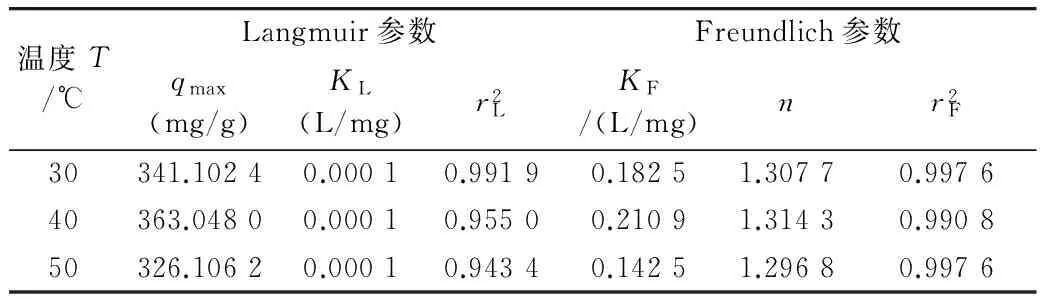
表4 吸附等温线
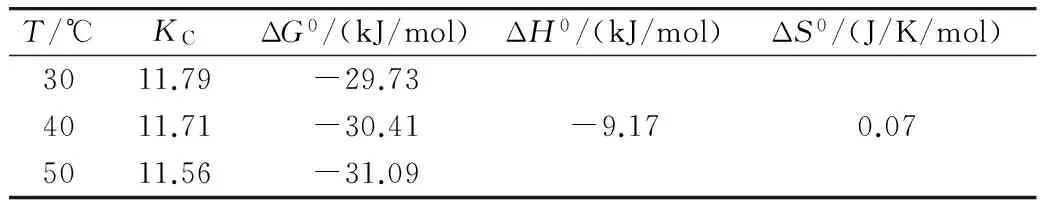
表5 热力学参数
2.4 多孔淀粉与石榴多酚复合物的抗氧化活性
多孔淀粉与石榴多酚复合物的人工光热降解对照实验结果见图3。由图3可知,石榴多酚的光降解与光照强度、光照持续时间等因素有关,光照强度越大、光照持续时间越长,抗氧化活性的保存率越低。相同光照强度和光照时间,低浓度石榴多酚复合物的抗氧化活性保存率比石榴多酚保存率高。

图3 光照对抗氧化活性的保存率的影响
3 讨论
通过正交实验得到对吸附影响力顺序从大到小排列为吸附剂用量>初始浓度>pH值>吸附时间。吸附剂用量对吸附量的影响极显著,其他因素对吸附量的影响则不显著。ΔH0为-9.17 kJ/mol,表明多孔淀粉对石榴多酚的吸附以物理吸附包埋、范德华力、静电吸附为主。因为是自发的弱放热过程,因此温度对吸附的影响不显著。由于石榴多酚在酸性条件下比较稳定,在碱性条件易发生氧化聚合反应,但pH对弱放热过程的物理吸附影响不明显,pH在单因素实验中可以观察到,对石榴多酚吸附量的影响也不大,正交实验对于pH的影响没有显著性。
一般情况下,一级吸附动力学方程通常只适用于吸附的初始阶段,二级动力学模型是建立在整个吸附平衡时间范围内。研究表明吸附动力学行为同时符合一级反应动力学(R2>0.99)和二级反应动力学(R2>1.00)。但更符合二级反应动力学吸附模型。同样,研究表明吸附过程同时符合Langmuir吸附规律(R2>0.94)和Freundlich吸附规律(R2>0.99),但更符合Freundlich吸附等温吸附模型。Langmuir模型的前提是假设固体表面是均匀的,为单层表面吸附;Freundlich吸附等温式是基于吸附质在多相表面上的吸附。由此可推测多孔淀粉对石榴多酚的吸附主要为多相表面上的吸附。Freundlich等温线中n代表Fueundlich方程参数,并被Powell等[15]认为与吸附剂-吸附质之间吸附推动力密切相关。计算求得n=1.30左右,表明多孔淀粉对石榴多酚的吸附较慢[16]。这与吸附时间在单因素实验结果完全吻合。
对石榴多酚和复合物光降解对照实验结果表明,在自然光下两者差异不明显,但在强光下5 d后,石榴多酚抗氧化活性保存率降低了5.83%,而石榴多酚与多孔淀粉复合物仅下降了3.53%。这说明多孔淀粉对石榴多酚的抗氧化活性有一定的保护作用,与骆慧敏等学者的研究结果一致[17-18]。
4 结论
通过四因素三水平正交实验对多孔淀粉对石榴多酚的吸附条件进行优化,得到吸附的最佳条件为:吸附时间60 min,吸附温度30 ℃,溶液pH为2.0,石榴多酚质量浓度为5.0 mg/mL。在该条件下,得到石榴多酚的实际最大吸附量为225.84 mg/g,与Langmuir等温曲线拟合所得的理论最大吸附量341.10 mg·g-1有差异。主要原因在于正交实验没有考虑各影响因子的交互作用。
多孔淀粉对石榴多酚的吸附更符合Freundlich吸附等温吸附模型,其动力学行为更符合二级反应速率方程。对表观热力学参数表明,其吸附主要是一个自发放热的物理吸附过程。
人工光降解对照实验表明,多孔淀粉在保护石榴多酚的抗氧化能力方面有较好的作用。
[1]李云峰,郭长江,杨继军,等.石榴皮抗氧化物质的提取及其体外抗氧化作用研究[J].营养学报,2004,26(2):143-147
LI Y F,GUO C J,YANG J J,et al.Extraction of antioxidant substances from pomegranate peel and their antioxidant activities in vitro[J].Journal of Nutrition,2004,26(2):143-147
[2]ORAKI H H,DEMICI A S,GOMUS T.Antibacterial and antifungal activity of pomegranate(Punica granatum L.cv.)peel.[J].Electronic Journal of Environmental Agricultural & Food Chemistry,2011,10(3):1958-1969
[3]杨鑫.富含芦丁、槲皮素淀粉的制备及特性研究[D].天津:天津科技大学,2009
YANG X.Preparation and characterization of rutin rich quercetin starch[D].Tianjin:Tianjin University of Science and Technology,2009
[4]王后生.生物可降解高吸附性多孔淀粉的研究[D].南京:南京航空航天大学,2011
WANG H S.Study on biodegradable high adsorptive porous starch[D].Nanjing:Nanjing University of Aeronautics and Astronautics,2011
[5]GB 8275—2009.食品添加剂α-淀粉酶制剂[S].北京:中国标准出版社,2009
GB 8275—2009.Food additiveα-amylase preparation[S].Beijing:Standards Press of China,2009
[6]GB 8276—2006.食品添加剂 糖化酶制剂[S].北京:中国标准出版社,2006
GB 8276—2006.Food additive,saccharifying enzyme preparation[S].Beijing:Standards Press of China,2006
[7]王占一,张立华,王玉海,等.超声提取石榴皮多酚的传质动力学模型研究[J].中药材,2015,38(5):1063-1068
WANG Z Y,ZHANG L H,WANG Y H,et al.Mass Transfer Kinetics Model of Ultrasonic Extraction of Pomegranate Peel Polyphenols[J].Chinese Medicinal Herbs,2015,38(5):1063-1068
[8]陈颖,杨朝晖,李小江,等.茶树菇废菌体对水中Cr(VI)吸附的响应面优化及机理研究[J].环境科学学报,2010,306(8):1593-1600
CHEN Y,YANG Z H,LI X J,et al.Biosorption of Cr(Ⅵ)from Aqueous Solutions by Wasteagrocybe aegerita:Optimization and Mechanism[J].Chinese Journal of Environmental Science Research and Response Surface Optimization and Mechanism of Adsorption,20103,6(8):1593-1600
[9]OKAWA M,KINJO J,NOHARA T,et al.DPPH(1,1-dipheny-2-picrylhydrazy1)radical scavenging activity of flavonoids obtained from some medicinal plants[J].Biological and Pharmaceutical Bulletin,2001,24(10):1202-1205
[10]TAKARA K,OTSUKA K,WADA K,et al.1,1-Diphenyl-2-picrylhydrazyl radical scavenging activity and tyrosinase inhibitory effects of constituents of sugarcane molasses[J].Bioscience,Biotechnology,and Biochemistry,2007,71(1):183-191
[11]李政,王国良,金珊,等.31种常见抗菌中药对DPPH自由基清除作用的分析[J].海洋水产研究,2005,26(1):38-40
LI Z,WANG G L,JIN S,et al.Scavenging free radical with thirty-one species of Antimicrobial Chinese herb medicines in aquiculture[J].Marine Fisheries Research,2005,26(1):38-40
[12]黄洪,颜环环,雷鸣,等.中性红在柚子皮上的吸附机制研究[J].环境污染与防治,2010,326(10):41-45
HUANG H,YAN H H,LEI M,et al.Study on the adsorption mechanism of neutral red in aqueous solution by pomelo peel[J].Environmental Pollution and Control,2010,326(10):41-45
[13]刘晓晓.明胶与多酚的相互作用研究[D].成都:西华大学,2014
LIU X X.Study on the interaction of Gelatin and polyphenols[D].Chengdu:Xihua University,2014
[14]刘彬.明胶微球对石榴果汁中多酚的吸附研究[D].成都:西华大学,2014
LIU B.Study on the Interaction of Gelatin and Polyphenols[D].Chengdu:Xihua University,2014
[15]POWELL T,BRION G M,JAGTOYEN M,et al.Investigating the effect of carbon shape on virus adsorption[J].Environmental Science and Technology.2000,34:2779-2783
[16]KITAK W,SUZUKI R.Adsorption Basis and Design[M].Lu Zhengli.,Trans.,Chemical Industry Press,Beijing,1983:33
[17]骆慧敏,宁敏,徐迎波,等.多孔淀粉对茶多酚的吸附性能及其复合物抗氧化能力的研究[J].茶叶科学,2015,35(5):473-480
LUO H M,NING M,XU Y B,et al.Adsorption Properties of Porous Starch on Tea Polyphenols and Antioxidative Capacity of the Complex[J].Tea Science,2015,35(5):473-480
[18]江慧娟,吕小兰,黄赣辉.多孔淀粉粉末紫苏籽油的制备及其抗氧化性[J].食品科学,2013,34(12):95-98
JIANG H J,Lü X L,HUANG G H.Preparation of Perilla Seed Oil Powder and Its Antioxidant Activity[J].Food Science,2013,34(12):95-98.

