采后烟叶碳代谢的动态变化分析
蒋博文,王 涛,宋朝鹏,王松峰,高华锋,解 燕,毛建书,贺 帆*
碳水化合物及糖类代谢是植物最基本的初生代谢,直接影响着植物的基本生命活动[1-2]。淀粉是烟叶中碳水化合物贮藏的主要形式,成熟鲜烟叶中的淀粉含量可达40%[3]。烤后烟叶中残留的淀粉严重影响烟叶质量,而由淀粉降解产生的还原糖既可以增加烟叶香吃味,又可以参与调节烟气酸碱平衡[4],因此采后烟叶淀粉和糖代谢对烟叶质量有重要影响。成熟烟叶采收至烘烤定色前,烟叶处于饥饿代谢状态,其内部进行着复杂的生理生化变化,研究采后烟叶内碳代谢的变化规律对提高烟叶的烘烤品质具有重要意义。
张松涛等[5]研究发现,云南烟叶成熟过程中焦磷酸化酶基因NtAGPase和颗粒结合型淀粉合成酶基因NtGBSS1表达量明显强于河南烟叶,推测淀粉组分之间的差异可能是造成云南烤后烟叶淀粉含量显著低于河南的原因。张嘉炜等[6]、贾宏昉等[7]研究发现,土壤中添加腐熟秸秆、生物碳等,淀粉代谢相关基因NtAGPase、NtGBSS1和蔗糖代谢相关基因NtSuS等表达增强,从而促进成熟期烟叶碳代谢的进行,有利于提高烟叶的品质。杨胜男等[8]研究发现,复合有机肥可促进叶片细胞中淀粉的积累,并改变淀粉组分,其中NtGBSS1的表达随复合有机肥施用量的增加而减弱,可溶性淀粉合成酶基因NtSS的表达随复合有机肥施用量增加而增强。王红丽等[9]研究发现,糖代谢相关基因NtINV、NtSuS、NtSPS表达量随生育期的推进而逐渐增强,淀粉代谢相关基因NtGBSS1表达量不受烟叶成熟时期的影响。
烟叶离体至烘烤定色前仍然进行着剧烈的生理生化反应[10],但目前关于碳代谢的研究集中在烟草大田成熟期,且涉及的碳代谢基因较片面,对于采后离体烟叶内淀粉和糖代谢的变化规律研究鲜有报道。本研究以豫烟12号和秦烟96为材料,在生态环境、土壤肥力、栽培措施等一致前提下,测定采后不同时段烟叶中淀粉、总糖和还原糖含量变化,利用实时荧光定量PCR技术检测采后烟叶淀粉和糖代谢相关基因的表达规律,为分子调控烟叶碳代谢,合理调控烘烤工艺提供理论依据,并为进一步研究烘烤过程中烟叶碳代谢规律奠定基础。
1 材料与方法
1.1 试验材料
试验材料取自河南省洛阳市洛宁县烟草科技示范基地,供试品种为豫烟12号和秦烟96。试验田地处东经 111°38′,北纬 34°26′,年平均气温13.7 ℃,日照时数2217.6 h,无霜期216 d,常年降水量600~800 mm。植烟土壤为黄棕壤,肥力中等,pH 7.17,有机质 12.10 g/kg,碱解氮71.74 mg/kg,速效磷9.32 mg/kg,速效钾170.59 mg/kg,试验田地势平坦,灌排方便,在该烟区代表性强。按照当地施氮量施肥,磷、钾肥施用量保持一致,其余田间管理措施同当地优质烟叶生产技术规范。
1.2 试验设计
2016年8月15日采摘成熟度一致的无病虫害的适熟中部叶(10~12叶位),置于温度为 30 ℃,相对湿度为90%恒温恒湿的暗箱(暗箱提前用0.1%的 DEPC水处理)中。适熟烟叶成熟特征统一为:移栽后 80 d,叶面落黄八成左右,主脉全白发亮,支脉变白,叶尖、叶缘下卷,叶面起皱[11]。于采后0、6、12、18、24和30 h分别进行取样,每次随机选取 10片烟叶进行淀粉、糖含量和基因表达量的测定,重复3次取样。
1.3 糖和淀粉含量测定
将各个时段所取的烟叶叶尖和叶基部各剪去10 cm,去主支脉,先用烘箱在105 ℃下杀青15 min,再降至65 ℃烘干,研磨,并经60目过滤筛过滤保存。总糖、还原糖采用 AAⅢ型连续流动化学分析仪(德国BRAN+LUEBBE公司生产)测定,淀粉采用高氯酸超声萃取-连续流动法测定[12]。试验重复3次。
1.4 基因表达量分析
各个时段分别取5片烟叶,去主支脉后混合以减少试验误差,所取叶片用纱布和锡箔纸包裹,迅速置于液氮中冷冻,于-80 ℃超低温冰箱保存。采用Trizol法提取烟叶总RNA,通过随机引物法反转录合成cDNA[13]。根据GenBank发布的碳代谢基因的序列设计PCR引物(表1),进行实时定量PCR检测。以烟草核糖体蛋白编码基因NtL25作为内参基因,引物由苏州金唯智生物科技公司合成。按照Invitrogen公司的RealMasterMix (SYBR Green)试剂盒说明书进行实时定量RT-PCR,每个样品3次重复。实时定量的实验结果采用 2-ΔΔCt算法[14]进行分析。植物细胞内淀粉和糖的代谢是一个有机循环过程,葡萄糖、果糖、蔗糖和淀粉之间通过各种酶相互转化,论文中涉及的淀粉和糖代谢基因所处的碳代谢位置见图1[15-28]。
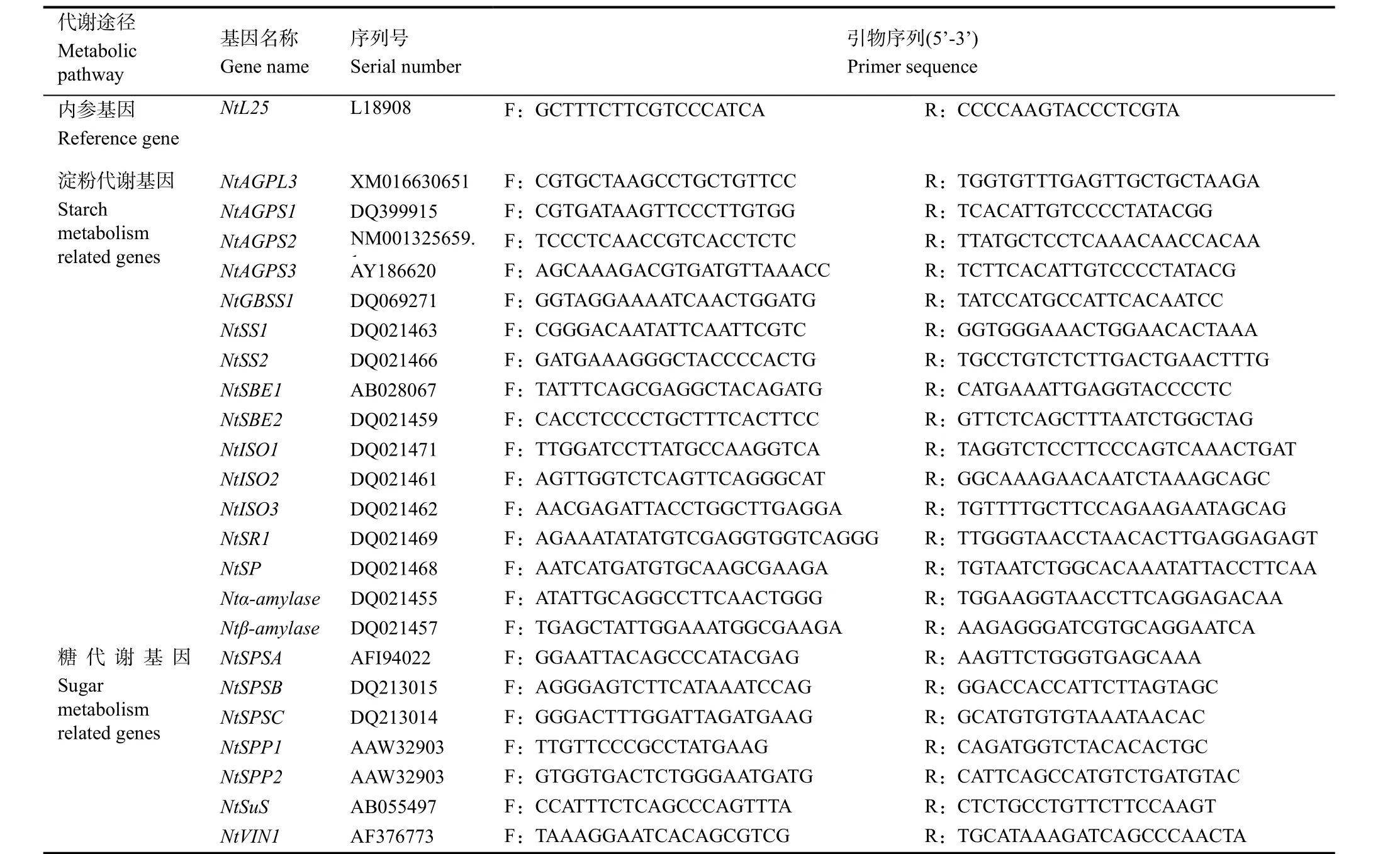
表1 糖和淀粉代谢相关基因的实时定量PCR引物序列Table 1 Primers for qPCR of sugar and starch metabolism related genes in tobacco
1.5 数据统计分析
用Microsoft Excel 2010进行数据处理和绘图。用SPSS 20统计软件进行数据分析,用Pearson相关系数进行相关分析。
2 结 果
2.1 采后烟叶淀粉和糖含量变化
如图2所示,秦烟96鲜烟叶(采后0 h)淀粉和总糖含量均显著高于豫烟12号,其中秦烟96鲜烟叶淀粉含量为 30.56%,极显著高于豫烟 12号(25.49%),总糖含量为4.83%,显著高于豫烟12号(3.86%);随着采收时间的推移,烟叶内淀粉含量呈下降趋势,而总糖和还原糖含量呈上升趋势,其中糖含量在采后12 h后增加速率变快;采后30 h,豫烟12号淀粉含量较0 h降解19.22%,而秦烟96降解23.89%,秦烟96淀粉降解率显著大于豫烟12号,但总糖和还原糖的增长率(3.38%、4.12%)却小于豫烟12号(4.30%、5.04%)。
2.2 采后烟叶淀粉代谢相关基因的表达量变化
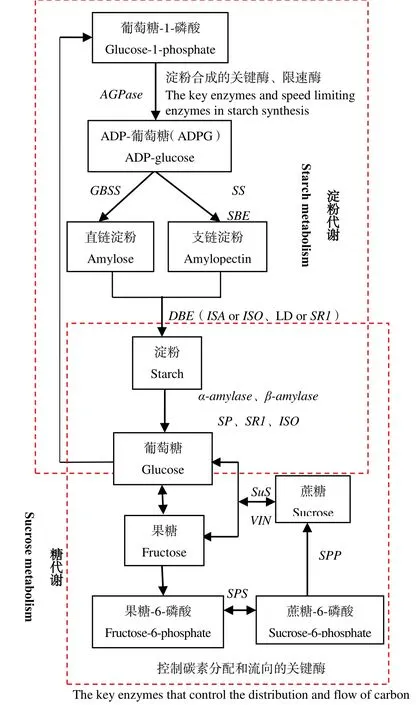
图1 植物碳代谢途径Fig. 1 Carbon metabolism pathways in plants
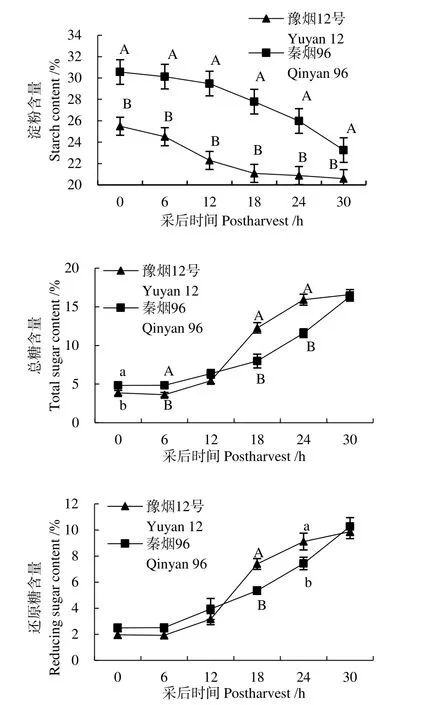
图2 采后烟叶淀粉和糖含量的变化Fig. 2 Changes of starch and sugar contents in tobacco leaves after harvest

表2 采后烟叶淀粉代谢相关酶基因的相对表达量变化Table 2 Changes of relative expression levels of starch metabolism related genes in tobacco leaves after harvest
由淀粉合成起始步骤的关键酶AGPase的基因表达分析发现(表2),豫烟12号和秦烟96成熟和采后烟叶中NtAGPL3和NtAGPS2无表达;NtAGPS1和NtAGPS3在秦烟96成熟烟叶(0 h)中的表达量均高于豫烟12号;NtAGPS1表达量在采收后的30 h内逐渐下降,而NtAGPS3表达量在采后6 h迅速下调至较低水平。NtAGPS1基因的变化趋势与总淀粉含量变化相似,可能是淀粉合成起始步骤的关键基因。
秦烟96鲜烟叶(0 h)中直链淀粉合成的关键酶基因NtGBSS1表达量高于豫烟12号。在采后30 h内,NtGBSS1表达量逐渐下降,其整体变化趋势与总淀粉变化相似,可能是淀粉合成的关键基因。
可溶性淀粉合成酶基因在两个品种中的表达量变化趋势不同:NtSS1的表达量在烟叶采收后6 h降至低谷,随后略有增加,采后30 h时,秦烟96的表达量高于豫烟12号;NtSS2在秦烟96中的表达量变化与NtSS1相似,而NtSS2在豫烟12号中呈逐渐下降趋势。
淀粉分支酶基因表达量变化趋势在两个品种中不同:秦烟96成熟烟叶(0 h)中NtSBE1和NtSBE2的表达量均高于豫烟12号;秦烟96中的NtSBE1的表达量在烟叶采收后6 h降至低谷,随后逐渐增加;豫烟12号中的NtSBE1的表达量在烟叶成熟至采收后12 h均维持在较低水平,随后逐渐增加并在采后18 h达到高峰,而后降低至采后6 h的表达量水平;NtSBE2在秦烟96中的表达趋势与NtSS1和NtSS2相似,而在豫烟12号中呈逐渐下降趋势。可见,不同淀粉分支酶在不同品种中的表达特性不同。
淀粉去分支酶基因表达量变化研究发现,烟叶成熟时,NtISO1在豫烟12号中的表达量高于秦烟96;随后其在两个品种中均呈先增再降的变化趋势,在采收后30 h,秦烟96中NtISO1表达量高于豫烟12号。NtISO2、NtISO3和NtSR1基因在秦烟96烟叶成熟期的表达量高于豫烟 12号,烟叶采收后,秦烟96中NtISO2、NtISO3和NtSR1基因表达量呈“U”型变化,而豫烟12号中这些基因的表达量整体无剧烈变化。
淀粉水解酶基因Ntα-amylase和Ntβ-amylase的表达模式显示,烟叶成熟时,豫烟 12号的淀粉水解酶基因表达量高于秦烟96;烟叶采收后两个品种中Ntα-amylase和Ntβ-amylase表达量整体呈上调趋势;采后30 h,秦烟96中淀粉水解酶基因表达量高于豫烟12。
淀粉磷酸化酶基因NtSP表达量变化研究发现,烟叶成熟时,秦烟96的NtSP表达量远高于豫烟12号;烟叶采后6 h,两品种中NtSP表达量均迅速降低,烟叶采收30 h时,秦烟96的NtSP表达量高于豫烟12号。
2.3 采后烟叶糖代谢相关酶基因的表达量变化
如表3所示,检测采后烟叶蔗糖磷酸合成酶基因(NtSPSA、NtSPSB、NtSPSC)的表达量发现,这些基因在两个品种中的表达量差异较大,烟叶成熟及采后30 h,秦烟96中NtSPS的表达量远高于豫烟12号;豫烟12号NtSPSA、NtSPSB和NtSPSC的表达量均呈先升高后降低趋势;秦烟 96三个基因表达量在采后6 h迅速下调至较低水平,但随后呈上调趋势,30 h时又迅速降低,其中NtSPSA表达量在采后30 h时仍处于较高水平。
蔗糖磷酸合成酶和蔗糖磷酸酶常以复合体的形式存在于植物体内。秦烟 96成熟烟叶和采收后烟叶中NtSPP1和NtSPP2表达量整体高于豫烟12号;秦烟96成熟烟叶(0 h)中NtSPP1和NtSPP2表达量较高,采后6 h表达量迅速下降,随后呈上调趋势。

表3 采后烟叶糖代谢相关酶基因的相对表达量变化Table 3 Changes of relative expression levels of sucrose metabolism related genes in tobacco leaves after harvest
烟叶成熟时及采后30 h,秦烟96中蔗糖合成酶基因NtSuS和糖酵解关键基因NtVIN1的表达量远高于豫烟12号;豫烟12号NtSuS和NtVIN1表达量呈先上升后下调趋势;秦烟 96中NtSuS和NtVIN1表达量在采后6 h迅速下降至较低水平,随后呈逐渐上调趋势。
2.4 采后烟叶淀粉、糖含量变化与酶基因表达量变化的相关性
由表 4看出,淀粉合成代谢关键酶基因NtAGPS1表达量变化与两品种烟叶中淀粉和糖含量呈显著相关性,且与豫烟 12号淀粉含量变化相关性达极显著水平(r=0.987,p<0.01);NtGBSS1表达量变化与豫烟 12号采后烟叶淀粉含量变化呈显著正相关(r=0.876,p<0.05),与其余碳水化合物变化相关性较强(r=-0.776、-0.785、0.709、-0.671、-0.696);NtAGPS3、NtSS2、NtSBE2、NtSR1和Ntβ-amylase虽然与豫烟12号和秦烟96某一生理指标相关性显著,但与其余碳水化合物相关性较弱。总体来说,采后烟叶中碳水化合物变化与淀粉代谢相关酶基因表达量变化相关性较强,与糖代谢相关酶基因表达量变化相关性较弱,即采后烟叶碳代谢由淀粉代谢相关酶基因起关键调控作用。
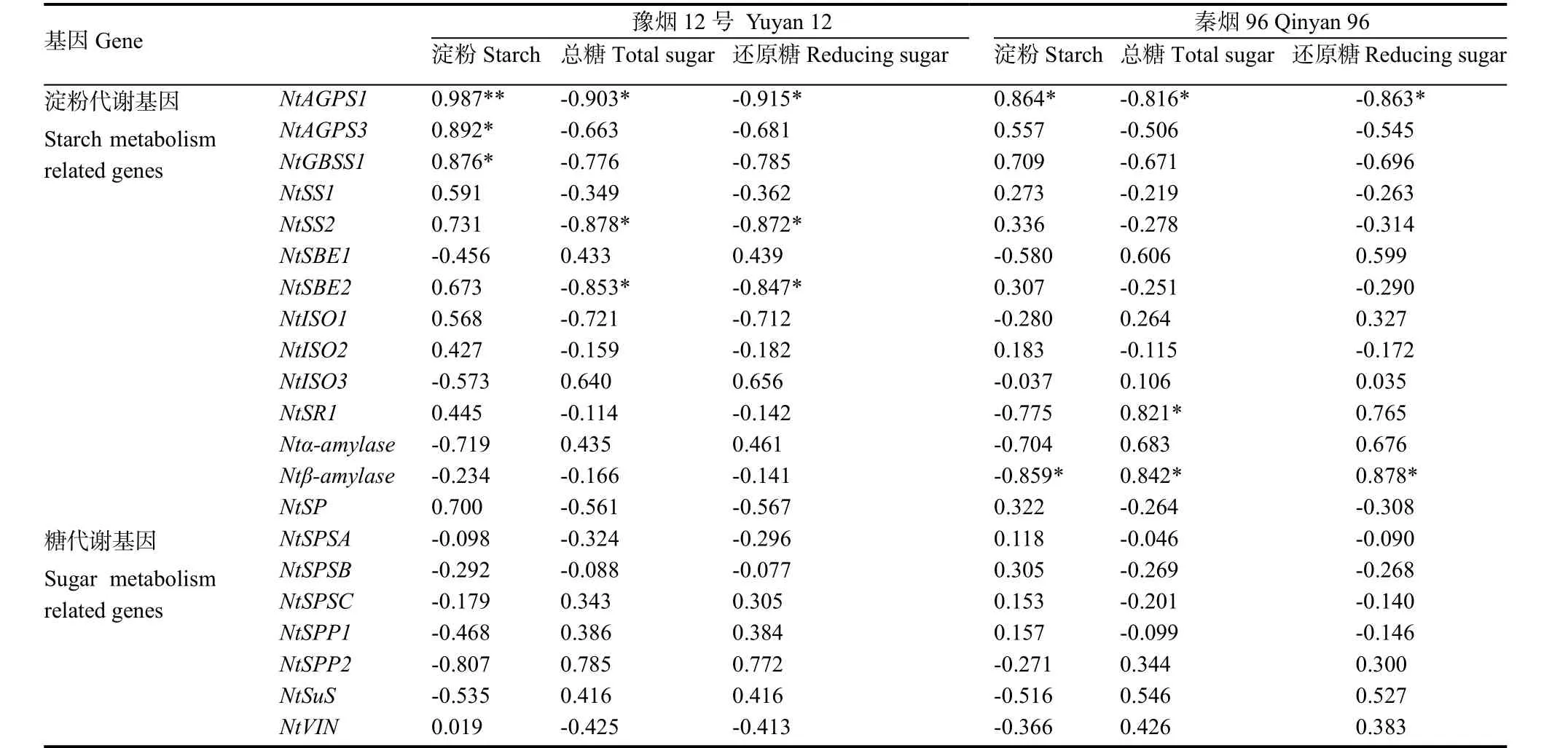
表4 采后烟叶淀粉、糖含量和代谢相关酶基因表达量的相关性Table 4 Correlation between starch, sugar contents and metabolic related gene expression
3 讨 论
烟叶烘烤过程中碳水化合物含量变化显著,淀粉在淀粉酶的作用下大量分解,同时糖类在相关酶的作用下进行呼吸消耗,但淀粉产生的糖量大大超过呼吸消耗的糖量,因此,采后离体烟叶淀粉含量逐渐下降,而糖含量逐渐增加[29-30]。本研究中豫烟12号和秦烟96生态条件、栽培措施和生育期一致,但成熟期烟叶中营养物质差异较大,秦烟 96鲜烟淀粉含量极显著高于豫烟 12号,这可能与烤烟品种本身的基因表达量关系密切;采后30 h时,秦烟96淀粉降解率大于豫烟12号,而糖含量增加率却低于豫烟12号,一定程度上说明秦烟96采后烟叶呼吸代谢旺盛,消耗糖较多,即秦烟 96烘烤过程中烟叶碳水化合物降解转化较豫烟12号充分。
碳代谢是烟株生长发育、产量和品质形成过程中最基本的代谢过程,烟叶碳代谢既受烟株本身遗传基因的支配,又受环境条件和栽培技术的影响,是一种多基因系统与环境因素交互作用的结果[31]。从豫烟12号和秦烟96鲜烟叶(0 h)中淀粉和糖代谢相关酶基因的表达量的差异对比可以看出,秦烟96鲜烟叶中淀粉和糖代谢的相关酶基因NtAGPS3、NtGBSS1、NtSS1、NtSS2、NtSBE1、NtSBE2、NtISO2、NtISO3、NtSP、NtSPSA、NtSPSB、NtSPSC、NtSPP1、NtSPP2、NtSuS和NtVIN1的表达量均显著高于豫烟12号,而淀粉分解的关键酶基因Ntα-amylase和Ntβ-amylase表达量却显著低于豫烟12号,说明同一生态环境和栽培措施条件下,秦烟 96成熟期淀粉合成代谢和糖代谢较豫烟12号强,因此秦烟96鲜烟叶中淀粉含量显著高于豫烟 12号。这与品种自身的遗产特性和适应性有关。有研究表明,豫烟12号不耐肥,在高氮条件下碳代谢弱,氮代谢强,成熟特性较差,难落黄[32];而秦烟 96则是一个能够兼顾品质、抗性、产量、适应性等方面的优良品种[33]。
AGPase是淀粉合成的限速酶,该酶活性的大小直接决定淀粉合成的速率和最终合成量多少[15];颗粒结合型淀粉合成酶GBSS主要参与直链淀粉的合成,是植物中研究最多的一类淀粉合成酶[16]。本研究发现,豫烟12号和秦烟96淀粉合成的关键酶基因为NtAGPS1,NtAGPS1在采后烟叶中呈逐渐下调趋势,且与采后烟叶淀粉、糖含量变化呈显著相关性,是采后烟叶碳水化合物代谢的关键基因;NtAGPS3和NtGBSS1在鲜烟叶中的表达量明显高于采后烟叶,说明鲜烟叶以淀粉合成代谢为主,采后烟叶淀粉合成代谢迅速减弱,且直链淀粉合成速率明显下降;相关性分析结果表明,直链淀粉合成的关键酶基因NtGBSS1与豫烟12号淀粉含量变化成显著正相关,与其他碳水化合物变化相关性较高,是采后烟叶淀粉代谢的关键控制基因。可溶性淀粉合成酶(SS)与淀粉粒结合程度较弱,主要参与支链淀粉中分支链的合成[17],淀粉分支酶(SBE)的主要功能是水解α-1,4-糖苷键,形成α-1,6-糖苷键,连接形成支链淀粉的分支结构[18]。本研究分析发现,豫烟12号和秦烟96采后烟叶中支链淀粉合成相关酶基因NtSS1、NtSS2、NtSBE1和NtSBE的表达量或呈缓慢下降趋势,或呈逐渐上调趋势,即采后一定时间内相关基因表达量较高,采后烟叶支链淀粉合成代谢减弱缓慢甚至有逐渐加强趋势。玉米不同淀粉链研究[34]中发现,直链淀粉比例高,结构致密性强,不易水解。推测采后烟叶内部淀粉形态重新发生分配,直链淀粉逐渐向更易水解的支链淀粉转化,为淀粉降解并维持细胞生命活动做准备。拟南芥中包括3种异淀粉酶(ISO1、ISO2和ISO3),在
淀粉合成中起最后修饰作用[19-21],本研究中NtISO1、NtISO2和NtISO3基因表达量在成熟、采收后呈无序增降模式,这可能与该基因在淀粉合成和降解中的双重作用有关。淀粉降解主要通过淀粉酶(Ntα-amylase、Ntβ-amylase)和淀粉磷酸化酶(NtSP)进行,且水解和磷酸解两种途径均需要R酶(NtSR1)的参与才能彻底完成[22-24]。本研究结果表明,采后烟叶中Ntα-amylase和Ntβ-amylase的表达量较高,说明采后烟叶功能正由积累淀粉向分解淀粉逐渐转化,采后 30 h内,豫烟 12号Ntα-amylase和Ntβ-amylase表达量呈先升后降趋势,秦烟96则呈逐渐上调趋势,这可能与底物即烟叶淀粉含量的多少有关;秦烟96烟叶在采后24~30 h,NtSR1和NtSP的表达量有明显上调,即秦烟 96采后烟叶较豫烟12号淀粉降解更快、更彻底。
在糖代谢中,蔗糖磷酸合成酶和蔗糖合成酶是控制碳素分配和流向的关键酶,能够调控植物叶片中蔗糖的合成和总糖的积累[25-27]。液泡转化酶(VIN)则催化蔗糖分解形成葡萄糖和果糖,参与植物渗透调节和细胞膨大,调控贮藏器官中糖成分及比例[28]。本研究结果发现,豫烟 12号糖代谢相关酶基因NtSPSA、NtSPSB、NtSPSC、NtSPP1、NtSPP2、NtSuS和NtVIN1在采后烟叶中的表达量均呈先上升后下降趋势,说明采后烟叶糖代谢旺盛,当糖代谢底物消耗殆尽或叶片衰老至一定程度,糖代谢减弱;秦烟96糖代谢相关酶基因表达量则呈明显上调趋势,推测秦烟 96成熟烟叶营养物质充实,糖代谢周期持续时间长,因此30 h内糖代谢相关基因表达量持续上调;秦烟 96采后烟叶中糖代谢相关酶基因表达量除NtSuS外均整体强于豫烟12号,即秦烟96采后烟叶糖代谢较豫烟12号更活跃。
4 结 论
本研究结果表明:(1)采后烟叶的淀粉合成代谢减弱,分解代谢加强,NtAGPS1和NtGBSS1是采后离体烟叶中碳代谢途径的关键调控基因;离体烟叶直链淀粉合成代谢持续减弱,支链淀粉合成代谢减弱缓慢甚至有上调趋势,推测采后烟叶内部淀粉形态重新发生分配,直链淀粉逐渐向更易水解的支链淀粉转化;采后烟叶糖代谢先逐渐旺盛,当糖代谢底物消耗殆尽或叶片衰老至一定程度,糖代谢又减弱;(2)同一生态条件(豫西烟区)和栽培措施下,秦烟96成熟鲜烟叶中淀粉和糖代谢较豫烟12号强,营养物质充实,且采后烟叶中淀粉分解代谢和糖代谢旺盛,碳水化合物降解转化更加充分;(3)本研究从分子生物学角度分析了同一生态条件下不同烤烟品种采后烟叶淀粉和糖代谢的规律和差异,为进一步探究烘烤过程中烟叶碳代谢规律奠定了试验基础和理论基础。
[1] 鲁黎明,陈勇,鲁逸飞,等. 低钾胁迫对烟草幼苗碳氮代谢基因表达谱的影响[J]. 中国烟草科学,2015,36(4):12-17.LU L M, CHEN Y, LU Y F, et al. The impact of low potassium stress on tobacco gene expression profiles of carbon and nitrogen metabolism[J]. Chinese Tobacco Science, 2015, 36(4)∶ 12-17.
[2] 刘国顺,何永秋,杨永锋,等. 不同钾肥配施对烤烟质体色素和碳氮代谢及品质的影响[J]. 中国烟草科学,2013,34(6):49-55.LIU G S, HE Y Q, YANG Y F, et al. Effects of combining application of various potassium fertilizers on plastid pigment, carbon-nitrogen metabolism and quality in flue-cured tobacco[J]. Chinese Tobacco Science, 2013,34(6)∶ 49-55.
[3] 唐煌,张军杰,鲁黎明,等. 四川三大烟区烤烟淀粉分解酶类及其基因表达差异分析[J]. 南方农业,2017,11(25):31-36.TANG H, ZHANG J J, LU L M, et al. Analysis on the difference of starch decomposing enzymes and their gene expression in flue-cured tobacco of three large tobacco planting areas in Sichuan[J]. South China Agriculture,2017, 11(25)∶ 31-36.
[4] 王涛. 烤烟烟叶淀粉颗粒结构与特性研究[D]. 郑州:河南农业大学,2013.WANG T. Study on granule structure and characteristics of flue-cured tobacco leaves starch[D]. Zhengzhou∶Henan Agricultural University, 2013.
[5] 张松涛,杨永霞,滑夏华,等. 不同生态区烟叶淀粉生物合成动态比较研究[J]. 中国烟草学报,2012,18(4):31-34,40.ZHANG S T, YANG Y X, HUA X H, et al. Comparison of dynamic metabolism of starch biosynthesis in tobacco leaves from different ecological zones[J]. Acta Tabacaria Sinica, 2012, 18(4)∶ 31-34, 40.
[6] 张嘉炜,杨永霞,冯小虎,等. 添加生物碳对烤烟碳氮代谢的影响[J]. 江西农业学报,2016,28(3):1-6.ZHANG J W, YANG Y X, FENG X H, et al. Effects of biochar on carbon and nitrogen metabolism of flue-cured tobacco[J]. Acta Agriculturae Jiangxi, 2016, 28(3)∶ 1-6.
[7] 贾宏昉,陈红丽,黄化刚,等. 施用腐熟秸秆肥对烤烟成熟期碳代谢途径影响的初报[J]. 中国烟草学报,2014,20(4):48-52.JIA H F, CHEN H L, HUANG H G, et al. Preliminary report on effect of applying rotten straw fertilizer on carbon metabolism in maturing flue-cured tobacco[J].Acta Tabacaria Sinica, 2014, 20(4)∶ 48-52.
[8] 杨胜男,张洪映,连文力,等. 复合有机肥对烤烟淀粉生物合成的影响[J]. 中国烟草学报,2016,22(1):64-70.YANG S N, ZHANG H Y, LIAN W L, et al. Effect of compound organic fertilizer on starch biosynthesis in flue-cured tobacco leaves[J]. Acta Tabacaria Sinica, 2016,22(1)∶ 64-70.
[9] 王红丽,杨惠娟,苏菲,等. 氮用量对烤烟成熟期叶片碳氮代谢及萜类代谢相关基因表达的影响[J]. 中国烟草学报,2014,20(5):116-120.WANG H L, YANG H J, SU F, et al. Effects of nitrogen on expression of key genesrelated to carbon/nitrogen metabolism and terpenoid metabolism in maturingflue-cured tobacco leaves[J]. Acta Tabacaria Sinica, 2014, 20(5)∶ 116-120.
[10] 王涛,贺帆,詹军,等. 烤烟淀粉微观结构特性及其与品质关系研究进展[J]. 中国烟草科学,2013,34(1):102-106.WANG T, HE F, ZHAN J, et al. Research advance in microstructure and properties of tobacco starch and their relationship with the quality[J]. Chinese Tobacco Science,2013, 34(1)∶ 102-106.
[11] 王怀珠,杨焕文,郭红英. 烘烤过程中不同成熟度烟叶淀粉的降解动态[J]. 烟草科技,2004(10):36-39.WANG H Z, YANG H W, GUO H Y. Studies on starch degradation in tobacco leaves of different maturity during flue-curing[J]. Tobacco Science & Technology,2004(10)∶ 36-39.
[12] 王洪波,徐玉琼,王颖,等. 高氯酸超声萃取—连续流动法测定烟草中的淀粉[J]. 烟草科技,2009(5):44-47.WANG H B, XU Y Q, WANG Y, et al. Determination of starch in tobacco by ultrasonic extraction and continuous flow method[J]. Tobacco Science & Technology, 2009(5)∶44-47.
[13] 丁福章,李继新,袁有波,等. 烟草不同组织总RNA的提取方法初探[J]. 中国农学通报,2007,23(12):98-101.DING F Z, LI J X, YUAN Y B, et al. Effective isolation of total RNA from tobacco tissues[J]. Chinese Agricultural Science Bulletin, 2007, 23(12)∶ 98-101.
[14] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J]. METHODS, 2001, 25∶402-408.
[15] 袁亮,潘光堂,张志明,等. 植物中淀粉的代谢及其调控研究进展[J]. 分子植物育种,2006,4(6S):65-72.YUAN L , PAN G T, ZHANG Z M, et al. Research progress of starch metabolism and its regulation in plants[J]. Molecular Plant Breeding, 2006, 4(6S)∶ 65-72.
[16] 张海艳,董树亭,高荣岐. 植物淀粉研究进展[J]. 中国粮油学报,2006,21(1):41-46.ZHANG H Y, DONG S T, GAO R Q. The study progress in plant starch[J]. Journal of the Chinese Cereals and Oils Association, 2006, 21(1)∶ 41-46.
[17] 康国章,王永华,郭天财,等. 植物淀粉合成的调控酶[J]. 遗传,2006,28(1):110-116.KANG G Z, WANG Y H, GUO T C, et al. Key enzymes in starch synthesis in plants[J]. Hereditas(Beijing), 2006,28(1)∶ 110-116.
[18] TAKEDA Y, GUAN H P, PREISS J. Branching of amylose by the branching isoenzymes of maize endosperm[J]. Carbohydrate Research, 1993, 240∶253-263.
[19] 黄冰艳,李忠谊,吉万全,等. 利用RNA干扰技术抑制水稻淀粉极限糊精酶基因表达[J]. 农业生物技术学报,2007,15(1):71-75.HUANG B Y, LI Z Y, JI W Q, et al. Down-regulation of rice pullulanase gene expression by RNA interference[J].Journal of Agricultural Biotechnology, 2007, 15(1)∶71-75.
[20] 郑义,陆维忠,马鸿翔. 植物淀粉生物合成的研究进展[J]. 江苏农业科学,2009(6):13-16.ZHENG Y, LU W Z, MA H X. Progress of biosynthesis of plant starch[J]. Jiangsu Agricultural Sciences, 2009(6)∶13-16.
[21] BUSTOS R, FAHY B, HYLTON C M, et al. Starch granule initiation is controlled by a heteromultimeric isoamylase in potato tubers[J]. Proc. Natl. Acad. Sci.USA, 2004, 101(7)∶ 2215-2220.
[22] 张晓宇,艾志录,李梦琴,等. 极限糊精酶的研究进展及展望[J]. 中国食品添加剂,2004(3):32-35,72.ZHANG X Y, AI Z L, LI M Q, et al. The research progress and prospect of limit dextrinase[J]. China Food Additives, 2004, 03∶32-35,72.
[23] 张东方,崔大方,赵赣,等. 植物叶片暂时淀粉分解途径研究进展[J]. 西北植物学报,2011,31(9):1927-1932.ZHANG D F, CUI D F, ZHAO G , et al. Advance on the pathway of transitory starch degradation in leaves[J].Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(9)∶1927-1932.
[24] 段丽斌,崔国民,赵昶灵,等. 烤烟烘烤中烟叶淀粉降解的研究进展[J]. 中国农学通报,2013,29(18):180-186.DUAN L B, CUI G M, ZHAO C L, et al. Research advances in the degradation of the leaf starch of the flue-cured tobacco during flue-curing[J]. Chinese Agricultural Science Bulletin, 2013, 29(18)∶ 180-186.
[25] 黄东亮,李双喜,廖青,等. 植物蔗糖磷酸合成酶研究进展[J]. 中国生物工程杂志,2012,32(6):109-119.HUANG D L, LI S X, LIAO Q, et al. Advances on sucrose phosphate synthase in plants[J]. China Biotechnology, 2012, 32(6)∶ 109-119.
[26] 张永平,乔永旭,喻景权,等. 园艺植物果实糖积累的研究进展[J]. 中国农业科学,2008,41(4):1151-1157.ZHANG Y P, QIAO Y X, YU J Q, et al. Progress of researches of sugar accumulation mechanism of horticultural plant fruits[J]. Scientia Agricultura Sinica,2008, 41(4)∶ 1151-1157.
[27] 张明方,李志凌. 高等植物中与蔗糖代谢相关的酶[J].植物生理学通讯,2002,38(3):289-294.ZHANG M F, LI Z L. Sucrose-metabolizing enzymes in higher plants[J]. Plant Physiology Communications,2002, 38(3)∶ 289-294.
[28] 刘炳清,许嘉阳,黄化刚,等. 不同海拔下烤烟碳氮代谢相关酶基因的表达差异分析[J]. 植物生理学报,2015,51(2):183-188.LIU B Q, XU J Y, HUANG H G, et al. Analysis of differential gene expression of the related enzymes in carbon and nitrogen metabolism of flue-cured tobacco at different altitudes[J]. Plant Physiology Journal, 2015,51(2)∶ 183-188.
[29] 宫长荣. 烟草调制学[M]. 北京:中国农业出版社,2011.GONG C R. Tobacco modulation[M]. Beijing∶ China Agriculture Press, 2011.
[30] 李春艳,聂荣邦. 烟叶烘烤过程中部分化学成分的动态变化研究进展[J]. 作物研究,2005(5):390-394.LI C Y, NIE R B. Research progress in dynamic changes of some chemical components during flue curing[J].Crop Research, 2005(5)∶ 390-394.
[31] 张生杰,黄元炯,任庆成,等. 不同基因型烤烟烟叶碳氮代谢差异研究[J]. 华北农学报,2010,25(3):217-220.ZHANG S J, HUANG Y J, REN Q C, et al. Differences in foliar carbon and nitrogen metabolism among genotypes of flue-cured tobacco[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(3)∶ 217-220.
[32] 张凯. 洛阳烟区烤烟品种筛选与配套技术的推广应用[D]. 郑州:河南农业大学,2015.ZHANG K. Screening of varieties of flue-cured tobacco and promotion and application of the supporting technology in Luoyang tobacco-growing areas[D].Zhengzhou∶ Henan Agricultural University, 2015.
[33] 孙渭,陈志强,马英明,等. 烤烟新品种秦烟96的选育及其特征特性[J]. 中国烟草科学,2012,33(2):28-33.SUN W, CHEN Z Q, MA Y M, et al. Breeding and characteristics of a new flue-cured tobacco variety Qinyan96[J]. Chinese Tobacco Science, 2012, 33(2)∶28-33.
[34] 李佳佳,卢未琴,高群玉. 不同链淀粉含量玉米微晶淀粉理化性质研究[J]. 粮食与油脂,2011(2):13-17.LI J J, LU W Q, GAO Q Y. Studies on physicochemical properties of microcrystalline starches made from different content of amylose[J]. Cereals & Oils, 2011(2)∶13-17.

