基于RAD-seq数据开发烟草多态性SSR标记
李海洋,李荣华,夏岩石,袁清华,张振臣,赵伟才,郭培国*
简单重复序列(simple sequence repeat, SSR)又称为微卫星序列,是以1~6个核苷酸为单位多次串联重复组成的 DNA序列[1],而基于其开发出的DNA分子标记具有特异性强、共显性、稳定性高以及操作简单等诸多优点,已经广泛应用到大豆、小麦、水稻等作物的遗传研究[2-4]。虽然已有 SSR标记应用于烟草的遗传图谱构建[5]、遗传多样性分析[6]、基因定位[7-8]等方面的研究报道,但与其他作物相比,烟草中可用的SSR标记较少。
根据 EST和基因组的 DNA序列挖掘和开发SSR标记作为传统方法,在其他植物中已经有大量应用[9-10],在烟草中亦有报道。如根据野生绒毛状烟草基因组的测序结果,分析了SSR位点的组成、分布及特征[11];利用3种烟草基因组信息,对SSR位点的分布情况进行探索,并设计出SSR引物组合[12];根据烟草EST序列数据分析了EST-SSR位点信息及分布特征,并设计了一些SSR引物组合[13-15]。但由于常规栽培的普通烟草为异源四倍体,基因组较为复杂[16],且我国的烟草品种还存在遗传狭窄的问题[17],开发出的SSR标记多态性水平低[16,18-19],制约了烟草SSR标记的利用,导致SSR标记在烟草中的研究和应用相对较薄弱。
近年来,在第2代测序基础上建立的简化基因组测序技术,可利用酶切技术、序列捕获芯片技术等其他手段降低物种基因组复杂程度,进而了解物种部分基因组的特性。目前,主要应用的简化基因组测序技术包括复杂度降低的多态序列测序(complexity reduction of polymorphic sequences,CRoPS)[20]、基因分型测序技术(genotyping by sequencing, GBS)[21]、限制性酶切位点相关的DNA测序(restriction-site associated DNA, RAD-seq)[22]。其中应用较为广泛的 RAD-seq是利用酶切技术降低基因组的复杂度,对酶切产生的RAD-tag进行高通量测序,能够开发大量的SNP和SSR标记,而且具有成本低、准确率高、不受参考基因组序列限制等优点[23]。运用该方法,已经在茄子[24]、菠萝[25]、花生[26]等其他植物上开发出 SSR标记并应用于遗传分析。
本研究利用RAD-seq技术,对两份烟草材料进行简化基因组测序,分析SSR位点的数量、重复序列次数、基序类型,大规模开发SSR分子标记,并发现在两个材料之间具有多态性的SSR标记,可降低具多态性SSR标记引物筛选的工作量和成本,为多态性SSR标记的筛选和应用提供参考。
1 材料与方法
1.1 供试材料
供试4份烟草材料中“118-3”和“粤烟98”由广东省烟草南雄科学研究所提供,“大叶密合”和“长脖黄”由广东省农业科学院作物研究所提供。其中用于简化基因组测序的两份烟草材料中,“118-3”为广东省特色烤烟品种,“粤烟98”是赵伟才等[27]以“Coker206”为母本、“K326”为父本选育的烤烟新品种。另外两份材料“大叶密合”和“长脖黄”分别为广东省优良的地方晒烟品种和河南省优良地方烤烟品种。2016年3月采取4份烟草材料的新鲜叶片,利用李荣华等[28]改良的CTAB法提取4份烟草材料基因组DNA,琼脂糖凝胶电泳和微孔板分光光度计检测DNA的质量。
1.2 简化基因组测序
利用RAD-seq技术,对“118-3”和“粤烟98”两份烟草材料的基因组DNA进行简化测序。操作流程简述如下:选用六碱基限制性内切酶 EcoR I酶切基因组DNA,构建RAD文库,利用Illumina MiSeq PE300平台进行高通量测序;测序所得的原始数据进行过滤、质检、评估等分析,获得各个样品的干净读长(clean reads)及序列数据。过滤参数如下:去除含adapter的reads,去除含N比例大于10%的reads,去除低质量reads(质量值Q≤20的碱基数占整条read的50%以上)。
1.3 基因组SSR位点的鉴别及SSR引物的设计
利用Burrows-Wheeler Aligner(BWA)version 0.7.12软件将过滤后得到的clean reads与参考烤烟基因组K326进行比对,利用MISA(http∶//pgrc.ikpgatersleben.de/misa)软件在read覆盖的参考基因组序列中查找SSR位点。配置参数如下:单核苷酸、二核苷酸、三核苷酸、五核苷酸和六核苷酸最低重复次数分别为15、6、5、4、4和4,相邻 SSR序列间隔区域长度不小于100 bp。根据SSR位点两翼的序列,利用Primer 3.0软件设计SSR引物。对两份测序样品中共有的 SSR位点进行序列分析,若SSR位点在两份测序材料之间存在重复差异即为多态性SSR。
1.4 PCR扩增和检测方法
PCR反应体系为10 μL,其中包含30 ng/μL的DNA 模板 2 μL;10×PCR Buffer 1.2 μL,10 μmol/L的正反向引物各 0.2 μL;10 mmol/L dNTPs 0.3 μL,Taq DNA 聚合酶(5 U/μL)0.1 μL,dd H20 6.0 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性45 s,适宜退火温度45 s(退火温度视引物的不同而改变),72 ℃延伸1 min,35个循环;72 ℃充分延伸10 min。PCR产物采用6%非变性聚丙烯酰胺凝胶电泳分离,按照郭培国等[29]改良的银染技术进行染色检测PCR扩增产物。
2 结 果
2.1 烟草简化基因组序列的产出和质量检测
烟草简化基因组测序结果显示,“118-3”和“粤烟98”两个烟草样品分别获得45 120 744和50 362 336 clean reads,分别具有6.63 Gb和7.42 Gb的原始数据(表 1)。对原始数据进行质量控制、过滤,2个样品共获得95 480 084个高质量干净读长(HQ clean reads),平均Q30(测序碱基质量值,即测序时错误识别的概率是0.1%、正确率为99.9%的碱基比例)为93.99%,平均GC含量为38.78%。从表1中可以看出,过滤前后差异很小,Q30处于较高水平,表明测序数据可靠;但GC含量处于较低水平,对本试验测序反应影响不大。
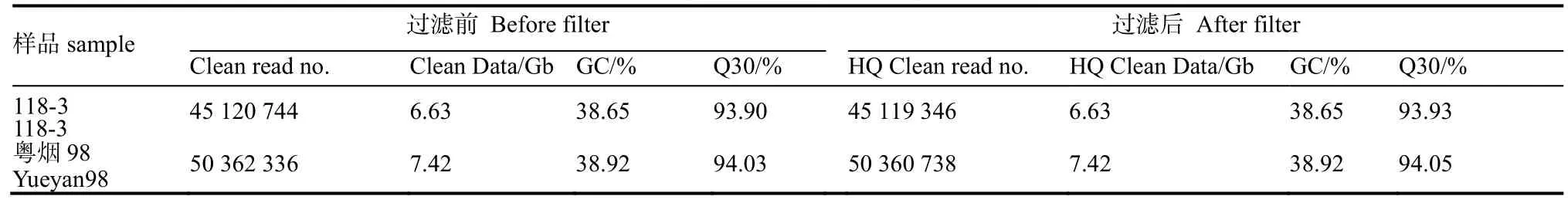
表1 RAD-seq基因组测序数据统计表Table 1 Summary of genomic sequences generated by RAD-seq
2.2 烟草简化基因组中SSR位点的频率和分布
运用BWA软件将“118-3”和“粤烟98”简化测序获得的clean reads与参考基因组进行比对,分别比对上44 995 698和50 187 807个reads。在此基础上,利用 MISA软件在比对到参考基因组上的reads覆盖区域中搜索SSR位点,在“118-3”和“粤烟98”中分别检测到19 746和20 340个reads含有1个或以上的SSR位点,其中两份材料中共有SSR位点的reads数为17 941个。两份材料中共检测到22 145个reads上含有25 343个SSR位点;这些含有SSR位点reads中,其中有17 882(80.74%)个reads含有1个SSR位点,剩余的reads含有2个或以上的SSR位点。
在所发现的SSR位点中,完全重复型(P型)所占的比例最大,共计 23 660个,占位点总数的93.35%;复合型(C型)只有 1683个,占位点总数的6.65%(表2)。P型SSR位点中,二核苷酸类型出现比例最高,达 10 513个,占位点总数的41.48%;其次是三核苷酸,为 7631个(30.11%);单核苷酸和四核苷酸的差别不大,分别为 2595(10.23%)和2108个(8.31%);五核苷酸和六核苷酸最少,分别只有451(1.77%)和362个(1.42%)。从表2还可以看出,P型SSR位点中,以六核苷酸类型重复序列的平均长度最长,达到 26 bp;四核苷酸的平均长度最短,为17 bp;C型SSR位点的平均长度较长,为28 bp。
在P型SSR位点中共发现298种基序,出现频率最高的基序是AT/TA,为5337个位点,占总SSR位点数的21.06%;随后分别为T/A(2278个位点,8.99%)、AG/CT(1383个位点,5.46%)和TC/GA(1066个位点,4.21%);此外TTG/CAA(816)、AAC/GTT(834)、AAG/CTT(461)、TTA/ATT(644)、TAT/ATA(539)、TTC/GAA(881)和AAAT/ATTT(805)基序达到总SSR位点数的1.5%以上(表2)。
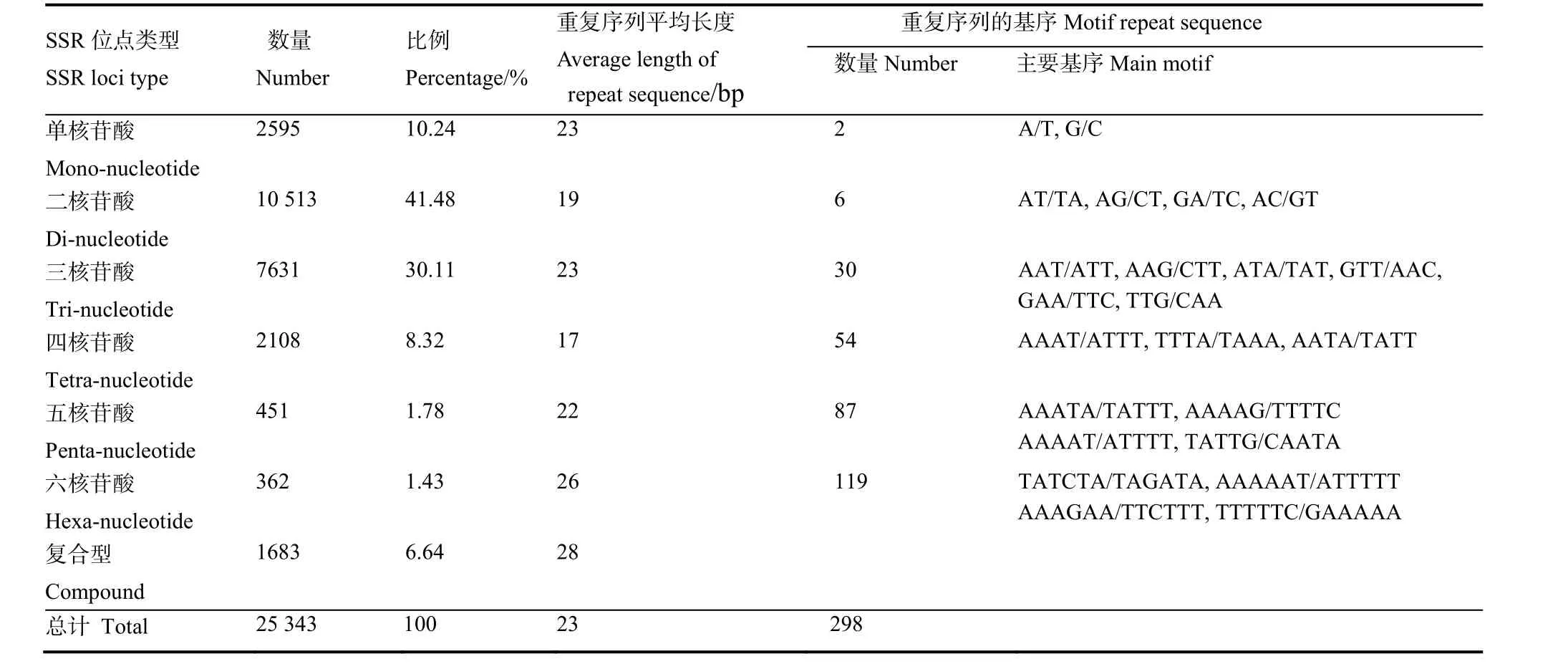
表2 烟草基因组中的SSR位点的分布信息Table 2 Distribution of SSR loci in the tobacco genome
2.3 烟草基因组SSR位点基序重复次数
烟草不同类型SSR位点基序的重复次数如表3所示。从中可见,单核苷酸的基序重复次数集中在15~18次,二核苷酸和三核苷酸基序重复次数主要分布在6~9次和5~8次,四核苷酸在4~6次,而五和六核苷酸基序的重复次数主要集中在4~5次。从SSR位点基序重复次数来看,以6次基序重复次数的SSR位点数最高,达到5171个SSR位点,占总SSR位点数20.4%;5次和7次重复次数分别为3945和3141个SSR位点,占总SSR位点数15.56%和12.39%。另外,从表3还可以看出,各个SSR位点类型出现的频率均存在随重复次数的增加而逐渐下降的趋势。
2.4 烟草简化基因组SSR引物设计与多态性验证
利用Primer 3.0软件对25 343个SSR位点进行引物设计,成功设计出23 346对SSR引物,引物设计的成功率为 92.12%;根据“118-3”和“粤烟98”两份材料的简化测序数据,初步发现其中有323对引物的SSR位点在两份材料间具有多态性,多态性比例为1.38%。
随机选择50对具有多态性位点的SSR引物,利用两份简化测序烟草材料和另两份烟草种质材料对SSR位点的多态性进行验证(图1),SSR引物信息及验证结果如表4所示。从中可见50对引物在两个简化测序样品中均能扩出清晰的条带,其中有 38对引物的扩增产物具有多态性,多态率达到76%;在另两份种质材料中有48对引物能扩增出清晰条带,有效扩增率达96%,其中有10对引物的扩增产物具有多态性,多态率为20%。
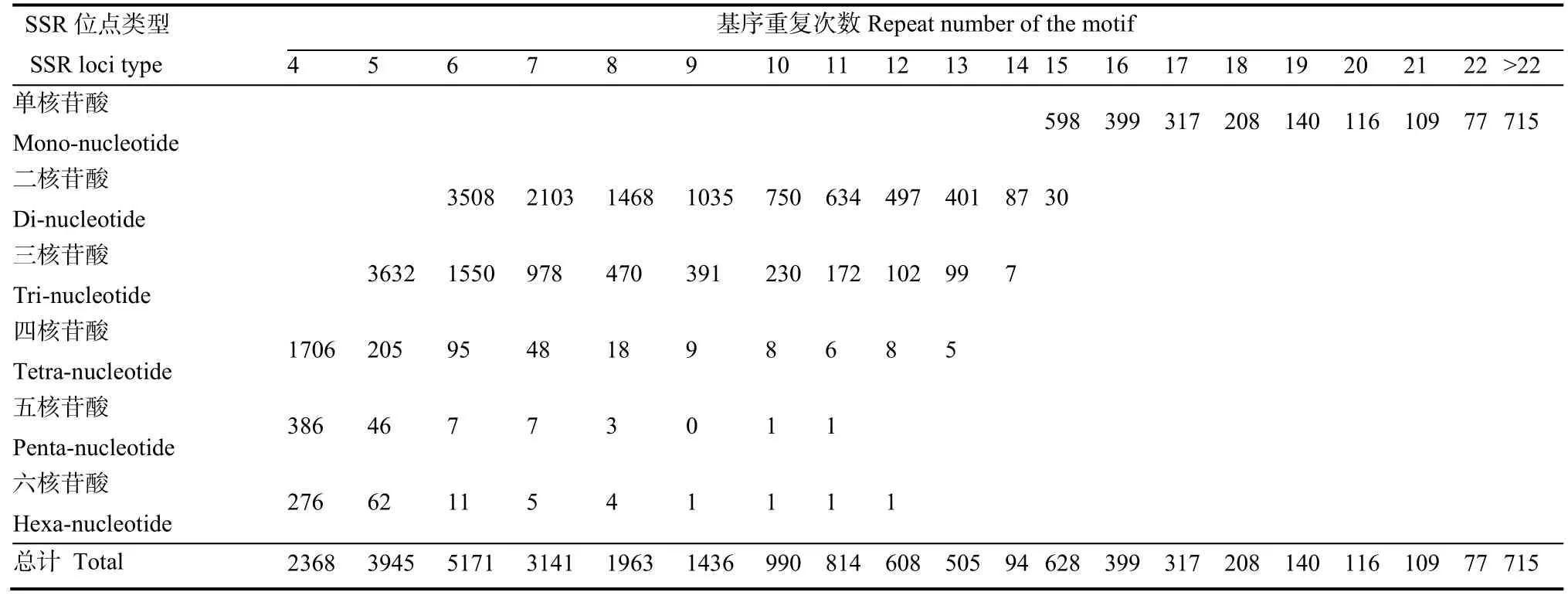
表3 烟草基因组中SSR位点的基序重复次数分布Table 3 Distribution of repeat numbers of SSR motifs in tobacco genome
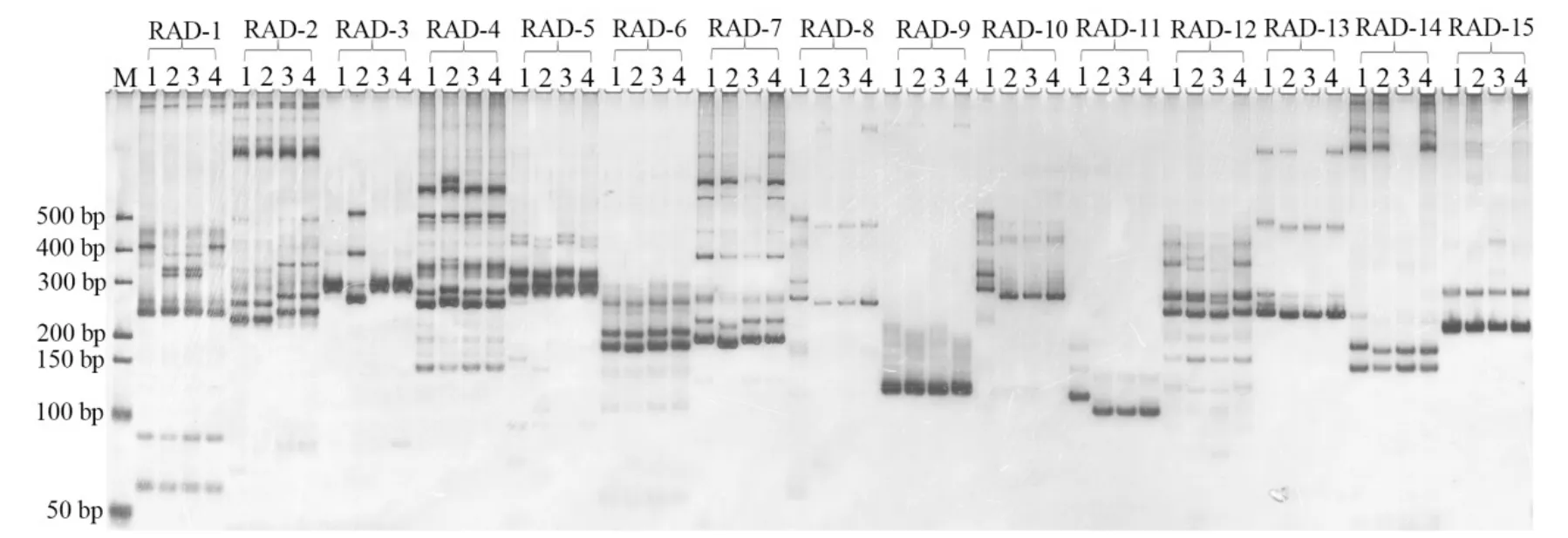
图1 部分SSR引物在4份烟草材料中扩增产物的银染图Fig. 1 Image of silver staining for PCR amplicons of partial SSR primer pairs in four tobacco genotypes
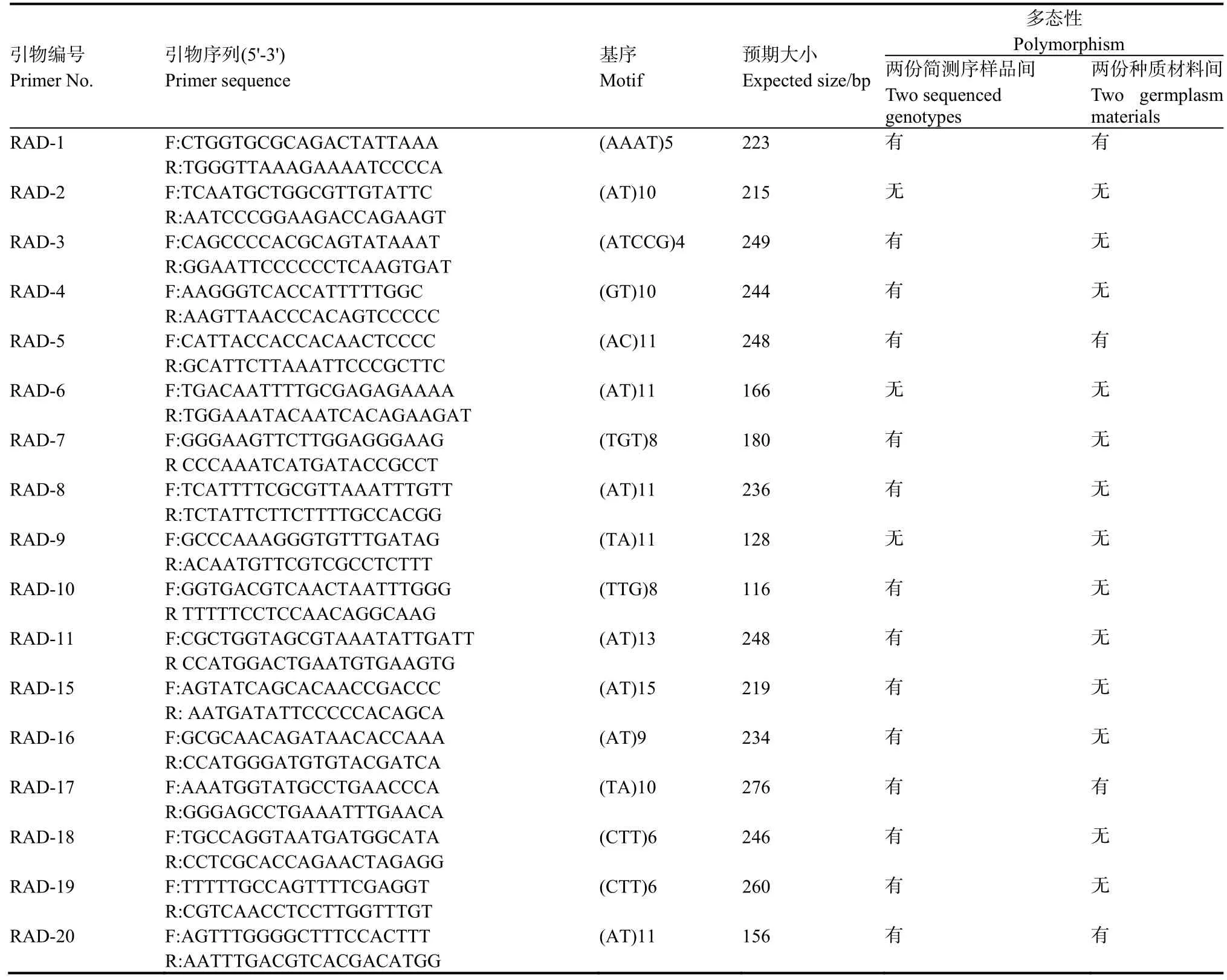
表4 50对SSR引物在4份烟草材料中扩增产物的多态性分析Table 4 Polymorphic analysis for PCR amplicons of 50 SSR primer pairs in 4 tobacco genotypes
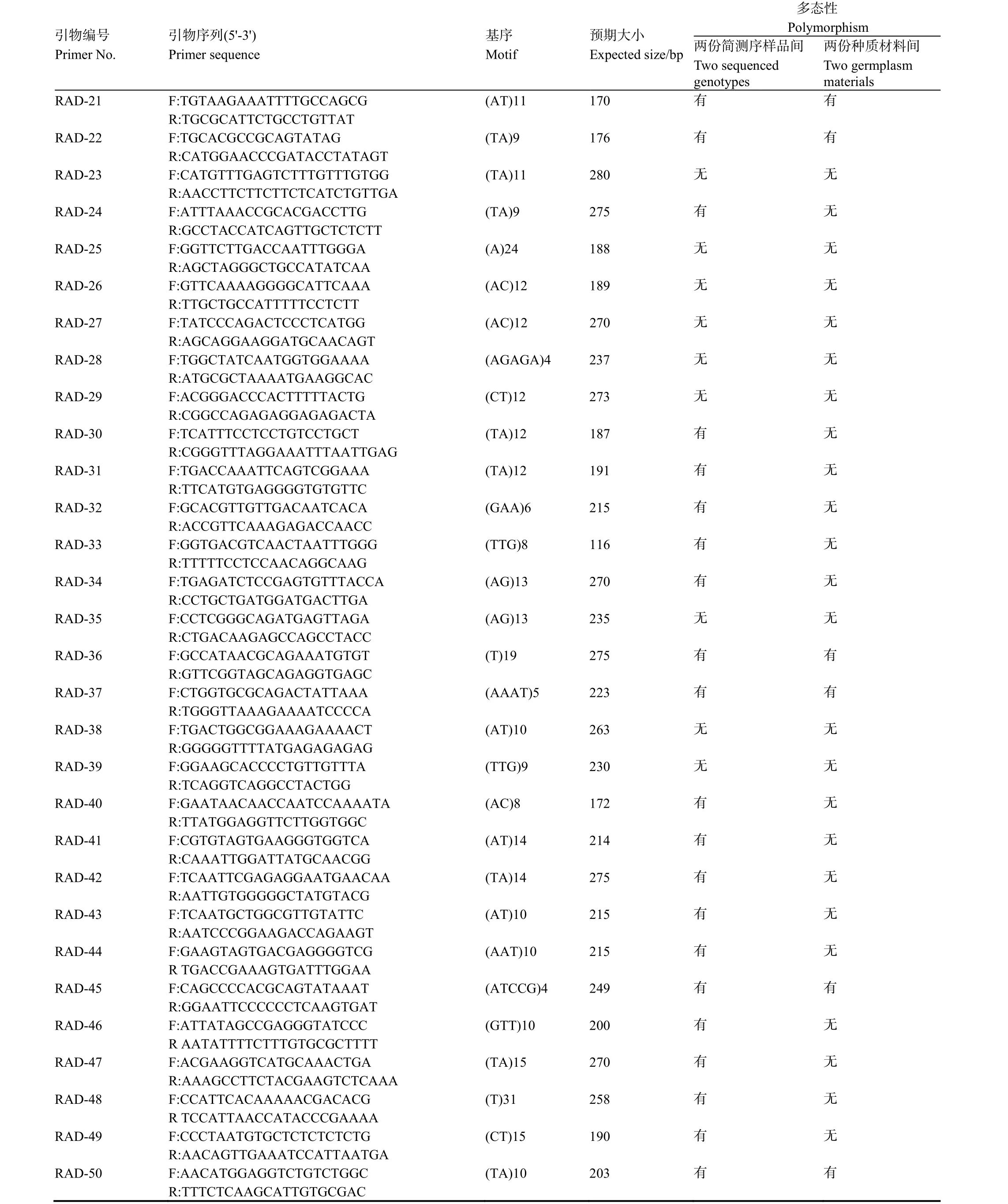
表4 (续)Table 4 (Continued)
3 讨 论
3.1 烟草简化基因组SSR位点分布特征
本研究在两份烟草材料简化基因组中共检测到2种类型SSR位点:P型和C型。P型SSR位点中,二、三核苷酸类型出现的频率最高,达到SSR位点总数的 71.59%,这与童治军等[19]利用 3份烟草基因组序列数据搜索的 SSR位点的基序结果一致,也与其他作物[3,9,30]基因组中SSR位点的分布特征相符。在SSR基序的结构方面,共发现298种重复类型的基序,以T/A、AT/TA、TC/GA、CT/AG、AAT/ATT、AAC/GTT、ACA/TGT、GAA/TTC 和AAAT/ATTT基序最为丰富,此结果与前人在烟草基因组和EST序列研究所得的结果一致[15,19],但与水稻[9,30]SSR位点中主要基序类型有所不同。另外,C型 SSR位点占总 SSR位点数的 6.65%,低于BOSAMIA等[31]在花生EST序列中检测到10.38%的C型SSR位点,但未有在烟草基因组或EST序列研究中关于C型SSR位点的相关报道。
本研究所获得的reads和检测到的SSR位点中的基序结构中,均存在富含A、T和较低的G、C碱基的情况,且存在SSR位点的基序中G、C出现的越少,则该基序的分布频率越高的现象;这一现象在多种真核生物基因组SSR位点中也有发现[32]。形成这一现象的原因可能是与GC、AT碱基对之间所含的能量相关,即AT比GC更容易变动[19,32]。
3.2 SSR标记的开发和多态性SSR标记
随着新一代高通量测序技术的快速发展,测序的成本和时间大大减少,基于基因组序列开发SSR标记的方法已经成为植物研究中 SSR标记开发的重要手段[33-34]。虽然烟草全基因组测序已经完成[35],并可根据基因组序列设计出大量的SSR引物组合。但由于常规栽培烟草品种之间亲缘关系较近,可用的SSR标记多态性水平低,从而造成一些研究成本的增加。如刘文杰等[36]选用 1405对由 BINDLER等[1,5]和TONG等[37]开发的SSR引物对烟草青枯病进行定位时,只发现214(15.23%)对SSR引物在两亲本材料间(“118-3”和“粤烟 98”)具有多态性。TONG等[38]选用5718对依据基因组数据开发的SSR引物,对烟草赤星病进行QTL定位时,发现只有227对引物的扩增产物具有多态性,多态率仅为3.96%。刘文杰等[17]选用90对前人开发的SSR引物分析94份烟草核心种质资源的遗传多样性时,只有17对引物检测出34个等位变异位点,平均PIC值只有0.2811。本研究利用简化基因组测序技术开发和设计出23 346对SSR标记引物,并依据两个测序样品间的序列数据,初步发现 323对引物的SSR位点具有多态性,以减少在引物合成及其筛选的成本和工作量。在利用 4份烟草材料对多态性SSR进行验证时,发现在两份测序样品中多态率达到76%,并发现24%的假阳性,可能是因为测序结果有一定的错误率造成,或者是多态性验证时所采用的 6%非变性聚丙烯酰胺凝胶的分辨率不足,造成一部分多态性SSR标记验证结果错误[38]。同时,在另外两份种质材料中也发现了20%的多态率,该比率高于牟建英等[39]在“台烟 7号”和“NC89”两份烟草材料间得到的 4.8%以及高亭亭等[40]在“Beinhart1000-1”和“小黄金 1025”两份烟草材料间得到的7.2%。值得说明的是,多态性SSR在4份材料之间的多态率高达84%,表明开发的多态性标记不仅能够用于两个测序材料的后续基因定位,也能用于种质资源的遗传多样性分析。另外,一些研究发现,基因组或EST序列中SSR位点的重复序列长度与所开发出 SSR标记的多态性有关,即SSR位点的重复序列越长,多态性出现的概率越大,且认为当SSR位点中重复序列长度≥20 bp,多态性的比例高[33,41]。本研究开发的323个多态性SSR中只有2个重复序列的长度低于20 bp,也表明重复序列的长度与其多态性相关。最后,单从多态性SSR开发和选用前人开发的 SSR的研究成本角度考虑,由于测序技术快速发展,测序分析开发多态性 SSR的研究成本显著低于选用前人开发的 SSR标记,尤其在遗传距离较近的材料中。综上所述,简化基因组测序可快速高效开发烟草多态性 SSR标记,为后续的 QTL定位和遗传多样性分析等研究提供基础。
4 结 论
通过对两份烟草材料“118-3”和“粤烟 98”进行简化基因组测序,共检测到25 343个SSR位点,依据序列设计出23 346对SSR标记引物组合;序列对比发现其中323对SSR引物组合在两份测序材料间具有多态性,试验验证表明其多态率为76%。研究结果表明,简化基因组测序可为烟草具有多态性SSR标记的开发和应用提供参考,亦可为后续的QTL定位和遗传多样性分析等研究提供基础。
[1] BINDLER G, HOEVEN V, GUNDUZ I, et al.Microsatellite marker based linkage map of tobacco[J].Theoretical and Applied Genetics, 2007, 114(2)∶ 341-349.
[2] SONG Q J, JIA G F, ZHU Y L, et al. Abundance of SSR motifs and development of candidate polymorphic SSR markers (BARCSOYSSR_1.0) in soybean[J]. Crop Science, 2010, 50(5)∶ 1950-1960.
[3] EUIJAY I, SORRELLS M E, BAUM M, et al. Isolation of EST-derived micro-satellite markers for genotyping the A and B genomes of wheat[J]. Theoretical and Applied Genetics, 2002, 104(2)∶ 399-407.
[4] SINGH A K, SINGH P K, ARYA M, et al. Molecular screening of blast resistance genes in rice using SSR markers[J]. Plant Pathology Journal, 2015, 31(1)∶ 12-24.
[5] BINDLER G, PLIESKE J, BAKAHER N, et al. A high density genetic map of tobacco (Nicotiana tabacumL.)obtained from large scale microsatellite marker development[J]. Theoretical and Applied Genetics, 2011,123(2)∶ 219-230.
[6] 吴超,夏岩石,李荣华,等. 烟草青枯病抗性与分子标记的关联分析[J]. 烟草科技,2015,48(10):1-12.WU C, XIA Y S, LI R H, et al. Association analysis of tobacco bacterial wilt resistance with molecular markers[J]. Tobacco Science & Technology, 2015,48(10)∶ 1-12.
[7] QIAN Y L, WANG X S, WANG D Z, et al. The detection of QTLs controlling bacterial wilt resistance in tobacco (Nicotiana TabacumL.)[J]. Euphytica, 2013,192(2)∶ 259-266.
[8] LAN T, ZHENG S P, YANG L, et al. Mapping of quantitative trait loci conferring resistance to bacterial wilt in tobacco (Nicotiana tabacumL.)[J]. Plant Breeding,2015, 133(5)∶ 672-677.
[9] KANTETY R V, ROTA M L, MATTHEWS D E, et al.Data mining for simple sequence repeats in expressed sequence tags from barley, maize, rice, sorghum and wheat[J]. Plant Molecular Biology, 2002, 48(5)∶ 501-510.
[10] CHEN H M, LI L Z, WEIX Y, et al. Development,chromosome location and genetic mapping of EST-SSR markers in wheat[J]. Chinese Science Bulletin, 2005,50(20)∶ 2328-2336.
[11] 王卫锋,晁江涛,龚达平,等. 绒毛状烟草基因组中SSR位点的信息分析[J]. 中国烟草科学,2011,32(3):32-35,40.WANG W F, CHAO J T, GONG D P, et al. Analysis of SSR information inN.tomentosiformisgoodspeed genome[J]. Chinese Tobacco Science, 2011, 32(3)∶ 32-35,40.
[12] 童治军,肖炳光. 3种烟草基因组SSR位点信息分析和标记开发[J]. 西北植物学报,2014,34(8):1549-1558.TONG Z J, XIAO B G. Survey of SSR loci information in three tobacco genomes and development of SSR markers[J]. Acta Botanica Boreali-Occidentalia Sinica,2014, 34(8)∶ 1549-1558.
[13] 张俊娥,李芬,孙蒙祥. 烟草EST-SSR位点分析[J]. 武汉植物学研究,2007,25(5):427-431.ZHANG J E, LI F, SUN M X. Analysis of EST-SSR loci in tobacco (Nicotiana tabacumL)[J]. Journal of Wuhan Botanical Research, 2007, 25(5)∶ 427-431.
[14] 胡重怡,蔡刘体,陈兴江. 烟草ESTs资源的SSR信息分析[J]. 生物技术通报,2009,25(7):82-85,93.HU C Y, CAI L T, CHEN X J. Analysis of SSR information in ESTs resource of tobacco (Nicotiana tabacum)[J]. Biotechnology Bulletin, 2009, 25(7)∶ 82-85,93
[15] 薛金爱,赵彦宏. 烟草SSR分布特征与开发利用[J]. 山西农业科学,2011,39(4):295-298,306.XUE J A, ZHAO Y H. Distribution characteristics and utilization of SSRs inNicotiana tabacum[J]. Journal of Shanxi Agricultural Sciences, 2011, 39(4)∶ 295-298, 306.
[16] MOON H S, NICHOLSON J S, HEINEMAN A, et al.Changes in genetic diversity of U.S. Flue-cured tobacco germplasm over seven decades of cultivar development[J]. Crop Science, 2009, 49(2)∶ 498-508.
[17] 刘文杰,李荣华,夏岩石,等. 利用荧光SSR和MFLP标记技术分析烟草核心种质的遗传多样性[J]. 分子植物育种,2016,14(10):2869-2881.LIU W J, LI R H, XIA Y S, et al. Analysis of genetic diversity for core tobacco germplasm by using fluorescent SSR and fluorescent MFLP marker techniques[J]. Molecular Plant Breeding, 2016, 14(10)∶2869-2881.
[18] MOON H S, NIFONG J M, NICHOLSON J S, et al.Microsatellite-based analysis of tobacco (Nicotiana tabacumL.)genetic resources[J]. Crop Science, 2009,49(6)∶ 2149-2159.
[19] 童治军,焦芳婵,肖炳光. 普通烟草及其祖先种基因组SSR 位点分析[J]. 中国农业科学,2015,48(11):2108-2117.TONG Z J, JIAO F C, XIAO B G. Analysis of SSR loci inNicotina tabacumgenome and its two ancestral species genome[J]. Scientia Agricultura Sinica, 2015, 48(11)∶2108-2117.
[20] ALTSHULER D, POLLARA V J, COWLES C R, et al. An SNP map of the human genome generated by reduced representation shotgun sequencing[J]. Nature, 2000,407(6803)∶ 513-516.
[21] ELSHIRE R J, GLAUBITZ J C, SUN Q, et al. A robust,simple genotyping-by-sequencing (GBS) approach for high diversity species[J]. PloS ONE, 2011, 6(5)∶ e19379.
[22] MILLER M R, DUNHAM J P, AMORES A, et al. Rapid and cost-effective polymorphism identification and genotyping using restriction site associated DNA (RAD)markers[J]. Genome Res, 2007, 17(2)∶ 240-248.
[23] 王洋坤,胡艳,张天真. RAD-seq技术在基因组研究中的现状及展望[J]. 遗传,2014,36(1):41-49.WANG Y K, HU Y, ZHANG T Z. Current status and perspective of RAD-seq in genomic research[J]. Hereditas,2014, 36(1)∶ 41-49.
[24] BARCHI L, LANTERI S, PORTIS E, et al. Identification of SNP and SSR markers in eggplant using RAD tag sequencing[J]. Bmc Genomics, 2011, 12(1)∶ 304.
[25] URASAKI N, GOEKU S, KANESHIMA R, et al. Leaf margin phenotype-specific restriction-site-associated DNA-derived markers for pineapple (Ananas comosusL.)[J].Breeding Science, 2015, 65(3)∶ 276-284.
[26] GUPTA S K, BAEK J, ACARRASQUILLA-GARCI N, et al. Genome-wide polymorphism detection in peanut using next-generation restriction-site-associated DNA (RAD)sequencing[J]. Molecular Breeding, 2015, 35(7)∶ 145.
[27] 赵伟才,邱妙文,陈杰,等. 烤烟新品种粤烟98的选育及其特征特性[J]. 中国烟草学报,2013,19(4):35-40.ZHAO W C, QIU M W, CHEN J, et al. Breeding of new flue-cured tobacco variety Yueyan98 and its characteristics[J]. Acta Tabacaria Sinica, 2013, 19(4)∶35-40.
[28] 李荣华,夏岩石,刘顺枝,等. 改进的 CTAB提取植物DNA方法[J]. 实验室研究与探索,2009,28(9):14-16.LI R H, XIA Y S, LIU S Z, et al. CTAB-improved method of DNA extraction in plant[J]. Research and Exploration in Laboratory, 2009, 28(9)∶ 14-16.
[29] 郭培国,刘文杰,李海洋,等. 一种快速有效检测 SSR标记的非变性聚丙烯酰胺凝胶的银染方法[J]. 广州大学学报(自然科学版),2016,15(4):8-12.GUO P G, LIU W J, LI H Y, et al. A rapid and effective method of silver staining for detecting SSR markers in nondenaturing polyacrylamide gels[J]. Journal of Guangzhou University(Natural Science Edition), 2016,15(4)∶ 8-12.
[30] LAWSON M J, ZHANG L Q. Distinct patterns of SSR distribution in the Arabidopsis thaliana and rice genomes[J].Genome Biology, 2006, 7(2)∶ R14.
[31] BOSAMIAT C, MISHRA G P, THANKAPPAN R, et al.Novel and stress relevant EST derived SSR markers developed and validated in peanut[J]. PloS One, 2015, 10(6)∶e0129127.
[32] TOTH G, GASPARI Z, JURKA J. Microsatellites in different eukaryotic genomes∶ survey and analysis[J].Genome Research, 2000, 10(7)∶ 967-981.
[33] 李荣华,王直亮,陈静芳,等. 菜薹转录组中 SSR信息与可用性分析[J]. 园艺学报,2016,43(9):1816-1824.LI R H, WANG Z L, CHEN J F, et al. Analysis of SSR information in transcriptome and their usability in flowering Chinese cabbage[J]. Acta Horticulturae Sinica, 2016, 43(9)∶1816-1824.
[34] 米奇,龙志成,MUCHUKU J K,等. 基于新一代高通量测序技术开发巨人半边莲Lobelia deckenii的SSR标记[J].植物科学学报,2015,33(6):847-854.MI Q, LONG Z C, MUCHUKU J K, et al. Development of SSR markers in giant lobeia(Lobeia deckenii) based on next-generation high-through sequencing[J]. Plant Science Jounal, 2015, 33(6)∶ 847-854.
[35] SIERRO N, BATTEY J N, OUADI S, et al. The tobacco genome sequence and its comparison with those of tomato and potato[J]. Nature Communications, 2014, 5(5)∶ 3833.
[36] 刘文杰. 烟草遗传图谱的构建及青枯病抗性与一些农艺性状的QTL定位[D]. 广州:广州大学,2017.LIU W J. Construction of linkage genetic map and QTL mapping for bacterial wilt resistance and some agronomic traits in tobacco[D]. Guangzhou∶ Guangzhou University,2017.
[37] TONG Z J, YANG Z M, CHEN X J, et al. Large-scale development of microsatellite markers inNicotiana tabacumand construction of a genetic map of flue-cured tobacco[J].Plant Breeding, 2012, 131(5)∶ 674-680.
[38] TONG Z J, JIAO T L, WANG F Q, et al. Mapping of quantitative trait loci conferring resistance to brown spot in flue-cured tobacco (Nicotiana tabacumL.)[J]. Plant Breeding, 2012, 131(2)∶ 335-339.
[39] 牟建英,钱玉梅,任民,等. 烟草白粉病抗性基因的QTL定位[J]. 中国烟草学报,2013,19(4):105-108.MU J Y, QIAN Y M, REN M, et al. QTL analysis of resistance gene to powdery mildew in tobacco[J]. Acta Tabacaria Sinica, 2013, 19(4)∶ 105-108.
[40] 高亭亭,蒋彩虹,罗成刚,等. 烟草品种 Beinhart1000-1抗黑胫病基因的QTL定位[J]. 植物遗传资源学报,2015,16(2):330-335.GAO T T, JIAN C H, LUO C G, et al. Mapping of quantitative trait loci affecting resistance to black shank in tobacco line Beinhart1000-1[J]. Journal of Plant Genetic Resources, 2015, 16(2)∶ 330-335.
[41] SINGH H, DESHUMUKH R K, SINGHA, et al. Highly variable SSR markers suitable for rice genotyping using agarose gels [J]. Molecular Breeding, 2010, 25 (2)∶ 359-364.

