连作杨树人工林细根寿命的代际差异及其影响因素
朱婉芮,汪其同,刘梦玲,高明宇,董玉峰,王华田,王延平
1 山东农业大学林学院, 泰安 271018 2 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101 3 山东省林业科学研究院, 济南 250014 4 国家林业局泰山森林生态系统定位研究站, 泰安 271018
树木根系是树木个体与土壤环境进行物质交换和能量输送的关键器官。细根(直径小于2 mm)虽然仅占树木0.1%—3%的生物量[1],但由于其周期性的衰老死亡,对树木吸收水分和养分[2]及生态系统碳氮分配格局[3]具有重大影响。在森林生态系统内通过细根周转归还给土壤中的养分相当于或多于森林地上部分凋落物输入总量[4-6],同时这一过程消耗了大量净初级生产力[7-9]。因此,在生态系统水平上开展细根寿命研究对于揭示森林生态系统养分循环和碳分配格局具有重要意义。
细根寿命与其直径有较好的正相关关系,直径越细的根寿命越短[10],利用直径可解释细根寿命62%的变异性[11]。因此,基于细根直径统计细根寿命的研究较多[12-13]。但研究者认为根序(root order)对植物生长更具意义[14],仅凭直径大小可能无法揭示不同发育等级的细根在结构和功能上的差异[15]。国际上,针对许多树种的细根根序特征已进行了研究[16-17],我国学者也从细根根序视角开展了非常出色的研究工作[18-20]。依据根序监测细根寿命对深入认识细根周转过程、精准评估陆地生态系统地下碳分配格局均具有重要理论价值。
杨树(Populus)是重要的工业用材树种之一,尤其在我国栽培极为广泛。但是,连作经营使杨树人工林出现生产力严重下降趋势[21],这威胁到我国木材生产和木材战略安全。针对连作人工林生产力下降机制有待于深入认识,尤其是细根周转与林分生产力的关系有待明确。课题组前期针对杨树人工林细根的研究发现,杨树1—2级细根都具有吸收根的特征,3—5级细根木栓层和维管束均较发达,是典型的输导根[22]。杨树对地下根系的碳投入在前5级细根中主要分布于1—2级细根,且在连作人工林中具有明显差异,如二代林中1—2级根生物量占87%,而在一代林中仅占75%[23]。寿命是控制细根周转的关键因素,课题组认为连作杨树人工林低级细根的寿命差异是造成杨树连作人工林生产力耗损的重要机制。为此,本研究采用微根管技术对连作人工林杨树不同根序细根寿命进行了观测比较,以期阐明杨树人工林细根寿命的代际差异性,为深入揭示连作杨树人工林生产力衰退机制提供理论依据。同时,本研究可为深入揭示林木不同根序细根寿命差异的影响因素研究提供参考。
1 研究区自然概况
试验样地位于山东省宁阳县国有高桥林场,地理位置为35°53′N, 116°50′E。该区属于暖温带大陆性季风气候,年平均气温13.4℃,极端最高气温40.7℃,极端最低气温-19.4℃,大于10℃的年平均积温为5009℃,年平均日照时数为2679 h,无霜期199 d,年总辐射量5274 MJ/m2,年均降水量690 mm。固定观测样地分别设置在一代(Ⅰ)和连作二代(Ⅱ)人工林内,面积1.2 hm2,林地土壤均为粗砂质河潮土,颗粒较粗,保肥保水性差。林分来源均为2009年春季植苗造林,其中,一代(Ⅰ)和二代(Ⅱ)林均为5年生林分,株行距3 m×5 m。造林后间作小麦2年,此后无浇水、施肥等抚育管理措施。固定样地2012年建立并用铁丝网围封,林下植被以一年生草本植物为主,未出现灌木种类。其中,Ⅰ代林草本层以小藜(Chenopodiumserotinum)为优势物种,苋(Amaranthustricolor)、马唐(Digitariasanguinalis)等为亚优势种,林下植被盖度约0.6;Ⅱ代林草本层植物以马唐为优势种,其次是狗尾草(Setairaviridis)、小藜等,林下植被盖度平均0.4。两样地杨树生长量存在显著差异,Ⅰ代林杨树胸径和树高大于Ⅱ代林。连作林地土壤质地和土壤物理特性也存在一定差异,Ⅱ代林土壤有机质和速效氮显著低于Ⅰ代林,且Ⅱ代林土壤酚酸含量显著高于Ⅰ代林(表1)。
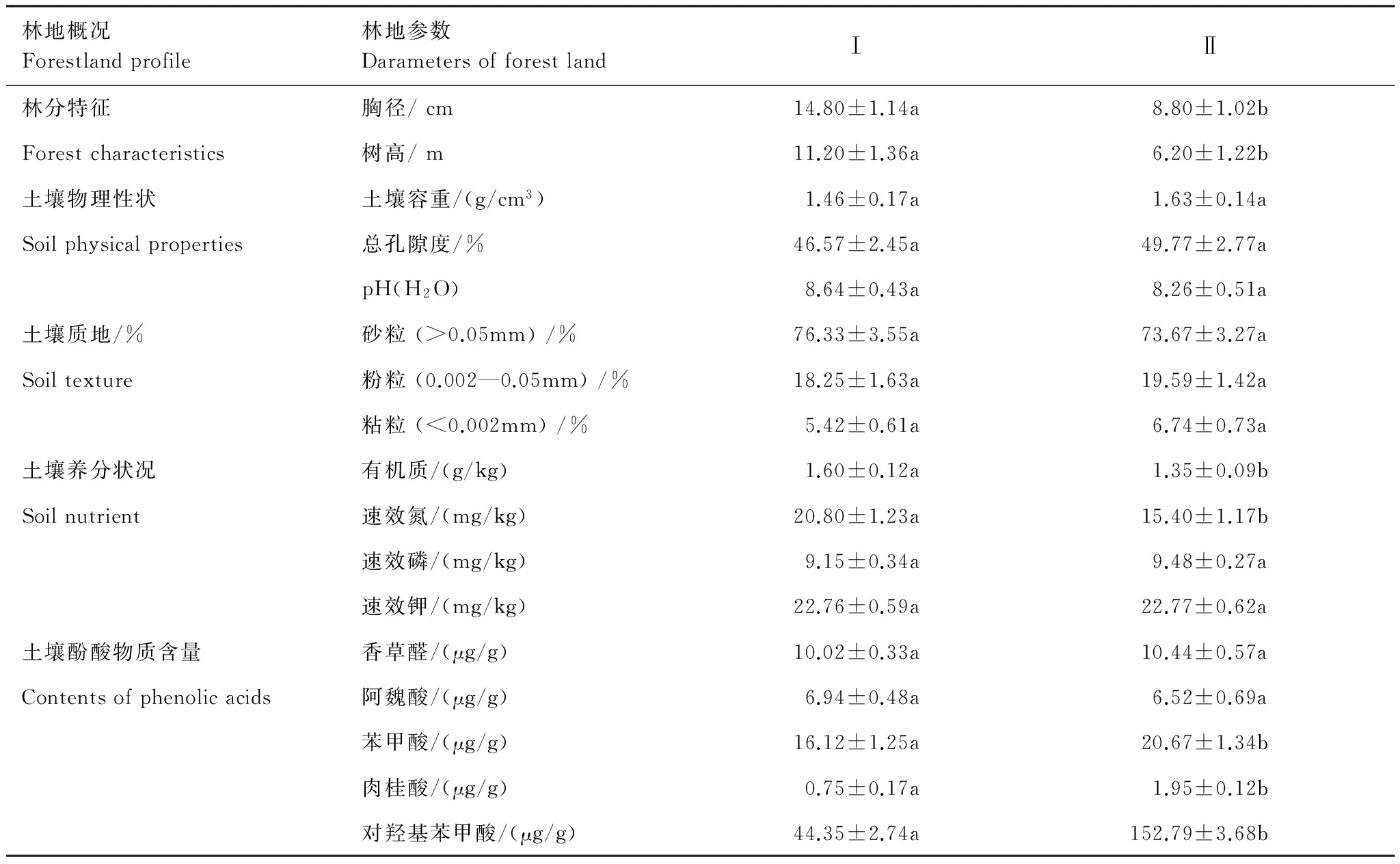
表1 试验林地基本概况(平均值±标准误)Table 1 General characteristics of two poplar plantation forests (mean±SE)
不同字母表示不同林地间差异显著(P<0.05) Ⅰ: 一代林;Ⅱ: 二代林
2 研究方法
2.1 微根管埋置
2013年11月于Ⅰ、Ⅱ代固定样地内各设置3个1000 m2的标准地,在各标准地内分别确定5株平均木安置微根管(内径6.4 cm,外径6.9 cm,长度100 cm,下端封闭)。参照Vamerali 等介绍的方法[24],微根管埋置位置距离杨树树干0.5—1.0 m,首先用钢钻(内径7.0 cm,外径7.2 cm)沿地面约45°夹角钻出一个与微根管外径接近的管洞,将微根管插入管洞70 cm(垂直深度约50 cm),微根管管壁与土壤间隙用钻出的原土(去除杂质)进行回填,以保证两者之间的无缝衔接。微根管露出地表的部分用黑色胶带缠绕,顶端加盖密封,防止光线及灰尘进入。外壁划定图像采集起始位置,以保证每次图像采集时,能够保证对同一位置进行根系图像采集工作[25-26]。本研究中微根管安置后至根系图像采集前经历了10个月的稳定平衡期,以保证根系生长动态监测及寿命估测的相对准确。
2.2 土壤样品采集及测定
在Ⅰ、Ⅱ代固定样地内随机抽取6株平均木,距树干基部0.5 m处呈梅花形分布5个取样点,用土钻钻取鲜土样,除去砂砾、杂质和根系,装入消毒密封塑料袋,编号标记带入实验室,用于土壤物理性状、土壤质地、土壤养分状况及土壤酚酸物质含量分析。各林地土壤因子测量方法参考中华人民共和国林业行业标准LY/T 1952—2011《森林生态系统长期定位观测方法》[27]开展,土壤质地采用比重计法测定,土壤容重采用环刀法测定,总孔隙度采用容重与相对密度的比值计算,土壤酸碱度采用电位法测定土壤悬液pH值;土壤有机质采用水合热重铬酸钾氧化容重法测定,速效氮采用碱解扩散法测定,速效磷采用碳酸氢钠法测定,速效钾采用醋酸铵火焰光度法测定;土壤酚酸物质含量采用高效液相色谱(HPLC)方法检测。
2.3 细根图像采集

图1 杨树根系生长状态Fig.1 The grow status of poplar rootsⅠ代林(T1)3号微根管(L3)的根系生长动态监测图,拍摄于2015年4月23日;图中,A为白色新生根,B为棕色成熟的活根,C为褐色发黑的死根,D为具有独立分枝的1级根,E为具有两叉分枝的2级根,F为分枝较多的高级根
细根观测时间自2014年9月起至2016年10月,每隔2周用微根管图像采集系统(CI-600,CID Bio-Science.Inc., Washington State, USA)对根系进行一次图像采集工作,每次获取数据的微根管窗口尺寸为21.56 cm × 19.56 cm,分辨率为300 dpi。采集工作于连续的2 d内完成,影像带回室内用WinRHIZO根系分析系统(Regent Instruments Company, Quebec City, Canada)进行处理。图像采集时将褐色发黑的根定义为死根,将白色根和成熟未呈现衰老状态的棕色根定义为活根(图1),分析细根总数量及根系分布的特征。追踪图像采集后首次出现的白色根系的动态生长过程以估算细根寿命,如已有根段在微根窗内消失即判定其为死亡状态。微根管图像中,依照根系生长发育顺序进行等级分类,具有明显独立分枝的标记为1级根,具有两叉分枝的标记为2级根,细根分枝较多的3—5级根标记为高级根(图1)。每次图像采集标记好根系所属林地编号、管号、图片采集号、根数量编号、生长状态、生存时间等,以进行生长状态追踪及数据统计分析。
2.4 细根寿命估测模型
考虑到研究区内林木物候特征、不同季节细根生长的差异性和低级细根短寿命特点[28-30],本研究截取2014年9月至2015年10月时间区间的微根管图像监测到的杨树新根用于细根寿命估计运算。在根系生长状态观察结束时,有部分细根仍保持存活状态(即栅失数据),细根寿命呈非正态性分布,具有不对称性,用平均寿命参数来估计细根寿命具有一定偏差,因此本研究以中值寿命作为细根寿命估测的重要参数,以平均寿命作为细根寿命估测的辅助参数。采用Kaplan-Meier方法进行生存分析,分别计算出Ⅰ代林、Ⅱ代林的细根平均寿命(Mean lifespan)、中值寿命(Median lifespan)与累计存活率(Cumulative survival rate),并绘制细根生存曲线(Survival curve)。同上方法,分别计算出1级根、2级根及高级根的细根平均寿命、中值寿命与累计存活率,并绘制细根生存曲线。通过对数秩检验(Log rank test)对连作代数、不同根序间的细根寿命进行单一因素比较,并检验其差异显著性。采用SPSS 17.0软件中的Correlate过程进行细根生存时间与土壤因子的相关性分析,并对其相关系数进行显著性检验(α=0.05)。
3 结果与分析
3.1 杨树细根总数量及根序分布
Ⅰ代林中共观测到细根总数572个,其中活根524个,约占总根数的91.6%;Ⅱ代林中共观测到细根总数1852个,其中活根1407个,约占总根数的76.0%。Ⅰ代林与Ⅱ代林细根数量存在极显著差异,Ⅱ代林活根数量约为Ⅰ代林的2.7倍,而所观测到的细根总数却是Ⅰ代林的3.2倍(图2)。
Ⅰ代林中共观测到1级根304个,2级根181个,高级根39个,分别占根系追踪总活根数的58.1%、34.5%、7.4%;Ⅱ代林中共观测到1级根479个,2级根564个,高级根364个,分别占根系追踪总活根数的34.0%、40.1%、25.9%。Ⅰ代林各级细根数量呈逐级下降趋势,而Ⅱ代林中2级根数量显著高于1级根和高级根序(图2)。
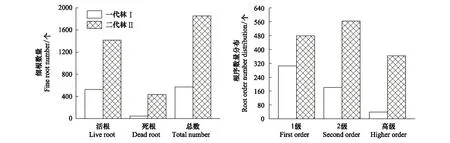
图2 连作杨树人工林细根总数量及根序分布Fig.2 Total root numbers and fine root order distribution in the successive poplar plantationⅠ:一代林; Ⅱ:二代林
3.2 杨树不同根序细根累积生存率动态及其寿命
如图3所示,不同根序细根累积生存率存在显著差异,高级根累积生存率显著高于低级根序,寿命较长。但是,不同根序细根寿命在连作代数杨树人工林的差异性不同。Ⅱ代林中,不同根序细根累积生存率存在显著差异(P< 0.05)。Ⅰ代林中,高级根序与1—2级细根累积生存率差异较显著(P< 0.05),而1、2级根序在150—350 d范围内的细根累积生存率差异不显著。此外,Ⅱ代林中2级和高级根序细根中位值寿命高于Ⅰ代林,而1级根序细根中位值寿命却呈相反趋势(表2)。由于随着时间延长,Ⅰ代林中初始观测被定义为1级根序的细根继续生长发育不断生成侧根分枝进而成为2级根序甚至高级根序,致使其中位值寿命延长。
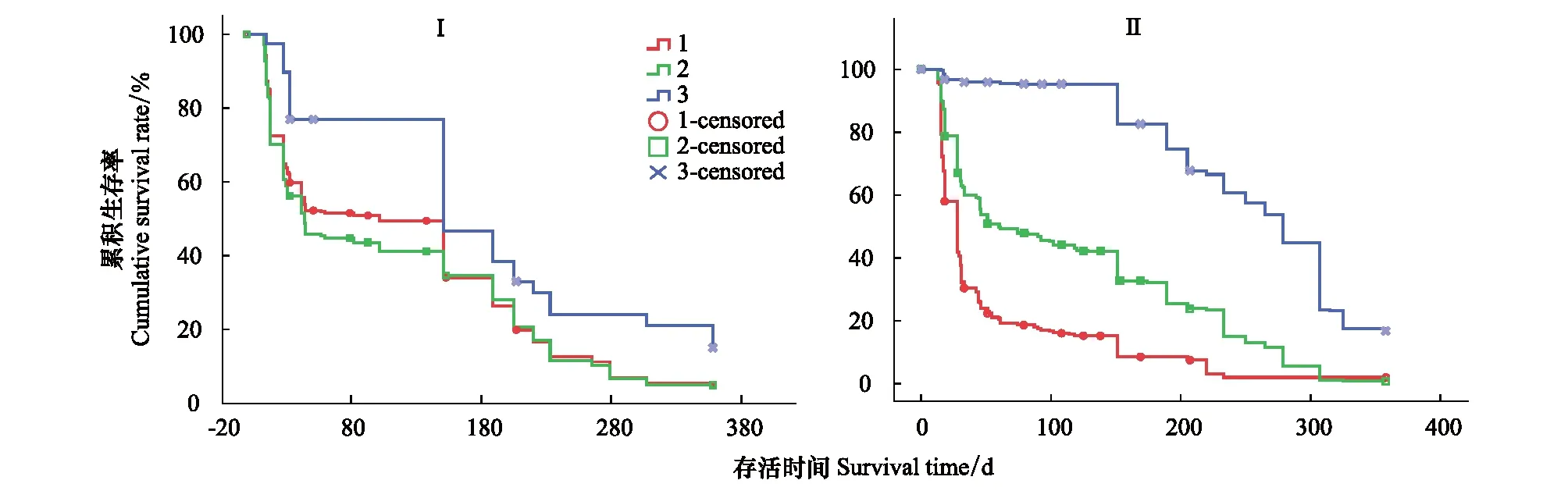
图3 不同根序等级细根累积生存率曲线Fig.3 Cumulative survival rate curve of different fine root orders in poplar plantationⅠ:一代林; Ⅱ:二代林;图中数字1、 2、3分别代表1级根、 2级根和高级根序;符号○,□,×分别表示1级根、2级根和高级级根序中栅失数据
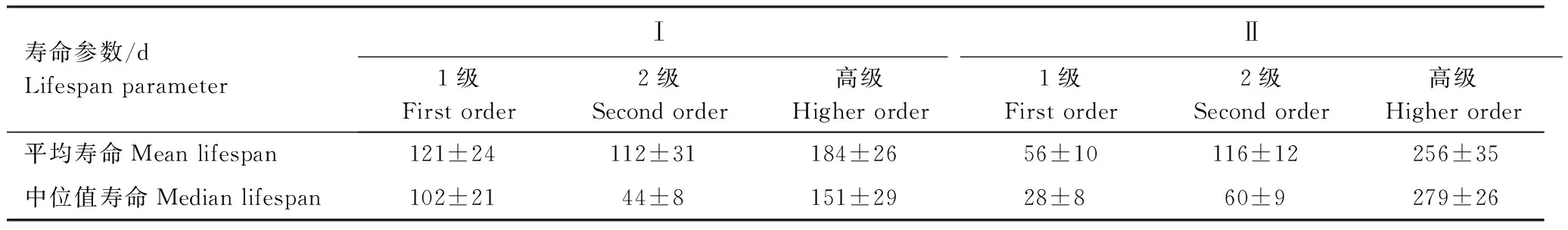
表2 不同根序等级细根的平均寿命和中位值寿命Table 2 The mean lifespan and median lifespan of different fine root orders in poplar plantation
3.3 连作杨树人工林细根累积生存率动态的比较
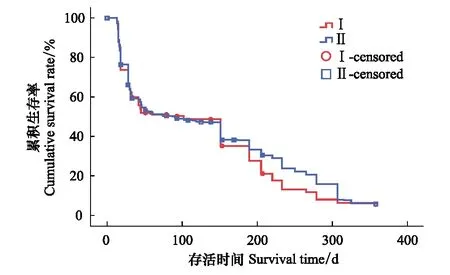
图4 不同连作代数杨树细根累积生存率曲线 Fig.4 Fine root cumulative survival rate curve of different succession poplar plantations图中红线和蓝线代表Ⅰ代林和Ⅱ代林生存曲线;符号“○”表示Ⅰ代林中栅失数据,符号“□”表示Ⅱ代林中栅失数据
如图4所示,随着细根生存时间的延长,细根累积生存率下降,细根逐渐衰老并死亡。Ⅰ代林细根平均寿命为(123±24) d,中位值寿命为(102±27) d,而Ⅱ代林细根平均寿命为(134±19) d,中位值寿命为(90±16) d。不同连作代数杨树人工林细根累积生存率不同,在150 d前细根寿命差异不显著,而在150—300 d范围内,Ⅰ代和Ⅱ代连作杨树人工林细根累积生存率存在显著差异,Ⅱ代林中低级细根累积生存率低于Ⅰ代林而高级细根累积生存率显著高于Ⅰ代林(P=0.015)。
3.4 杨树细根寿命与林地土壤因子的相关性分析
从表3可以看出,杨树细根生存时间与土壤因子存在一定程度的相关性,这说明细根寿命受制于土壤物理及化学性质的影响。其中,土壤速效氮是唯一与1级根呈显著相关性的土壤因子(r=-0.861),说明1级细根生存时间受制于土壤氮素有效性,并随速效氮含量的增加而延长。2级细根生存时间与土壤物理性状相关性较强,土壤容重及土壤质地等指标与其具有显著(或极显著)相关,且与土壤总酚含量的相关性呈现极显著相关(r=0.870),这说明2级细根的寿命将受制于林地土壤紧实度和颗粒组成,并随着酚酸累积而增加。高级根序细根生存时间与土壤物理性质和养分状况等具有一定相关性,如土壤容重和总孔隙度与其存在极显著相关性;土壤总酚含量也与其寿命存在显著正相关。因此,较Ⅰ代林而言,Ⅱ代林地土壤速效氮含量下降而土壤总酚含量升高,其细根中位值寿命呈现较Ⅰ代林下降的趋势。
*表示在0.05水平下相关系数的显著性; **表示在0.01水平下相关系数的显著性
4 讨论
4.1 不同根序细根寿命差异的影响因素
细根具有极强的形态可塑性,生长在不同立地条件下的同一树种细根寿命具有较大的差异,甚至不同根序的细根寿命也不相同[31-32],这说明环境条件和细根生长发育均可影响细根寿命[33-34]。本研究发现,杨树不同根序细根寿命及累积生存率存在着显著差异,高级根累积生存率显著高于低级根序,且寿命较长(图4)。此结论与以往研究具有一致性。如,研究发现碧桃(Prunuspersica)1级细根的平均寿命约为190 d,2级和3级细根平均寿命约为452 d[35];水曲柳1—3级细根寿命在510—692 d之间,而4级以上细根寿命则很长(>820d)[36];低级细根作为短命模块在其他树种中也有发现[37-38]。一方面,细根寿命与其形态结构关系密切。如,日本扁柏(Chamaecyparisobtusa)根系中具有二元型和三元型原生木质部(diarch and triarch protoxylem)的细根寿命较短,而具有四元型原生木质部(tetrarch protoxylem)的细根寿命较长[39]。另一方面,细根根序与其寿命存在显著正相关,通常低根序细根(如1、2级根)寿命较短,高根序细根寿命较长。不同根序细根寿命的差异性可能与其功能有关,如低级根序在功能特征上主要承担养分和水分的吸收作用,木质化程度较低,细根寿命较短[18],尤其在养分匮乏立地条件下为了捕获氮素养分需要不断产生新生根,致使低级根序细根寿命缩短[10]。此外,细根碳氮分配格局可直接影响细根的生长、死亡和分解的动态[40]。其中,碳氮比是衡量细根组织周转和分解的重要指标。有研究表明,碳氮比可解释细根寿命20%以上的变异,且碳氮比越高,细根寿命越长[11]。本论文前期研究已表明,杨树细根碳含量随根序呈现逐渐增加的趋势,而氮含量呈现随根序逐渐减少的趋势,C∶N比在1级根中约为20∶1,而在2—5级根中大多在30∶1以上[23]。本研究对不同根序杨树细根寿命的监测,结合以往对杨树不同根序细根碳氮比的研究结论,支持细根碳氮比影响细根寿命的科学论断。
此外,在林木细根根序形态研究中,研究者均发现了菌根真菌对低根序细根侵染现象[18, 41-42]。研究表明,真菌侵染显著改变了植物根系寿命,如外生菌侵染导致火炬松(Pinustaeda)细根寿命延长[7],而丛枝菌根真菌侵染导致杨树(Populusgenerosa×Americana)细根寿命缩短[43]。杨树是菌根真菌易侵染树种[44]。迄今为止,研究人员已在杨树根系中分离鉴定了多达30余种的外生菌根真菌和5种内生菌根真菌[45]。在自然条件下,菌根真菌对不同根序杨树细根的侵染力尚不清楚,但菌根调控杨树细根寿命的机制仍可能是未来细根寿命研究的重要内容。
4.2 杨树细根寿命代际差异的影响因素及其与人工林生产力下降的关系
细根寿命受环境因素的影响巨大,土壤资源有效性对细根生长发育具有重要调控作用[46-47]。如,当细根周围可供吸收利用的有效氮匮乏时细根则出现衰老死亡[10],这说明氮素有效性与细根寿命之间具有密切联系。N素很久以来就被认为是大多数北方、温带和一部分热带生态系统物质循环的限制性资源[48]。土壤N素有效性与细根生长的关系备受关注[49-50]。Nedelhoffer 等[8]与郭大立和范萍萍[51]分别针对细根周转与N有效性关系进行了综述,提出了4种假说:1)土壤N素有效性对细根生长有正效应,对细根寿命是负效应(即,N素有效性提高,细根生长量增加,但寿命缩短,周转加快);2)土壤N素有效性对细根生长呈现负效应,对细根寿命呈正效应(即,N素有效性提高,细根寿命延长,周转减慢,但细根生长量下降);3)N素有效性对细根生长和寿命均有负效应(即,N素有效性提高,细根生长量下降,寿命缩短,周转加快);4)N素有效性对细根生长和寿命均有正效应(即,N素有效性提高,细根生长量增加,寿命也增长,细根周转下降)。依据本研究前期结果,Ⅱ代林地土壤养分含量低于Ⅰ代林,其中速效氮含量下降尤为显著(表1)。这种土壤养分有效性变化将显著影响细根对土壤养分的吸收利用,为了获取更多的养分,杨树细根生长量和细根数目呈现Ⅱ代高于Ⅰ代林的趋势[22],但是细根寿命显著缩短(Ⅰ、Ⅱ代林中值寿命分别为102 d和90 d)以提高细根的周转能力。因此,连作人工林杨树细根寿命的差异性可能与连作林地土壤养分有效性变化具有密切联系。
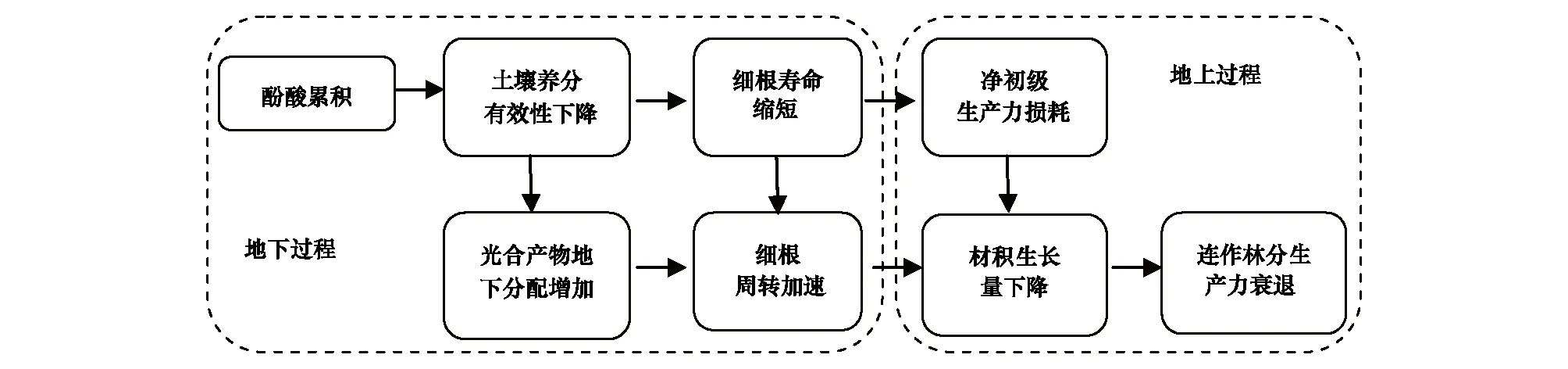
图5 连作杨树人工林细根寿命代际差异与生产力衰退关系模式图Fig.5 The relationship profile of fine root lifespan and productivity decline in poplar plantation
此外,连作杨树人工林土壤酚酸物质的累积问题已受到广泛重视,且对土壤中酚酸物质的检测表明根际酚酸累积异常显著[52]。酚酸累积一方面既可与土壤养分离子发生络合、螯溶等非生物化学过程从而造成土壤有效养分含量下降[53],也可能影响到土壤酶活性和微生物群落结构继而影响土壤养分的矿化过程[54-55]。伴随大量酚酸物质进入土壤,并经由土壤胶体吸附、微生物降解等一系列过程后,在根际土壤中形成累积,致使土壤氮素有效性降低。连作人工林日渐贫乏的土壤养分环境引发植株对地下碳的投入(Ⅱ代林杨树细根生物量高于Ⅰ代林)[22]。依据光合产物的最优分配理论,林木分配给根系更多的碳将以牺牲地上部分的生长为代价,而且伴随细根的死亡和周转,大量光合产物碳被转移至土壤从而导致净初级生产力的的丧失,导致林分生产力逐渐下降。本研究针对细根寿命的观测,发现Ⅱ代林杨树细根具有较短的细根寿命,这意味着连作林地细根周转速率较高,必然导致连作人工林生产力的下降更加显著。因此,连作杨树人工林土壤中酚酸物质的累积引发的养分有效性下降,并导致细根寿命缩短周转加速,最终导致净初级生产力的大量损耗(图5)。鉴于连作杨树人工林细根寿命与林分生产力下降的密切联系,今后应更加注重杨树细根寿命调控与碳氮分配格局研究,这对揭示连作人工林生产力下降机制具有重要意义。
5 结论
(1)杨树不同根序细根寿命存在显著差异,1—2级低级细根寿命较短;而高级根累积生存率较高,寿命较长。不同等级细根寿命的差异性暗示其在生态系统碳氮循环中具有各自不同的贡献,1—2级细根在杨树人工林净初级生产力耗损中占重要地位,在连作人工林生产力衰退机理研究中应重点关注。
(2)杨树细根寿命在连作人工林代际间差异较大,Ⅱ代林中低级细根累积生存率低于Ⅰ代林而高级细根累积生存率显著高于Ⅰ代林。连作人工林1—2级细根的短寿命暗示其具有较快的周转速率,可造成连作人工林净初级生产力的更大耗损。杨树细根寿命与土壤中酚酸显著相关,伴随着连作杨树人工林土壤中酚酸物质的累积,细根寿命缩短周转加速,这可能是连作人工林生产力衰退的新机制。
[1] Vogt K A, Grier C C, Vogt D J. Production, turnover and nutrient dynamics of above-and below-ground detritus of world forests. Advances in Ecological Research, 1986, 15: 303-377.
[2] Caldwell M M, Dawson T E, Richards J H. Hydraulic lift: consequences of water efflux from the roots of plants. Oecologia, 1998, 113(2): 151-161.
[3] Hendricks J J, Nadelhoffer K J, Aber J D. Assessing the role of fine roots in carbon and nutrient cycling. Tends in Ecology & Evolution, 1993, 8(5): 174-178.
[4] Arthur M A, Fathey T J. Biomass and nutrients in an Engelmann spruce-subalpine fir forest in north central Colorado: Pools, annual production and internal cycling. Canadian Journal of Forest Research, 1992, 22(3): 315-325.
[5] 何永涛, 石培礼, 张宪洲, 钟志明, 徐玲玲, 张东秋. 拉萨河谷杨树人工林细根的生产力及其周转. 生态学报, 2009, 29(6): 2877-2883.
[6] 廖利平, 陈楚莹, 张家武, 高洪. 杉木、火力楠纯林及混交林细根周转的研究. 应用生态学报, 1995, 6(1): 7-10.
[7] King J S, Albaugh T J, Allen H L, Buford M, Strain B R, Dougherty P. Below-ground carbon input to soil is controlled by nutrient availability and fine root dynamics in loblolly pine. New Phytologist, 2002, 154(2): 389-398.
[8] Nadelhoffer K J. The potential effects of nitrogen deposition on fine-root production in forest ecosystems. New Phytologist, 2000, 147(1): 131-139.
[9] Vogt K A, Persson H. Measuring growth and development of roots // Lassoie J P, Hinckle T M, eds. Techniques and Approaches in Forest Tree Ecophysiolgy. Boston: CRC Press, 1991: 477-501.
[10] Eissenstat D M, Yanai R D. The ecology of root lifespan. Advances in Ecological Research, 1997, 27: 1-60.
[11] McCormack L M, Adams T S, Smithwick EAH, Eissenstat D M. Predicting fine root lifespan from plant functional traits in temperate trees. New Phytologist, 2012, 195(4): 823-831.
[12] Xu W Q, Liu J X, Liu X Z, Li K, Zhang D Q, Yan J H. Fine root production, turnover, and decomposition in a fast-growthEucalyptusurophyllaplantation in southern China. Journal of Soils and Sediments, 2013, 13(7): 1150-1160.
[13] Leppälammi-Kujansuu J, Salemaa M, Kleja D B, Linder S, Helmisaari H S. Fine root turnover and litter production of Norway spruce in a long-term temperature and nutrient manipulation experiment. Plant and Soil, 2014, 374(1/2): 73-88.
[14] Pregitzer K S, Kubiske M E, Yu C K, Hendrick R L. Relationships among root branch order, carbon, and nitrogen in four temperate species. Oecologia, 1997, 111(3): 302-308.
[15] Pregitzer K S. Tree root architecture-form and function. New Phytologist, 2008, 180(3): 562-564.
[16] Pregitzer K S, De Forest J L, Burton A J, Allen M F, Ruess R W, Hendrick R L. Fine root architecture of nine North American trees. Ecological Monographs, 2002, 72(2): 293-309.
[17] Goebel M, Hobbie S E, Bulaj B, Zadworny M, Archibald D D, Oleksyn J, Reich P B, Eissenstat D M. Decomposition of the finest root branching orders: linking belowground dynamics to fine-root function and structure. Ecological Monographs, 2011, 81(1): 89-102.
[18] Guo D L, Xia M X, Wei X J, Liu Y, Wang Z Q. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species. New Phytologist, 2008, 180(3): 673-683.
[19] Wang Z Q, Guo D L, Wang X R, Gu J C, Mei L. Fine root architecture, morphology, and biomass of different branch orders of two Chinese temperate tree species. Plant and Soil, 2006, 288(1/2): 155-171.
[20] Long Y Q, Kong D L, Chen Z X, Zeng H. Variation of the linkage of root function with root branch order. PLoS One, 2013, 8(2): e57153.
[21] 孙翠玲, 朱占学, 王珍, 佟超然. 杨树人工林地力退化及维护与提高土壤肥力技术的研究. 林业科学, 1995, 31(6): 506-512.
[22] 许坛, 王华田, 朱婉芮, 王延平, 李传荣, 姜岳忠. 连作杨树细根根序形态及解剖结构. 林业科学, 2015, 51(1): 119-126.
[23] 王延平, 许坛, 朱婉芮, 王华田, 张光灿, 李传荣, 姜岳忠. 杨树细根碳、氮含量的季节动态及代际差异. 应用生态学报, 2015, 26(11): 3268-3276.
[24] Vamerali T, Ganis A, Bona S, Mosca G. An approach to minirhizotron root image analysis. Plant and Soil, 1999, 217(1/2): 183-193.
[25] Johnson M G, Tingey D T, Phillips D L, Storm M J. Advancing fine root research with minirhizotrons. Environmental and Experimental Botany, 2001, 45(3): 263-289.
[26] 白文明, 程维信, 李凌浩. 微根窗技术及其在植物根系研究中的应用. 生态学报, 2005, 25(11): 3076-3081.
[27] 国家林业局. LY/T 1952-2011 森林生态系统长期定位观测方法. 北京: 中国标准出版社, 2011.
[28] 凌华, 袁一丁, 杨智杰, 黄锦学, 陈光水, 杨玉盛. 杉木人工林细根寿命的影响因素. 生态学报, 2011, 31(4): 1130-1138.
[29] 郑金兴, 黄锦学, 王珍珍, 熊德成, 杨智杰, 陈光水. 闽楠人工林细根寿命及其影响因素. 生态学报, 2012, 32(23): 7532-7539.
[30] 史建伟, 秦晴, 陈建文. 柠条人工林细根不同分枝根序寿命估计. 生态学报, 2015, 35(12): 4045-4052.
[31] 张小全, 吴可红, Dieter Murach. 树木细根生产与周转研究方法评述. 生态学报, 2000, 20(5): 875-883.
[32] 黄刚, 赵学勇, 黄迎新, 李玉霖, 苏延桂. 两种生境条件下差不嘎蒿细根寿命. 植物生态学报, 2009, 33(4): 755-763.
[33] Eissenstat D M, Wells C E, Yanai R D, Whitbeck J L. Building roots in a changing environment: implications for root longevity. New Phytologist, 2000, 147(1): 33-42.
[34] 梅莉, 王政权, 程云环, 郭大立. 林木细根寿命及其影响因子研究进展. 植物生态学报, 2004, 28(5): 704-710.
[35] Wells C E, Glenn D M, Eissenstat D M. Changes in the risk of fine-root mortality with age: a case study in peach,Prunuspersica(Rosaceae). American Journal of Botany, 2002, 89(1): 79-87.
[36] Xia M X, Guo D L, Pregitzer K S. Ephemeral root modules inFraxinusmandshurica. New Phytologist, 2010, 188(4): 1065-1074.
[37] Valenzuela-Estrada L R, Vera-Caraballo V, Ruth L E, Eissenstat D M. Root anatomy, morphology, and longevity among root orders inVacciniumcorymbosum(Ericaceae). American Journal of Botany, 2008, 95(12): 1506-1514.
[38] Espeleta J F, West J B, Donovan L A. Tree species fine-root demography parallels habitat specialization across a sandhill soil resource gradient. Ecology, 2009, 90(7): 1773-1787.
[39] Hishi T, Takeda H. Dynamics of heterorhizic root systems: Protoxylem groups within the fine-root system ofChamaecyparisobtuse. New Phytologist, 2005, 167(2): 509-521.
[40] 梅莉, 王政权, 张秀娟, 于立忠, 杜英. 施氮肥对水曲柳人工林细根生产和周转的影响. 生态学杂志, 2008, 27(10): 1663-1668.
[41] Reinhardt D R, Miller R M. Size classes of root diameter and mycorrhizal fungal colonization in two temperate grassland communities. New Phytologist, 1990, 116(1): 129-136.
[42] Kong D L, Ma C G, Zhang Q, Li L, Chen X Y, Zeng H, Guo D L. Leading dimensions in absorptive root trait variation across 96 subtropical forest species. New Phytologist, 2014, 203(3): 863-872.
[43] Hooker J E, Black K E, Perry R L, Atkinson D. Arbuscular mycorrhizal fungi induced alteration to root longevity of poplar. Plant and Soil, 1995, 172(2): 327-329.
[44] 陈辉, 唐明. 杨树菌根研究进展. 林业科学, 1997, 33(2): 183-188.
[45] 唐明, 陈辉, 郭建林, 侯登武. 陕西省杨树外生菌根种类的调查研究. 林业科学, 1994, 30(5): 437-441.
[46] 程云环, 韩有志, 王庆成, 王政权. 落叶松人工林细根动态与土壤资源有效性关系研究. 植物生态学报, 2005, 29(3): 403-410.
[47] Ruffel S, Krouk G, Ristova D, Shasha D, Birnbaum K D, Coruzzi G M. Nitrogen economics of root foraging: Transitive closure of the nitrate-cytokinin relay and distinct systemic signaling for N supply vs. demand. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(45): 18524-18529.
[48] Chapin F S, Vitousek P M, Van Cleve K. The nature of nutrient limitation in plant communities. The American Naturalist, 1986, 127(1): 48-58.
[49] Grossman J D, Rice K J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications, 2012, 5(8): 850-857.
[50] Yuan Z Y, Chen H Y. A global analysis of fine root production as affected by soil nitrogen and phosphorus. Proceedings of the Royal Society B: Biological Sciences, 2012, 279(1743): 3796-3802.
[51] 郭大立, 范萍萍. 关于氮有效性影响细根生产量和周转率的四个假说. 应用生态学报, 2007, 18(10): 2354-2360.
[52] Wang Y P, Li C R, Wang Q K, Wang H T, Duan B L, Zhang G C. Environmental behaviors of phenolic acids dominated their rhizodeposition in boreal poplar plantation forest soils. Journal of Soils and Sediments, 2016, 16(7): 1858-1870.
[53] Chapin F S. New cog in the nitrogen cycle. Nature, 1995, 377(6546): 199-200.
[54] Kong C H, Chen L C, Xu X H, Wang P, Wang S L. Allelochemicals and activities in a replanted Chinese fir (Cunninghamialanceolata(Lamb.) Hook.) tree ecosystem. Journal of Agricultural and Food Chemistry, 2008, 56(24): 11734-11739.
[55] Qu X H, Wang J G. Effect of amendments with different phenolic acids on soil microbial biomass, activity, and community diversity. Applied Soil Ecology, 2008, 39(2): 172-179.

