MnSOD基因Val-16Ala多态性与前列腺癌易感性关系的Meta分析
张万生,韩 冬,宋晓辉,于 航,包二平,王立国
(吉林医药学院附属医院泌尿外科,吉林 吉林 132013)
前列腺癌被视为男性发病率最高的恶性肿瘤,已经成为导致西方国家男性死亡的第二大恶性肿瘤[1-2]。关于前列腺的发病原因一直是大家关注和研究的焦点。当前,大量研究发现遗传结合环境因素在前列腺癌发病过程中扮演重要角色。同样环境作用下的不同个体患前列腺癌的风险也存在一定差异,这说明遗传因素是导致到前列腺癌易感性的一个重要因素。当前,已存在大量有关基因多态性和前列腺癌易感性关联的文章[3-5],关于该疾病的潜在发病机制尚待进一步明确。
正常生理状态下,抗氧化酶,特别是锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD),可以不断清除体细胞所产生的富余活性氧物质,以此来稳定体内的氧化-还原系统[6]。然而,一旦这种动态平衡遭到破坏,可以致使活性氧簇(reactive oxygen species,ROS)过剩,接着引发各种氧化应激反应,损害细胞,导致肿瘤发生。研究发现,肿瘤细胞一般都有抗氧化应激系统的缺陷。过剩的氧化应激影响细胞内氧化还原反应,并且氧化修饰关键氨基酸残基,进而攻击细胞的DNA、脂质及蛋白质,继而诱发肿瘤等疾病[6-7]。此外,MnSOD基因启动子区域的突变改变了基因编码序列,也能减弱其抗氧化作用。近年来,已有研究证实,MnSOD基因Ala多态性可明显增加乳腺癌[8]、前列腺癌[9]、食管癌[10]及子宫颈癌[11]的患病风险。但是,也有研究发现该基因的突变可降低肺癌[12]和膀胱癌[13]等肿瘤的发病风险。
鉴于以上结果,本研究收集国内外相关MnSOD基因Val-16Ala多态性与前列腺癌易感性的病例-对照实验研究实施Meta分析,旨在为科研及临床工作人员提供更可靠的循证医学依据。
1 资料与方法
1.1 纳入与排除标准
已发表的有关MnSOD基因Val-16Ala多态性与前列腺癌易感性相关的设计严谨、方法可靠的病例对照研究,文献限中、英文;干预措施研究中需涵盖等位基因或各基因型等数据;由病例组和对照组基本构成,诊断明确,统计方法恰当,数据表达明确,有综合统计指标如OR值或有足够信息可以计算出来;对重复发表的文献,选择样本量最大的或者最近发表的研究为对象。排除:1)评论、摘要、综述或病例报道等类型文章;2)未提供有效原始数据;3)重复报道。
1.2 文献检索
计算检索外文PubMed,以“manganese superoxide dismutase OR MnSOD”AND“polymorphism OR variant OR mutation OR allele OR genotype”AND“prostate cancer OR prostate carcinoma OR prostate tumor”为英文检索关键词,检索相关合格文献;同时以“锰超氧化物歧化酶OR MnSOD AND前列腺癌”等中文关键词检索万方数据、中国知网和中国生物医学文献数据库等。检索年限为从建库至2016年1月1日。
1.3 质量评价
文章质控依据于英国牛津循证医学中心文献严格评价项目,评价指标如下6点:1)病理诊断标准在文章中是否描述清楚;2)病例-对照研究分组的匹配情况;3)病例组和对照组是否存在可比性;4)分型方法是否合理;5)纳入的样本量是否充足;6)数据是否充分。按照纳入和排除标准逐一筛选,由2人分别进行评价,如遇分歧可通过讨论解决或者由第三位研究专家协助解决。
1.4 统计学分析
文章所有计算均采用Stata 12.0软件进行。采用χ2检验来计算估计研究间的异质性情况(并以α=0.05为检验标准)。若研究间不存在异质性,计算则采用固定效应模型;反之,则采用随机效应模型以计算各比较模型的OR值和95%CI。与此同时,还需计算对照组的哈迪温伯格平衡(Hardy Weinberg Equilibrium,HWE),以P<0.05为差异具有统计意义。利用敏感性分析,评估合并效应量。利用Begg’s funnel plot和Egger’s test来评估发表偏倚。
2 结 果
2.1 文献检索结果及质量评价
初检出文献63篇,通过阅读标题和摘要后,排除动物实验、重复和综述等文献28篇。然后,进一步阅读全文,剔除不符合纳入标准文献24篇,最终纳入合格研究11篇,共13项病例-对照研究,计病例组4377例,对照组7123例[9,14-23]。纳入13项研究中有9项为高加索人群,2项为非洲人群,2项为混合人种。有10项研究对照组来源为普通健康人群,3项为医院来源人群。基因分型方法主要为PCR-RFLP、Sequenom和Taqman。13项研究中有12项对照组处于HWE状态,1个研究的对照组不符合HWE[20]。
2.2 Meta分析结果
MnSOD基因Val-16Ala多态性与前列腺癌易感性相关,Val/Ala+Ala/Ala vs Val/ValOR=1.101,95%CI:1.007~1.203,P=0.035(图1)。在根据种族类型的亚组分析中,发现该基因多态性与高加索人种前列腺癌易感性显著相关,Ala vs ValOR=1.067,95%CI:1.004~1.135,P=0.038;Ala/Val+Ala/Ala vs Val/ValOR=1.118,95%CI:1.011~1.236,P=0.029;Ala/Ala vs Val/ValOR=1.142,95%CI:1.009~1.291,P=0.035。
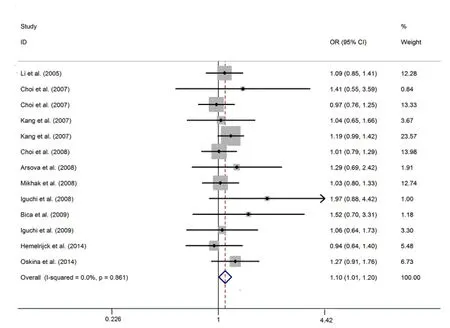
图 1 MnSOD基因多态性与前列腺癌易感性相关森林图
2.3 敏感性分析和发表偏移
在剔除1项不符合HWE的病例-对照研究后,结果与剔除前比较基本一致。利用Begg’s test绘制倒漏斗图(图2)发现图形基本对称,提示无发表偏倚。进一步Egger’s test分析显示,在总体研究的各模型组均无明显发表偏倚(显性模型:P=0.177)。

图 2 MnSOD基因多态性与前列腺癌易感性相关漏斗图
3 讨 论
当前,肿瘤遗传易感性是生命科学领域研究的热点之一。其中,MnSOD基因多个多态性位点与肿瘤间的关联得到众人关注。国内外学者为证明两者之间的关联做了许多研究。MnSOD基因Val16Ala多态性位点可能在肿瘤的发生过程中起着重要作用,包括前列腺癌[24]、肺癌[25]和肝癌[26]等。
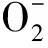
前列腺肿瘤是男性最为常见的一种恶性疾病,多项研究已证明MnSOD基因Val16Ala多态性与前列腺癌易感性相关。然而结论尚未统一,所以我们开展一项荟萃分析,以进一步的探究MnSOD基因Val16Ala多态性与前列腺癌易感性关联。本研究共纳入13项病例-对照研究,结果显示MnSOD基因Val-16Ala多态性在V vs A、VV vs AA、VV vs VA+AA的模型比较中显著增加了前列腺癌的易感性。其中以种族类型为依据的亚组分析中,该基因多态性与高加索人群膀胱癌发病存在显著关联,这些结果与前人研究相一致。
然而,本研究尚有多处不足。第一,纳入研究的各类肿瘤病例可能是遗传性、家族性或者偶发性的前列腺癌病例,这些可能影响最终的结论;第二,在亚组分析中,有关非洲人种的数据很少,需要在未来的分析中进一步补充;第三,我们的结论未经调整,应该对各类细节如年龄、种族、家族史、环境因素和生活方式等进行调整,从而得到更加准确的结论。总之,MnSOD基因Val-16Ala多态性与前列腺癌易感性相关,需要开展更多更可靠的多中心、大样本和同质性的病例-对照研究,以期达到更加确切的结论。
[1] TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] HEGARTY N J,FITZPATRICK J M,RICHIE J P,et al.Future prospects in prostate cancer[J].Prostate,1999,40(4):261-268.
[3] XU J F,MEYERS D,FREIJE D,et al.Evidence for a prostate cancer susceptibility locus on the X chromosome[J].Nat Genet,1998,20(2):175-179.
[4] SMITH J R,FREIJE D,CARPTEN J D,et al.Major susceptibility locus for prostate cancer on chromosome 1 suggested by a genome-wide search[J].Science,1996,274(5291):1371-1374.
[5] DUFFIELD-LILLICO A J,DALKIN B L,REID M E,et al.Selenium supplementation,baseline plasma selenium status and incidence of prostate cancer:an analysis of the complete treatment period of the Nutritional Prevention of Cancer Trial[J].BJU Int,2003,91(7):608-612.
[6] WINTERBOURN C C.Reconciling the chemistry and biology of reactive oxygen species[J].Nat Chem Biol,2008,4(5):278-286.
[7] NISHIKAWA M.Reactive oxygen species in tumor metastasis[J].Cancer Lett,2008,266(1):53-59.
[8] KNIGHT J A,ONAY UV,WELLS S,et al.Genetic variants of GPX1 and SOD2 and breast cancer risk at the Ontario site of the Breast Cancer Family Registry[J].Cancer Epidemiol Biomarkers Prev,2004,13(1):146-149.
[9] CHOI J Y,NEUHOUSER M L,BARNETT M J,et al.Iron intake,oxidative stress-related genes (MnSOD and MPO) and prostate cancer risk in CARET cohort[J].Carcinogenesis,2008,29(5):964-970.
[10] MURPHY S J,HUGHES A E,PATTERSON C C,et al.A population-based association study of SNPs of GSTP1,MnSOD,GPX2 and Barrett’s esophagus and esophageal adenocarcinoma[J].Carcinogenesis,2007,28(6):1323-1328.
[11] TONG S Y,LEE J M,SONG E S,et al.Functional polymorphism in manganese superoxide dismutase and antioxidant status:their interactions on the risk of cervical intraepithelial neoplasia and cervical cancer[J].Gynecol Oncol,2009,115(2):272-276.
[12] WANG L I,MILLER D P,SAI Y,et al.Manganese superoxide dismutase alanine-to-valine polymorphism at codon 16 and lung cancer risk[J].J Natl Cancer Inst,2001,93(23):1818-1821.
[13] HUNG R J,BOFFETTA P,BRENNAN P,et al.Genetic polymorphisms of MPO,COMT,MnSOD,NQO1,interactions with environmental exposures and bladder cancer risk[J].Carcinogenesis,2004,25(6):973-978.
[14] LI H J,KANTOFF P W,GIOVANNUCCI E,et al.Manganese superoxide dismutase polymorphism,prediagnostic antioxidant status,and risk of clinical significant prostate cancer[J].Cancer Res,2005,65(6):2498-2504.
[15] CHOI J Y,NEUHOUSER M L,BARNETT M,et al.Polymorphisms in oxidative stress-related genes are not associated with prostate cancer risk in heavy smokers[J].Cancer Epidemiol Biomarkers Prev,2007,16(6):1115-1120.
[16] KANG D,LEE K M,PARK S K,et al.Functional variant of manganese superoxide dismutase (SOD2 V16A) polymorphism is associated with prostate cancer risk in the prostate,lung,colorectal,and ovarian cancer study[J].Cancer Epidemiol Biomarkers Prev,2007,16(8):1581-1586.
[17] ARSOVA-SARAFINOVSKA Z,MATEVSKA N,PETROVSKI D,et al.Manganese superoxide dismutase (MnSOD) genetic polymorphism is associated with risk of early-onset prostate cancer[J].Cell Biochem Funct,2008,26(7):771-777.
[18] MIKHAK B,HUNTER D J,SPIEGELMAN D,et al.Manganese superoxide dismutase (MnSOD) gene polymorphism,interactions with carotenoid levels and prostate cancer risk[J].Carcinogenesis,2008,29(12):2335-2340.
[19] IGUCHI T,SUGITA S,WANG C Y,et al.MnSOD genotype and prostate cancer risk as a function of NAT genotype and smoking status[J].In Vivo,2009,23(1):7-12.
[20] BICA C G,DE MOURA DA SILVA L L,TOSCANI N V,et al.MnSOD gene polymorphism association with steroid-dependent cancer[J].Pathol Oncol Res,2009,15(1):19-24.
[21] IGUCHI T,WANG C Y,DELONGCHAMPS N B,et al.Association of prostate cancer and manganese superoxide dismutase AA genotype influenced by presence of occult cancer in control group[J].Urology,2008,72(2):238-241.
[22] VAN HEMELRIJCK M,ROHRMANN S,STEINBRECHER A,et al.Heterocyclic aromatic amine[HCA] intake and prostate cancer risk:effect modification by genetic variants[J].Nutr Cancer,2012,64(5):704-713.
[23] OSKINA N A,ERMOLENKO N A,BOYARSKIH U A,et al.Associations between SNPs within antioxidant genes and the risk of prostate cancer in the Siberian region of Russia[J].Pathol Oncol Res,2014,20(3):635-640.
[24] PARLAKTAS B S,ATILGAN D,GENCTEN Y,et al.A pilot study of the association of manganese superoxide dismutase and glutathione peroxidase 1 single gene polymorphisms with prostate cancer and serum prostate specific antigen levels[J].Arch Med Sci,2015,11(5):994-1000.
[25] MARTIN R C,BARKER D F,DOLL M A,et al.Manganese superoxide dismutase gene coding region polymorphisms lack clinical incidence in general population[J].DNA Cell Biol,2008,27(6):321-323.
[26] SU S,HE K,LI J L,et al.Genetic polymorphisms in antioxidant enzyme genes and susceptibility to hepatocellular carcinoma in Chinese population:a case-control study[J].Tumour Biol,2015,36(6):4627-4632.
[27] TRACHOOTHAM D,LU W Q,OGASAWARA M A,et al.Redox regulation of cell survival[J].Antioxid Redox Signal,2008,10(8):1343-1374.
[28] ORRENIUS S,GOGVADZE V,ZHIVOTOVSKY B.Mitochondrial oxidative stress:implications for cell death[J].Annu Rev Pharmacol Toxicol,2007,47:143-183.
[29] SUTTON A,KHOURY H,PRIP-BUUS C,et al.The Ala16Val genetic dimorphism modulates the import of human manganese superoxide dismutase into rat liver mitochondria[J].Pharmacogenetics,2003,13(3):145-157.

