miR-1、miR-27a、miR-369和miR-378在7个地方猪种背最长肌中的表达与肉质性状的关系研究
杨雪梅,顾以韧,梁 艳,陶 璇,钟志君,杨跃奎,曾 凯,陈晓晖,吕学斌
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,四川成都 610066)
miRNA是一类内生的、长度约为20~22个核苷酸,通过结合到靶mRNA上参与基因转录后水平调控的非编码小分子RNA,其在基因表达调控、脂肪细胞分化、脂质代谢等生理过程中均发挥着重要的作用[1-3]。miR-1可通过HDAC4作为靶基因促进肌发生,对调节骨骼肌增殖与分化起了非常重要的作用[4],它会与转录因子结合,促进心肌细胞膨胀,从而抑制心肌细胞的增殖;miR-27是迄今发现与人类脂肪细胞分化相关性最强的miRNA之一,其过表达能够降低LPL基因的表达量,进而抑制甘油三酯的积累以及脂肪生成基因的表达;miR-369通过招募AGO2和FXR1蛋白复合体结合到肿瘤坏死抑制因子-α基因3'UTR区域的腺嘌呤/尿嘧啶富集元件上靶向调控TNF-α的表达[5],TNF-α与猪肉品质存在显著相关;miR-378与脂肪分化密切相关,其在小鼠3T3-L1前体脂肪细胞分化成熟后表达量明显上调[6-7],miR-378还可通过影响雄烯酮和粪臭素代谢而对公猪的膻味起调控作用进而影响猪肉质[8]。我国的地方猪种以肌内脂肪含量(IMF)高、肌纤维细、肉质风味好著称,但各个地方猪种间又存在一定差异,如藏猪和雅南猪的IMF、丫杈猪和乌金猪的瘦肉率极显著高于其他地方猪种,其他肉质性能指标也存在显著或极显著差异。
签于这4种miRNA与猪肉品质调控存在的关系,研究采用q-PCR技术对四川省7个地方猪种背最长肌组织中miR-1、miR-27a、miR-369和miR-378的表达与肉质性状的差异进行研究,为进一步探明不同猪种肉质差异形成的分子机制提供基础数据,并为培育优质高效的新品种/配套系提供科学依据。
1 材料与方法
1.1 实验动物及样本采集 藏猪、成华猪、雅南猪、丫杈猪、青峪猪、内江猪和乌金猪均由四川省畜牧科学研究院种猪科研基地提供。每个猪种随机选取6头,共计42头,所有实验猪于同一时间开始组建群体,30日龄断奶,采用相同营养水平和饲喂方式,达到9月龄时进行屠宰,屠宰前停食24 h,自由饮水。屠宰后迅速采集倒数3~4肋骨间对应处的背最长肌组织,用于后续的肉质相关表型指标测定和miRNA荧光定量检测。
1.2 IMF测定 采用瑞士步琪(BUCHI)全自动快速抽提仪进行抽提,程序设置为萃取2 h,淋洗5 min,干燥20 min,每个样本独立测定2次。样品处理和实验操作严格按照国标GB/T 9695.1-2008《肉与肉制品游离脂肪含量测定》进行。
1.3 肌纤维面积测定 采用KD-2508 型切片机(Kedee,China)制作背最长肌样本的冰冻切片,H.E染色后用显微成像系统(Optec,China)采集代表性区域图像,通过Motic Images Advanced 3.2显微图像分析软件测定每个样品中100根肌纤维的面积。
1.4 硫胺素含量测定 样本处理和实验方法参照国家标准GB/T 5009.84-2003《食品中硫胺素(维生素B1)的测定》。
1.5 眼肌面积和瘦肉率测定 测量左胴体倒数3~4肋眼肌的宽、高,按照宽×高×0.7计算眼肌面积。按《猪胴体性状测定技术规范—NY/T825-2004》方法测定并计算瘦肉率。
1.6miR-1、miR-27a、miR-369和miR-378含量的测定 肌肉组织中总RNA提取:肌肉组织的RNA按照miRNeasy Mini Kit(Qiagen,China)的操作说明书提取,采用NanoDrop ND-1000(Thermo公司)测定260/280 nm 的ratio值(ratio > 2.0)检测总RNA的质量和浓度,检测合格用于后续实验。qRT-PCR:采用miScript II RT Kit(Qiagen,China)根据操作说明将RNA转录成cDNA,采用 miScript SYBR® Green PCR Kit(Qiagen,China) 在CFX96 Real-Time PCR Detection System(Bio-Rad,USA)仪器上进行荧光定量检测,每个反应体系20 μL。5 S、18 S和U6作为miRNA定量的内参基因,引物信息见表1。所有目的miRNA定量结果均通过熔解曲线分析验证PCR产物的特异性,确保产物无引物二聚体,每个样本重复3次,每次检测含3个阴性对照。采用2−ΔΔCt法计算目的miRNA的相对表达量。
1.7 统计分析 实验数据采用Sigmaplot 12.0对性状指标和基因表达量进行ANOVA分析,相关性采用Pearson Correlation程序分析。
2 结果与分析
2.1 相关肉质指标含量 由表2可知,在7个地方猪种中,藏猪IMF最高(5.59%),其次为雅南猪(5.07%),青峪猪最低(3.29%),均属于高IMF猪种,其中藏猪、雅南猪和内江猪的IMF极显著高于成华猪、丫杈猪、青峪猪和乌金猪(P<0.01);藏猪肌纤维直径最小(68.72 µm),其他6个猪种的肌纤维直径为73~80 µm,藏猪的肌纤维直径显著小于其他猪种(P<0.05);7个猪种的眼肌面积为14~23 cm2,藏猪、成华猪和青峪猪的眼肌面积显著低于其他猪种(P<0.05);青峪猪的瘦肉率最低(42.61%),其次为藏猪(42.65%),乌金猪的瘦肉率最高(49.27%),丫杈猪的瘦肉率达到了45%以上(47.07%),乌金猪和丫杈猪的瘦肉率显著低高于藏猪、成华猪、雅南猪、内江猪和青峪猪(P<0.05);雅南猪的硫胺素含量最高,为2.79 µg/g,其次是藏猪(2.12 µg/g),丫杈猪硫胺素含量最低,为0.60 µg/g,极显著低于其他6个猪种(P<0.01),而内江猪和青峪猪肌肉中硫胺素含量显著低于藏猪、成华猪、雅南猪和青峪猪(P<0.05)。

表1 引物信息表
2.2 4种miRNA的表达水平 由表3可知,内江猪的miR-27a、miR-378的相对表达量最高,其次为藏猪,最低的为丫杈猪,丫杈猪和乌金猪的miR-27a、miR-378的相对表达量极显著低于其他5个猪种(P<0.01),内江猪的miR-27a、miR-378的相对表达量显著高于藏猪、成华猪、雅南猪和青峪猪(P<0.05);成华猪的miR-369的相对表达量最高,其次为雅南猪,最低的为丫杈猪, 内江猪、丫杈猪和青峪猪的miR-369的相对表达量极显著低于其他4个猪种(P<0.01),藏猪和乌金猪的miR-369的相对表达量显著低于成华猪和雅南猪(P<0.05);藏猪miR-1的相对表达量最高,其次为成华猪,最低的为丫杈猪,内江猪、丫杈猪和乌金猪的miR-1相对表达量极显著低于藏猪、成华猪和雅南猪(P<0.01),青峪猪和雅南猪的miR-1相对表达量显著低于藏猪和成华猪(P<0.05),青峪猪极显著高于内江猪、丫杈猪和乌金猪(P<0.01)。
2.3 4种miRNA的表达水平与肉质相关指标含量的相关性 由 表 4可知,miR-27a、miR-378、miR-369、miR-1在背最长肌中的表达水平与IMF和硫胺素含量呈 正 相 关(rIMF=0.4~0.7;r硫 胺 素 =0.09~0.85),其中miR-369与硫胺素呈显著正相关(r=0.801,P<0.05);miR-27a、miR-378、miR-369、miR-1在背最长肌中的表达水平与肌纤维直径、眼肌面积、瘦肉率呈负相关(r肌纤维直径=-0.08~-0.55;r眼肌面积=-0.20~-0.85;r瘦肉率=-0.24~-0.70),其中miR-1与眼肌面积呈显著负相关(r=0.804,P<0.05)。
3 讨 论
3.1 肌纤维直径、IMF、眼肌面积、瘦肉率和硫胺素对肉质的影响 探明猪肉质性状相关基因或调控因子差异表达的分子遗传机理,从而有效地控制和提高猪肉品质,对提供满足消费者需求的猪肉产品具有重要意义。近年来育种学家已在猪肉质的调控机理方面做了大量研究[9-11],然而这些研究主要集中在DNA和mRNA水平的编码基因,随着miRNA的发现和功能的深入研究,从转录后的miRNA水平探索猪肉质差异形成的分子机理成为研究的热点。影响猪肉质风味的因素很多,其中IMF是重要决定因素之一,其与肉的多汁性、嫩度和风味密切相关[12],肌肉中的脂肪越多,则肉的多汁性越好,在7个地方猪种中,IMF在3.29%~5.60%,肉质优良;肌纤维直径越细,肉质就越细嫩,味美。藏猪的肌纤维最细,其他猪种均在70~80 µm,肉质细嫩;胴体瘦肉率是评价胴体品质的主要指标,与眼肌面积呈极显著正相关,与IMF呈负相关,7个猪种的胴体瘦肉率在42%~50%,属脂肪型猪种,这是我国地方猪种的一个普遍共性;硫胺素是一种非常重要的风味前体物质,其热降解是食品加工过程中风味形成的主要途径之一[13]。本研究显示,藏猪、乌金猪、雅南猪肌肉中的硫胺素含量较高,风味更好。本研究所测的地方猪种均属于肉质优良猪种,其风味佳、口感好,但瘦肉率较低,可作为优质风味猪培育的育种素材,利用外种猪进行杂交改良。

表2 不同猪种相关肉质指标含量
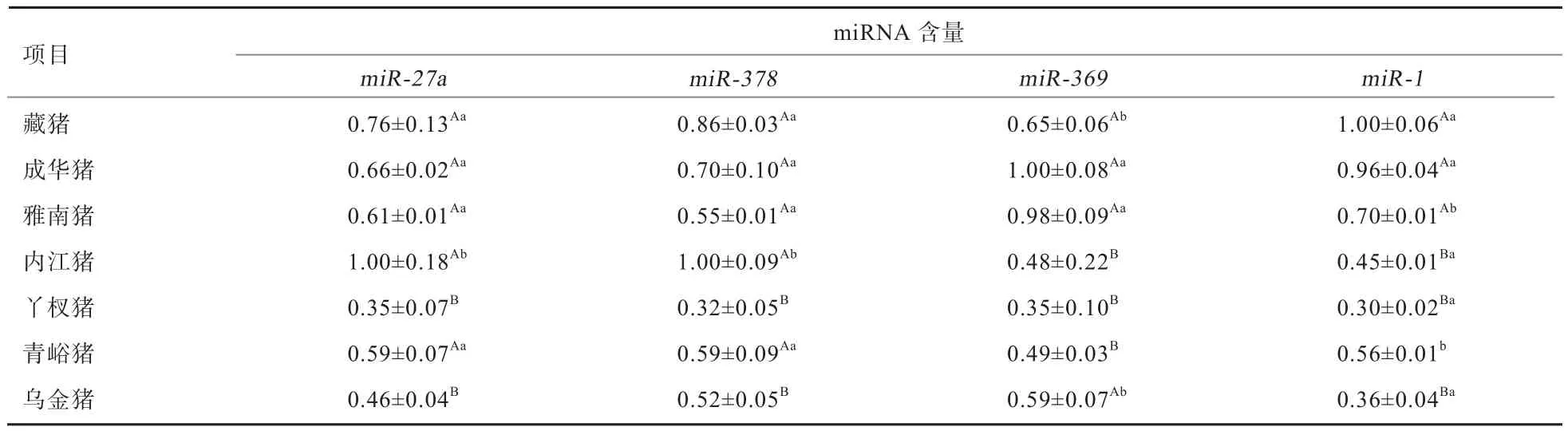
表3 不同猪种的miR-27a、miR-378、miR-369、miR-1水平
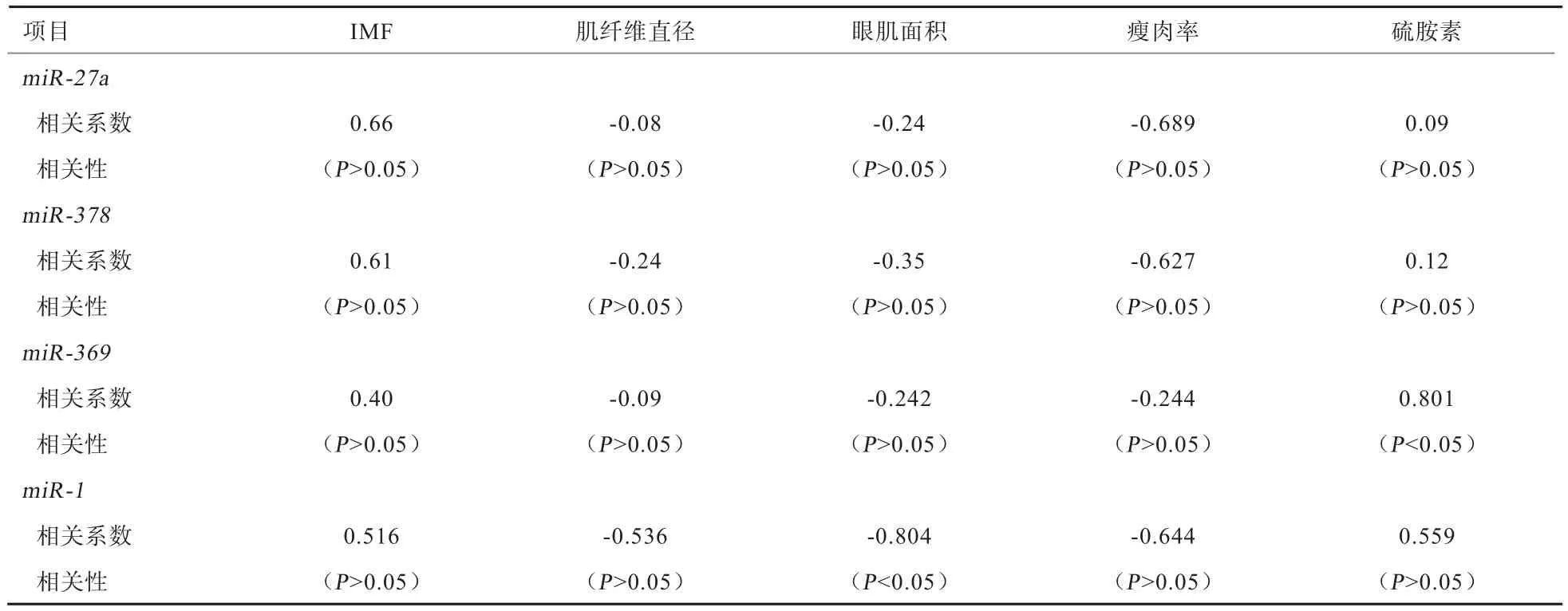
表4 miR-27a、miR-378、miR-369、miR-1与肉质相关指标的相关性分析
3.2miR-1、miR-27a、miR-369和miR-378含量对肌肉生长和脂肪沉积的影响 miRNA对猪肌肉发育有着重要的调节作用[4]。Chen等[14]研究发现,miR-1在骨骼肌细胞分化成熟过程中呈一定的时空特异性表达,促进骨骼肌细胞分化。miR-27与脂肪代谢和脂类细胞分化有着重要的联系,在调节能量代谢的动态平衡中起着重要的作用,其可通过减少成熟脂肪细胞分化和减少过氧化物酶体增殖物激活受体γ、视黄素X受体α的表达来抑制脂肪细胞的分化[15]。miR-369靶向调控TNF-a的表达,在脂肪沉积过程中扮演着重要角色[5]。miR-378受过氧化物酶体增殖物激活受体γ的调控,减少过氧化物酶体增殖物激活受体γ的表达,可以抑制脂肪细胞的分化[16]。本研究结果显示,背最长肌组织中miR-1、miR-27a、miR-369和miR-378的表达水平在7个猪种中趋于一致,具体表现为在藏猪、内江猪、雅南猪和成华猪中相对表达量较高,在丫杈猪和乌金猪中相对表达量较低,这与它们的生物学功能相一致。相关性分析显示,4种miRNA在背最长肌中的表达水平与IMF和硫胺素含量呈正相关,与肌纤维直径、眼肌面积和瘦肉率呈负相关,表明miR-1、miR-27a、miR-369和miR-378对猪肉质具有正调控作用,而对猪胴体性能具有负调控作用,其可以影响猪肌肉生长和脂肪沉积,为通过调控其表达水平实现猪肉质风味的改善提供了可能。
鉴于miRNAs对猪肌肉生长和脂肪沉积具有重要的调控功能,有必要对其具体调控机制进行系统深入的研究。本研究结果可为阐明猪肉品质形成的分子机理提供基础数据,并为畜牧业中的优质风味猪育种提供新的研究思路。
[1] 孙文星 , 南文婷, 谷淑华 , 等 . miR-27b 及其靶基因 PPARγ在肌内和皮下脂肪细胞中的差异表达分析[J].南京农业大学学报, 2016, 39(2) : 249-254.
[2] Bartel D P. MicroRNAs: target recognition and regulatory functions [J]. Cell, 2009, 136: 215-233.
[3] Li G, Li Y, Li Xet al. MicroRNA identity and abundance in developing swine adipose tissue as determined by Solexa sequencing[J]. Cell Biochem, 2011, 112(5):1318-1328.
[4] 刁欠云, 周莲莲, 李虹仪, 等. 不同品种猪肌肉组织miR-1和miR-133基因的表达分析[J]. 畜牧兽医学报, 2012,43(6):843-848.
[5] 母治平, 邓娟, 王滔, 等. 猪miR-369 靶基因肿瘤坏死抑制因子-α(TNF-α)的鉴定 [J]. 农业生物技术学报, 2012,20(8):922-927.
[6] 徐露莲, 史春梅, 陈玲, 等. 脂肪细胞分化相关miRNA-hasmiR-378生物信息学分析[J]. 中国儿童保健杂志, 2012,20(11):1001-1004.
[7] 徐露莲. has-miR-378的生物信息学特征及其在人脂肪细胞中的表达调控规律[D]. 南通: 南通大学, 2013:27-30.
[8] 马义涛, 李艳华, 周辉云, 等. 阉割对金华猪肝脏miR-122和miR-378表达量和膻味性状的影响[J]. 农业生物技术学报, 2013, 21(8): 957-964.
[9] 曾俊棋, 岳万福. 猪脂肪性状相关功能基因的研究[J]. 现代畜牧兽医, 2015, (10):17-22.
[10] 刘莹莹, 李凤娜, 印遇龙, 等. 中外品种猪的肉质性状差异及其形成机制探讨[J]. 动物营养学报, 2015, 27(1):8-14.
[11] 门小明. 肌肉纤维类型组成对猪肉品质的影响及其机理研究[D]. 无锡: 江南大学, 2012:35-40.
[12] Hoehne A, Nuernberg G, Kuehn C,et al. Relationships between intramuscular fat contents,selected carcass traits,and fatty acid profile in bulls using a F2-population[J]. Meat Sci, 2012, 90:629 -635.
[13] 秦刚. 荣昌猪肉在不同烤制温度中挥发性风味物质的研究[D]. 重庆: 西南大学, 2011:28-29.
[14] Chen J F, Mandel E M, Thomson J M,et al. The role of microRNA-1 and miR-133 in skele-tal muscle proliferation and differentiation[J]. Nat Genet, 2006, 38(2):228-233.
[15] 彭君慧, 郭娇. MicroRNAs对脂质代谢的调控研究进展[J].广东药学院学报, 2013, 29(1):101-105.
[16] John E, Wienecke-Baldacchino A, Liivrand M,et al. Dataset integration identifies transcriptional regulation of micro RNA genes by PPAR gamma in differentiating mouse 3T3-L1 adipocytes[J]. Nucleic Acids Res, 2012, 40(10):46-60.
——探访煤炭博物馆

