金魁猕猴桃RT-qPCR内参基因的筛选
张计育,黄胜男,王 涛,潘德林,翟 敏,郭忠仁
(江苏省中国科学院植物研究所,南京210014)
实时荧光定量PCR(Reverse transcription quantitative real-time PCR,RT-qPCR)技术是对PCR反应中每一个循环的产物进行定量分析,具有特异性强、灵敏度高、定量准确、速度快等优点,已成为研究基因功能的重要方法之一。选择较为稳定的内参基因是利用RT-qPCR方法进行基因表达分析的基础。目前,常用的内参基因有肌动蛋白基因(Actin,ACT)、18S rRNA基因、甘油醛-3-磷酸-脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因、微管蛋白基因(Tubulin)等。RT-qPCR反应中所需的内参基因在各种类型的组织、细胞和各种试验因素条件下均需恒定表达。近年来,关于RT-qPCR试验内参基因的选择已经在许多物种中进行了研究,包括葡萄[1]、甘蔗[2]、白杨[3]、香蕉[4]、荔枝[5]、柑橘[6]、木瓜[7]、苹果[8]、桃[9]等,发现没有一个内参基因在任何组织、任何试验条件下绝对稳定的表达。目前,关于猕猴桃组织特异性表达中内参基因选择的研究还未见报道。本试验以猕猴桃(Actinidia deliciosa)优良品种‘金魁’为材料,研究 6个常用的内参基因在不同组织中的表达特性,并利用 geNorm[10]、NormFinder[11]、BestKeeper[12]3种软件分别评价6个候选内参基因的稳定性,以期为研究猕猴桃各组织中基因表达分析选择稳定的内参基因。
1 材料与方法
1.1 材料
供试材料为‘金魁’猕猴桃5年生扦插苗,2016年4—5月取其根、茎、叶、花瓣、花萼、雌蕊、子房、幼果(花后10 d),于液氮中速冻保存用于后续RNA的提取。
1.2 方法
1.2.1 RNA提取和cDNA的合成
RNA的提取采用改良的CTAB法[13]。RNA的完整性用2%的琼脂糖凝胶溴化乙锭染色检测。RNA浓度和纯度通过在NanDropND-2000分光光度计上测230 nm、260 nm、280 nm的值确定。cDNA合成采用能消除残留DNA的试剂盒PrimeScript RT reagent kitwith gDNA Eraser(TaKaRa,Japan)进行,每个RNA样品取1μg,具体方法参考说明书。
1.2.2 引物设计和RT-qPCR分析
选取6个内参基因进行RT-qPCR试验以检测其稳定性,包括最常用的ACT基因、亲环蛋白基因(Cyclophilin,CYP)、RNA聚合酶亚基2基因(RNA polymerase subunit2,RP2)、GAPDH基因、β-微管蛋白基因(β-tubulin,TUB)、α-微管蛋白基因(α-tubulin,TUA)。其中 ACT基因的引物参照 Zhang等的报道[14],其余5个内参基因的序列来源于猕猴桃基因组数据库(http://bioinfo.bti.cornell.edu/cgi-bin/kiwi/home.cgi),引物设计采用Beacon Designer软件进行,引物序列如表1。采用RT-qPCR方法确定内参基因的表达水平,应用Applied BiosystemsTM7300 Real Time PCR System,20μL反应体积中包含1.5μL 10倍稀释后的cDNA,0.3μL(10 pmol/L)上、下游引物,10μL SYBR荧光染料(TaKaRa code:DRR041A)和7.9μL无菌ddH2O。PCR反应条件:94℃4 min;94℃30 s,60℃20 s,72℃43 s,40个循环。最后一个循环之后,利用热熔解曲线(55—95℃)监控每个PCR扩增的特异性。利用7300系统软件和2-ΔCt方法分析候选基因的表达水平。

表1 猕猴桃6个内参基因的引物序列Table1 Primer sequences of the 6 reference genes in kiwifruit
1.2.3 数据分析
参照公式Q=2ΔCt,根据每个扩增样品的Ct值计算各基因的相对表达量Q。△Ct=Ct x-Ct样品(Ct x为所有样品中最低的 Ct值,Ct样品为每个样品的 Ct值)。利用 geNorm[10]、NormFinder[11]、BestKeeper[12]3种软件分别评价6个候选基因在猕猴桃不同组织中表达的稳定性,比较稳定值大小以确定适宜的内参基因。

图1 猕猴桃不同组织总RNA提取的琼脂糖凝胶电泳检测Fig.1 Agarose gel analysis of total RNA extracted from different tissues of kiw ifruit p lant
2 结果与分析
2.1 RNA质量分析
利用CTAB法从猕猴桃不同组织中提取总RNA,琼脂糖凝胶电泳检测结果表明:猕猴桃所有样品电泳图谱28S rRNA和 18S rRNA条带清晰(图 1),无弥散带,且28S rRNA亮于18S rRNA,说明在提取过程中几乎没有RNA降解现象。核酸定量检测结果表明:在所有的RNA样品中,其A260/A280比值介于1.90—2.15(表2),表明所提取的RNA较少有蛋白质等的污染。同时,A260/A230的比值均大于2.0(表2),说明RNA纯度较高,没有糖类、盐类和有机物质等的污染。猕猴桃不同组织中总RNA的产量依材料不同存在较大的差别(表2),其中子房中的RNA含量最高,为1 105.7 ng/μL,花瓣中的含量最低,为398.79 ng/μL。以上结果表明,提取的RNA符合后续分子生物学试验的要求。
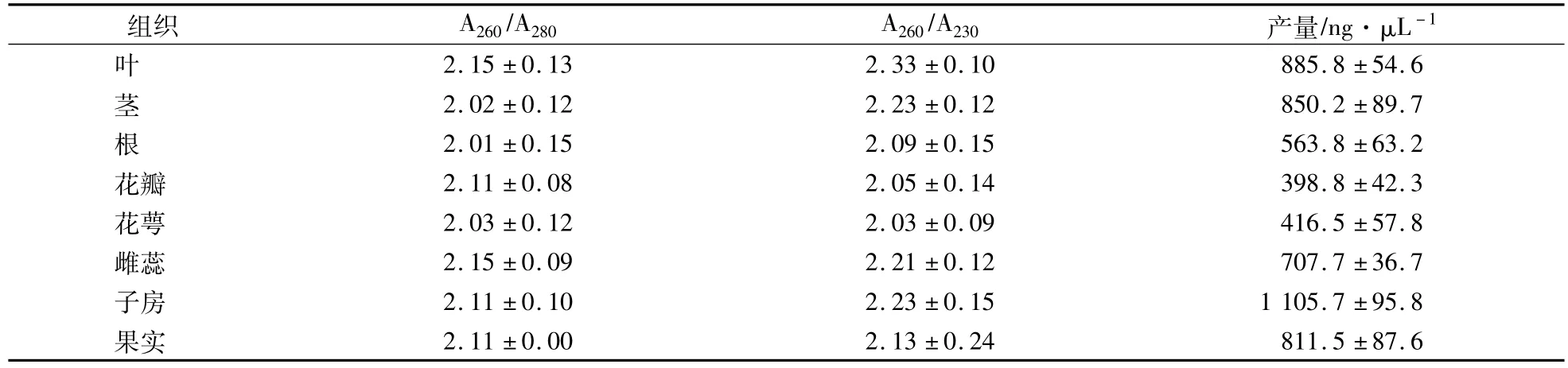
表2 猕猴桃不同组织总RNA提取质量的比较Table 2 Comparison of the quality of total RNA extracted from different kiwifruit tissues
2.2 引物质量检测
为了确定所设计内参基因引物扩增的单一性,以猕猴桃叶片的第一链cDNA为模板,进行RT-PCR分析。结果表明:6个内参基因引物扩增的熔解曲线均只有明显的单一峰(图3),说明所用引物都能特异性地扩增各内参基因的相应产物,不存在引物二聚体,RT-qPCR的结果准确可靠。

图2 猕猴桃内参基因RT-qPCR扩增产物熔解曲线分析Fig.2 Melting curve analysis of RT-qPCR amplications product of kiwifruit reference genes
2.3 内参基因在不同组织中表达特性分析
利用比较Ct法分析内参基因在猕猴桃不同组织中的表达特性(图3),结果表明:ACT和TUA基因在各组织中的表达量差异较小,表达相对稳定。GAPDH、RP2、CYP、TUB基因在猕猴桃各组织中的表达量差异较大。GAPDH基因在根中的表达量最高,在花瓣中的表达量最低。RP2在叶中的表达量最高,其次是子房,在花萼中的表达量最低。CYP基因在根中的表达量最高,在茎中的表达量最低。TUB在茎中的表达量最高,其次是雌蕊,在花萼中的表达量最低。
2.4 内参基因稳定性分析
利用geNorm软件计算出所有基因与其他候选基因所得配对变异值的平均值M,M值越小,表明所选的内参基因越稳定。结果表明:CYP、TUB、RP2、GAPDH、TUA、ACT基因的 M值依次为 1.577、1.317、1.121、0.804、0.340和0.340,即表达稳定性由高到低为ACT=TUA>GAPDH>RP2>TUB>CYP(表3)。根据NormFinder软件分析可得(表3),ACT基因在猕猴桃不同组织中表达最为稳定,为最适内参基因,其次是TUA基因,CYP基因表达稳定性最差。BestKeeper软件的分析结果与NormFinder软件分析结果相同(表3)。可以得出,ACT基因是猕猴桃不同组织中表达最为稳定的内参基因。

图3 猕猴桃内参基因在各组织中的表达特性分析Fig.3 Expression analysis of reference genes in different tissues of kiw ifruit p lant

表3 利用geNorm,Norm Finder和BestKeeper软件计算的不同内参基因表达稳定性的顺序Table 3 Ranking of candidate reference genes in order of their expression stability calculated by geNorm,Norm Finder and BestKeeper
3 讨论
RT-qPCR是有效、快速、可靠的检测基因表达的方法之一,在探索基因功能方面起到了重要的作用。通常情况下,在不同物种、不同品种、不同组织以及不同的试验条件,选择的内参基因是不同的。为了得到更加准确的基因表达结果,在进行基因表达研究之前,必须对内参基因进行稳定性评估,从而选择更加稳定合适的内参基因。Yeap等[15]在5个不同的试验设计下对油棕中14个内参基因进行了稳定性评估,结果表明:油棕生殖器官中表达稳定的内参基因是赤霉素响应蛋白2基因(Gibberellin-responsive protein 2,GRAS)和钙调蛋白基因(Glutaredoxin);果皮不同发育阶段表达稳定的内参基因是GRAS和亲环蛋白基因(Cyclophilin 2,Cyp2);营养器官和油棕其他器官中表达稳定的内参基因是Cyp2、GRAS和信使RNA前体剪切因子SLU7(Pre-mRNA splicing factor SLU7,SLU7);油棕所有组织中最稳定的内参基因是GRAS。Upadhyay等[16]对葡萄中10个内参基因进行了稳定性研究,发现在叶轴伸长过程中,tubulin、EF1α和UBC基因稳定表达,在花和浆果发育阶段,PP2A、SAND、Sutra基因表达稳定。Tong等[9]利用相关软件对11个内参基因在‘雨花1号’和‘京玉’桃不同cDNA样品中表达的稳定性进行了比较分析,发现内参基因TEF2、UBQ10和RP II在所有的供试样品中表达稳定,可以用于总样品组合中桃果实果胶物质降解相关基因的表达分析。Kim等[19]对李子中20个候选内参基因在141个样品中的表达进行了稳定性评估,发现SAND蛋白相关交换蛋白基因(SAND protein related trafficking protein,MON)、延长因子 1α基因(Elongation factor 1 alpha,EF1α)、起始因子5A(Initiation factor 5A,IF5A)是所有样品中表达较为稳定的内参基因,可以用于基因表达研究。本研究对‘金魁’猕猴桃8个不同组织的6个内参基因的表达稳定性进行了研究,结果表明:ACT基因在不同组织的表达较为稳定,可以作为基因在组织中表达研究的内参基因。
[1]REID K E,OLSSON N,SCHLOSSER J,et al.An optimized grapevine RNA isolation procedure and statistical determination of reference genes for real-time RT-PCR during berry development[J].BMC Plant Biology,2006,6:27.
[2]ISKANDAR H,SIMPSON R,CASU R,et al.Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J].Plant Molecular Biology Reporter,2004,22:325-337.
[3]XU M,ZHANG B,SU X,et al.Reference gene selection for quantitative real-time polymerase chain reaction in Populus[J].Analytical Biochemistry,2011,408(2):337-339.
[4]CHEN L,ZHONG H Y,KUANG JF,et al.Validation of reference genes for RT-qPCR studiesof gene expression in banana fruitunder different experimental conditions[J].Planta,2011,234(2):377-390.
[5]ZHONGH Y,CHEN JW,LICQ,etal.Selection of reliable reference genes for expression studiesby reverse transcription quantitative real-time PCR in litchiunder different experimental conditions[J].Plant Cell Reports,2011,30(4):641-653.
[6]MAFRA V,KUBO K S,ALVES-FERREIRA M,et al.Reference genes for accurate transcript normalization in citrus genotypes under different experimental conditions[J].PloSONE,2012,7(2):e31263.
[7]ZHU X,LIX,CHENW,et al.Evaluation of new reference genes in papaya for accurate transcript normalization under different experimental conditions[J].PloSONE,2012,7(8):e44405.
[8]PERINIP,PASQUALIG,MARGIS-PINHEIRO M,et al.Reference genes for transcriptional analysis of flowering and fruit ripening stages in apple(Malus×domestica Borkh.)[J].Molecular Breeding,2014,34(3):829-842.
[9]TONG Z,GAO Z,WANG F,et al.Selection of reliable reference genes for gene expression studies in peach using real-time PCR[J].BMC Molecular Miology,2009,10:71.
[10]VANDESOMPELE J,DE PRETER K,PATTYN F,etal.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3(7):research0034.1-0034.11.
[11]ANDERSEN C,JENSEN J,ORNTOFT T.Normalization of realtime quantitative reverse transcription-PCR data:A model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J].Cancer Res,2004,64:5245.
[12]PFAFFLMW,TICHOPAD A,PRGOMETC,et al.Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeper Excel-based tool using pair-wise correlations[J].Biotechnology Letters,2004,26:509-515.
[13]张计育,杜小丽,渠慎春,等.一种简便的提取植物总RNA和DNA的方法[J].上海农业学报,2011,27(3):140-143.
[14]ZHANG B,CHEN K,BOWEN J,et al.Differential expression within the LOX gene family in ripening kiwifruit[J].Journal of Experimental Botany,2006,57(14):3825-3836.
[15]YEAPW-C,LOO JM,WONG Y C,et al.Evaluation of suitable reference genes for qRT-PCR gene expression normalization in reproductive,vegetative tissues and during fruit development in oil palm[J].Plant Cell,Tissue and Organ Culture,2013,116(1):55-66.
[16]UPADHYAY A,JOGAIAH S,MASKE S R,et al.Expression of stable reference genes and SPINDLY gene in response to gibberellic acid application at different stages of grapevine development[J].Biologia Plantarum,2015,59(3):436-444.
[17]KIM H-Y,SAHA P,FARCUH M,etal.RNA-Seq analysis of spatiotemporal gene expression patterns during fruit development revealed reference genes for transcript normalization in plums[J].Plant Molecular Biology Reporter,2015,33(6):1634-1649.

