重组酶聚合酶扩增技术快速检测转基因玉米Bt11
刘 静,武国干,吴 潇,刘 华,王金斌,吕贝贝,蒋 玮,唐雪明,3,4*
(1上海海洋大学食品学院,上海200090;2上海市农业科学院生物技术研究所,上海201106;3农业部转基因植物环境安全监督检验测试中心(上海),上海201106;4上海市农业遗传育种重点实验室,上海201106)
随着转基因技术研究与应用的快速发展,转基因产品检测技术的研究已成为全球转基因生物安全管理的重要组成部分。PCR技术在转基因检测中有着广泛的应用,但是常规的PCR检测需要精密的热循环仪以及复杂的实验程序,难以满足非实验室环境下转基因核酸成分快速筛查和检测的需求。近年来,核酸等温扩增技术得到了较快的发展。与常规PCR相比,核酸等温扩增技术不需要热循环仪器,可在恒温条件下快速扩增出目的片段,具有简便、灵敏的特点。目前,主要的等温扩增技术有环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)、滚环扩增技术(Rolling circle amplification,RCA)以及重组酶聚合酶扩增技术(Recombinase ploymerase amplification,RPA)等[1-2]。
RPA技术原理是模拟生物体内DNA复制,由重组酶介导、在37℃下对目标片段进行等温扩增,实现单分子核酸检测。RPA最大的特点是不需要通过高低温度循环来实现核酸解链和退火,只需要1对引物即可在37℃恒温、30 min以内完成模板核酸的扩增,与其他等温扩增技术相比具有明显优势。该技术对硬件设备的要求较低,特别适合用于体外诊断、食品安全、生物安全、农业等领域[3]。目前,该技术在转基因农产品检测领域研究的还很少,但极具发展潜力。
全球已经商业化和正在研究的转基因植物中,大多数与食品和饲料有关,主要有大豆、玉米、油菜、马铃薯、番茄等。玉米是世界上重要的粮食作物之一,基因工程技术最早应用在玉米上是开发具有抗虫和抗除草剂特性的转基因玉米品系。瑞士先正达公司研发的转基因玉米Bt11兼具抗虫及耐除草剂两种特性,其转入的耐草丁膦除草剂基因是草丁膦乙酰转移酶基因(Phosphinothricin acetyl transferase gene,PAT)。本研究基于RPA技术,根据外源基因PAT与载体骨架相连区段,设计上下游引物,特异性扩增转基因玉米Bt11的边界序列,拟建立转基因玉米Bt11的特异性RPA检测方法。
1 材料与方法
1.1 材料
转基因玉米Bt11含量5%、1%、0.1%的标准品,转基因玉米GA21、Bt176、NK603均购自上海宜醇化工科技有限公司;非转基因玉米购自国内市场。
RPA凝胶检测试剂盒(TwistAmp DNA Amplification Basic Kits)购自苏州达麦迪生物医学科技有限公司;DNA提取试剂盒购自北京康为世纪生物科技有限公司。DNA Ladder Marker购自大连宝生物公司。RPA引物由上海生工生物技术有限公司合成。
1.2 方法
1.2.1 基因组DNA的提取
植物种子粉末作为DNA提取材料,依照康为植物基因组提取试剂盒的操作手册,进行植物总DNA的提取,并测其浓度,于-20℃保存备用。
1.2.2 引物设计与筛选
引物设计是RPA扩增成功的关键因素,要求引物长度在30—35 bp,扩增片段控制在100—200 bp[4-5]。本研究根据转基因玉米Bt11外源基因PAT与载体骨架相连区段,依照RPA凝胶检测试剂盒引物设计说明,设计6对引物用于筛选、建立检测方法(表1)。

表1 RPA方法检测转基因玉米Bt11引物序列Table 1 Primers of RPA assay for GM maize Bt11
1.2.3 RPA反应
RPA的反应体系是50μL,向含有冻干酶粉的0.2 mL TwistAmp Basic反应管中加入水合缓冲液(Rehydration Buffer)29.5μL,去离子水 12.2μL,上下游引物各 2.4μL(10μmol/L),植物基因组 DNA 1μL,最后加入醋酸镁溶液2.5μL(280 mmol/L),充分混匀后将反应试管放在37℃金属浴中,恒温反应30 min。取反应产物经酚/氯仿抽提纯化后,在2%琼脂糖凝胶上以120 V恒压电泳25 min,利用凝胶成像系统进行鉴定[6-7]。
1.2.4 转基因玉米Bt11特异性验证
以转基因玉米品系GA21、Bt176、NK603、Bt11的DNA为模板,验证所筛选引物检测Bt11的特异性。
1.2.5 RPA反应时间和温度优化
时间优化:以转基因玉米Bt11的DNA为模板,配置反应体系,于37℃金属浴中反应,控制反应时间分别为5 min、10 min、15 min、20 min、30 min、40 min。反应结束后立即加酚/氯仿抽提纯化。
温度优化:以转基因玉米Bt11的DNA为模板,配置反应体系,控制反应时间为20 min,反应温度设定围绕37℃,以5℃为梯度展开,分别设置为17℃、22℃、27℃、32℃、37℃、42℃、47℃、52℃。反应结束后立即加酚/氯仿抽提纯化。
1.2.6 灵敏度试验
将已测定浓度的各样品基因组 DNA用灭菌水稀释成含量分别为1 000拷贝/μL、500拷贝/μL、200拷贝/μL、100拷贝/μL、50拷贝/μL及10拷贝/μL的溶液,作为模板进行RPA扩增,进行绝对检测限试验。
转基因玉米Bt11含量5%、含量1%、含量0.1%的DNA为直接提取所购标准品。用相同浓度的非转基因玉米DNA将含量0.1%的Bt11玉米DNA稀释成含量为0.05%、0.01%的DNA样品,得到5%、1%、0.1%、0.05%、0.01%5个含量梯度的模板,进行RPA扩增,确定其相对检测限。研究中所有扩增的目标片段均经过测序验证。
2 结果与分析
2.1 特异性检测Bt11引物筛选
如图1所示,引物对F1/R1、F2/R2和F3/R3均未扩增出目的条带;F4/R4扩增的条带不明确;F5/R5出现目的条带,但扩增效率低;F6/R6出现明显的目的条带,且扩增效率较高。
2.2 特异性检测转基因玉米Bt11验证
对筛选的特异性引物对F6/R6进行特异性验证。如图2所示,不含模板的空白和阴性对照(非转基因玉米)中均无扩增条带,表明试验过程无污染。只有含转基因玉米Bt11的反应体系中出现188 bp的目的条带,其他转基因玉米品系GA21、Bt176、NK603中均无扩增条带。
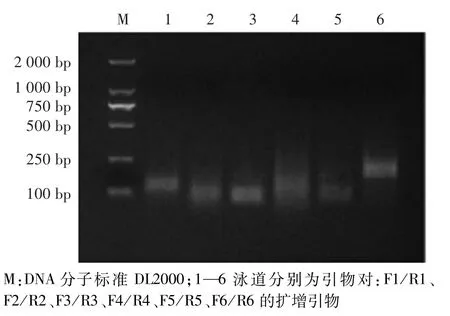
图1 特异性检测Bt11引物筛选结果Fig.1 Screening of primers for specific detection of GM Bt11
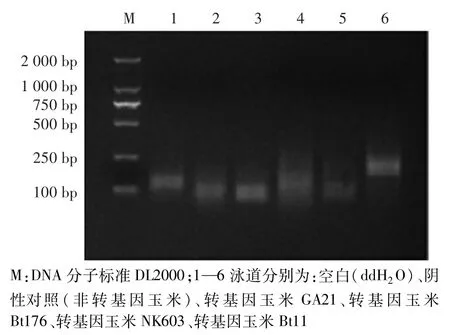
图2 特异性检测转基因玉米Bt11验证Fig.2 Verification of specific detection of GM maize Bt11
2.3 反应时间优化和温度优化
如图3所示,随着反应时间的延长,目的条带亮度逐渐增强。反应15 min时,已出现明显的目的条带;反应20 min时,目的条带更亮;反应30 min和40 min,亮度与20 min相似,表明RPA反应在20 min时,就已经大量扩增。
如图4所示,反应温度在17℃、22℃与52℃时,无扩增;在27℃与47℃时,有微弱扩增;在32℃、37℃与42℃时均有扩增,37℃与42℃时扩增效率较高。
2.4 灵敏度检测
分别取1.2.6所述6个浓度梯度的转基因玉米Bt11 DNA稀释液1μL作为模板,进行RPA绝对检测限检测。如图5所示,当 DNA含量为1 000拷贝/μL、500拷贝/μL、200拷贝/μL、100拷贝/μL时,均有188 bp的目的条带;DNA含量为50拷贝/μL及10拷贝/μL时,无目的条带;表明本试验建立的RPA特异性检测Bt11的绝对检测限约为100拷贝/μL。
将1.2.6中5个百分含量梯度的Bt11作为模板,进行RPA相对检测限检测。如图6所示,当Bt11的含量为5%、1%、0.1%时,出现188 bp的目的条带;当Bt11含量为0.05%、0.01%时,无目的条带;表明建立的RPA反应特异性检测Bt11的相对检测限约为0.1%。
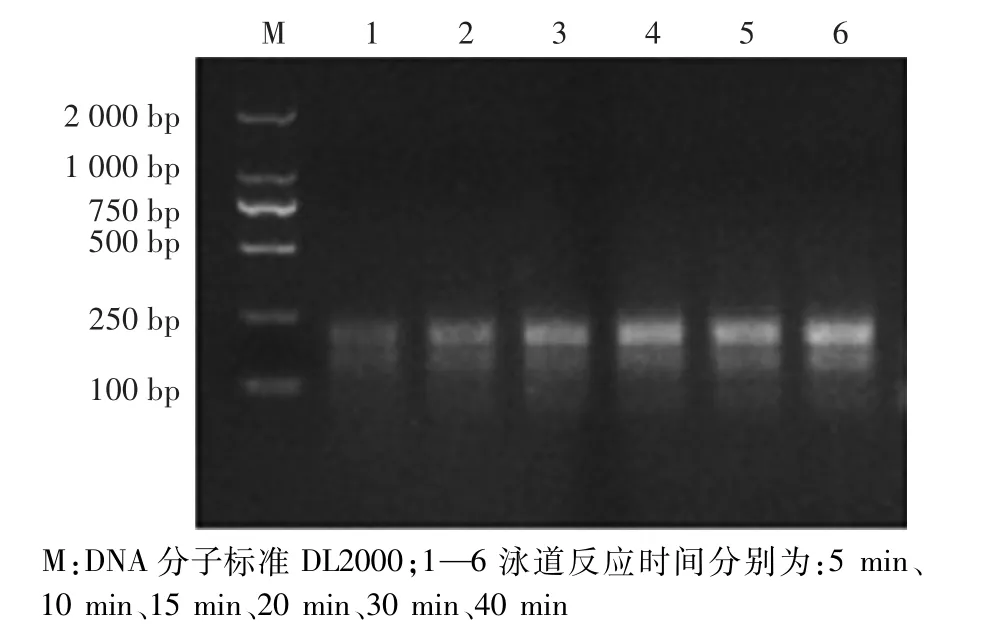
图3 反应时间优化Fig.3 Optim ization of reaction time
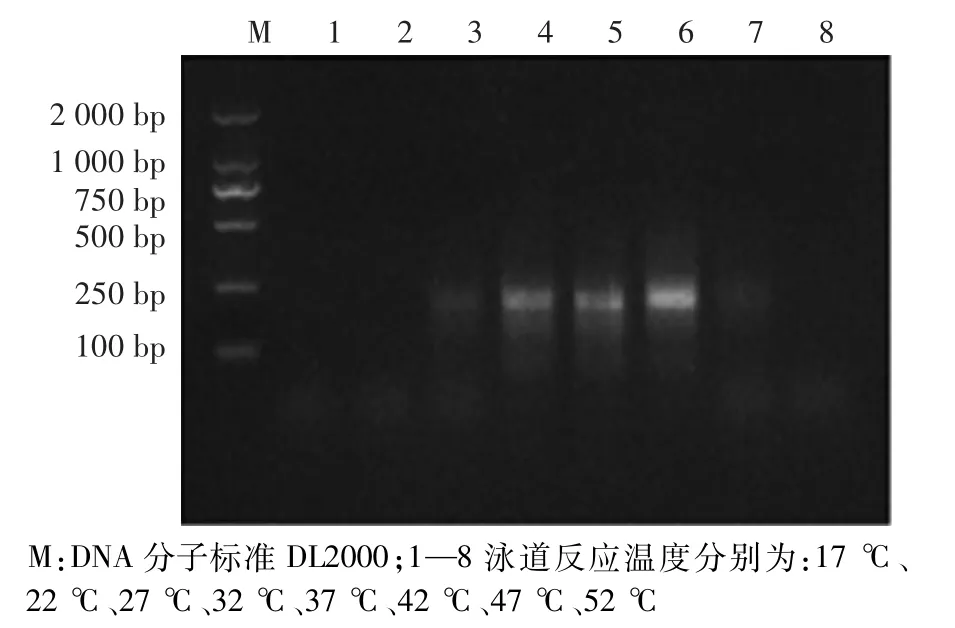
图4 反应温度优化Fig.4 Optim ization of reaction temperature
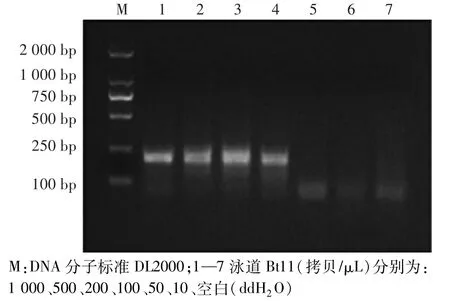
图5 绝对灵敏度检测Fig.5 Detection of absolute sensitivity
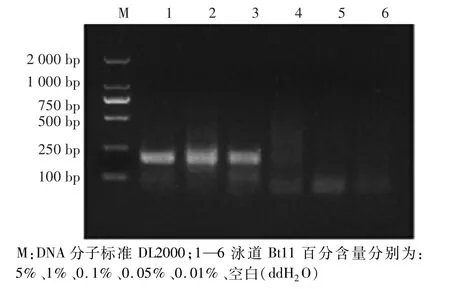
图6 相对灵敏度检测Fig.6 Detection of relative sensitivity
3 讨论
随着国际转基因产品商业化推广的迅猛发展,为了抢占农业生物技术的制高点,我国在“十三五”规划中重点强调了加强转基因产品的研究和推进商业化进程。为了保障转基因产品安全有效的研发和管理,研究和应用新型快速的转基因产品检测技术是主管部门用于市场监管和例行监测的重要手段,也是落实我国转基因产品标识制度的有力技术支撑。
转基因产品成分的检测根据检测的靶标不同分为4个层次,分别是通用元件筛选检测、基因特异性检测、构建特异性检测和品系特异性检测。其中,构建特异性检测是在外源基因与载体骨架连接区序列设计引物[8]。本研究根据转基因玉米Bt11外源基因PAT与载体骨架相连区段设计引物,属于构建特异性检测方法。
RPA方法检测的特异性、灵敏度与引物设计有很大关系,为建立更灵敏的RPA方法,根据不同的转基因产品的靶标序列,需要进行引物筛选。作为一项新兴的技术,目前在农产品检测中,RPA引物的设计还没形成可供参考的设计规则,传统的PCR引物是不适用的,RPA引物比传统PCR引物长,引物太短会影响重组率和扩增效率[9]。本研究的经验:RPA引物的长度为30—35个核苷酸较适宜;扩增片段长度为100—200 bp,扩增效果较好;5’端的3—5个核苷酸应当避免聚鸟嘌呤,胞嘧啶在这里是有益的,能促进片段的重组;对于3’端的3个核苷酸来说,鸟嘌呤和胞嘧啶有助于聚合酶的稳定结合,可以提升引物的扩增性能;其他规则类似于普通PCR引物设计。
本研究显示,RPA技术在37℃下扩增时间为20 min时,就能出现明显的条带,并且只需要1对引物。相比较而言,LAMP需要在靶基因6个区域设计4—6种特异引物,且设计方法复杂,60℃下反应60 min左右;而RPA操作简单,反应更快速,温度要求低,不需要热循环仪,只需简单的恒温加热器,更适合应用于条件较简陋的基层卫生机构及野外条件下转基因的检测。本研究首次对转基因玉米Bt11初步建立了RPA特异性检测方法,在20min内37℃下就可完成扩增,其绝对检测限约为100拷贝/μL,相对检测限约为0.1%,远低于欧盟国家设定的转基因最低限量0.9%,灵敏度高,可满足相关行业的日常检测需求。
本研究建立的特异性检测转基因玉米Bt11的RPA方法,短时间内能实现对目的片段的指数扩增,特异性强、灵敏性高,对环境设备要求低,操作简便,在转基因产品成分检测领域具有广阔的推广应用前景。
[1]GURINDER J R,RASHMI C,MONIKA S.Multiplex PCR-based simultaneous amplification of selectable marker and reporter genes for the screening of geneticallymodified crops[J].J.Agric.Food Chem.,2009,57(12):5167-5172.
[2]XU C,LIL,JINW J,et al.Recombinase Polymerase Amplification(RPA)of CaMV-35S Promoter and nos Terminator for Rapid Detection of Genetically Modified Crops[J].International Journal of Molecular Sciences,2014,15:18197-18205.
[3]XIA X M,YU Y X,WEIDMENN M,et al.Rapid Detection of Shrimp White Spot Syndrome Virusby Real Time,Isothermal Recombinase Polymerase Amplification Assay[J].PLOSONE,2014,9(8):e104667.
[4]MEKURIA T A,ZHANG S,EASTWELL K C.Rapid and sensitive detection of little cherry virus 2 using isothermalreverse transcriptionrecombinase polymerase amplification[J].Journal of Virological Methods,2014,205:24-30.
[5]AMER H M,WAHED A A E,SHALABYM A,etal.A new approach for diagnosis of bovine coronavirus using a reverse transcription recombinase polymerase amplification assay[J].Journal of Virological Methods,2013,193:337-340.
[6]MILENA E,WANG Y J,PETER O,et al.Recombinase polymerase amplification assay for rapid detection of Francisella tularensis[J].Journal of Clinical Microbiology,2012,50(7):2234-2238.
[7]KRÕLOV K,FROLOVA J,TUDORAN O,et al.Sensitive and Rapid Detection of Chlamydia trachomatis by Recombinase Polymerase Amplification Directly from Urine Samples[J].The Journal of Molecular Diagnostics,2014,16(1):127-135.
[8]LU X B,WU H B,WANGM,etal.Developing amethod of oligonucleotidemicroarray for event specific detection of transgenicmaize(Zeamays)[J].Acta Agron Sin,2009,35(8):1432-1438.
[9]BOYLE D S,MCNERNEY R,TENG L H,et al.Rapid Detection of Mycobacterium tuberculosis by Recombinase Polymerase Amplification[J].PLOSONE,2014,9(8):e103091.

