核苷类似物结合肝动脉化疗栓塞术对乙型肝炎病毒再激活的研究
张晶芬,付广双
(吉林大学第四医院感染科,长春 130011)
原发性肝癌是常见的恶性肿瘤之一。据统计,每年我国原发性肝癌发病例数约为100万。该病早期无明显症状,就诊时已多属中晚期,增大了治疗难度[1]。中晚期肝癌患者主要采用肝动脉化疗栓塞术(TACE)治疗,该方法得到医学界的共同认可,且行之有效。在我国,原发性肝癌患者经TACE治疗后长期生存率不高,因约为85%以上的肝癌患者均在乙型肝炎病毒(HBV)感染导致的肝硬化基础上发病,超过60%的患者存在HBV活动性复制[2-3]。HBV病毒复制和宿主免疫功能之间存在一个动态平衡,对宿主内感染过程有重大影响。一旦停止抗病毒治疗或出现外来刺激而改变HBV和宿主免疫功能之间的平衡,即可出现HBV再激活,从而引起病情的反复。在治疗过程中部分患者的肝功能可因此受到损伤,对后续治疗及预后造成严重影响。大量实验表明,原发性肝癌患者TACE治疗后,出现HBV再激活现象[4-5]。较多学者尝试行TACE治疗时应用核苷类似物,如恩替卡韦分散片,防治HBV再激活造成的肝炎发作,可延长患者的生存时间、保护原发性肝癌患者的肝功能。现探讨核苷类似物结合TACE对HBV再激活的影响,并分析其临床意义。
1 资料与方法
1.1一般资料 2014年1月至2016年1月该院诊治的原发性肝癌患者150例,男123例,女27例;平均年龄(52.16±16.25)岁。随机选择50例患者作为对照组,单纯进行TACE。具有慢性乙型肝炎基础的原发性肝癌患者100例作为观察组,观察组患者手术前服用恩替卡韦分散片,1 d 1片,至少服用1年。诊断标准[6]:(1)甲胎蛋白(AFP)≥400 g/L,排除妊娠、活动性肝病及转移性肝癌,且能触及肿大、坚硬及有大结节状肿块的肝脏或影像学检查有肝癌特征的占位性病变者。(2)AFP<400 g/L,排除妊娠、生殖系胚胎源性肿瘤、活动性肝病及转移性肝癌,且2种影像学检查有肝癌特征的占位性病变,或有2种肝癌标志物阳性及1种影像学检查有肝癌特征的占位性病变者。(3)有肝癌临床表现并肯定肝外转移病灶,包括肉眼可见的血性腹腔积液或在其中发现癌细胞,并能排除转移性肝癌者。
1.2纳入与排除标准[7-8](1)纳入标准:符合上述诊断标准;以TACE为主的治疗方法;患者血清乙型肝炎表面抗原(HBsAg)阳性。(2)排除标准:存在严重的心肺疾病、凝血功能障碍及其他部位肿瘤;精神类疾病者;在接受治疗前曾进行过消融手术。所有患者均签署知情同意书。
1.3方法 (1)术前准备:2组患者术前均进行凝血功能检查、血常规、心电图、乙型肝炎两对半、肝肾功能检查等,并进行CT检测,区分肿瘤的类型。同时将患者的病理状况、服用核苷类似物(替卡韦分散片),以及TACE风险等告知患者并对其疑虑进行解答。所有患者术前均禁水4 h、禁食6 h。(2)术后处理:术后密切观察患者是否血肿形成或渗血现象,对状况较差患者,应对其生命体征进行密切观察,如疼痛、体温、呕吐、骨髓抑制等,较为严重时给予药物治疗。(3)术后指标观察:术后2周及1个月之后,分别对患者的肝功能、乙型肝炎病毒DNA(HBV DNA)、乙型肝炎两对半指标进行观察。(4)HBV病毒再激活标准:患者在免疫抑制治疗中HBV病毒复制由低至高,或患者血清HBV DNA由阴转阳,便是HBV病毒再激活指标。
1.4仪器与试剂 (1)设备及器械:Siemens AXIOM Artis dFA型平板臂血管造影机(美国GE公司)。高压注射器设备为Mark 5型高压注射器(美国GE公司)。造影导管采用RH管、Cobra管、Yashiro导管等。(2)操作方法:TACE治疗前1 d及介入治疗后1个月分别采集外周血经荧光定量PCR法检测血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)、清蛋白(ALB)及乙型肝炎两对半。

2 结 果
2.12组患者一般资料结果比较 2组患者的年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
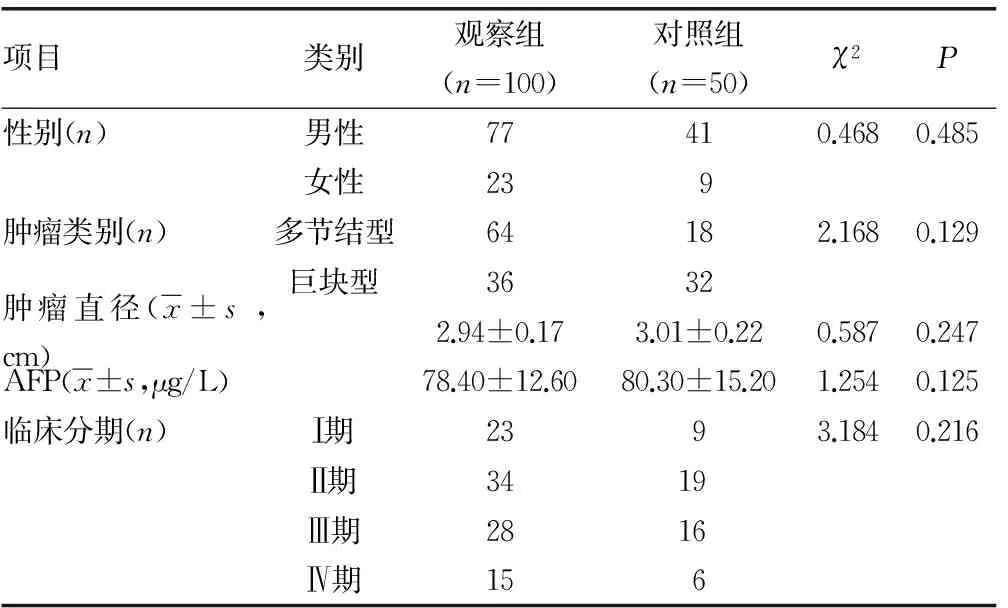
表1 2组患者的一般资料结果比较
2.22组患者HBV再激活结果比较 观察组患者HBV再激活率为16.0%,对照组为36.0%,2组比较,差异有统计学意义(χ2=3.847,P<0.05)。

表2 再激活与未激活患者手术前后肝功能结果比较
2.3HBV再激活与未激活患者手术前后肝功能结果比较 观察组且HBV未激活患者TACE前后肝功能比较,差异有统计学意义(P<0.05);而HBV再激活患者手术前后肝功能比较,差异无统计学意义(P>0.05)。见表2。
3 讨 论
HBV再激活作用是指已经康复或非活动性HBV感染患者突然出现血清HBV DNA含量升高,常伴肝炎活动,严重者造成肝衰竭,甚至导致患者因肝衰竭而病死[9-12]。HBV激活方式有多种,其再激活可以自发也可以由多种因素诱发,如癌症的化疗及免疫状态发生改变[13]。目前诊断HBV再激活的主要方法是通过患者血清HBV DNA含量。当机体免疫机制受到抑制,HBV便大量复制且使更多的肝细胞被感染,进一步诱发HBV的再激活[14-17]。TACE具有阻断肿瘤供血和化疗药物治疗的双重作用,故常被应用于临床治疗。但患者经过TACE后,原发性肝癌患者的免疫系统发生改变。化疗时患者免疫功能受到较严重的抑制作用,从而打破机体内部免疫系统原有的平衡状态[18-21]。HBV细胞快速复制,导致HBV发生再激活。
本研究结果表明,只进行TACE的患者,术后HBV再激活发生率为36.0%,而较高的HBV再激活会降低患者的生存率,因此需要一种可抑制再激活的药物。本研究采用恩替卡韦分散片结果显示,该药物对大部分患者的治疗有一定作用,观察组患者口服恩替卡韦分散片至少需要1个月。本研究结果表明,对照组患者HBV再激活的概率明显高于观察组,差异有统计学意义(P<0.05);观察组HBV再激活患者手术前后肝功能比较,差异无统计学意义(P>0.05),提示经TACE后HBV再激活对患者肝功能无显著影响,对观察组患者进一步随访,发现虽然出现HBV再激活现象,但肝功能无明显变化,也无不良反应,因此1个月后继续进行TACE治疗,且再次治疗后患者肝功能仍然无明显变化,表明核苷类药物可改善由TACE引发的肝功能损伤。
综上所述,患者坚持服用恩替卡韦分散片之后,可预防由TACE致使的HBV再激活,且对未激活患者术后的肝功能具有明显的改善作用。但长期服用恩替卡韦分散片可能会出现耐药性,因此需对HBV DNA含量进行定期复查[22-24]。本研究样本量较少,还需进一步的实验研究。
[1]李敏,蒋菲菲,赵阳,等.HBV基因组序列扩增的条件优化和结果分析[J].中国输血杂志,2016,29(1):42-45.
[2]李铃,敬雪明,朱其荣,等.HBV感染后不同临床类型及HBV DNA载量与外周血T细胞亚群变化的相关性分析[J].中国现代医学杂志,2015,25(7):35-41.
[3]KENNEDY E M,BASSIT L C,MUELLER H,et al.Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease[J].Virology,2015,47(6):196-205.
[4]臧爽,徐阳,梁松年.原发性肝癌患者经肝动脉化疗栓塞术后住院天数影响因素的多元线性回归分析[J].介入放射学杂志, 2015,24(1):80-83.
[5]余梁,吕维富.经肝动脉化疗栓塞术治疗中晚期肝癌的预后因素分析[J].中国介入影像与治疗学,2015,9(1):14-17.
[6]GHOLAMREZANEZHAD A,MIRPOUR S,GESCHWIND J F H,et al.Evaluation of 70-150-μm doxorubicin-eluting beads for transcatheter arterial chemoembolization in the rabbit liver VX2 tumour model[J].Euro Radiol,2016,26(10):1-9.
[7]田文广,何平,万克强,等.核苷类似物防治化疗后HBV再激活的临床疗效[J].中国新药与临床杂志, 2015,12(7):560-564.
[8]杨小舟,崔铁军,解莹,等.核苷类药物对恶性肿瘤患者化疗后乙型肝炎病毒再激活[J].中华医院感染学杂志,2016,26(2):289-291.
[9]REDDY K,BEAVERS K L,HAMMOND S P,et al.American Gastroenterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy[J].Gastroenterology,2015,148(1):215-219.
[10]张秋明,钟鉴宏,游雪梅,等.核苷类似物联合TACE治疗HBV相关性肝细胞癌的预后分析[J].肿瘤防治研究,2016,43(9):792-795.
[11]付艳玲,余祖江.核苷类似物治疗慢性乙型肝炎耐药现状及进展[J].中国实用内科杂志, 2015,9(4):370-373.
[12]李星,江岚,邢艳芳,等.拉米夫定预防化疗后乙型肝炎再活动致病毒耐药效果[J].广东医学, 2015,15(7):1117-1119.
[13]GREIG S L,DEEKS E D.Abacavir/Dolutegravir/Lamivudine single-tablet regimen:a review of its use in HIV-1 infection[J].Drugs,2015,75(5):503-514.
[14]PALOMBI L,PIRILLO M F,MARCHEI E,et al.Concentrations of tenofovir,lamivudine and efavirenz in mothers and children enrolled under the Option B-Plus approach in Malawi[J].J Antimicrob Chemother,2015,71(4):1-4.
[15]KEIICHI Z,FUJIWARA C,SHIN B,et al.Corticosteroid and nucleoside analogue for hepatitis B virus-related acute liver failure[J].World J Gastroenterol,2015,21(36):10485-10486.
[16]BOETTLER T,THIMME R.Antiviral therapy in hepatitis B virus-associated liver cirrhosis[J].Digest Dis,2015,33(4):608-612.
[17]TAKAYAMA H,SATO T,IKEDA F,et al.Reactivation of hepatitis B virus during interferon-free therapy with daclatasvir and asunaprevir in patient with hepatitis B virus/hepatitis C virus co-infection[J].Hepatol Res,2015,46(5):489-491.
[18]WANG W N,WU M Y,MA FZ,et al.Meta-analysis of the efficacy and safety of nucleotide/nucleoside analog monotherapy for hepatitis B virus-associated glomerulonephritis[J].Clin Nephrol,2016,85(1):21-26.
[19]MORI S,FUJIYAMA S.Hepatitis B virus reactivation associated with antirheumatic therapy:risk and prophylaxis recommendations[J].World J Gastroenterol,2015,21(36):10274.
[20]BAE S K,SHIMODA S,IKEGAMI T,et al.The risk factors for hepatitis B virus recurrence after living donor liver transplantation:a 17-year experience at a single center[J].Hepatol Res Official J Japan Society Hepatol,2015,45(12):1203.
[21]LENCI I,BAIOCCHI L,TARICIOTTI L,et al.Complete hepatitis B virus prophylaxis withdrawal in hepatitis B surface antigen-positive liver transplant recipients after longterm minimal immunosuppression[J].Liver Transplantation,2016,22(9):1205-1213.
[22]MALLET V,SCHWARZINGER M,VALLET-PICHARD A,et al.Effect of nucleoside and nucleotide analogues on renal function in patients with chronic hepatitis B virus monoinfection[J].Clin Gastroenterol,2015,13(6):1181.
[23]孙静怡,贾蓓,黄文祥.乙型肝炎病毒相关性原发性肝癌术后患者对核苷(酸)类似物预存耐药变异的研究[J].牡丹江医学院学报,2017,10(1):35-39.
[24]潘静,陆伦根.核苷(酸)类似物初始治疗慢性乙型肝炎患者疗效和安全性的网络Meta分析[J].实用肝脏病杂志,2017,20(1):29-33.

