HBV感染患者氧化应激状态与病毒基因型和耐药突变的相关性**
杨渝伟,陈小红,彭 玲,唐 洁,俸家富
(四川省绵阳市中心医院检验科 621000)
据2013年流行病学调查显示,中国有乙型肝炎病毒(HBV)感染携带者约1亿人,其中至少20 000 000为慢性活动性HBV感染患者,包括慢性乙型肝炎(CHB)、乙型肝炎肝硬化(HBC)、CHB相关肝细胞癌(HCC)[1]。有研究证实,约60%肝硬化患者和80%HCC患者由HBV持续感染所致,是中国HBC和HCC发病的主要原因[2]。据WHO报道,全世界每年约650 000例死于HBV感染所致的肝衰竭、肝硬化、HCC[3]。有许多研究表明HBV基因变异与HCC发病风险密切相关。但迄今为止,有关HBC和HCC的发生、发展与HBV基因组之间的作用机制尚不十分清楚[4]。目前,HBV基因分型和耐药突变基因检测已在中国广泛用于指导临床对HBV感染所致肝病的抗病毒药物治疗。但是,HBV耐药突变基因是否与HBC、HCC发病风险和疾病发展(疾病严重程度)有关,至今少有报道。
氧化应激(OxS)是机体抗氧化物质消耗和/或氧化物质生成过多,引起机体氧化与抗氧化平衡失调所致的一种疾病。因此,OxS和炎性反应密切相关。HBV感染不同肝病状态下,OxS状态与HBV病毒基因型和耐药突变基因是否存在某种必然的相关性,也少有研究报道。
现检测HBV感染不同肝病状态下,病毒基因型和耐药突变率,以及患者血清总氧化态(TOS)、总抗氧化态(TAS)、OxS指数(OSI)水平,分析HBV基因变异与患者OxS之间的相关性,以了解不同基因型HBV感染后,其耐药突变率与患者OxS状态和病情严重程度的关系。
1 资料与方法
1.1一般资料 2014年2月至2016年4月该院经乙型肝炎血清学标志物和/或HBV DNA检测,确诊的HBV感染肝病患者296例,男232例,女64例,平均年龄(42.4±13.5)岁。CHB患者145例(CHB组),HBC患者101例(HBC组),HCC患者50例(HCC组)。所有病例诊断均符合WHO 2015版CHB、APASL 2012版肝纤维化和/或NCCN 2016版肝胆肿瘤诊疗指南标准[5]。所有患者在OxS相关参数检测的前1周,均停止使用抗氧化治疗药物,如螺旋藻、维生素E、维生素C、多烯磷脂、肌苷片、辅酶Q10等。
1.2仪器与试剂 血清TOS和TAS检测试剂由本研究通过方法学改良研制,均在LST008型全自动生化分析仪(日本,HITACHI)上测定;TOS试剂制备的主要化学试剂为二甲酚橙四钠盐(CAS:3618-43-7,Cat.No.:398187)和六水硫酸亚铁铵(CAS:7783-85-9,Cat.No.:215406),均购自Sigma-Aldrich公司;TAS试剂制备的主要化学试剂为ABTS(CAS:30931-67-0,Cat.No.:11557),购自Sigma-Fluka公司。HBV基因型及耐药突变基因试剂盒购自亚能生物技术有限公司(深圳,中国),严格按照说明书操作程序进行测定;聚合酶链式反应(PCR)扩增反应采用ABI7500 Real Time PCR System(AB公司,美国);杂交反应使用YN-H16型恒温杂交仪(中国,深圳亚能)。
1.3方法
1.3.1标本采集 用2支不含任何添加剂的Vacutainer真空采血普通管(BD公司,美国),各抽取患者静脉血约5 mL,待血块自然收缩后,以3 000 r/min离心10 min,分离血清。其中1管4 h内用于血清TOS和TAS检测;另1管血清用于HBV基因分型及耐药突变基因检测,按试剂盒说明书,未检测前置―20 ℃冰冻保存。
1.3.2OxS指标测定 血清TOS测定采用改良二甲酚橙法:血清中氧化物质可使酸性环境中的亚铁离子(Fe2+)氧化成高铁离子(Fe3+),后者使二甲酚橙溶液颜色改变,颜色变化强度与血清TOS水平呈正比,以100.0 μmol/L H2O2作为标准,结果以μmol H2O2Eq./L表示。血清TAS测定采用改良ABTS法[10]:血清中抗氧化物质可将蓝绿色的激活态ABTS还原,颜色变化程度与血清TAS水平呈正比,以5 mmol/L水溶性维生素E类似物(Trolox)作标准,结果以mmol TroloxEq./L表示。OSI根据两者检测结果按公式计算[6]:
1.3.3HBV基因型及耐药突变基因检测 患者血清标本、阳性和阴性质控品用病毒DNA提取纯化试剂同步处理(离心柱法)后,采用PCR-反向点杂交法检测3种HBV基因型(B、C、D型)和8种耐药突变基因(t180L、rt204M、rt207V、rt236N、rt250M、rt181A、rt184T、rt202S)。

2 结 果
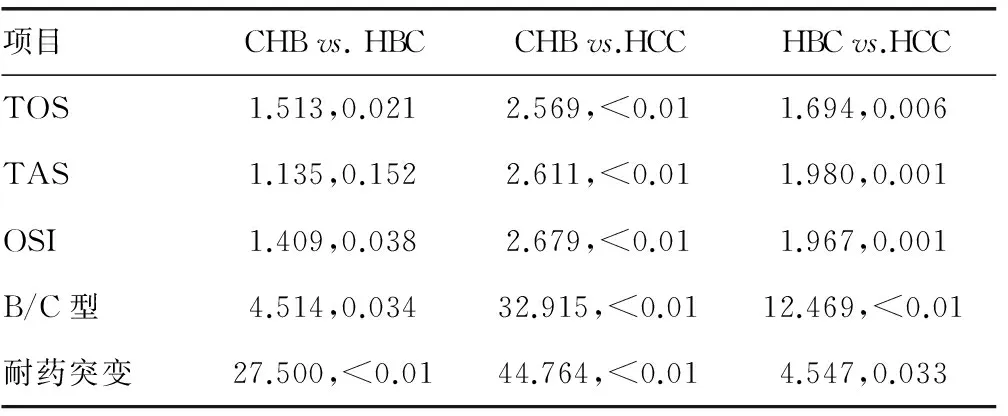
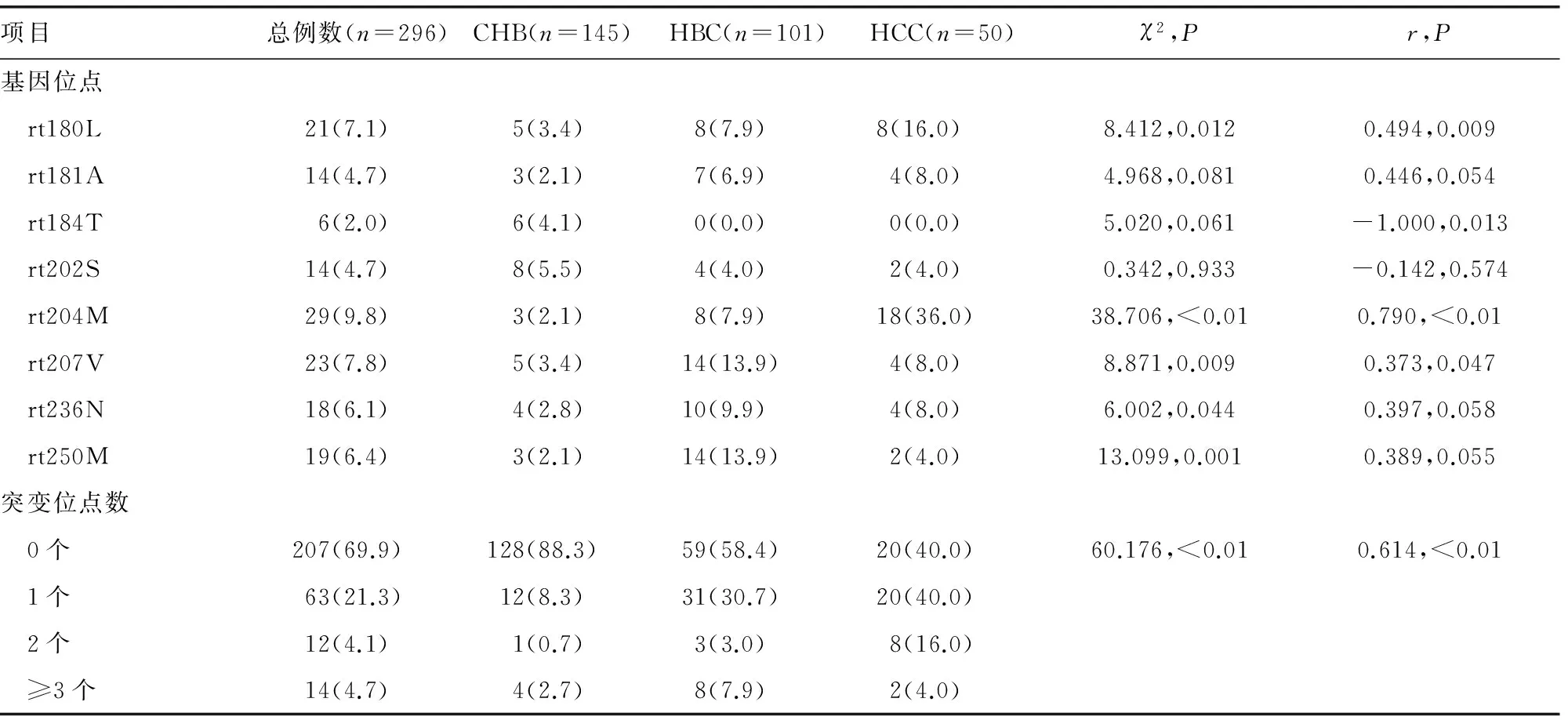
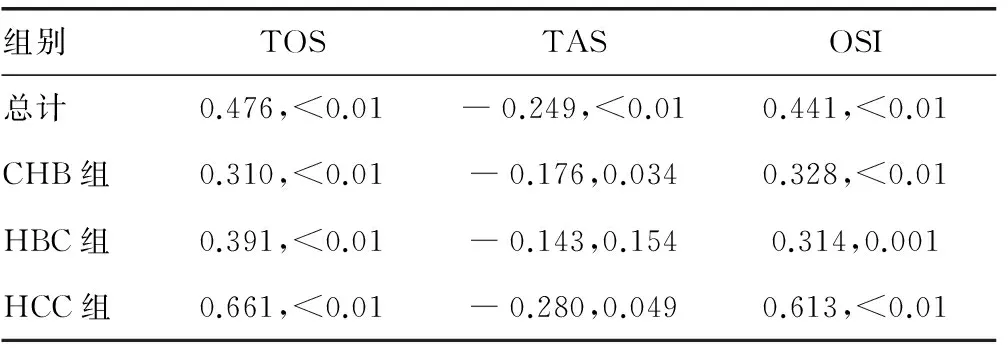
2.1各组患者实验室检测结果比较 各组患者的性别、年龄、OxS参数和基因检测结果比较,差异有统计学意义(P<0.05)。经单样本Kolmogorov-Smirnov检验分析显示,患者OxS参数TOS(Z=1.547,P=0.017)、TAS(Z=1.702,P=0.006)和OSI(Z=2.034,P=0.042)检测结果均非正态分布。本组296例肝病患者感染HBV分为B型213 例(72.0%)和C型83 例(28.0%);HBV发生耐药突变89/296例(30.1%),其中B基因型占64/296例(21.6%),C基因型占25/296例(8.5%)。各组患者随疾病的严重度加深(CHB组 表1 各组患者实验室检测结果比较 注:-表示无数据 2.2各组患者HBV感染状况及OxS结果比较 TAS在CHB、HBC组之间差异无统计学意义(Z=1.135,P=0.152),但在CHB、HCC组(Z=2.611,P<0.01)和HBC、HCC组(Z=1.980,P=0.001)之间比较,差异有统计学意义;TOS和OSI,以及HBV基因型分布和耐药突变率在任意2组患者之间比较,差异有统计学意义(均P<0.05)。见表2。 表2 各组患者之间的结果比较(χ2/Z,P) 2.3各组患者HBV耐药基因突变结果比较 8种耐药突变基因在CHB患者中的突变率相近(2.1%~5.5%);HBC患者以rt207V(13.9%)和rt250M(13.9%)突变率最高;HCC患者以rt204M(36.0%)突变率最高,其次为rt180L(16.0%)。3组患者rt180L、rt204M、rt207V、rt236N、rt250M突变率比较,差异有统计学意义(P<0.05),rt181A、rt184T、rt202S突变率差异无统计学意义(P>0.05)。Gamma相关分析显示,rt180L、rt184T、rt204M、rt207V突变率与病情严重程度相关,其中rt180L(r=0.494,P=0.009)、rt204M(r=0.790,P<0.01)和rt207V(r=0.373,P=0.047)突变率呈明显的正相关,rt184T呈负相关(r=―1.000,P=0.013)。89例HBV耐药突变患者中,突变位点数在1 ~ 7个,将其按0、1、2个或多个(≥3)突变位点进行分组,经Gamma相关分析显示,突变位点数与HBV感染后病情严重程度呈正相关(r=0.614,P<0.01)。见表3。 2.4HBV基因分型或耐药突变各组患者血清OxS结果比较 C基因型与B基因型HBV感染患者比较,TOS水平在肝病各组,即CHB组(Z=1.691,P=0.007)、HBC组(Z=1.461,P=0.028)、HCC组(Z=1.443,P=0.031)均升高;OSI水平在CHB组(Z=2.019,P=0.001)和HBC组(Z=1.431,P=0.033)升高,但在HCC组差异无统计学意义(Z=1.155,P=0.139);TAS水平仅在CHB组降低(Z=1.586,P=0.013),在HBC组(Z=1.124,P=0.160)和HCC组(Z=0.693,P=0.723)间差异无统计学意义(P<0.05)。有突变患者与无突变患者比较,TOS、OSI水平在各组均明显升高,其中TOS结果显示:CHB组(Z=1.605,P=0.012)、HBC组(Z=1.845,P=0.002)、HCC组(Z=2.309,P<0.01);OSI结果显示:CHB组(Z=1.997,P=0.0011)、HBC组(Z=1.711,P=0.006)、HCC组(Z=2.021,P=0.001);各组TAS水平仅在CHB组降低(Z=1.467,P=0.027),而在HBC组(Z=1.083,P=0.191)和HCC组(Z=1.212,P=0.106)差异无统计学意义(P<0.05)。 2.5HBV基因耐药突变与患者OxS参数的相关性 Spearman相关分析结果显示,各组患者HBV感染后耐药突变与TOS(r=0.476,P<0.01)和OSI(r=0.441,P<0.01)呈正相关,与TAS(r=―0.249,P<0.01)呈负相关(除外HBC组)。见表4。 表3 不同肝病患者HBV感染8个耐药基因突变率[n(%)] 表4 各组患者血清OxS参数和耐药突变发生与否的相关性(r,P) HBV感染是一个世界性公众健康问题,其感染机体后,HBsAg持续保存6个月及以上即为CHB[3]。CHB反应促进肝纤维疤痕形成,肝纤维化从门管区轻度纤维增生到周围星芒状纤维条束,桥样纤维化,直至肝硬化。因此,炎性反应伴随CHB发展的一切病理过程。很多研究证实,HBV持续感染可促进患者的OxS反应,从而引起患者基因改变及表达异常,进一步导致患者氧化/抗氧化平衡破坏,致使疾病恶化向HBC和/或HCC发展[7]。本研究结果显示, CHB、HBC、HCC组患者OxS状态比较,差异有统计学意义(P<0.05),且随疾病的严重程度加深(通常情况下,按CHB 目前共发现A、B、C、D、E、F、G、H、I共9种HBV基因型[8]。流行病学调查显示中国已发现A~H共8种基因型,其中以B、C型为主,其次为D型,其极少[9]。本组296例HBV感染患者,仅检出B、C型2种基因型,未发现其他类型,可能与选择的病例多为较严重的慢性肝病有关,但提示四川地区与我国HBV基因型分布特征基本一致。大量研究表明,B、C型与重症肝病有关,且C型较B 型更加严重[10]。这也可能是本研究仅检出B、C型2种基因型的原因。本组研究结果显示,按疾病严重程度CHB HBV感染后可通过多种途径逃逸免疫系统的免疫应答,使之在体内长期存在,导致CHB发生。基因突变是HBV引起免疫逃逸最主要和最根本的原因。本研究296例HBV感染患者,按不同疾病分组后发生突变的患者,其血清TOS水平均高于未发生突变患者;TAS水平均低于未发生突变患者,虽然仅CHB患者差异有统计学意义(P<0.05),但OSI水平均高于未发生突变的患者,而且从CHB经HBC到HCC发展过程中,患者的耐药突变均与血清TOS、OSI水平呈正相关,与血清TAS水平呈负相关(HBC患者差异无统计学意义,可能与样本数和/或抽样有关)。研究结果表明,HBV感染患者氧化物质积累和/或抗氧化物质消耗,与HBV基因变异密切相关。推测其原因,可能感染HBV后,因免疫防护激活OxS反应,在其炎性状态下,一方面通过氧化损伤引起HBV耐药基因突变发生,以逃逸机体免疫应答;另一方面,可增强其对药物的抵抗,以达到自由复制并长期存在的目的[11]。结果是进一步加剧患者氧化/抗氧化平衡破坏,加大OxS反应,加重对组织细胞的氧化损伤,进而促进疾病加重,即向HBC和/或HCC发展[12-14]。 本研究进一步分析,所检测的8个耐药基因位点中,rt180L、rt204M、rt207V、rt236N、rt250M突变率在各组之间的差异均有统计学意义(P<0.05),且rt180L、rt204M、rt207V位点突变率与病情严重程度呈正相关,其中rt204M的相关系数r高达0.790,提示HBV位点突变,特别是rt204M位点突变,是否有可能是HBV感染患者致HBC和/或HCC发生的潜在因素,值得进一步研究证实。对耐药突变位点个数的统计分析表明,HBV感染后其突变位点数与病情发展程度呈明显正相关(r=0.614,P<0.001),说明随CHB向HBC和/或HCC发展,患者OxS反应逐渐增强,以应答HBV感染所致炎性反应,而HBV为逃逸机体免疫应答,其基因组不稳定性更加突出,基因位点随之发生多元化突变[15-19]。 综上所述,OxS反应可能是CHB患者病情发展及HBV基因在感染者体内变异的重要机制。但OxS与HBV基因突变之间的原因和结果,或者两者兼而有之,以共同促进HBV感染后肝病的发生与发展,因未连续观察患者的疾病进程,以致本研究对此问题难以解答,需进一步的实验研究。 [1]CUI Y,JIA J.Update on epidemiology of hepatitis B and C in China[J].J Gastroenterol Hepatol,2013,28(Suppl 1):7-10. [2]WANG F S,FAN J G,ZHANG Z,et al.The global burden of liver disease:the major impact of China[J].Hepatology,2014,60(6):2099-2108. [3]WHO Guidelines Approved by the Guidelines Review Committee.Guidelines for the prevention,care and treatment of persons with chronic hepatitis B infection[M].Geneva:World Health Organization,2015. [4]DONG H,QIAN Z,ZHANG L,et al.Genomic and transcriptome profiling identified both human and HBV genetic variations and their interactions in Chinese hepatocellular carcinoma[J].Genomics Data,2015,6(6):1-3. [5]LEE D,LYU H,CHUNG Y H,et al.Genomic change in hepatitis B virus associated with development of hepatocellular carcinoma[J].World J Gastroenterol,2016,22(23):5393-5399. [6]ZHANG X,DING H G.Key role of hepatitis B virus mutation in chronic hepatitis B development to hepatocellular carcinoma[J].World J Hepatol,2015,7(9):1282-1286. [7]WANG Y,ZENG L I,CHEN W.HBV X gene point mutations are associated with the risk of hepatocellular carcinoma:A systematic review and meta-analysis[J].Mol Clin Oncol,2016,4(6):1045-1051. [8]RUNYON BA.Management of adult patients with ascites due to cirrhosis:update 2012[M].Alexandria(VA):American Association for the Study of Liver Diseases,2013. [9]BENSON A B,MALAFA M P,SINGH G,et al.Hepatobiliary cancers,Version 2.2016,NCCN Clinical Practice Guidelines in Oncology[S].NCCN,2016. [10]FENG J F,LU L,DAI C M,et al.Analysis of the diagnostic efficiency of serum oxidative stress parameters in patients with breast cancer at various clinical stages[J].Clin Biochem,2016,49(9):692-698. [11]SHOMALI S,AVVAL F Z,BOOSTANI R,et al.Serum total antioxidant capacity status of HTLV-1 infected patients[J].Acta Virol,2015,59(2):199-203. [12]LEE H,KIM H,LEE S A,et al.Upregulation of endoplasmic reticulum stress and reactive Oxygen species by naturally occurring mutations in hepatitis B virus core antigen[J].J Gen Virol,2015,96(Pt 7):1850-1854. [13]SUKOWATI C H,EL-KHOBAR K E,IE S I,et al.Significance of hepatitis virus infection in the oncogenic initiation of hepatocellular carcinoma[J].World J Gastroenterol,2016,22(4):1497-1512. [14]BELL T G,YOUSIF M,KRAMVIS A.Bioinformatic curation and alignment of genotyped hepatitis B virus(HBV) sequence data from the GenBank public database[J].Springerplus,2016,5(1):1896. [15]SONG J E,KIM D Y.Diagnosis of hepatitis B[J].Ann Transl Med,2016,4(18):11-15. [16]SU C,LIN Y,CAI L,et al.Association between mannose-binding lectin variants,haplotypes and risk of hepatocellular carcinoma:A case-control study[J].Sci Rep,2016,6(3):321-330. [17]TAROCCHI M,POLVANI S,MARRONCINI G,et al.Molecular mechanism of hepatitis B virus-induced hepatocarcinogenesis[J].World J Gastroenterol,2014,20(33):11630-11640. [18]HOLLINGWORTH R,GRAND R J.Modulation of DNA damage and repair pathways by human tumour viruses[J].Viruses,2015,7(5):2542-2591. [19]TAN L,MEIER T,KUHLMANN M,et al.Distinct set of chromosomal aberrations in childhood hepatocellular carcinoma is correlated to hepatitis B virus infection[J].Cancer Genet,2016,209(3):87-96.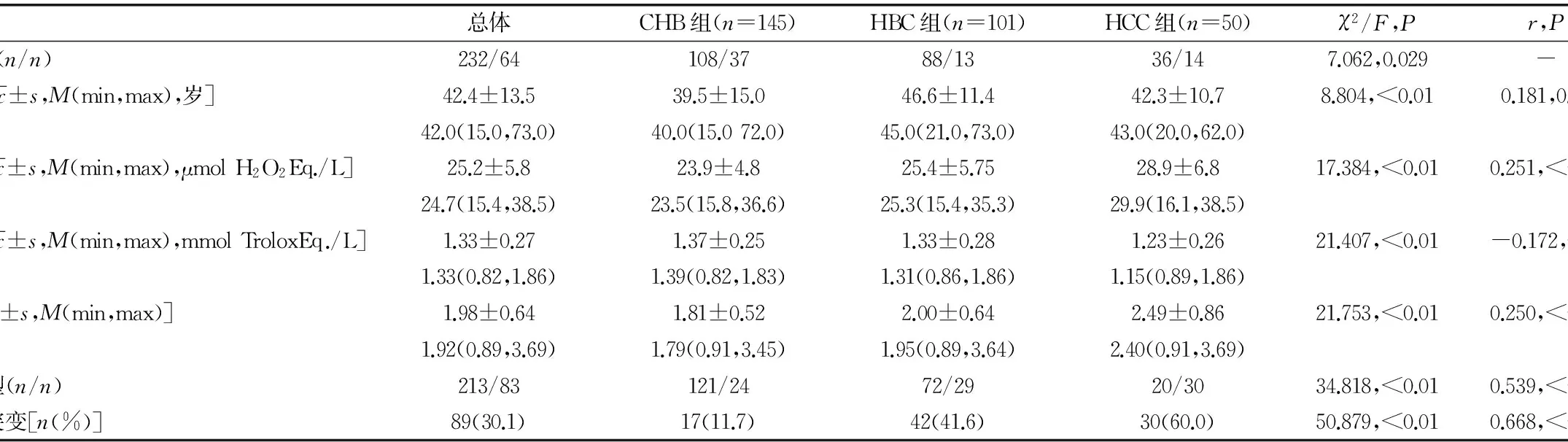
3 讨 论

