耐碳青霉烯类抗菌药物的耐药性及其相关影响因素
罗洪英,余水泉
(1.四川省宜宾市第三人民医院检验科 6444000;2.重庆市涪陵区中心医院检验科 408000)
目前细菌的耐药性随着医学科学的发展及临床实践中各种主客观因素的影响作用,已成为全球关注的问题之一,同时也是临床面临的新挑战[1-2]。肠杆菌科细菌与人们的日常生活密切相关,其中大肠埃希菌、肺炎克雷伯菌等均为常见的病原菌,并以多重耐药菌株引起的感染为显著特点。碳青霉烯类抗菌药物是目前临床治疗的最常用药物之一,但近年来随着其在临床使用的不断增加,以及较多的不合理使用,导致出现了碳青霉烯类抗菌药物耐药的菌株。碳青霉烯类耐药机制包括产碳青霉烯酶、外膜通透性障碍、细菌生物膜的形成、整合子的介导等,其中产碳青霉烯酶和外膜通透性障碍是对碳青霉烯类耐药最主要的特征[3-5]。现探讨碳青霉烯类抗菌药物的耐药情况,以及耐碳青霉烯类肠杆菌科产碳青霉烯酶、整合子分布、外膜孔蛋白的缺失情况。
1 资料与方法
1.1一般资料 收集宜宾市第三人民医院2014年2月至2016年8月各个科室患者的痰液、尿液、分泌物、血液等标本,对87株耐碳青霉烯类抗菌药物的肠杆菌科细菌(CRE)菌株进行研究。
1.2方法 菌株鉴定按照原卫生部《全国临床检验操作规程(第3版)》标准。采用VITEK-2 Compact全自动细菌分析鉴定系统(法国生物梅里埃公司),药敏检测使用抗菌药物纸片(英国Oxoid公司),药敏纸片使用纸片扩散法;质控菌株为大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603,依照2007年CLSI制定的标准,使用推荐的折点判断耐药性。应用聚合酶链式反应(PCR)检测常见碳青霉烯酶基因并描述分布特征,使用煮沸法制备菌株模板后,运用25 μL反应体系,PCR扩增KPC、NDM-1(中国疾病预防控制中心传染预防控制所推荐)基因序列,引物序列(NDM-1:正义链5′-CAG CAC ACT TCC TAT CTC-3′,反义链5′-CCG CAA CCA TCC CCT CTT -3′;KPC:正义链5′-TGR AAG TTA CCG CGC TGA GG-3′,反义链5′-CCA GAC GAC GGC ATA GTC AT-3′),反应过程:95 ℃预变性10 min后变性30 s,退火55 ℃和52 ℃均30 s,72 ℃延伸30 s,30个循环。产物采用1.2%琼脂糖凝胶电泳,GoldviewⅠ型核酸染色剂染色,紫外灯下观察结果。对整合子分布特征进行总结分析,PCR检测体系同上,引物(整合子1:正义链5′-GGT CAA GGA TCT GGA TTT CG-3′,反义链5′-ACA TCG GTC TAA ATC ATC GTC-3′;整合子2:正义链5′-CAC GGA TAT GCG ACA AAA AGG T-3′,反义链5′-GTA GCA AAC GAG TGA CGA AAT G-3′;整合子3:正义链5′-AGT GGG TGG CGA ATG AGT G-3′,反义链5′-TGT TCT TGT ATC GGC AGG TG-3′);与此同时还通过电泳对外膜孔蛋白的缺失情况进行分析。
1.3统计学处理 采用SPSS17.0统计软件进行数据分析,计数资料以例数或百分率表示,组间比较应用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1对碳青霉烯类抗菌药物耐药的CRE菌株产碳青霉烯酶情况 87株对碳青霉烯类抗菌药物耐药的CRE菌株进行PCR扩增碳青霉烯酶基因,检出碳青霉烯酶基因74株,占85.06%。包括肺炎克雷伯菌65株,占87.84%,大肠埃希菌检出6株(8.11%),阴沟肠杆菌、产酸克雷伯菌、产气肠杆菌各检出1株,分别占1.35%。见表1。PCR图谱以大肠埃希菌进行分析。见图1。
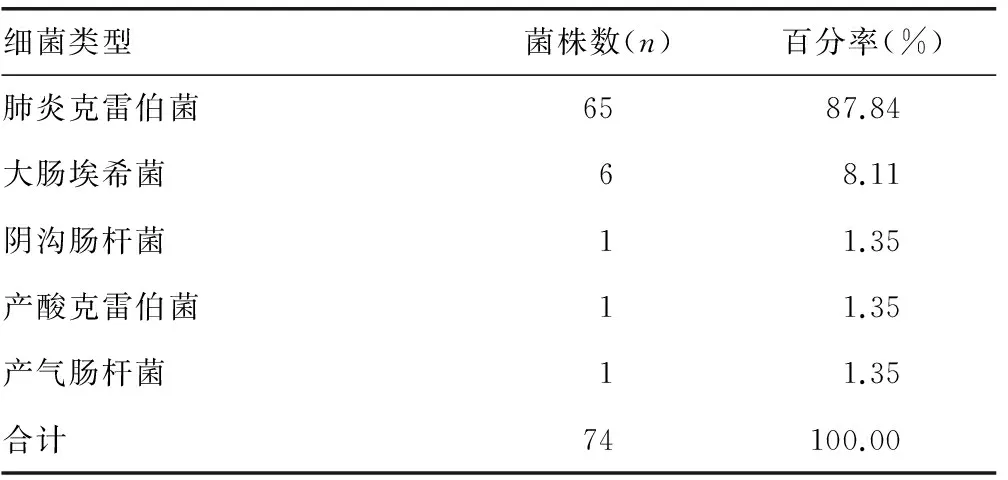
表1 耐碳青霉烯类抗菌药物的CRE菌株产碳青霉烯酶的分布特征
注:M表示DNA 标记物;P表示阳性;N表示阴性
图1大肠埃希菌PCR图谱
2.2耐碳青霉烯类CRE菌株表型耐药情况 74株分离菌中检测出携带KPC型碳青霉烯酶基因33株,阳性检出率为44.59%。未检测到NDM-1基因。
2.3对碳青霉烯类抗菌药物耐药的CRE菌株整合子情况 Ⅰ类整合子共检出52株,检出率为59.77%(52/87),其中47株来自产碳青霉烯酶菌株,5株为非产碳青霉烯酶菌株,同时均以肺炎克雷伯菌检出的比例最高(分别为39株和3株);Ⅱ类整合子检出共8株,检出率为9.20%(8/87),其中4株来自产碳青霉烯酶的菌株,4株为非产碳青霉烯酶菌株;未检出Ⅲ类整合子。Ⅰ类和Ⅱ类整合子检出3株,2株来自产碳青霉烯酶的肺炎克雷伯菌株,1株为非产碳青霉烯酶的肺炎克雷伯菌株。见表2。
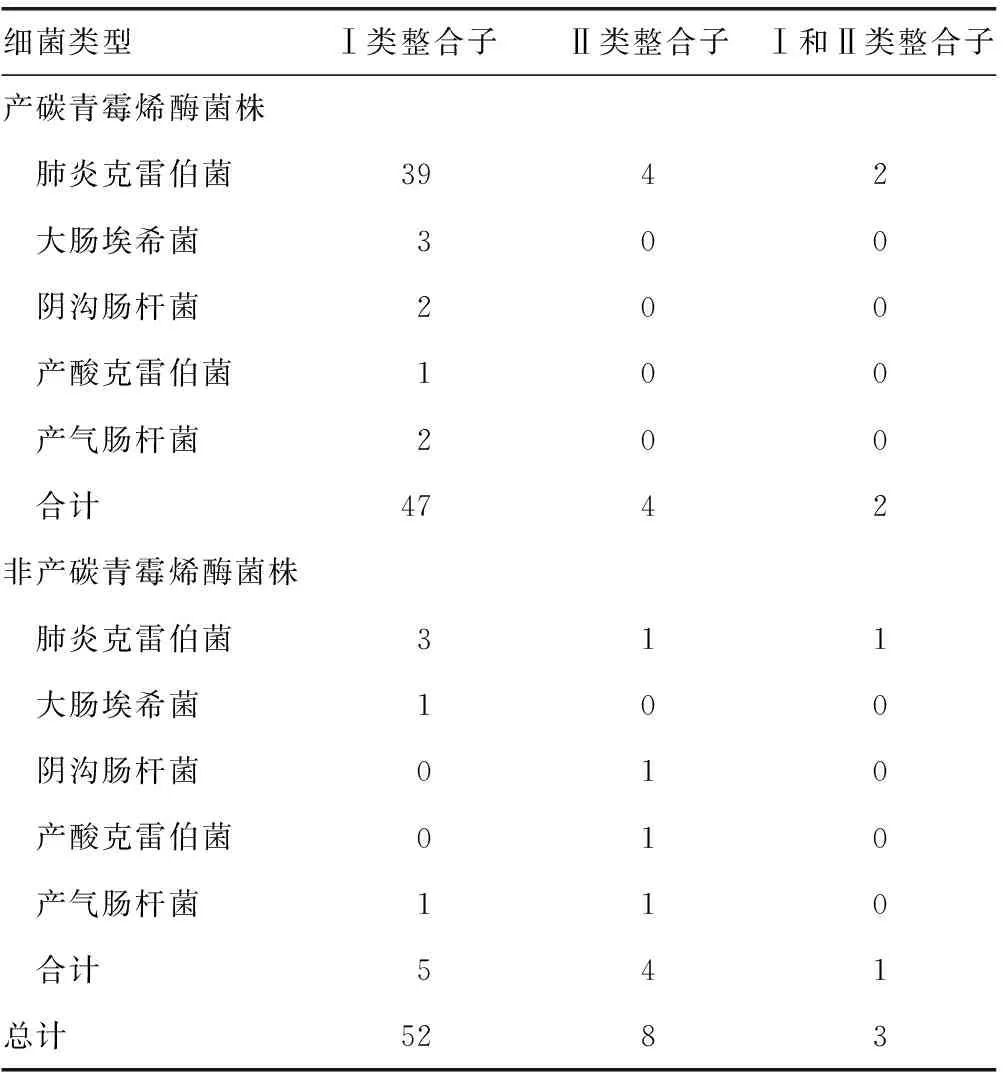
表2 对碳青霉烯类抗菌药物耐药的CRE菌株整合子的分布特征(n)
2.4对碳青霉烯类抗菌药物耐药的肺炎克雷伯菌外膜孔蛋白缺失情况 对碳青霉烯类抗菌药物耐药比例较高的肺炎克雷伯菌,菌株外膜孔蛋白缺失结果显示,共70株对碳青霉烯类抗菌药物耐药的肺炎克雷伯菌株中,膜蛋白无异常达18.57%,其中产碳青霉烯酶菌株中膜蛋白无异常为16.92%;OmpK35表达下调菌株占24.29%,OmpK35缺失占10.00%;OmpK36表达下调和缺失的比例分别为4.23%和57.14%;产碳青霉烯酶菌株中OmpK35表达下调的菌株占50.77%,OmpK35缺失占9.23%;OmpK36表达下调和缺失的比例分别为3.08%和55.38%。见表3和图2。
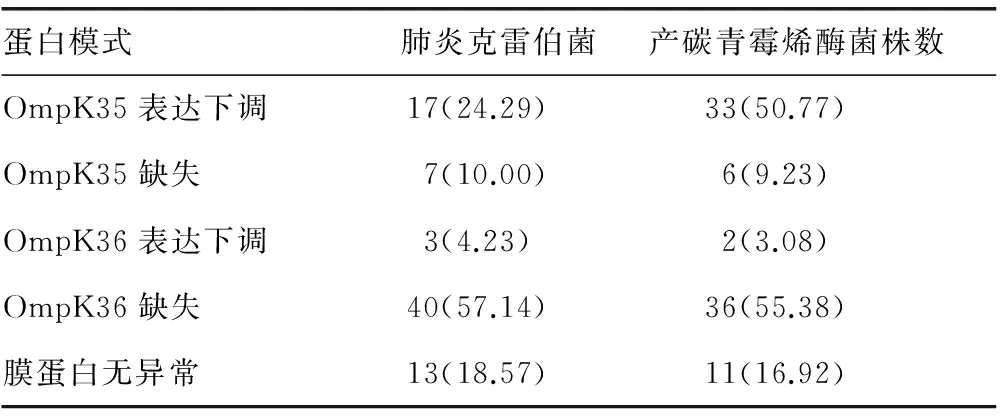
表3 对碳青霉烯类抗菌药物耐药的肺炎克雷伯菌株外膜孔蛋白缺失情况[n(%)]
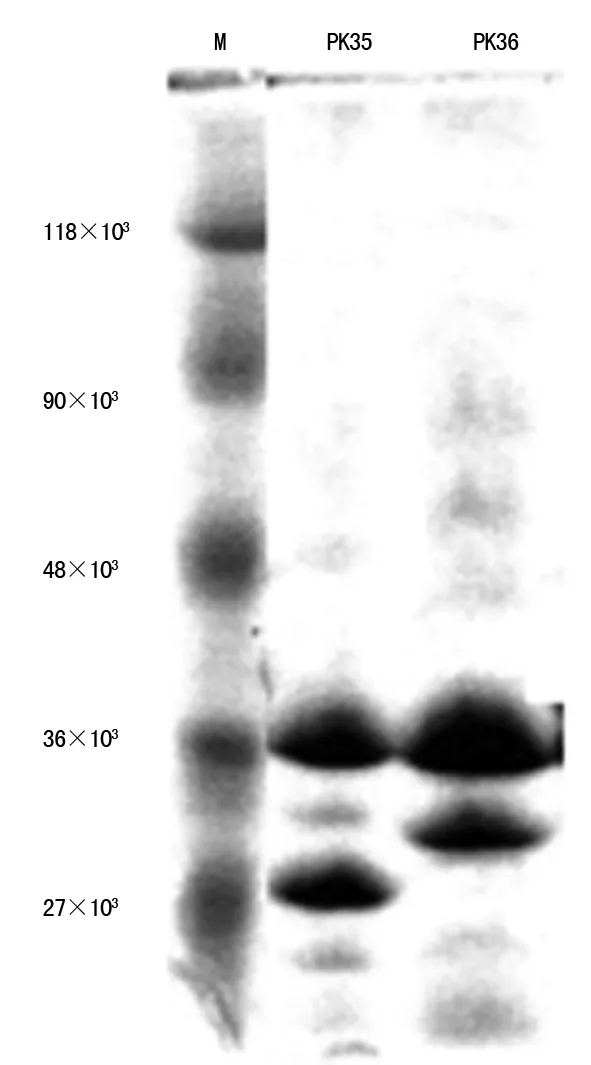
注:M表示标准蛋白质分子
图2孔膜蛋白电泳图
3 讨 论
近年来,抗菌药物广泛应用于临床抗感染,细菌在抗菌药物的选择压力下,耐药性也逐渐表现出来[6-8]。亚胺培南或美洛培南抗菌药物是目前临床特异性强、效果良好的药物,但目前耐碳青霉烯类杆菌的分离率也逐年升高,主要耐药菌株常见一些革兰阴性杆菌,同时也是引起临床感染最常见的细菌类型,包括大肠埃希菌、肺炎克雷伯菌属等,以及非发酵革兰阴性杆菌(铜绿假单胞菌、不动杆菌属等)。细菌的耐药性之所以能在抗菌药物出现之后迅速产生,并且扩散,主要原因之一与基因水平转移密切相关,细菌的耐药基因多位于质粒、转座子、整合子等区域,现研究临床杆菌的相关机制,对指导临床合理使用抗菌药物意义重大[9-11]。
本研究对87株耐碳青霉烯类抗菌药物的CRE菌株进行PCR扩增碳青霉烯酶基因,检出碳青霉烯酶基因74株(85.06%),其中包括肺炎克雷伯菌65株,占87.84%,大肠埃希菌检出6株(8.11%),阴沟肠杆菌、产酸克雷伯菌、产气肠杆菌各1株,分别占1.35%。该耐药机制的研究近年来早已成为微生物领域的又一个关注焦点[8,12],其相关机制除了与上述碳青霉烯酶基因的表达有关外,还与整合酶基因相关。本研究整合酶基因检测结果表明,Ⅰ类整合子共检出52株,检出率59.77%(52/87),其中47株来自产碳青霉烯酶菌株,5株为非产碳青霉烯酶菌株,同时均以肺炎克雷伯菌检出的比例最高(分别为39株和3株);Ⅱ类整合子检出8株,检出率9.20%(8/87),其中4株来自产碳青霉烯酶菌株,4株为非产碳青霉烯酶菌株;未检出Ⅲ类整合子。Ⅰ、Ⅱ类整合子检出3株,2株来自产碳青霉烯酶的肺炎克雷伯菌株,1株为非产碳青霉烯酶的肺炎克雷伯菌株。
近年来的研究提示,产生ESBL和AMPC酶的同时合并外膜孔蛋白缺失现象的菌株也可导致耐药作用。外膜孔蛋白表达减低或者缺失对碳青霉烯类抗菌药物耐药作用起着重要的作用,特别是OmpK35、OmpK36、OmpK37,使用抗菌药物治疗的同时,不少菌株会产生下调这些孔蛋白表达的作用,或者诱导其缺失[13-15]。本研究结果显示,70株对碳青霉烯类抗菌药物耐药的肺炎克雷伯菌株中,膜蛋白无异常达18.57%,其中产碳青霉烯酶菌株中膜蛋白无异常为16.92%;OmpK35表达下调菌株占24.29%,OmpK35缺失占10.00%;OmpK36表达下调和缺失的比例分别为4.23%和57.14%;产碳青霉烯酶菌株中OmpK35表达下调的菌株占50.77%,OmpK35缺失占9.23%;OmpK36表达下调和缺失的比例分别为3.08%和55.38%。碳青酶烯酶是能够水解碳青霉烯类抗菌药物的β-内酰胺酶,其包括Ambler分子分类为A、B、C、D的4类酶,其中C类酶,即头孢菌素酶仅水解头孢菌素而不水解碳青霉烯;肺炎克雷伯菌碳青酶烯酶是目前引起CRE对碳青霉烯类抗菌药物耐药的主要原因,其基因位于可移动的质粒上,几乎可以水解除头孢菌素类以外的所有β-内酰胺类抗菌药物,包括碳青霉烯类。而与此同时,产碳青酶烯酶肺炎克雷伯菌可通过质粒、整合子、插入序列的基因元件进行水平传播使其他细菌获得耐药性。耐碳青霉烯类肠杆菌与产碳青霉烯酶、整合子、外膜孔蛋白均存在相互关联,且这些机制本身又存在不同程度的协同等作用,本研究结果也说明了其间的复杂相关性。
综上所述,对碳青霉烯类抗菌药物耐药的CRE耐药情况严峻,且肺炎克雷伯菌碳青霉烯酶基因检出率最高,耐药最严重;耐药性的发生还与整合酶基因Ⅰ类整合子,以及孔膜蛋白表达减低与缺失密切相关。本研究拟为新型抗菌药物的研发提供一些理论支持,为预防抗菌药物耐药性的产生提供依据。
[1]张丽,朱元祺,张小兵,等.耐碳青霉烯类肺炎克雷伯菌的耐药基因检测[J].中华医院感染学杂志,2014,24(23):5734-5736.
[2]赵慧铮,师志云,李刚,等.耐碳青霉烯类肠杆菌科细菌耐药性分析与分子流行病学研究[J].中华医院感染学杂志,2016,26(3):494-497.
[3]陈刚,茹纳丹,翁幸鐾.耐碳青霉烯类鲍氏不动杆菌β-内酰胺酶与膜孔蛋白carO、oprD基因研究[J].中华医院感染学杂志,2014,24(15):3641-3644.
[4]李渊婷,金凤玲.肠杆菌科细菌对碳青霉烯类药物的耐药机制及临床治疗进展[J].中国感染控制杂志,2015,14(9):644-648.
[5]王炜,苏建荣.铜绿假单胞菌碳青霉烯酶耐药的机制研究[J].临床和实验医学杂志,2014,13(8):610-613.
[6]李军,邹明祥,王海晨,等.耐碳青霉烯类肠杆菌科细菌耐药机制的研究[J].中华医院感染学杂志,2016,26(21):4801-4804.
[7]张传明.碳青霉烯非敏感大肠埃希菌耐药机制初步研究及分子流行病学调查[D].重庆:重庆医科大学,2015.
[8]杨秋,陆文婷,芮勇宇.耐碳青霉烯鲍曼不动杆菌耐药机制及分子流行病学研究[J].实用医学杂志,2015,12(24):4129-4132.
[9]梁权辉,徐韫健.耐碳青霉烯肺克雷伯菌和大肠埃希菌耐药机制研究[J].国际检验医学杂志,2014,35(2):165-167.
[10]解春宝,喻华,肖代雯,等.一株对3种碳青霉烯类抗菌药物均耐药的肺炎克雷伯菌耐药机制研究[J].检验医学,2014,29(4):369-374.
[11]刘萍,闫雪苗,张坚磊,等.23株耐碳青霉烯类肠杆菌科细菌耐药基因分析[J].山东医药,2016,56(24):91-93.
[12]刘淑敏,许云敏,牛敏,等.急诊重症监护病房耐碳青霉烯类肠杆菌科细菌的分子流行特征[J].中国感染与化疗杂志,2015,15(4):372-376.
[13]代强,郑波.2012美国疾病预防控制中心耐碳青霉烯类肠杆菌控制指南简介[J/CD].中国医学前沿杂志(电子版),2013,5(8):30-31.
[14]杨勇文,李从荣.耐碳青霉烯类肠杆菌科细菌耐药基因研究进展[J].山东医药,2016,56(2):96-98.
[15]徐丽英,丁卉,陈丽燕,等.30株耐碳青霉烯类肠杆菌科细菌的调查分析[J].中华医院感染学杂志,2012,22(12):2678-2680.

